摘要
背景
胸苷激酶1 (Thymidine kinase 1, TK1)是一种细胞周期调控酶,在DNA合成过程中,其峰值表达在S期,是一种有吸引力的细胞增殖生物标志物。血清TK1活性在早期乳腺癌患者中显示出预后价值。因为周期蛋白依赖性激酶4/6 (CDK4/6)抑制剂阻止G1/S转变,我们假设血清TK1可能是CDK4/6抑制剂的生物标志物。在NeoPalAna试验中,我们检测了药物诱导的血清TK1变化及其与肿瘤Ki-67水平变化的相关性(ClinicalTrials.gov identifier NCT01723774)。
方法
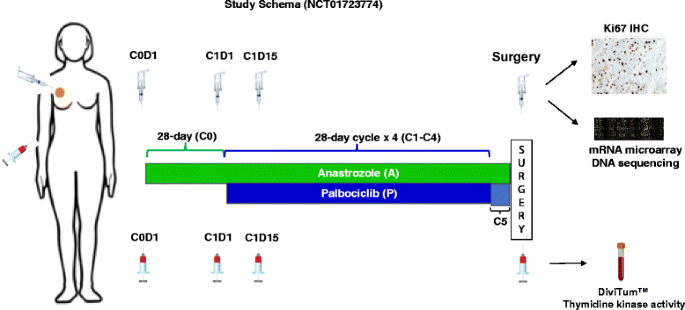
参加NeoPalAna试验的临床II/III期雌激素受体阳性(ER+)/ her2阴性乳腺癌患者接受了最初4周的阿那曲唑治疗,随后在第1周期第1天(C1D1)接受帕博西布治疗,共4个28天周期,除非C1D15肿瘤Ki-67为> 10%,在这种情况下,患者因反应不充分而退出研究。除连续接受palbociclib(第5周期)直至手术的8例患者外,最后一次用药palbociclib冲洗3-5周后均进行手术。在基线、C1D1、C1D15和手术时间测定血清TK1活性,我们发现它与肿瘤Ki-67和TK1信使RNA (mRNA)水平相关。
结果
尽管阿那曲唑单药治疗后肿瘤Ki-67显著下降,但TK1活性无统计学意义上的变化。然而,在palbociclib开始使用2周后,观察到TK1活性显著降低(C1D15),然后随着palbociclib停用而显著升高。在C1D15时,92%的患者的TK1活性低于检测限(<20 DiviTum单位/升Du/L),表明帕博西利的效果显著。从C1D1到C1D15,以及从C1D15到手术时间点,血清TK1和肿瘤Ki-67的变化方向一致,达到89.8% (95% CI: 79.2% - 96.2%)。palbociclib诱导的血清TK1降低对肿瘤ki -67反应的敏感性和特异性分别为94.1% (95% CI 86.2% - 100%)和84% (95% CI 69.6% -98.4%)。κ-统计值为0.76 (pTK1和Ki-67的差异< 0.001),表明基本一致。
结论
血清TK1活性是palbociclib在ER+乳腺癌中很有前景的药理学标志物,其在预测CDK4/6抑制剂反应中的价值值得进一步研究。
试验注册
ClinicalTrials.gov NCT01723774。2012年11月6日注册。
背景
细胞质胸苷激酶1 (TK1)是一种众所周知的细胞周期调节酶,在DNA合成过程中对核苷酸代谢很重要[1].TK1催化胸苷转化为脱氧胸苷单磷酸,脱氧胸苷单磷酸在与DNA结合之前进一步磷酸化为二磷酸和三磷酸。TK1活性在静息细胞中较低或不存在,在G1在S期达到峰值,在有丝分裂时逐渐消失[2,3.,4,5].然而,与健康个体相比,癌症患者血清TK1活性升高,乳腺癌和其他癌症患者预后升高[6,7,8,9,10,11],在极少数研究中,研究人员评估了血清TK1用于监测癌症治疗反应的效用。
抗周期蛋白依赖激酶4/6 (CDK4/6)的抑制剂是一类重要的新型药物,在晚期激素受体阳性(HR+)和人表皮生长因子受体2阴性(HER2−)乳腺癌患者中具有显著的抗肿瘤活性[12,13,14,15,16].这些药物通过激活视网膜母细胞瘤蛋白抑制细胞增殖,该蛋白与E2F转录因子结合,导致G0/ G1逮捕[17,18].CDK4/6抑制剂在管腔性或HR+疾病中的优先活性是由于雌激素受体(ER)信号通路和CDK4/6激活之间的直接联系,因为周期蛋白D是ER和其他与内分泌抵抗相关的有丝分裂信号的直接转录靶点[17,18].
NeoPalAna试验(临床II- iii期ER+/HER2−乳腺癌患者中,阿那曲唑和CDK4/6抑制剂帕博西lib的II期试验)的系列活组织检查中的肿瘤Ki-67分析证明了CDK4/6抑制在ER+乳腺癌中的有效抗增殖作用,其中帕博西lib加入阿那曲唑可诱导87%的患者完全细胞周期阻滞(Ki-67≤2.7%),而单药阿那曲唑治疗的患者为26% [19].由于TK1是E2F的直接转录靶点,并且严格受细胞周期调控,我们假设在CDK4/6抑制剂使用前后TK1活性水平的变化表明CDK4/6被成功抑制,并且血清TK1活性可以作为CDK4/6抑制的抗肿瘤活性的无创伤替代标记物。NeoPalAna试验中palbociclib前后收集的血清样本提供了一个理想的样本集来验证这一假设。本研究的目的是比较阿那曲唑和帕博昔利前后采集的血清中TK1活性,并将NeoPalAna试验中纳入的早期ER+/HER2−乳腺癌患者的血清TK1活性与肿瘤Ki-67增殖指数和肿瘤TK1 mRNA水平相关联。
方法
NeoPalAna试验患者群体和研究程序
NeoPalAna试验是一项针对临床II期或III期ER+/HER2−乳腺癌的palbociclib(一种CDK4/6抑制剂)和阿那曲唑的新辅助II期试验,主要终点为阿那曲唑和palbociclib联合使用的完全细胞周期阻滞(Ki-67≤2.7%)。患者群体和试验结果已在我们之前的出版物中描述[19].如图所示。1,患者接受阿那曲唑每日口服1 mg,持续一个28天周期(周期0,C0),随后加入帕博西布每日口服125 mg(每个28天周期的1 - 21天),从周期1,第1天(C1D1)开始,共4个周期,除非周期1,第15天(C1D15),肿瘤Ki-67为> 10%,这种情况下患者因反应不充分而退出研究。绝经前和围绝经期妇女每28天接受goserelin 3.6 mg皮下注射。阿那曲唑持续到手术,发生在palbociclib暴露后3-5周,除了8名患者在4个联合治疗周期后,在手术前再给予10-12天的palbociclib(第5周期)。在基线(C0之前)、C1D1、C1D15和手术时间进行连续活检和采血。采用病理学家引导的图像分析,集中分析肿瘤活检组织的肿瘤Ki-67水平[20.].在这项试验中,我们招募了50名患者(18名绝经前患者和32名绝经后患者)1),中位年龄为58岁(34-79岁),并证明帕博西布在ER+/HER2−乳腺癌中具有有效的抗增殖作用,即使在对阿那曲唑耐药的患者中也是如此[19].该试验提供了一个合适的样本集,以将血清TK1活性与帕博西利治疗和肿瘤Ki-67反应联系起来。TK mRNA水平来源于肿瘤RNA的微阵列分析(安捷伦基因组公司,加州圣克拉拉,美国)[19].在研究入组时(基线,C0D1)、C1D1、C1D15和手术时间测定血清TK1活性。
DiviTumTM血清TK1活性测定
的DiviTumTM测定方法(Biovica International, Uppsala,瑞典)根据制造商说明书(http://biovica.com/),如上文所述[21].当血清与96孔酶联免疫吸附试验(ELISA)滴度板中的反应混合物混合时,TK反应生成溴脱氧尿苷(BrdU)单磷酸,它进一步磷酸化为BrdU三磷酸,并结合到结合在微量滴度板孔底部的DNA链中。然后用酶碱性磷酸酶偶联的抗BrdU单克隆抗体和显色底物ELISA检测BrdU的掺入,产生颜色的光密度。吸光度读数为DiviTum单位每升(Du/L),使用已知TK活性的标准值进行转换,工作范围为20至4000 Du/L。这些分析是在瑞典乌普萨拉的Biovica实验室进行的,研究人员对患者或肿瘤数据一无所知。
帕博昔利对细胞内TKA影响的体外细胞培养实验
将人细胞系K562S (Sigma-Aldrich, St. Louis, MO, USA)接种到含有RPMI 1640培养基(Thermo Fisher Scientific, Waltham, MA, USA)的T25烧瓶(300万细胞/瓶)中,添加10% FBS (Thermo Fisher Scientific)、100 U/ml青霉素和100 U/ml链霉素(Thermo Fisher Scientific),并用palbociclib (0.1 nM至100 μM;Selleckchem, Houston, TX, USA) 6小时。然后收集细胞,用台锥蓝活力测定法测定细胞活力,或用DiviTum法裂解细胞内TK活性。
统计分析
通过盒状图显示所有患者的肿瘤Ki-67和TK1 mRNA在时间点上的变化。线状图显示三种肿瘤Ki-67应答类型患者血清TK1活性和Ki-67随时间点的水平。采用Wilcoxon符号秩检验比较血清TK1活性、肿瘤Ki-67指数或肿瘤TK1 mRNA水平的时间点。TK1检测限为20 Du/L,以20 Du/L为值进行统计分析。采用Bland-Altman方法计算血清TK1与肿瘤Ki-67之间的受试者水平双变量相关系数(BCC)(对数尺度)[22]、元分析方法和双变量线性混合效应模型[23].血清TK1活性变化和肿瘤Ki-67水平变化的一致性是通过计算TK1下降预测肿瘤Ki-67下降的敏感性和特异性来评估的,使用的数据是C1D1、C1D15和最终手术时间,排除了8例额外接受第5周期治疗的患者的数据。不可比较的数据,如在两个时间点都检测不到TK1活性,也被排除在外。所有测试均为双侧,显著性设置为5% α水平。所有统计分析均使用R版本3.3.2软件(R Foundation for statistical Computing,维也纳,奥地利)进行。
结果
临床前数据表明CDK4/6抑制以剂量依赖的方式降低细胞内TK1活性
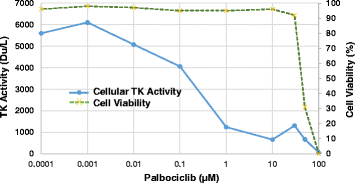
为了评估CDK4/6抑制对细胞内TK1活性的影响,将人细胞系K562S在增加浓度的palbociclib (0.1 nM至10 μM)的存在下培养6小时,并收集用于DiviTum分析。同时用台盼蓝检测细胞活力。如图所示。2结果表明,在药物暴露时间较短(6 h)时,当对细胞活力的影响还不明显时,palbociclib对TK1活性的反应呈线性和剂量依赖方式降低。
在NeoPalAna试验中,CDK4/6抑制降低了血清TK1活性
为了确定血清TK1活性是否可以作为CDK4/6抑制剂患者CDK4/6抑制和肿瘤细胞增殖的替代标记物,我们分析了NeoPalAna试验中接受新辅助阿那曲唑和帕博昔利的临床II-III期ER+/HER2−乳腺癌患者的样本集[19].如图所示。3.和表2在阿那曲唑单药治疗28天后,TK1活性在基线和C1D1之间无统计学差异(中位血清TK活性分别为46和42.55 Du/L;p= 0.52),尽管肿瘤Ki-67指数显著降低,肿瘤TK mRNA水平降低。相反,在palbociclib开始使用2周后TK活性显著下降(C1D15),中位血清TK活性低于20 Du/L, (p< 0.001);92%(44 / 48)患者血清TK活性低于20 Du/L检出限。其余4例受试者血清TK活性分别为24、26、26和58 Du/L。这表明palbociclib具有较强的靶向抑制作用。停用palbociclib后,中位血清TK水平从C1D15到手术显著升高(手术时143.96 Du/L),表明CDK4/6抑制恢复,手术时肿瘤Ki-67也出现类似反弹。8例患者术前再给予palbociclib 10-12天(第5周期),手术时血清TK水平仍被抑制在与C1D15相似的水平(中位血清TK活性< 20 Du/L;p= 0.7893)。总的来说,这些数据表明血清TK活性可以作为CDK4/6抑制的药效学标记。
参加NeoPalAna试验的患者血清胸苷激酶1 (TK1)、肿瘤Ki-67和肿瘤TK1信使RNA (mRNA)水平随时间点的箱线图。时间点之间的比较使用Wilcoxon符号秩检验。与肿瘤Ki-67相似,在添加帕博西利2周后,第1周期第15天(C1D15)血清TK活性显著降低。然而,与肿瘤Ki-67和TK1 mRNA水平不同,单独使用阿那曲唑时,血清TK1活性在基线(C0D1)和周期1、第1天(C1D1)之间没有差异。与肿瘤Ki-67相似,在停药palbociclib手术时观察到血清TK1水平的显著反弹性升高,而在术前添加palbociclib额外周期(第5周期)时,TK1水平被抑制。手术时间点肿瘤TK1 mRNA的变化无统计学意义。***p< 0.001, *p< 0.05
肿瘤Ki-67反应类别对palbociclib的血清TK活性的响应
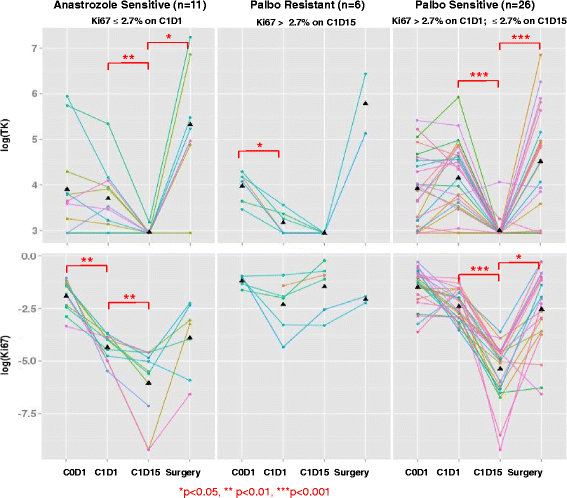
为了分析对帕博西利有不同反应的肿瘤中血清TK1活性之间的相互作用,我们以肿瘤Ki-67反应类别为临界值2.7%(定义完全细胞周期停止水平)分析了TK1数据:阿那曲唑敏感(C1D1 Ki-67 > 2.7%,但C1D15 Ki-67≤2.7%),帕博西利耐药(C1D15 Ki-67 > 2.7%)。如图所示。4,在阿那曲唑敏感组和帕博西利敏感组中,血清TK水平在C1D15处均显著降低,随后由于帕博西利冲洗而在手术中恢复。在帕博西利耐药组,血清TK1活性和肿瘤Ki-67值均无明显变化。
palbociclib对血清TK活性和肿瘤Ki-67变化方向的一致性
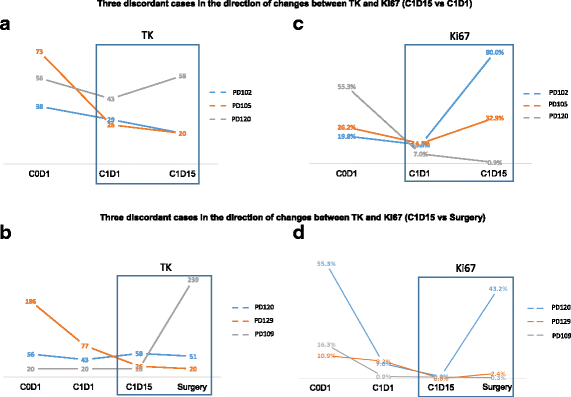
为了评估palbociclib的疗效和评价一致性,我们比较了个别患者C1D15和C1D1之间以及C1D15和手术(无第5周期)之间的数据。palbociclib对血清TK与肿瘤Ki-67变化方向的总体一致性为89.8%(59例患者中53例,95% CI为79.2% - 96.2%)(表2)3.).血清TK活性降低预测肿瘤Ki-67降低对palbociclib的敏感性和特异性分别为94.1% (32 / 34,95% CI 86.2% -100%)和84% (21 / 25,95% CI 69.6% - 98.4%)。κ-统计值为0.76 (p< 0.001),表明两种试验之间基本一致。palbociclib对肿瘤Ki-67的影响与血清TK1活性之间的六个不一致实例如图所示。5.在C1D1和C1D15时间点不一致的3例病例中,有2例在C1D1时血清TK水平在20s(以20 Du/L为检出限)(图。5a和b), 3例C1D15与手术时间点不一致的病例中,有1例肿瘤Ki-67和血清TK水平变化极小。这一观察可能限制了肿瘤Ki-67与血清TK活性变化之间的比较。
Bland-Altman法检测血清TK1与肿瘤Ki-67的患者水平BCC均为0.46 [22]和二元线性混合效应模型[23],说明两者相关性中等。然而,血清TK1活性在C1D15的绝对值并不能预测Ki-67染色评估的持续肿瘤增殖(图7)。4和附加文件1:表S1),因为6例患者的血清TK1活性均低于20 Du/L的检测限。由于阿那曲唑治疗后血清TK1水平显著降低,其中3例患者血清TK1水平< 20 Du/L,另外3例患者仅轻微升高(分别为26、29和35 Du/L),因此我们无法评估帕波西利耐药患者C1D1和C1D15时间点之间血清TK1活性和Ki-67变化之间的相关性。
讨论
基于血液的生物标记物作为评估预后和疾病监测的非侵入性工具具有重要意义。循环肿瘤细胞、外泌体、循环肿瘤核酸和分泌蛋白是这些潜在生物标志物中最常被研究的[24].然而,这些生物标志物的临床应用往往受到不令人满意的敏感性、特异性和实验室间重复性的限制[25].DiviTum TK1活性测定已被证明是一种高度敏感和可靠的测量工具,可用于测量细胞增殖[6].由于TK1是一种细胞周期调节酶,在DNA合成中起着关键作用,我们研究了血清TK1活性是否可以作为palbociclib抗增殖作用的替代标记物,用于参加NeoPalAna试验的早期ER+/HER2−乳腺癌患者(新辅助palbociclib和阿那曲唑)。
本研究显示,帕博西利治疗2周后,血清TK1活性显著降低,血清TK1的变化与肿瘤Ki-67增殖指数和肿瘤TK1 mRNA水平的变化显著相关。palbociclib诱导的血清TK与肿瘤Ki-67变化方向的总体一致性为89.8% (53 / 59,95% CI为79.2% -96.2%)。palbociclib降低血清TK1活性在该患者人群中预测肿瘤Ki-67反应的敏感性为94.1% (32 / 34,95% CI 86.2% -100%),特异性为84% (21 / 25,95% CI 69.6% -98.4%)。据我们所知,这是第一个表明血清TK1活性可能是CDK4/6抑制剂抗增殖作用的无创药效学标记物的研究。
不受控制的细胞增殖是癌症的主要特征之一[26].TK1作为细胞增殖标志物的价值最初是通过免疫组化研究人类乳腺癌来探索的[27].与增殖细胞核抗原(PCNA)的表达相比,尽管TK1和PCNA在恶性病变中的表达均明显高于非恶性病变,但只有TK1与肿瘤分期或组织学分级相关[28],表明它是比PCNA更好的增殖标记物。随后,研究人员使用抗TK1单克隆抗体或多克隆抗体将血清TK1作为肿瘤标志物,结果表明术前乳腺癌患者的TK1水平明显高于健康志愿者或良性肿瘤患者或乳腺癌治愈手术后的患者[29].另一项研究表明,乳腺癌手术后3个月血清TK1水平升高与局部和远处复发风险增加有关[30.].这些早期的研究进一步引起了开发血清TK1测定和临床应用研究的兴趣。DiviTum检测的创新技术能够以高灵敏度测量血清TK1活性,与其他检测平台相比具有优势[6].DiviTum血清TK1活性已被探索作为实体肿瘤(包括乳腺癌)的预后标志物[6,7,8,9,21,31].具体而言,在一项涉及368名女性的研究中,包括149名健康献血者(对照组)、59名良性乳腺疾病(BBD)患者和160名原发性乳腺癌患者,浸润性乳腺癌或增生性乳腺疾病患者的血清TK1活性明显高于非增生性乳腺疾病患者和健康对照组[6].此外,血清TK1活性与肿瘤大小、ER和PgR缺乏、肿瘤分级和分子亚型显著相关[6].调整分期、分级和HR状态的多变量分析表明,血清TK1是疾病复发的独立预测因子(p= 0.013) [6].其他研究表明TK1活性与晚期和转移性乳腺癌患者的无进展生存期和总生存期相关[21].然而,在少数研究中,研究人员仅调查了血清TK1活性在监测抗肿瘤药物治疗反应中的临床应用。
评估血清TK1活性对CDK4/6抑制剂反应的特别兴趣源于这些药物已知的细胞周期抑制特性及其在晚期HR+乳腺癌患者管理中的重要性[18,32].三种CDK4/6抑制剂,包括palbociclib、ribociclib和abemaciclib,正在临床开发中,用于治疗乳腺癌和其他实体恶性肿瘤。所有三种CDK4/6抑制剂已获得美国食品和药物管理局批准,用于治疗晚期HR+/HER2−乳腺癌(Drugs@FDA;https://www.accessdata.fda.gov/scripts/cder/daf/).然而,尽管取得了这一成功,特别是在内分泌未发病的疾病中,对CDK4/6抑制剂的耐药性最终会形成,并且在内分泌治疗进展后,相当一部分HR+/HER2−乳腺癌患者在二线治疗(>30%)或以上(>60%)对CDK4/6抑制剂无反应[11,13,33].早期反应标志物的临床应用可能导致最佳治疗方法的确定发生有益的变化。因此,在NeoPalAna试验中观察到的血清TK1活性变化与肿瘤Ki-67对palbociclib的反应之间的联系,为未来探索血清TK1活性对接受CDK4/6抑制剂治疗转移性疾病患者的反应和无进展生存的潜在预测性质提供了基础。
我们的研究受到样本量小的限制。然而,该研究的独特之处在于,它能够在新诊断的、未经治疗的HR+/HER2−乳腺癌患者中,在连续时间点同时获得肿瘤活检和血清样本收集,以检测Ki-67 IHC和TK1活性。在加入palbociclib之前使用阿那曲唑单药治疗的初始治疗,以及在手术前清洗palbociclib可以评估血清TK1活性的动态变化。
在这项研究中,血清TK1活性在阿那曲唑治疗28天后没有显著改变(表2)2).尽管肿瘤TK1 mRNA在C1D1上有统计学意义上的降低(表1)2).此外,在阿那曲唑敏感组的11例患者中,有3例观察到血清TK1活性在C1D1上升高,尽管变化相对较小(分别从基线< 20、38和44 Du/L到C1D1上的34、60和50 Du/L)(图1)。4).这是出乎意料的,因为阿那曲唑通过调节细胞周期蛋白D1间接抑制CDK4/6 [34,35].正如我们最初发表的NeoPalAna试验所证明的那样,阿那曲唑调节了广泛基因的mRNA表达水平,包括那些被添加palbociclib进一步抑制的基因[19].这是由阿那曲唑在C1D1后肿瘤TK1 mRNA的显著降低和约50%患者血清TK1活性的降低所支持的。阿那曲唑后血清TK1反应不明显的一个可能解释是,在早期乳腺癌患者中,非癌细胞的血清TK1活性有相对显著的贡献。在一项研究中,研究人员比较了健康受试者和乳腺癌患者之间的血清TK1活性,健康献血者中TK1活性的中位值和IQR值为16 Du/L (IQR 9-33 Du/L) (n(n=160),中位水平分别为37 Du/L (IQR 20-92 Du/L)。[6].虽然两组血清TK1活性差异有统计学意义,但存在重叠值。如表所示2, NeoPalAna试验纳入患者的中位基线血清TK1为46 Du/L (IQR 25-73 Du/L),这与之前研究观察到的情况相似[6].因此,阿那曲唑的抗肿瘤作用可能难以转化为血清TK1的改变,因为阿那曲唑的抗增殖作用仅限于雌激素依赖的乳腺癌细胞,而非恶性细胞则不受影响。在血清TK1基线水平较低的患者中尤其如此。这3例患者血清TK1 C1D1活性的轻微或中度升高也可能反映了个体的波动,因为TK1的半衰期很短[4].因此,包括晚期疾病患者的研究是有必要的,在这些患者中,肿瘤细胞贡献了大部分血清TK1活性。
同样,在palbociclib对肿瘤Ki-67的反应中,血清TK1和肿瘤Ki-67变化之间的不一致,以及在palbociclib耐药类别的患者中观察到的低血清TK1活性,尽管肿瘤细胞持续增殖,可以通过palbociclib对这种早期疾病设置中的癌细胞和非癌细胞中的CDK4/6的抑制作用来解释。然而,我们不能排除血清TK1活性仅在cdk4 /6依赖性癌细胞中降低的可能性。对晚期疾病患者进行更大规模的研究将最终提供进一步的见解并解决这些可能性。
结论
我们的研究首次证明,在早期HR+乳腺癌患者中,CDK4/6抑制剂治疗后2周的血清TK1活性与肿瘤细胞增殖反应高度相关。因此,未来的研究有必要调查血清TK1活性在监测接受内分泌治疗和CDK4/6抑制剂治疗的转移性乳腺癌患者的治疗反应和生存结果方面的价值。
缩写
- bdd:
-
乳腺良性疾病
- BCC:
-
二元相关系数
- BrdU:
-
溴脱氧尿苷
- C1D1:
-
周期1,第一天
- C1D15:
-
周期1,第15天
- CDK:
-
细胞周期蛋白依赖性激酶
- Du / L:
-
DiviTum单位每升
- ELISA:
-
酶联免疫吸附试验
- 呃:
-
雌激素受体
- HER2−:
-
人表皮生长因子受体2阴性
- 人力资源+:
-
激素受体阳性
- HRPO:
-
人类研究保护办公室
- 包含IHC:
-
免疫组织化学
- 差:
-
四分位范围
- IRB:
-
机构检讨委员会
- 信使rna:
-
信使核糖核酸
- PCNA:
-
增殖细胞核抗原
- PgR:
-
孕酮
- TK1:
-
胸苷激酶1
- 阿拉巴马大学:
-
阿拉巴马大学伯明翰分校
参考文献
韦林,朱晨,王琳,王丽娟,王丽娟,王丽娟。胸苷激酶1在人与支原体来源的结构研究。中国科学院学报(自然科学版),2004;29(3):379 - 379。
贝洛LJ。人类细胞中胸苷激酶合成的调控。科学通报,2004;29(2):379 - 379。
孟克-皮森B, Tyrsted G.胸苷激酶诱导植物血凝素刺激的人淋巴细胞。生物化学学报。1977;478(3):364-75。
Sherley JL, Kelly TJ。人胸苷激酶在细胞周期中的调节。中国生物医学工程学报。1988;26(3):339 - 344。
柯碧,张泽峰。人胸苷激酶1的有丝分裂降解依赖于后期促进复合物/环胞体- cdh1介导的途径。分子生物学杂志,2004;24(2):514-26。
Nisman B, Allweis T, Kadouri L, Mali B, Hamburger T, Baras M, Gronowitz S, Peretz T。两种检测乳腺癌患者血清中胸苷激酶1活性的方法诊断和预后的比较。临床化学检验。2013;51(2):439-47。
Nisman B, Allweis T, Kaduri L, Maly B, Gronowitz S, Hamburger T, Peretz T.乳腺癌血清胸苷激酶1活性。癌症生物标记。2010;7(2):65-72。
Nisman B, Appelbaum L, Yutkin V, Nechushtan H, Hubert A, Uziely B, Pode D, Peretz T.肾细胞癌肾切除术及射频消融后血清胸苷激酶1活性的研究中国癌症杂志,2016;36(4):1791-7。
Nisman B, Nechushtan H, Biran H, Gantz-Sorotsky H, Peled N, Gronowitz S, Peretz T.血清胸苷激酶1活性在肺癌患者预后和化疗监测中的作用:简要报道。中华外科杂志,2014;9(10):1568-72。
胸苷激酶活性对慢性淋巴细胞白血病患者预后的影响Postepy希格医学档案(在线)。2016; 70:1321-30。
DeMichele A, Clark AS, Tan KS, Heitjan DF, Gramlich K, Gallagher M, Lal P, Feldman M, Zhang P, Colameco C,等。CDK 4/6抑制剂palbociclib (PD0332991)在Rb中的作用+晚期乳腺癌:II期活性、安全性和预测性生物标志物评估临床癌症杂志2015;21(5):995-1001。
Hortobagyi GN, Stemmer SM, Burris HA, Yap YS, Sonke GS, palich - shimon S, Campone M, Blackwell KL, André F, Winer EP,等。Ribociclib作为hr阳性晚期乳腺癌的一线治疗方法。中华实用医学杂志,2016;29(4):344 - 344。
Cristofanilli M, Turner NC, Bondarenko I, Ro J, Im SA, Masuda N, Colleoni M, DeMichele A, Loi S, Verma S,等。氟维司坦加帕博西布与氟维司坦加安慰剂治疗激素受体阳性、her2阴性、既往内分泌治疗进展的转移性乳腺癌(palma -3):多中心、双盲、3期随机对照试验的最终分析中华肿瘤学杂志,2016;17(4):425-39。
Finn RS, Martin M, Rugo HS, Jones S, Im SA, Gelmon K, Harbeck N, Lipatov ON, Walshe JM, Moulder S,等。帕博西布和来曲唑治疗晚期乳腺癌。中华实用医学杂志,2016;29(4):344 - 344。
Patnaik A, Rosen LS, Tolaney SM, Tolcher AW, Goldman JW, Gandhi L, Papadopoulos KP, Beeram M, Rasco DW, Hilton JF,等。abemaciclib是一种CDK4和CDK6抑制剂,用于乳腺癌、非小细胞肺癌和其他实体肿瘤患者的疗效和安全性。癌症杂志,2016;6(7):740-53。
Sledge Jr GW, Toi M, Neven P, Sohn J, Inoue K, Pivot X, Burdaeva O, Okera M, Masuda N, Kaufman PA,等。MONARCH 2:阿贝西库联合氟维司坦治疗在接受内分泌治疗期间进展的HR+/HER2−晚期乳腺癌患者。中华临床杂志,2017;35(25):2875-84。
Finn RS, Aleshin A, Slamon DJ。靶向周期蛋白依赖激酶(CDK) 4/6在雌激素受体阳性乳腺癌。乳腺癌决议2016;18(1):17。
O 'Leary B, Finn RS, Turner NC。用选择性CDK4/6抑制剂治疗癌症。中华儿科杂志,2016;13(7):417-30。
马春霞,高峰,罗杰,Northfelt DW, Goetz MP, Forero A, Hoog J, Naughton M, adeuyiwa F, Suresh R,等。NeoPalAna:新辅助疗法palbociclib,一种周期蛋白依赖性激酶4/6抑制剂,以及用于临床2期或3期雌激素受体阳性乳腺癌的阿那曲唑。临床癌症杂志,2017;23(15):4055-65。
Ellis MJ, Suman VJ, Hoog J, Goncalves R, Sanati S, Creighton CJ, DeSchryver K, Crouch E, Brink A, Watson M,等。Ki67增殖指数作为乳腺癌新辅助芳香化酶抑制剂治疗期间和之后化疗决策的工具:来自美国外科医生学会肿瘤组Z1031试验(联盟)的结果。中华临床杂志,2017;35(10):1061-9。
Bjohle J, Bergqvist J, Gronowitz JS, Johansson H, Carlsson L, Einbeigi Z, Linderholm B, Loman N, Malmberg M, Soderberg M,等。在一项随机试验中,局部晚期和转移性乳腺癌的血清胸苷激酶活性与ca15 -3的比较。中华癌症杂志,2013;29(3):344 - 344。
布兰德JM,阿尔特曼DG。统计注释:用重复观测计算相关系数:第1部分:受试者之间的相关性。BMJ。1995, 310(6977): 446。
罗娟,高峰,丁娟,熊晨。家族型聚类研究的双变量相关系数。中国生物工程学报,2015;37(6):344 - 344。
Berghuis AM, Koffijberg H, Prakash J, Terstappen LW, IJzerman MJ。在转移性乳腺癌中检测基于血液的生物标志物:其现状和临床应用的系统综述。中华分子化学杂志,2017;18(2):363。
Cappelletti V, Appierto V, Tiberio P, Fina E, Callari M, Daidone MG。用于预测治疗反应的循环生物标志物。中华肿瘤学杂志2015;2015(51):60-3。
Hanahan D, Weinberg RA。癌症的特征:下一代。细胞。2011;144(5):646 - 74。
Aufderklamm S, Todenhofer T, Gakis G, Kruck S, Hennenlotter J, Stenzl A, Schwentner C.胸苷激酶与癌症监测。中华癌症杂志,2012;36(1):6-10。
毛艳,吴娟,王楠,何玲,吴超,何强,Skog S.乳腺癌细胞浆性胸苷激酶与增殖细胞核抗原免疫组化检测的比较研究。癌症投资,2002;20(7-8):922-31。
何倩,邹玲,张帕,吕建新,Skog S, Fornander T.抗tk1抗体检测乳腺癌患者血清中胸苷激酶1的临床意义。中国生物医学杂志,2000;15(2):139-46。
He Q, Fornander T, Johansson H, Johansson U, Hu GZ, Rutqvist LE, Skog S.血清中胸苷激酶1预测早期乳腺癌患者术后远处或局部复发风险增加。抗癌决议2006;26(6C): 4753-9。
Korkmaz T, Seber S, Okutur K, Basaran G, Yumuk F, Dane F, Ones T, Polat O, Madenci OC, Demir G,等。非小细胞肺癌患者血清胸苷激酶1水平与FDG摄取及预后相关生物标志物。2013;18(1):88 - 94。
Lim JS, Turner NC, Yap TA。CDK4/6抑制剂:在乳腺癌之外有希望的机会。中国癌症杂志,2016;6(7):697-9。
Turner NC, Ro J, André F, Loi S, Verma S, Iwata H, Harbeck N, Loibl S, Huang Bartlett C, Zhang K,等。Palbociclib在激素受体阳性晚期乳腺癌中的应用。中华实用医学杂志,2015;29(3):329 - 329。
普罗欧,萨瑟维克B,穆斯格罗夫EA,沃茨CK,萨瑟兰RL。雌激素诱导Cdk4和Cdk2在G1-S期进展伴有细胞周期蛋白D1表达增加和细胞周期蛋白依赖性激酶抑制剂与细胞周期蛋白E-Cdk2的关联减少。中国生物医学工程学报,2001;29(4):344 - 344。
Watts CK, Sweeney KJ, Warlters A, Musgrove EA, Sutherland RL。抗雌激素对MCF-7人乳腺癌细胞周期进程和cyclin D1基因表达的调控乳腺癌治疗。1994;31(1):95-105。
确认
作者感谢参与NeoPalAna试验的患者和家属以及照顾这些患者的工作人员。我们感谢西特曼癌症中心,组织采购核心,生物统计核心,麦克唐纳基因组研究所,基因组和病理服务,解剖和分子病理实验室。NeoPalAna试验由Siteman癌症中心拨款P30 CA91842(给Timothy Eberlein,密苏里州圣路易斯华盛顿大学医学院外科内分泌和肿瘤外科科),圣路易斯男性抗癌组织(给CXM), Susan G. Komen承诺拨款(给ME),国家癌症研究所(NCI)癌症临床研究团队领导奖(给CXM)和辉瑞(给CXM)资助。CXM是NCI临床研究团队领导奖的获得者。我是麦克奈尔医学基金会学者和德克萨斯州癌症预防研究所高级研究员奖的获得者。这项工作部分已在2016年圣安东尼奥乳腺癌研讨会(摘要P5-04-02)和2017年美国癌症研究协会年会(摘要2340)上发表。
资金
NeoPalAna试验由Siteman癌症中心拨款P30 CA91842(给Timothy Eberlein,密苏里州圣路易斯华盛顿大学医学院外科内分泌和肿瘤外科科),圣路易斯男性抗癌组织(给CXM), Susan G. Komen承诺赠款(给ME), NCI癌症临床研究团队领导奖(给CXM)和辉瑞(给CXM)资助。
数据和材料的可用性
本研究中使用和/或分析的数据集可根据合理要求从通讯作者处获得。
作者信息
作者及隶属关系
贡献
NB参与了数据的解读、稿件的起草和最终稿件的批准,并同意对所有方面的工作负责。ST参与了数据的获取和分析、稿件的起草和最终稿件的批准,并同意对所有方面的工作负责。NL参与了数据分析、稿件修改和最终稿件批准,并同意对所有方面的工作负责。JL参与了数据的分析、稿件的修改和最终稿件的批准,并同意对所有方面的工作负责。JH参与了数据的获取和分析、稿件的修改和最终稿件的批准,并同意对所有方面的工作负责。DWN参与了数据的获取、稿件的修改和最终稿件的批准,并同意对所有方面的工作负责。MPG参与了数据的获取、稿件的修改和最终稿件的批准,并同意对所有方面的工作负责。AF参与了数据的获取、稿件的修改和最终稿件的批准,并同意对所有方面的工作负责。MB参与了数据的获取和分析,手稿的起草和修改,以及最终的手稿批准,并同意对所有方面的工作负责。JK参与了数据的获取和分析,稿件的修改,最终稿件的批准,并同意对所有方面的工作负责。 MN contributed to acquisition and analysis of data, revision of the manuscript, and final manuscript approval and agreed to be accountable for all aspects of the work. EMS contributed to acquisition of data, revision of the manuscript, and final manuscript approval and agreed to be accountable for all aspects of the work. ZG contributed to acquisition of data, revision of the manuscript, and final manuscript approval and agreed to be accountable for all aspects of the work. KV contributed to acquisition of data, revision of the manuscript, and final manuscript approval and agreed to be accountable for all aspects of the work. SS contributed to acquisition of data, revision of the manuscript, and final manuscript approval and agreed to be accountable for all aspects of the work. ME contributed to the study concept and design, revision of the manuscript, and final manuscript approval and agreed to be accountable for all aspects of the work. CXM made substantial contributions to the study concept and design, acquisition and interpretation of data, revision of the manuscript for intellectual content, and final manuscript approval and agreed to be accountable for all aspects of the manuscript and the related research. All authors read and approved the final manuscript.
相应的作者
道德声明
伦理批准并同意参与
NeoPalAna方案和知情同意文件得到了所有参与机构的批准。参与研究的机构包括美国明尼苏达州罗切斯特市的梅奥诊所;美国亚利桑那州凤凰城/斯科茨代尔的梅奥诊所;阿拉巴马大学伯明翰分校(Alabama University at Birmingham, AL, USA);圣路易斯华盛顿大学(圣路易斯,密苏里州,美国)。试验文件由梅奥诊所机构审查委员会(IRB)批准,用于罗切斯特和凤凰城/斯科茨代尔地点(参考编号13x310)、UAB IRB(参考编号UAB1430)和华盛顿大学圣路易斯人类研究保护办公室(HRPO) IRB(参考编号201301106)。经批准后,所有参与机构同意遵守《赫尔辛基宣言》、良好临床实践指南和美国联邦法规的适用部分。入组时需要书面知情同意。
发表同意书
不适用。
相互竞争的利益
MPG是Eli Lilly and Company, bioTheranostics, Rna Diagnostics Inc.和Myriad Genetics的顾问委员会成员。MPG已获得礼来公司和辉瑞公司的研究资金。AF已获得辉瑞公司、基因泰克公司、诺华公司、西雅图基因公司、Tesaro公司和葛兰素史克公司的机构研究资金。MB是Biovica International AB的员工。MN是Biovica International AB的员工。EMS是Biovica International AB的前员工。ME已收到辉瑞公司的顾问委员会成员/咨询费和基于pam50的风险分类器(Prosigna;NanoString Technologies,西雅图,华盛顿州,美国)。CXM获得了辉瑞公司和诺华公司的机构研究资金和顾问委员会成员/咨询费。所有其他作者都宣称他们没有竞争利益。
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
额外的文件
附加文件1:表S1。
帕博西利耐药患者血清TK1活性和肿瘤Ki67水平随时间点变化(Ki67 > 2.7% C1D15)
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
巴格尼,N.,托马斯,S.,刘,N.。et al。接受palbociclib新辅助治疗的早期乳腺癌患者血清胸苷激酶1活性作为周期蛋白依赖性激酶4/6抑制的药理学标志。乳腺癌研究19, 123(2017)。https://doi.org/10.1186/s13058-017-0913-7
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13058-017-0913-7
关键字
- 乳腺癌
- 胸苷激酶
- Palbociclib
- 阿那曲唑
- 新辅助
- 生物标志物