摘要
背景
一个多世纪以来,科学家们一直在研究小龙虾鼠疫病原体之间的宿主-病原体相互作用丝囊霉属astaci和淡水小龙虾。据推测,由于北美小龙虾宿主与病原体长期共同进化,因此具有抗病能力。同样,在历史上敏感的欧洲小龙虾宿主中,潜伏感染数量的增加似乎表明,类似的共同进化过程正在欧洲小龙虾和欧洲小龙虾之间发生答:astaci.我们目前对宿主-病原体相互作用的理解主要集中在小龙虾血淋巴和角质层中的先天免疫过程,但观察到的抗病和易感性的分子基础仍不清楚。为了了解共同进化是如何塑造宿主对病原体的分子反应,易感的欧洲本土贵族小龙虾和入侵性抗病大理石纹小龙虾受到了两个挑战答:astaci不同来源的菌株:单倍群a菌株(至少50年前引入欧洲,低毒力)和单倍群B菌株(美国太浩湖的信号小龙虾,高毒力)。在此,我们比较了小龙虾免疫和代谢的综合器官肝胰脏的基因表达谱。
结果
我们在这两个小龙虾物种中鉴定了几个新的先天免疫相关基因群。在所有挑战组中,我们在高贵小龙虾中检测到412个差异表达基因(DEGs),在大理石纹小龙虾中检测到257个差异表达基因。尊贵小龙虾对单倍群B株有明显免疫反应,对单倍群a株无明显免疫反应。相比之下,在大理石纹小龙虾中,我们检测到对单倍群A菌株的免疫反应,但对单倍群B菌株没有免疫反应。
结论
我们强调,肝胰脏是免疫分子合成的一个重要枢纽答:astaci.大理石纹小龙虾和贵族小龙虾的先天免疫反应的明显区别在于大理石纹小龙虾有能力调动更高种类的先天免疫反应效应因子。通过这项研究,我们概述了宿主对病原体的免疫反应的类型和强度受到小龙虾与特异性小龙虾的共同进化历史的强烈影响答:astaci菌株.
背景
宿主-病原体相互作用是进化军备竞赛的模型,因此是相互相互适应的周期[1].宿主和病原体之间的共同进化是普遍存在的,往往会导致快速的进化变化,并与多样性的维持有关[2,3.].病原体对宿主施加强选择,以尽量减少其适应度损失,例如通过进化耐药性,而病原体本身处于强选择下,以破坏宿主的防御,而不导致宿主种群的完全崩溃[4].由于新的宿主尚未进化出任何特定的防御机制,寄生虫的毒力可能在宿主跳跃后达到峰值[4,5].宿主-寄生虫相互作用背后的理论已经很成熟[6,7,并且有大量的共同进化适应的例子[8,9].然而,我们才刚刚开始了解共同适应过程中潜在的基因组机制和基因[10].宿主-病原体的相互作用在保护生物学中具有高度的意义,因为它们不仅决定了入侵物种的命运,而且也影响了本地类群的生存[11].由于淡水小龙虾对养殖和管理的重要性,科学家们对其与病原体之间的相互作用进行了研究丝囊霉属astaci一个多世纪以来[12].然而,这种宿主-病原体相互作用的共同进化方面仍有待研究。
可能是因为它们的共同进化历史,北美小龙虾物种通常被认为对病原体有抵抗力a . astaci小龙虾鼠疫的病原体[13,14].假设这些小龙虾物种是其特异性的天然携带者答:astaci菌株,通常通过黑化介导的病原体菌丝在角质层的包封,有效地防止其在组织内传播[15,16].相比之下,欧洲的小龙虾物种并不自然携带病原体,被认为容易感染这种疾病[17,18,19].因此,北美小龙虾的入侵物种被引入欧洲,并随之而来答:astaci,导致欧洲小龙虾种群的大规模死亡和局部灭绝[20.].的答:astaci存在于欧洲的菌株可分为4个不同的单倍群[21].单倍群A包含毒力不等的菌株(从非毒力到高毒力不等),而单倍群B、D和E通常具有高毒力的特征[17,22,23].尽管欧洲本土小龙虾物种对小龙虾鼠疫病原体具有高度的易感性,但已有报告称,一些低毒力的小龙虾物种感染了潜伏的小龙虾鼠疫,而没有大规模死亡答:astaci单倍群A菌株[12,表明存在一个持续的动态共同进化过程。然而,这种基础自然发生的抵抗答:astaci仍不清楚。
初步研究表明,北美小龙虾物种耐药性的主要因素之一是血细胞中构成性过表达的酚氧化酶原(proPO),这是黑色素包裹病原体的关键酶[24].相反,在欧洲的小龙虾物种中,这种酶的表达依赖于病原体的刺激[24].根据目前对甲壳类先天免疫机制的认识,对病原体的反应包括细胞和体液两部分,其中proPO级联在体液反应中起作用[25,26,27].免疫反应由病原体相关分子模式(PAMPs)触发,如β-(1,3)-葡聚糖,这是卵菌细胞壁的主要成分之一[28].这些分子可以被宿主的特定模式识别蛋白(PRPs)识别,它们可以作为可溶性分子存在,也可以与细胞膜结合。特别相关的prp是凝集素样蛋白、唐氏综合症细胞粘附分子(DSCAMs)和toll样受体(TLRs) [25,29].配体和受体之间的相互作用导致了参与体液或细胞反应的不同分子通路的激活,所有这些通路都由甲壳类免疫的核心介质——血细胞协调。血细胞在吞噬、包封和黑化过程中至关重要,它们参与将体液反应的分子效应因子,如抗菌肽和proPO运送到感染部位[27,30.,31].
小龙虾免疫反应的潜在机制答:astaci然而,它比单纯的proPO级联激活要复杂得多,但它的分子效应器和血淋巴以外的其他组织还没有得到太多的关注。在甲壳纲动物中,肝胰脏是免疫和代谢的综合器官[32,33].它在病原体清除,抗原处理中起着重要作用[34,35]、解毒及重金属沉积[36].它也是免疫分子的来源,这些分子可以从上皮细胞释放到血腔窦中,使它们能够在小龙虾的血淋巴中迅速分布[33].近年来,在甲壳类动物中,肝胰脏参与对各种疾病和环境因素的反应已得到重视[36,37,38,39,40].然而,它在免疫反应中的作用答:astaci感染还没有明确的定义。
通过共同进化的转录组学方法,我们旨在加深我们对淡水小龙虾抗和易感性的分子机制的理解答:astaci,以揭示共同进化是如何塑造对病原体的分子反应的。通过分析肝胰脏的基因表达谱,我们比较了易感的欧洲本土贵族小龙虾(Astacus Astacus)和抗入侵的大理石纹小龙虾(Procambarus virginalis)一个答:astaci挑战。在对照感染实验中,两个物种分别被高毒力(单倍群B,下称Hap B)和低毒力(单倍群a,下称Hap a)感染答:astaci应变(41].之前的研究集中在早期阶段答:astaci但从急性感染到潜伏感染状态的转变尚未得到研究。因此,在攻毒早期(第3天)和攻毒后期(第21天)对小龙虾的肝胰脏进行取样。
我们假设肝胰脏在免疫反应中是一个高度相关的组织答:astaci感染,我们希望在所有治疗组中检测到几种免疫相关转录本。我们预期尊贵小龙虾和大理石纹小龙虾的免疫相关转录本基因表达谱不同,反映了该物种与特异性小龙虾不同的共进化历史答:astaci因此它们抵御病原体的能力也不同。此外,对于易感的尊贵小龙虾,我们预期高毒力的Hap B菌株比低毒力的Hap a菌株对尊贵小龙虾的免疫反应更强。相反,我们并没有期望抗性大理石纹小龙虾的基因表达在处理组之间有任何差异。最后,我们期望潜在感染的小龙虾显示出一种慢性免疫反应a . astaci挑战后21天出现差异表达的免疫相关转录本。
在这篇论文中提出的结果为参与免疫反应的基因库提供了新的见解答:astaci挑战,加深了我们对淡水小龙虾免疫力和它们与病原体相互作用的理解,答:astaci。
结果与讨论
肝胰脏中的免疫相关转录本,是小龙虾免疫应答的中介答:astaci挑战
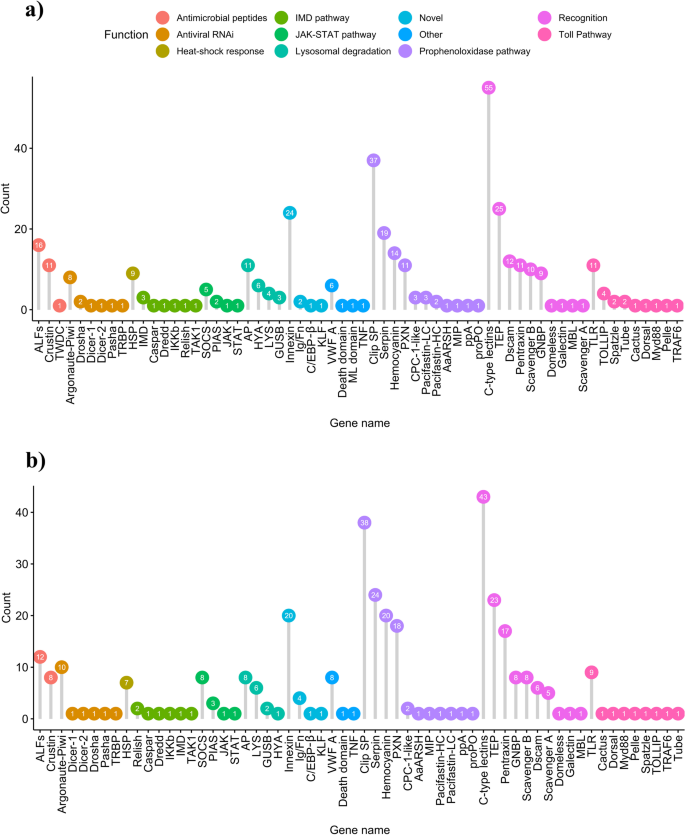
非模式生物的基因组研究面临着对来自未知来源的大量基因进行注释的挑战。这种挑战在甲壳纲动物中尤为明显[42,43],这在基因组研究中仍未得到充分代表。迄今为止,在代表Pancrustacea的727个基因组集合中,只有48个属于甲壳纲动物(其余679个基因组属于六足纲动物)(genome - ncbi数据集,访问日期:2021年4月)。此外,典型的proPO通路被认为是甲壳纲动物的核心免疫反应机制[44,在KEGG数据库中没有表示。因此,我们采用基于序列和区域相似性的方法对尊贵小龙虾和大理石纹小龙虾肝胰脏转录组中的先天免疫相关基因进行了注释。通过该方法在贵族小龙虾和大理石纹小龙虾中分别鉴定出了372和353个先天免疫相关基因(图2)。1,表2,表3.,文件2,文件3.).
有代表性的免疫相关通路的基因,通过在(一个)高贵的小龙虾和(b大理石小龙虾。所有基因的缩写都在表S中7
这些先天性免疫相关基因的鉴定为未来淡水小龙虾先天性免疫的转录组学和基因组学研究提供了基础。例如,我们成功地识别了免疫信号Toll通路的成员。这一途径在Malacostraca的大多数成员中是保守的[45],其激活对六足动物抗菌肽(AMPs)的表达至关重要[46,47].在尊贵小龙虾和大理石纹小龙虾中,我们发现大部分Toll通路相关基因为单拷贝(图1)。1).最近,对许多海洋和淡水十足类动物的先天免疫相关基因进行了广泛的综述[45].在这些物种中鉴定出的TLRs数量在0到8之间,与本研究中发现的TLRs数量略高于较高值(贵族小龙虾中有11个,大理石小龙虾中有8个)相匹配。.最后,在尊贵小龙虾TOLLIP中,Spätzle和Tube在多个拷贝中被检测到(图5)。1).
淡水小龙虾的先天免疫系统装备了大量的prr,能够识别各种pamp [48].β-(1,3)-葡聚糖受体(通常称为革兰氏阴性结合蛋白(GNBPs)或脂多糖结合蛋白)在proPO级联激活中起着至关重要的作用[49].本研究发现,所有gnbp都具有与碳水化合物结合的β-葡聚糖酶结构域[45].这个家族的扩张之前在Decapoda中有过报道[45],并在本研究中确认了高贵小龙虾中发现的9个gnbp和大理石纹小龙虾中的8个gnbp(图5)。1).免疫分子和通路参与了对答:astaci挑战将在本节中详细讨论免疫应答对阿斯塔奇菌挑战的分子机制.
基因表达谱答:astaci挑战小龙虾
测绘结果探索性分析
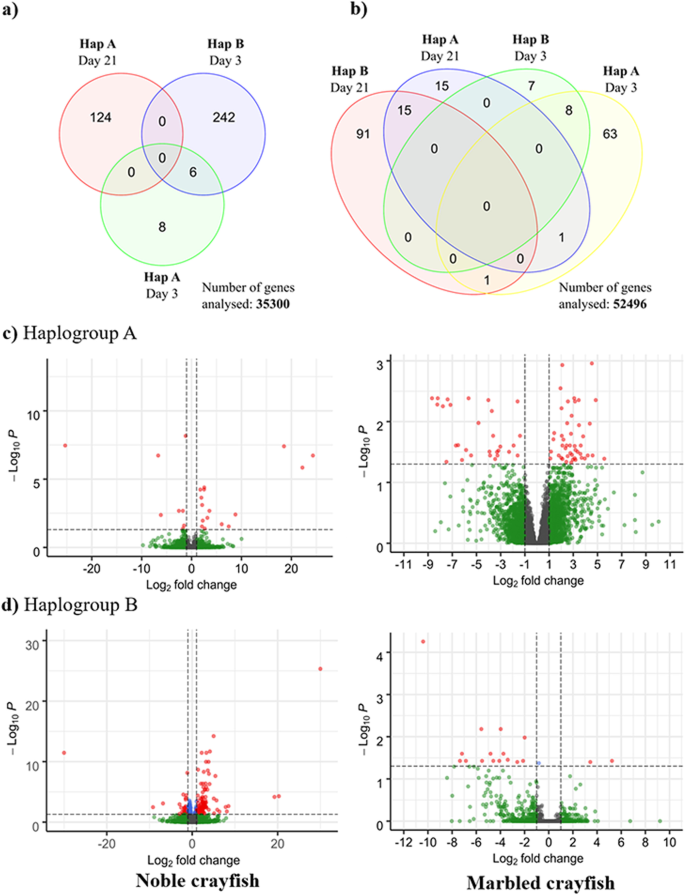
尊贵小龙虾的处理reads的平均映射率为88.96%,大理石纹小龙虾的平均映射率为91.98%(表S4).然后是主成分分析(PCA),进行比较的重复答:astaci挑战小龙虾与对照组。PCA的初步结果显示高贵小龙虾和大理石纹小龙虾样品存在批处理效应(图S1).对于高贵的小龙虾来说,这种影响与雄性和雌性个体之间的差异有关,占方差的21%。对于大理石纹小龙虾,最高水平的方差(63%)是由繁殖和非繁殖的孤雌雌虾之间的差异造成的(见Francesconi等人)。41),以获得详细信息)。因此,在下游差异基因表达分析中,我们考虑了贵族小龙虾的性别和大理石纹小龙虾的繁殖状况,将其作为因子纳入DESeq2分析。在去除批处理效应后,PCA分析显示只有对答:astaciHap B对尊贵小龙虾构成了挑战,而其他尊贵小龙虾样本和大理石纹小龙虾样本均未发现这种分组现象(图S1).
差异表达基因
在差异基因表达分析中,去除基因数量较少的基因后,对贵族小龙虾的35300个基因和大理石纹小龙虾的52491个基因进行了分析。在尊贵小龙虾中,共检测到380个DEGs(202个上调,178个下调)答:astaci所有处理的结果(图5)。2,表的年代5).在攻毒后3天,尊贵小龙虾中观察到的DEGs数量最多,达到243个(141个上调,102个下调)(图4)。2),其中许多参与免疫反应(图。3.).在攻毒后3天,尊贵小龙虾的DEGs含量最低,只有14个(7个上调,7个下调)(图4)。2).在攻毒3天后的尊贵小龙虾中观察到与先天免疫相关的DEGs,主要与proPO级联相关(图4)。2).在大理石纹小龙虾中,共检测到232个DEGs,其中102个表达上调,130个表达下调答:astaci所有处理的结果(图5)。2,表6).与先天免疫相关的DEGs在Hap A株攻毒后3 d最多,有79个(47个上调,32个下调),而在Hap B株攻毒后21 d,大理石纹小龙虾的DEGs总数最多,有107个(40个上调,67个下调)。在攻毒后3天,Hap B攻毒的大理石纹螯虾中观察到的DEGs含量最低,只有15个DEGs,且均下调(图2)。2,表6).
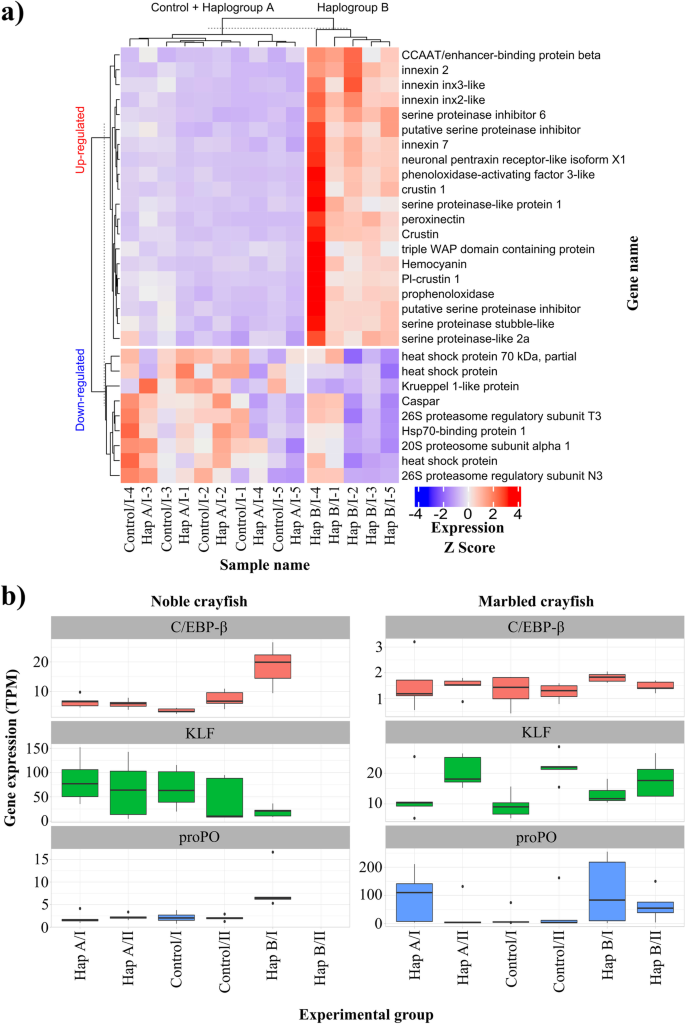
每种样本的免疫基因和在尊贵小龙虾(一个)将原始计数转换为每百万份转录本(TPM),然后用Z分数缩放进行标准化(其中Z分数计算如下:Z = s我——μ、σ我为样品在TPM中的基因表达量,μ为TPM中各基因表达量的均值,σ为TPM中各基因表达量的标准差)。因此,热图中的颜色反映了每个基因样本之间的相对表达量,红色表达量高,蓝色表达量低。Hap A,单倍群A;Hap B,单倍群B, I和II,分别为第一和第二采样点(攻毒后3天和21天),1-5,小龙虾识别号(b)酚氧化酶原蛋白(proPO)、CCAAT/增强子结合蛋白β (EBP)和Krueppel样蛋白(KLP)在石纹小龙虾和尊贵小龙虾中的基因表达答:astaci.表达式值显示在TPM中
我们的结果表明,没有慢性或长期的免疫反应的挑战答:astaci在这两个物种。挑战后21天缺乏明确的免疫反应信号表明,肝胰脏中的主动免疫反应已经停止,或低于第二次取样时差异基因表达分析的检测水平(丰富的基因集对答:astaci挑战).然而,正如先前在其他研究中所指出的,慢性反应可以通过潜伏感染小龙虾血淋巴中的循环血细胞介导[50].未来的研究重点是比较小龙虾多个免疫相关组织之间的基因表达模式,可能会澄清这方面的问题。
丰富的基因集对答:astaci挑战
作为差异基因表达分析的补充方法,我们利用了新发现的免疫相关基因(肝胰脏中的免疫相关转录本,是小龙虾免疫应答的中介答:astaci挑战)进行基因集富集分析。这种方法使我们能够检测到基因表达数据中适度或轻微的变化[51].对于尊贵的小龙虾,我们的结果显示,在Hap B挑战组中AMP、proo途径和新(包括本研究中发现的新基因)基因集的富集(图。4)和识别基因集(图S2).在攻毒后3天的尊贵小龙虾中,proPO途径基因组表达不足。在大理石纹小龙虾中,Hap B挑战组的AMP、proPO和识别基因集在两个采样点都得到了富集(图S2).此外,在Hap A挑战组中,识别和proPO基因集丰富(图。4).在大理石纹小龙虾中,在注射Hap A后21天,我们没有检测到富集的基因集。这些结果与差异基因表达分析一致,表明proo通路、AMPs和识别蛋白,虽然没有被检测到差异表达,但在应答中起着主要作用答:astaci挑战。它们的相互作用和意义将在下文讨论。
免疫反应的分子机制答:astaci挑战
酚氧化酶原级联的激活
尽管在两种小龙虾中,proPO通路都被激活了,但我们发现在两种小龙虾中,不同效应子群和数量的激活在免疫反应中存在显著差异。proPO级联的激活是甲壳类动物中研究最多的体液反应。4) [49,52].酚氧化酶(PO)以酶原/非活性形式合成(proPO),是该途径的中心酶。它被激活的丝氨酸蛋白酶(ppA)切割成具有催化活性的PO和20 kDA n端片段(ppA- propo),具有很强的凝集和杀菌能力[53].被激活的PO参与将酚类物质转化为有毒醌中间体,参与黑色素的产生,黑色素是proPO级联的最终病原体包封剂[50].与PO一起,ppA激活过辛素(PXN)的形成,参与调理、细胞粘附和包封[54,55].以前的假设是,只有成熟的血细胞(颗粒状和半颗粒状)在对病原体刺激的反应中负责proPO的释放[44,52],其特征是命题表达式的开始[26].我们的结果表明,除了血细胞外,肝胰脏也参与了这一途径的中心蛋白的产生(图。3.).
在我们的研究中,我们观察到在受Hap B挑战的尊贵小龙虾的肝胰脏中,proPO、ppA和过辛粘连素的上调。3.一个,无花果。5),而在大理石纹小龙虾中,这些基因在任何处理组中都没有差异表达。尽管如此,我们的研究结果表明,在对病原体刺激的反应中,易感和耐药小龙虾的肝胰脏中proPO的表达都可以发生改变(图1)。3.).事实上,虽然proPO在大理石纹小龙虾中没有差异表达,但在使用Hap A的大理石纹小龙虾中,proPO表达水平的差异(转录本/百万,TPM)要高得多答:astaci挑战后3天,Hap B答:astaci分别在攻毒后3天和21天,与用Hap B攻毒的尊贵小龙虾进行比较答:astaci(无花果。3.).两组大理石纹小龙虾的GSEA结果证实了proo通路的激活(图。4,无花果。2).此前的研究发现,在两种细胞中,proo的表达水平存在显著差异答:astaci -易感及耐药小龙虾[24].具体而言,我们观察到proPO在抗入侵信号小龙虾中的表达持续升高,表达水平不因免疫刺激而改变,而在易感的尊贵小龙虾中,proPO的表达水平较低,且表达水平取决于病原体的存在。我们的研究结果指出,在耐药大理石纹小龙虾中,proPO的表达对病原体的反应的调节表明,proPO在肝胰脏和血细胞中的基础表达水平和激活的动态可能是不同的。
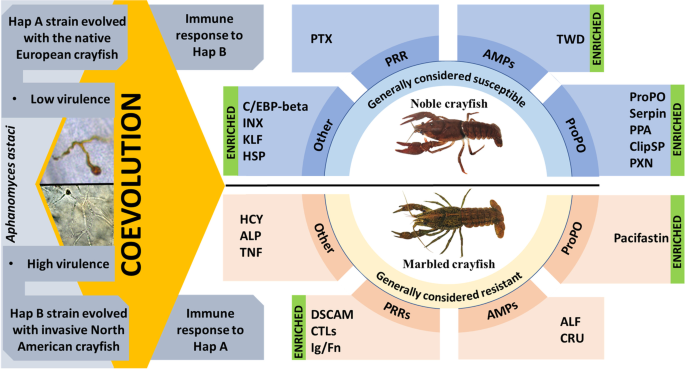
实验结果的图解总结。高贵小龙虾和大理石纹小龙虾都暴露在两种病原体菌株下答:astaci、高毒力Hap B和低毒力Hap A。两种物种都对a . astaci虽然只针对一种菌株。尊贵小龙虾的免疫系统对Hap B株有反应,大理石纹小龙虾的免疫系统对Hap A株有反应。利用的Hap A品系已经与欧洲尊贵小龙虾共存了70年,我们的结果表明,在这段时间内,它适应了新的宿主。另一方面,从塔霍湖的原始宿主中分离出来的Hap B菌株对入侵的北美小龙虾表现出了高度的适应能力。将差异表达基因(DEGs)分为4组:酚氧化酶级联相关原(proo)、抗菌肽(AMPs)、病原识别受体(PRR)和其他。强调了富集的基因集(基于GSEA)。有关发展计划的全称,请参阅缩写
我们的结果表明,在受Hap B挑战的尊贵小龙虾中,几种丝氨酸蛋白酶(Clip SPs)和丝氨酸蛋白酶抑制剂(serpin)在对感染的反应中上调(图。3.,表5), pacifatin - hc基因在攻毒后3天上调(图。5,表6).这些基因负责对proPO级联的空间和时间控制。4) [50].过度激活proo通路会因产生和释放有毒醌类物质而对宿主造成损伤,因此这种抑制蛋白是极其重要的。具体来说,参与proPO调控的蛋白有:pacifastin, ppA的调控抑制剂[56];黑化抑制蛋白[57];caspase -1样分子(CPC-1-like),与proPO同时释放,限制proPO的蛋白水解;甘露糖结合凝集素[53].据报道,serpin在proPO级联抑制中发挥作用[58].对卵菌β-(1,3)-葡聚糖的识别激活了Clip SP级联,负责ppA的裂解[44].上调的serpin也可能参与了对卵菌蛋白酶的抑制[59].因此,蛇形蛋白具有双重作用,既可作为抗卵菌剂,又可作为防止proPO级联过度激活的保护剂[33,60].这进一步被大量编码Clip SP的基因(贵族小龙虾37个,大理石纹小龙虾38个)和它们的抑制serpin(贵族小龙虾19个,大理石纹小龙虾24个)所支持。Lai和Aboobaker先前曾观察到Malacostraca中Clip SP的扩展(与其他Pancrustacea相比较)[45],在白腿虾中Clip SP的数量最多(72)。在感染了Hap B的尊贵小龙虾和感染了Hap A的大理石纹小龙虾的肝胰脏中,proPO级联效应子和proPO抑制剂的共表达表明,proPO级联高度参与了对大肠杆菌的反应答:astaci挑战。与贵族小龙虾相比,大理石小龙虾似乎激活了proPO通路的不同元素。不幸的是,我们无法区分这是由于两个物种的proPO通路中所涉及的分子表达的真正差异,还是由于大理石纹小龙虾的反应存在高度的个体差异。虽然只有一个基因被注释为假定的proPO,但在两个物种中都发现了多个含有血红素(HCY)结构域的基因(贵族小龙虾中有14个,大理石纹小龙虾中有20个)。1).HCY在进化上密切相关,但与命题不同[61].认为甲壳类HCYs在一定程度上可以模仿proPO功能[44].甲壳类HCY是一种大型的3型铜,含有呼吸蛋白,形成六聚体结构,负责氧气运输[62].除了proPO,在受Hap B挑战的尊贵小龙虾中,我们观察到其中一种含有HCY的蛋白质上调(图。3.,表5).在用Hap A刺激的大理石纹小龙虾中,在3天后肝胰脏中也观察到高表达的HCY蛋白上调(图1)。5,表6).与脊椎动物血红蛋白不同,HCYs是细胞独立的,只悬浮在小龙虾的血淋巴中[62].这意味着HCYs可以直接从合成它们的肝胰脏排出到小龙虾的血淋巴,而不会对机体造成损害[63,64].另一方面,proPO必须被运送到感染部位,并与半颗粒状和颗粒状的血细胞(血细胞)颗粒结合[24,50].在免疫挑战后不久,由于血细胞向感染部位移动,可观察到循环血细胞数量显著减少(称为血细胞减少)[31,65].这些血细胞在造血过程中主要由造血组织直接取代[28].这通常发生在初次挑战后12-48小时[27,65].因此,在循环血细胞消耗期间,敏感和耐药小龙虾都可以依靠体液先天免疫反应的成分,如抗菌肽和HCYs,直到血细胞补充。这与Decker等人的观察是一致的,[62]表明狼蛛循环血淋巴中高浓度的HCYs与先天免疫有关[66].最后,HCYs可以被蛋白水解处理,从而释放出amp,例如那些属于阿斯塔酸蛋白家族的amp [67].
模式识别受体(PRRs)的表达
我们在大理石纹小龙虾体内观察到两种推测的c型凝集素(ctl)上调,其中一种在大理石纹小龙虾体内答:astaciA组攻毒后3天,1组攻毒后3天答:astaciHap B攻毒组在攻毒后21天(图。5,表5).凝集素是一组不同的蛋白质,能够以高特异性结合碳水化合物结合结构域[68].在甲壳类动物中,凝集素的识别导致下游细胞和体液反应的激活,如凝集[69],内吞作用[70,包封和结节形成[71],安培的合成[72],抗病毒活性[73],以及通过proPO级联激活的黑化[74].我们已经在高贵小龙虾中确定了55个推测的ctl,在大理石纹小龙虾中确定了43个推测的ctl。1).在PRRs中,ctl在淡水小龙虾的先天免疫中起着主要作用,它们的多样性也大幅增加[45].
在与模式识别相关的差异表达基因中,我们观察到大理石纹小龙虾在受刺激3天后DSCAM上调答:astaciHap A(表S6).DSCAM是免疫球蛋白(Ig)超家族的一员,在哺乳动物和无脊椎动物中具有类似的结构。DSCAM分子由三个主要成分组成,一个含有多个Ig和纤维连接蛋白III型结构域的细胞外区域,一个跨膜结构域和一个细胞质尾巴。与哺乳动物不同,无脊椎动物DSCAM在细胞外结构域表现出高度变异性,这是通过mRNA成熟过程中的选择性剪接机制实现的[75,76].总的来说,我们在高贵小龙虾和大理石小龙虾中分别鉴定了12个和6个推测的dsca编码基因。1).DSCAM分子已被证明与抗病毒药物有关[77]和抗菌反应,主要在调理作用[49].值得注意的是,由于其高变量域,DSCAMs被认为可能是甲壳纲动物免疫记忆的关键分子[29].ctl和DSCAMs都可以以膜结合和分泌形式存在[78,79].因此,小龙虾肝胰脏中表达的ctl和DSCAMs很可能在受到免疫挑战时直接排泄到血淋巴中,作为病原体感染体液免疫应答机制的一部分。
除了DSCAM外,我们还观察到在大理石纹小龙虾受刺激3天后,另一种含有蛋白上调的免疫球蛋白/纤维连接蛋白(Ig/Fn)结构域答:astaciHap A(表S6).这种蛋白质与果蝇有27%的同源性(黑腹果蝇蛋白质汞合金(Ama, NCBI acc。不。:P15364.2). This amalgam-like protein was 510 amino acid (aa) long, with a molecular weight of 55.63 kDa. It contained 1–21 aa signal peptide domain, three Ig domains (67–158 aa, 166–254 aa, 257–345 aa), and a Fn domain (347–453 aa) with a cytokine receptor motive (439–443 aa). In total, we identified 2 Ig/Fn domain containing proteins with this domain organisation in the noble crayfish and 4 in the marbled crayfish (Fig.1).c -末端Fn结构域的存在清楚地区分了该蛋白质与果蝇Ama [80].尽管如此,我们可以假设这种蛋白质可以共享Ama的分泌特性及其细胞粘附特性[81],通过位于纤维连接蛋白结构域的细胞因子受体动机,可能在调理和免疫反应中介中起作用。
在受Hap B挑战的尊贵小龙虾中,我们发现了一个含有pentat - xin结构域的基因(表S5包含:PF00354)。该基因的蛋白产物长254 aa (27.95 kDa), n端有一个信号肽(1-21 aa),与来自白腿虾(XP_027224174.1, Blastx鉴定)的神经元pentat xin受体样亚型X2的同源性仅为55.5%。就像研究得最充分的戊心蛋白(如c反应蛋白(CRP)或血清淀粉样蛋白P成分(SAP))一样,这种戊心蛋白,由于其大小,可能属于短戊心蛋白组[82].我们在尊贵小龙虾和大理石小龙虾中分别鉴定了11个和17个penttraxin基因。1).五轴蛋白(或称五轴蛋白)是一组多功能和进化的保守蛋白,在体液先天免疫反应中起关键作用[83].它们可以识别多种与病原体相关的分子模式,并作为调理蛋白、细胞毒性效应剂、凝集促进剂或补体激活剂[82,84,85].我们对淡水小龙虾体内补体的复杂系统了解不多,之前假设penttraxin补体激活很可能不是通过补体的C3成分介导的[84],就像在脊椎动物中一样[85,因为据报道,panrustacea中已经丢失了c3样蛋白[45].
在吸热动物中,戊曲辛的来源是肝脏[86]和马蹄蟹(鲎波吕斐摩斯)和美国龙虾(也)这些蛋白质是在肝胰脏内产生的[87,88].从那里它们被释放到血淋巴。pentacins是典型的急性期蛋白。在人类中,CRP可被用作细菌和真菌疾病进展的标记物[84].据我们所知,这是第一次在小龙虾的反应中发现含有penttraxin结构域的蛋白质答:astaci感染。这种急性蛋白可能是疾病进展的良好指标。识别蛋白参与了对答:astaciGSEA的结果进一步支持了这一挑战(图。4,无花果。2).以前曾有人提出将急性期蛋白作为免疫状态的标记应用于美洲龙虾,其中含有戊新结构域的蛋白已被确认为对病原体挑战的免疫反应的重要组成部分[42,88,89].
抗菌肽:先天免疫反应的效应器
在受到Hap B菌株挑战的尊贵小龙虾中,我们发现了三种上调的甲壳蛋白(表S5).其中,特别令人感兴趣的是含有壳蛋白的DE三乳清酸性蛋白(TWP)结构域,该结构域在高贵小龙虾中被发现,但在大理石纹小龙虾中没有同类。我们在高贵的小龙虾中鉴定出11种,在大理石小龙虾中鉴定出8种假定的甲壳蛋白。1).甲壳蛋白是阳离子抗菌肽AMPs的一部分,主要由信号肽、n端多结构域和c端乳清酸性蛋白(WAP)结构域三个部分组成。按其结构分为五组(I-V型)[90].这些甲壳蛋白主要在小龙虾的血细胞中表达,在免疫挑战时可直接迅速分泌到血淋巴中[91,92].一些甲壳类也可以表现出抗蛋白酶活性,可能抑制蛋白酶分泌答:astaci,限制病原体的生长[93].最近,在红沼泽小龙虾中发现了一种含有壳蛋白的新TWD (Procambarus clarkii),显示抗菌活性[94].在受Hap B菌株刺激的大理石纹小龙虾中,我们在21天后发现了一个上调的壳蛋白(表S6).甲壳蛋白可能在淡水小龙虾的抗卵菌反应中发挥重要作用,值得进一步重视。含有甲壳蛋白的TWD可能是特别值得关注的,因为它们被推测为组织广泛的表达谱,并在全身参与宿主免疫[94].
抗脂多糖因子(ALF)在灌胃后3天被检测到上调(表S6),而高贵小龙虾中未检测到DE ALFs。这表明,ALF基因的上调可能在大理石纹小龙虾抗氧化过程中起着至关重要的作用答:astaci挑战,可能通过与卵菌β-1-3-葡聚糖结合,从而增强宿主的抗菌防御能力,作为血红细胞的调理蛋白[90].在高贵小龙虾中,我们确定了16个假定的alf,在大理石小龙虾中,我们确定了12个假定的alf(图。1).alf是一种n端疏水区形成的小蛋白,有三个β-片和三个α-螺旋[45),包含:DUF3254。在许多甲壳类动物中都观察到它们的存在[95],并在广泛的组织中表达,对细菌和真菌微生物表现出生长抑制活性,以及声学活性[96,97].与甲壳蛋白一样,它们具有信号肽结构域,可被排出体外[90].AMPs在贵族小龙虾和大理石纹小龙虾体内都得到了富集(图。4,无花果。2).
小龙虾先天免疫中缝隙连接蛋白的参与
在差异表达基因中,我们检测到4个内联蛋白(INXs)在攻毒后3天在Hap B攻毒的尊贵小龙虾中上调(表S5).这些蛋白质代表构成缝隙连接半通道的亚基,它们类似于脊椎动物连接蛋白亚基[98].的gap junctions represent the sites of the direct cell to cell communications. This interaction is achieved through the formation of the plasma membrane spanning channels, with each cell contributing to one half of the channel. The mechanisms of gap-junction communications and their repercussions have long been studied in vertebrates, where they are widely distributed across tissues [99,One hundred.].尽管这些通道最早于20世纪50年代在贵族小龙虾细胞中被观察到,但它们在淡水小龙虾物种免疫中的作用尚不清楚[101].我们在高贵小龙虾中确定了23个假定的INXs,在大理石纹小龙虾中确定了20个假定的INXs。1).相比之下,在果蝇中鉴定出8种INXs,在蛔虫中鉴定出25种INXs (Cenorabditis线虫),地中海药用水蛭21种(水蛭verbana)和约拿蟹(癌症北欧化工) [102,103,104,105].在泥蟹(“锡拉”paramamosin), Sp-inx2在细菌攻毒后的肝胰脏、鳃和血细胞中表达上调,在正常情况下,Sp-inx2在血细胞中高表达[106].尽管INXs在无脊椎动物中的作用在很大程度上尚不清楚,但基于目前对其他物种中缝隙连接蛋白功能的了解,我们可以认为它们可能参与抗原处理,以及代谢和信号分子运输[107].这进一步证实了肝胰脏作为免疫分子分布到小龙虾血淋巴的关键器官的作用[33].需要进一步的研究来阐明INXs在无脊椎动物免疫中的作用。
转录因子作为反应的新成分答:astaci挑战
基因表达水平的变化是通过一组特定的转录因子控制的,这些转录因子与基因调控序列相互作用,出现在启动子和增强子区域。在受Hap B侵袭的尊贵小龙虾中,我们在3天后发现了上调和下调的基因,这些基因作为转录因子,在病原体的免疫反应中发挥着至关重要的作用(表S5).其中一个基因是主基因表达调控因子,属于CCAAT/增强子结合蛋白(C/EBP)家族[108].该家族参与调节细胞生长、分化和死亡,以及在各种疾病中的造血、免疫和炎症过程[108,109].CCAAT/增强子结合蛋白β (C/EBP-β)在贵族小龙虾和大理石纹小龙虾中都存在,在受到Hap B刺激的贵族小龙虾中表达上调,而大理石纹小龙虾中的表达水平保持不变(图1)。1,无花果。3.).已有研究表明,ALFm3(抗脂多糖因子家族成员)在巨虎对虾中的表达受C/EBP-β的控制[110].此前也有研究表明,C/EBP-β结合位点存在于外壳蛋白Pm7中[111].C/EBP-β和NF-κB (Toll和IMD通路的关键转录因子)在促进炎症介质基因表达过程中的相互作用[112].在小鼠中,C/EBP-β负责控制肿瘤坏死因子α (TNFα)、SAP、补体C3成分的表达[108].这可能表明,推测的C/EBP-β上调对急性期的发病至关重要答:astaci高贵小龙虾的感染。
此外,我们检测到在尊贵小龙虾中,Krüppel-like因子(KLF)家族成员Krüppel 1-like因子蛋白(KLF1)下调答:astaciHap B(表S5,无花果。3.).KLF家族成员是参与多种代谢途径和各种组织能量稳态的转录因子[113].KLF1属于一组主要作为转录激活因子的klf,尽管也有与转录抑制因子相互作用的报道[113].它在高贵小龙虾和大理石纹小龙虾的单拷贝中都存在。1).在人类中,KLF4与抗真菌反应的调控密切相关来自烟曲霉属真菌而且白色念珠菌并被确定为免疫挑战中唯一被下调的转录因子[114].研究表明,在白腿虾(方面对虾),宿主LvKLF对病毒病原体的复制和基因表达很重要[115,116].在巨大的河虾(Macrobrachium rosenbergii)的研究表明,MrKLF是四种抗菌肽(即Crustin (Crus) 2、Crus8、ALF1和ALF3)表达的重要调控因子[117].目前对无脊椎动物KLF的表达和调控机制还缺乏研究,因此对KLF的功能还有待进一步研究。根据尊贵小龙虾KLF1表达水平的变化,我们可以推测,KLF1的抑制对该物种免疫反应基因的激活很重要。在大理石纹小龙虾中,KLF1的表达水平没有变化答:astaci挑战(图。3.).
与KLF1一起,我们还检测到Caspar的下调,Caspar是一种与fas相关因子1同源的转录抑制因子答:astaciHap B(表S5,无花果。3.).该转录因子已被证明在果蝇中发挥关键作用,通过抑制IMD通路对其抗菌抗性产生负面影响[118].在这两个物种中,卡斯帕在单个拷贝中被检测到(图。1).
其他deg在响应答:astaci挑战
在大理石纹小龙虾中上调的DEGs中,我们观察到几个其他的免疫相关基因,如肿瘤坏死因子(TNF)域包含蛋白(Panther入口:PTHR15151;蛋白质艾格尔峰;溶酶体酶和碱性磷酸酶(AP)(表S6).细胞因子,tnf所属的一类分子,在免疫和炎症反应的中介中起着重要作用[119].它们也是细胞外陷阱释放(ETosis)的激活剂,这是一种杀微生物机制[120].TNF也是上述klf的下游靶点[114].此外,在果蝇中,TNF的同系物Eiger负责晶体细胞中proPO的释放[121].TNF也是C/EBPβ表达和DNA结合活性的激活剂[109].该基因在抗卵菌反应调控中的意义有待于未来研究的实验证明。碱性磷酸酶、β-葡糖苷酸酶、溶菌酶、酯酶和蛋白酶被认为是无脊椎动物体内的一些主要溶酶体酶[31].溶酶体活性与巨虎对虾肝胰脏上皮细胞的抗原处理及其随后释放到血淋巴的机制有关[33,34,122].这一观察结果可能进一步证实肝胰脏在建立免疫耐受的作用答:astaci挑战。
有趣的是,我们发现热休克蛋白(HSP)家族的4个成员(HSP70-like, HSP-like-1, HSP-like2和HSPBP 1)以及蛋白酶体成分(20S蛋白体亚基α 1, 26S蛋白酶体调节亚基N3和26S蛋白酶体调节亚基T3),在急性感染的尊贵小龙虾中,Hap B菌株挑战后3天下调(表S5,无花果。3.).建立正确的蛋白质构象对蛋白质的活性非常重要。未能做到这一点可能是由于缺乏分子伴侣,如热休克蛋白家族成员[123].此外,泛素介导的蛋白水解蛋白酶体基因的下调可能导致了蛋白质的错误折叠聚集。已有研究表明,巨虎对虾对白斑综合征病毒(WSSV)的抗病毒反应中hsp70上调[124和红沼泽小龙虾[125].在果蝇中,已有研究表明HSP 27具有抗凋亡活性,抑制tnf介导的细胞死亡[126].这可能表明在答:astaci挑战,在急性感染的尊贵小龙虾中,组织广泛的凋亡正在进行中。
宿主对病原体挑战免疫反应的共同进化方面
我们的实验装置,由高贵的小龙虾和大理石小龙虾组成答:astaci不同来源和毒力的菌株,使我们能够推断宿主对病原体挑战的免疫反应的共同进化方面(图1)。5).利用的Hap B菌株具有高毒力的特点,是从一种潜伏感染的美洲入侵信号小龙虾(种渐渐来自太浩湖(美国)的主持人。利用的Hap A菌株的特点是毒力低,从一种反复受挑战的、潜伏感染的尊贵小龙虾宿主群体中分离出来,并可能在该群体中存在了至少70年[127].因此,这两种菌株应该代表了马赛克景观的极端答:astaci欧洲目前的紧张局势。Francesconi等人描述的感染实验结果[41表明高贵的小龙虾受到了挑战答:astaciHap B在它们的组织中有最高的病原体DNA,这表明病原体成功地克服了宿主的免疫防御。这与在这个实验组中观察到的大量免疫相关的DEGs相对应。此外,在其他实验(我们未发表的实验结果)中观察到,所有感染了这种特定Hap B菌株的尊贵小龙虾在受寄生虫挑战后2周内死亡。另一方面,感染Hap A的尊贵小龙虾含有病原体,在肝胰脏中没有明显的免疫反应,感染45天后无症状[41].在大理石纹小龙虾中,Hap A攻毒组的免疫相关DEGs含量最高,而Hap B攻毒组的免疫反应不明显。事实上,基于差异基因表达分析,我们在Hap B挑战的大理石纹小龙虾中没有观察到免疫反应激活,尽管prop、amp和识别基因集的富集表明这些通路有低水平的动员(图。4,无花果。5,无花果。2).有趣的是,大理石纹小龙虾中检测到的病原体DNA含量最高的是Hap B挑战组[41].这一结果表明答:astaci它在宿主组织上的定植能力并不是影响宿主免疫反应强度的唯一因素。事实上,一种可能的解释可能围绕着小龙虾和一种特定菌株之间的共同进化过程答:astaci.
有几个例子表明,无脊椎动物虽然缺乏适应性免疫系统,但可以建立免疫记忆,在随后接触同一病原体后,产生不同程度的免疫反应[29,128].这种反应可能是一种耐受性,对已知刺激的免疫反应降低,或在再次遇到同一病原体时增强免疫反应提高[128].此外,已在昆虫中观察到跨代免疫启动,即暴露于病原体的亲本将免疫记忆传递给下一代[129,130)和卤水虾(卤虫franciscana) [131].虽然具体的机制还不完全清楚,而且很可能根据宿主和寄生虫的不同而不同,但跨代免疫启动可能是北美小龙虾物种之间宿主-病原体共同进化的基础,这一争论已久答:astaci[14,132].
人们普遍认为,共同进化是一个动态和持续的过程,宿主对病原体的快速适应(反之亦然)可以在短时间内发生,甚至几十年[6].Hap A菌株从芬兰Venesjärvi湖潜在感染的尊贵小龙虾中分离得到。在过去的50年里,直到2000年,湖中高贵的小龙虾种群至少面临3次大规模死亡。2013年,该人群被确定为答:astaci[127].我们的研究结果表明,可能在至少50年的时间里,本研究中使用的Hap a菌株适应了它的naïve原生欧洲宿主,高贵的小龙虾,可能是通过修改其病原表位。这导致了病原体毒性的总体降低。一般来说,Hap A包含第一种答:astaci可能在1859年到达欧洲的菌株(奥尔德曼1996年)。因此,与其他欧洲小龙虾物种的长期共存很可能导致属于该单倍群的其他品系经历了与实验中使用的品系相同的适应过程。
本研究中使用的尊贵小龙虾来自居住在Rytky湖的种群。这个种群在20世纪80年代经历了一场小龙虾瘟疫流行病[19].从那以后,它已经恢复了,没有进一步的检测到答:astaci存在(19].感染了Hap A的尊贵小龙虾免疫系统的明显不激活可能代表免疫耐受的一个实例,万一答:astaci感染莱茨基湖人口的菌株属于Hap a。不幸的是,它的单倍群答:astaci应变是未知的。因此,对于可能的共同进化是如何塑造了从莱茨基湖到美国的小龙虾的免疫反应,我们不可能得出结论答:astaci实验中检测的菌株。As Hap A of答:astaci适应尊贵小龙虾,新的表位由此呈现答:astaci该菌株导致大理石纹小龙虾体内多种PRR基因的高表达,负责识别病原体并增强其免疫反应能力。
大理石纹小龙虾的起源可以追溯到最近发生在中国的一次三倍体化事件Procambarus fallax从佛罗里达(133,134].到目前为止,还没有关于答:astaci在佛罗里达州。然而,考虑到广泛分布答:astaci在美国东部(Martìn-Torrijos等人,2021年)和大理石小龙虾对病原体的耐药性升高(Francesconi等人,2021年),很可能是p . fallax和一些菌株共同进化答:astaci。发展出的抗药性答:astaci然后被大理石纹小龙虾继承。作为答:astaci单倍群B只分布在美国西部,大理石纹小龙虾和p . fallax遇到属于Hap B的菌株[135].然而,大理石纹小龙虾在感染实验中对Hap B菌株的显著耐药性表明,推测的共同进化p . fallax以其原生答:astaci菌株对不同菌株产生广泛的抗性。此外,在调查的分布答:astaci在美国,[135据观察,不同菌株的病原体可以在同一群体甚至同一个体中共存。生物多样性的提高答:astaci它的原生范围和广泛的分布为选择具有广泛抗性的小龙虾物种创造了有利条件。这进一步得到了缺乏的支持答:astaci即使淡水小龙虾在其自然活动范围之外进行了内部转移[135].有趣的是,美国东部富含单倍群A的菌株。135].如果p . fallax已经多次遇到属于这个单倍群的菌株,这将进一步验证我们的结果,表明来自Venesjärvi湖的Hap A菌株经历了快速的进化变化,以适应新的高贵的小龙虾宿主,而变得不那么容易识别大理石小龙虾。
有人认为,欧洲本土小龙虾种群的危害是由答:astaci如果出现了答:astaci在欧洲的出现只是由于1850年左右第一次偶然的引入[12].第一次大规模死亡可能导致小龙虾种群的局部灭绝,限制了小龙虾鼠疫的传播,并可能导致病原体的消失[12].不幸的是,随后有意引进的不同种类的北美小龙虾,与他们新的单倍群答:astaci,导致数种病原体菌株无法控制地扩散,这些菌株现在已在欧洲站稳脚跟[12].虽然我们可以得出结论,本研究中使用的Hap A菌株自引入欧洲以来经历了显著的进化变化,但现有的标记无法将该菌株与属于Hap A的其他菌株(无论是在欧洲还是北美)区分开来[135].越来越明显的是,虽然迄今为止使用的遗传标记(RAPD, mtDNA和微卫星)允许对种内多样性的第一次普遍区分答:astaci[21,136,137],它们并不能可靠地预测菌株的毒力以及菌株对欧洲本土小龙虾的潜在影响,从而对淡水生态系统的影响。对欧洲本土小龙虾的保护工作将大大受益于基因组方法分析全基因组种内多样性答:astaci。这种方法将使菌株之间的区分更加精细,综合了有关病原体毒性及其对淡水生态系统后果的信息。最终,这将导致更好的信息和精细调整的保护行动。
研究的局限性
这项研究为先天免疫反应提供了深刻的见解答:astaci挑战高贵的小龙虾和大理石小龙虾。转录组学数据使我们能够探索小龙虾免疫的基因表达格局,并识别关键基因。然而,对基因表达谱有很大影响的基因组位置和基因环境信息仍然没有得到。因此,为淡水小龙虾生成第一个高质量的基因组组合是小龙虾免疫领域的优先事项,并将允许未来全面的表观基因组研究。不幸的是,到目前为止,这被证明是一项具有挑战性的任务,因为淡水小龙虾的基因组通常很大,有很高比例的重复DNA序列[133,138,139].此外,虽然在十足目动物中,肝胰脏在对抗病原体的免疫反应中的作用已经得到证实,但必须考虑到观察到的表达谱可能受到渗透的血细胞的影响[27,93].未来,这个问题可以通过研究更多的组织和应用更高分辨率的单细胞RNA测序来解决,该测序能够区分一个组织内的不同细胞群[140].最后,在剔除了与繁殖小龙虾相关的批处理效应后,对大理石纹小龙虾进行了基因表达分析,这可能会使我们的结果产生偏差。已有研究表明,免疫相关基因在繁殖昆虫中过度表达[141].同样,如果小龙虾的繁殖涉及到免疫相关基因的上调,那么批量效应的去除可能也会去除大理石小龙虾组中相关的DEGs。一般来说,在选择属于同一队列的实验动物时,应尽量减少实验动物的性别、大小、年龄、脱毛阶段和繁殖状况不同所造成的基因表达差异。这样就可以避免由于去除批处理效应而可能产生的偏差。
结论
我们的结果表明,小龙虾和一个特定的品系共同进化答:astaci在决定宿主对病原体的免疫反应强度方面起着关键作用。本研究中使用的Hap A菌株的毒力降低,高贵小龙虾对该菌株的免疫反应降低,表明两者之间的共同进化答:astaci高贵的小龙虾在自然界中很快就会出现。这种宿主-病原体的协同适应为欧洲本土小龙虾的未来生存带来了希望。尽管如此,小说的反复介绍答:astaci菌株代表了欧洲本土小龙虾种群的巨大压力,从贵族小龙虾对Hap B菌株的急性反应可以明显看出。同时,入侵的大理石纹小龙虾似乎有能力对不同的答:astaci菌株要高得多,可能是由于它的北美起源和它的近亲之间可能的相互作用p . fallax与多个答:astaci菌株。根据这些结果,现在很明显,未来的研究工作应该致力于阐明这种病原体和宿主之间的积极适应的关键因素。因此,确定的基因和通路涉及到对病原体的免疫反应答:astaci是欧洲本土小龙虾物种保护和水产养殖工作的一个里程碑。虽然我们对淡水小龙虾先天免疫反应的认识还很有限,但越来越清楚的是,多个器官和多种分子途径在其中发挥着重要作用。在这里,我们展示了肝胰脏作为一个高度相关的免疫系统器官在反应的重要性答:astaci对本地高贵小龙虾和入侵的大理石纹小龙虾都是挑战。在两种小龙虾的免疫反应中都观察到proo通路的激活。尽管如此,我们发现两种物种在动员不同群体和效应因子数量方面的免疫反应存在显著差异。因此,未来的研究不应局限于分析血淋巴中的免疫反应和proPO通路,而应考虑先天免疫反应的多因子性质,这是至关重要的。最后,研究结果为小龙虾抗性种群的筛选分析提供了基础,为保护和管理小龙虾种群提供了一种有前途的工具。
材料和方法
目标、设计和学习设定
Francesconi等人此前曾进行过对照感染实验。[41大理石小龙虾和高贵的小龙虾。实验开始前,将所有小龙虾分别放入循环水罐中驯化20天。每天监测水的状况(含氧量、温度、电导率和pH值)。通过人造灯光模拟昼夜节律,8小时亮,16小时暗。实验小龙虾大小相近,大理石小龙虾(平均甲壳长度为39.7±2.7 mm)和贵族小龙虾(平均甲壳长度为43.5±2.3 mm)。小龙虾每隔一天被喂上煮熟的冷冻甜玉米。这些小龙虾被两种不同的答:astaci,一株高毒力的Hap B菌株和一株低毒力的Hap a菌株。每毫升感染1000个游动孢子。共选取55只个体(30只大理石纹小龙虾和25只贵族小龙虾)进行RNA测序,从两个时间点(攻毒后第3天、第21天),每个处理5个重复(Hap A、Hap B、对照),除Hap B攻毒贵族小龙虾组外,该组所有小龙虾在攻毒后的头几天内都已死亡,因此在第一个时间点采样。每个个体的一部分肝胰脏被解剖并快速冷冻在液氮中。Francesconi等人对感染实验及其结果的详细描述[41].bovtjaniich等人的RNA测序reads和转录组组装的生物信息学处理细节,[142].
小龙虾先天免疫基因的鉴定及转录本的分类分布
我们检索了Lai和Aboobaker在Malacostraca中鉴定的先天免疫相关基因的数据集[45].该数据集通过筛选到的差异表达基因(DEGs)在Hap B挑战的尊贵小龙虾中得到扩展。此外,我们还包括了与proPO级联特异相关的基因。已使用的固有免疫基因及其序列的完整列表载于表S1和文件1.对带有BLASTn和BLASTx 2.10.1+的先天免疫相关基因子集进行转录组组合查询。然后检查命中,根据其e值(低于1e-10)确认其功能,并通过Pfam搜索确定功能重要的基因域的存在。
读地图
所有样本2 × 150 bp的对齐端读取(Illumina NovaSeq6000;SRA研究:SRP318523,读取深度:36.8 M- 68.9 M,平均:48.59 M)被映射到新获得的参考转录组[142](高贵小龙虾TSA: GJEB00000000和大理石纹小龙虾TSA: GJEC00000000),使用在Salmon 0.13.1中实现的伪对齐方法[143].在Salmon映射步骤中使用了几个“标志”来纠正可能源于序列数据的偏差:144, "——seqBias "和"——gcBias " [145].
差异基因表达分析
差异基因表达分析按照DESeq2协议进行[146]在R中使用以下模型设计实现了贵族小龙虾:性别(雄性/雌性)+组(对照组vs Hap A或Hap B挑战),大理石小龙虾:~繁殖(是/否)+组(对照组vs Hap A或Hap B挑战)。对每个采样点进行独立比较。Salmon输出的原始计数被用作输入。在基于BLAST对丝裂基因组(NCBI登录号:KX279347.1和NC_020021.1)进行分析之前,分别删除了与大理石纹小龙虾和高贵小龙虾丝裂基因组高度相似的转录本。根据DIAMOND搜索,分配给细菌和古生菌的转录本也被删除了2.2).结果单个三位一体转录本亚型的计数按具有tximport R包的三位一体基因分组[147].低表达基因被过滤掉:只有在至少五个样本中原始计数高于/等于10的基因被保留。“EnhancedVolcano”邮包[148]被用于视析析图,而“apeglm”则用于去除噪音[149].导出了deg的列表和它们的计数,log2倍的变化和调整p-values (FDR = 0.1,p-value = 0.05)和它们各自的注释合并。利用维恩图检查了不同时间点差异的可能重叠情况[150].
基因集富集分析
先天免疫基因集的富集2.2.使用ClusterProfiler进行了分析[151].基于DESeq2分析的结果,每一组的所有基因都按照以下指标排序:-log10(x)/sign(y),其中x是p-value和y log2倍的变化。为了检测富集的基因集,我们使用GSEA()函数p根据多次检验的Benjamini-Hochberg校正调整的值(截止< 0.01)。使用gseaplot2()函数[得到结果的图形表示形式]151].
数据和材料的可用性
在研究过程中产生或分析的所有数据都包含在本文及其补充信息文件中。其他的数据集可以在联合发表的数据注释文章中找到,其中包括所需的转录组集和原始测序读数。
缩写
- DSCAM:
-
唐氏综合症细胞粘附分子
- proPO:
-
Prophenoloxidase
- PAMP时:
-
病原体相关分子模式
- PRP:
-
模式识别蛋白
- TLR:
-
toll样受体
- Hap B:
-
Haplogroup B
- 机会:
-
Haplogroup一
- 德:
-
差异表达
- 度:
-
差异表达基因
- AMP:
-
抗菌肽
- GNBPs:
-
β-(1,3)葡聚糖受体
- ppA:
-
丝氨酸蛋白酶
- PXN:
-
Peroxinectin
- 博:
-
化酵素
- 点:
-
Innexin
- HCY:
-
血蓝蛋白
- TPM:
-
记录每百万
- 剪辑SP:
-
丝氨酸蛋白酶
- Serpin:
-
丝氨酸蛋白酶抑制剂
- MIP:
-
Melanisation抑制蛋白
- CPC-1-like:
-
半胱天冬酶1分子
- 细胞毒性t淋巴细胞:
-
c型凝集素
- 搞笑:
-
免疫球蛋白
- Fn:
-
纤连蛋白
- aa:
-
氨基酸
- PTX:
-
Pentraxin
- c反应蛋白:
-
c反应蛋白
- SAP:
-
血清-淀粉样蛋白P成分
- 台币:
-
三乳清酸性蛋白
- WAP:
-
乳清酸蛋白
- 阿尔夫:
-
Antilipopolysaccharide因素
- C / EBP:
-
CCAAT / enhancer-binding蛋白质
- C / EBP -β:
-
CCAAT / enhancer-binding蛋白β
- KLF1:
-
Krüppel 1-like因子蛋白
- KLF:
-
Kruppel-like因素
- 史:
-
Crustin
- 肿瘤坏死因子α:
-
肿瘤坏死因子
- 肿瘤坏死因子:
-
肿瘤坏死因子
- 记者:
-
碱性磷酸酶
- ETosis:
-
细胞外陷阱释放
- HSP:
-
热休克蛋白的
- 种:
-
白斑综合征病毒
参考文献
种间寄生和社会寄生同时选择下细菌突变率的进化。生物学报2013;28:20131913。https://doi.org/10.1098/rspb.2013.1913.
Betts A, Gray C, Zelek M, MacLean RC, King KC.高寄生虫多样性加速宿主适应和多样化。科学。2018;360:907-11。https://doi.org/10.1126/science.aam9974.
Paterson S, Vogwill T, bend A, Benmayor R, Spiers AJ, Thomson NR,等。拮抗协同进化加速分子进化。大自然。2010;464:275-8。https://doi.org/10.1038/nature08798.
Paul REL, Lafond T, Müller-Graf CDM, Nithiuthai S, Brey PT, Koella JC。疟疾寄生虫感染中致死性或非致死性毒力与传播成功之间关系的实验评价。生物医学学报2004;4:30。https://doi.org/10.1186/1471-2148-4-30.
盖根JL,霍姆斯EC。进化病毒毒性的系统基因组学。2018; 19:756-69。https://doi.org/10.1038/s41576-018-0055-5.
汤普森约。共同进化。在:生命科学百科。伦敦:Nat Publ Gr;2001.
汤普森约。共同进化的地理镶嵌理论。芝加哥大学出版社;2005.3-11页。
Laanto E, Hoikkala V, Ravantti J, Sundberg L-R。自然环境中宿主-寄生虫相互作用的长期基因组协同进化。Nat Commun。2017;8:111。https://doi.org/10.1038/s41467-017-00158-7.
疟疾的毒性:一个进化的观点。中华生物学报2004;39:965 - 86。
伊伯特·D,菲尔兹警局。宿主-寄生虫协同进化及其基因组特征。Nat Rev Genet。2020;21:754-68。https://doi.org/10.1038/s41576-020-0269-1.
Strauss A, White A, Boots M.生物武器入侵:疾病介导的入侵的重要性。功能生态。2012;26:1249 - 61。
Jussila J, Edsman L, Maguire I, Diéguez-Uribeondo J, Theissinger K.金钱杀死本土生态系统:以欧洲小龙虾为例。环保前沿,2021年。https://doi.org/10.3389/fevo.2021.648495.
霍迪奇DM,雷诺兹JD,索蒂-格罗塞特C,西布里PJ。非本土小龙虾物种对欧洲小龙虾威胁日益增加的综述。11.水生生态系统。2009;https://doi.org/10.1051/kmae/2009025.
美国、日本和欧洲部分小龙虾对小龙虾鼠疫的抗性。罗廷宁霍尔姆出版社,1969;49:202-9。
Jussila J, Vrezec A, Makkonen J, Kortet R, Kokko H.欧洲的入侵性小龙虾及其入侵性疾病。生物入侵改变生态系统载体,生态影响,Manag预测,2015;183-211,第8章。
Nyhlén L, Unestam T.伤口反应和丝囊霉属astaci小龙虾表皮的生长。中华传染病杂志。1980;36:187-97。
Martín-Torrijos L, Campos Llach M, Pou-Rovira Q, Diéguez-Uribeondo J.小龙虾鼠疫的抗性,丝囊霉属astaci(卵菌门),Austropotamobius pallipes.《公共科学图书馆•综合》。2017;12:1-13。
Jussila J, Vrezec A, jaklichenko T, Kukkonen H, Makkonen J, Kokko H。丝囊霉属astaci从潜在感染的石螯虾中分离(Austropotamobius torrentium)的人口是有毒的。中华传染病杂志2017;149:15-20。https://doi.org/10.1016/j.jip.2017.07.003.
芬兰的Jussila J, Maguire I, Kokko H, Tiitinen V, Makkonen J.窄爪小龙虾:丝囊霉属astaci抗药性和与其他选定的欧洲和亚洲人群的遗传关系。Knowl Manag Aquat生态系统。2020;421:1-9。https://doi.org/10.1051/kmae/2020022.
奥德曼DJ。甲壳类细菌和真菌疾病的地理传播。世界高等科学技术学院。1996; 15:603-32。https://doi.org/10.20506/rst.15.2.943.
Makkonen J, Jussila J, Panteleit J, Keller NS, Schrimpf A, Theissinger K,等。MtDNA可以对小龙虾鼠疫病原进行敏感的检测和单倍分型丝囊霉属astaci揭示了它的起源和迁徙的线索。寄生虫学。2018;145:1210-8。https://doi.org/10.1017/S0031182018000227.
Makkonen J, Jussila J, Kortet R, Vainikka A, Kokko H.毒力不同丝囊霉属astaci高贵小龙虾的分离和抗性增强Astacus Astacus对小龙虾鼠疫。中华医学杂志2012;102:129-36。
Becking T, mrugaesa A, Delaunay C, Svoboda J, Raimond M, Viljamaa-Dirks S,等。实验暴露对不同毒力的影响丝囊霉属astaci高贵小龙虾免疫反应的菌株Astacus Astacus.中华传染病杂志2015;132:115-24。https://doi.org/10.1016/j.jip.2015.08.007.
Cerenius L, Bangyeekhun E, Keyser P, Söderhäll I, Söderhäll K.淡水小龙虾宿主酚氧化酶原表达与小龙虾鼠疫真菌耐药性增加有关,丝囊霉属astaci.细胞Microbiol。2003;5:353-7。
甲壳动物免疫系统控制疾病的范围。中华传染病杂志,2012;110:251-60https://doi.org/10.1016/j.jip.2012.03.005.
Cerenius L, Söderhäll K.小龙虾免疫-最新发现。2018; 80:94-8。
甲壳类动物的免疫系统,免疫生物学百科全书,爱思唯尔,阿姆斯特丹,2016。https://doi.org/10.1016/B978-0-12-374279-7.12005-3.
李立军,李立军,Söderhäll K.节肢动物的细胞免疫:造血、凝血、黑化和调理。免疫生物学。2006;211:213-36。
低CF,冲CM。甲壳类动物先天免疫记忆的特性。鱼类贝类免疫。2020;104:605-12。
林X, Söderhäll I.甲壳动物造血与虾素细胞因子。血。2011;117:6417-24。https://doi.org/10.1182/blood-2010-11-320614.
史密斯VJ。无脊椎动物免疫学:细胞:eLS,伦敦;纽约:自然酒吧。沃尔斯。21-32;奇切斯特:威利;2016.1-13页。
甲壳类动物的固定吞噬细胞和胞饮细胞的综述及血细胞的注释。免疫学杂志1987;11:679-704。https://doi.org/10.1016/0145 - 305 x (87) 90057 - 7.
无脊椎动物肠中腺(“肝胰脏”)是免疫和代谢整合的进化先驱。Cell Tissue Res. 2014; 358:685-95。
Alday-Sanz V, Roque A, Turnbull J.清除机制创伤弧菌黑虎虾的I型中国对虾学名:.中华医学杂志2002;48:91-9。https://doi.org/10.3354/dao048091.
陈丹,郭林,易春,王姝,茹艳,王慧。红螯小龙虾的生态毒理学与环境安全Cherax quadricarinatus)为副溶血性弧菌感染下的先天免疫调节提供了见解。生态毒理学环境Saf. 2021;217:112266。https://doi.org/10.1016/j.ecoenv.2021.112266.
孟X,洪亮,杨婷婷,刘艳,焦婷,褚晓华,等。在转录组范围内鉴定差异表达基因Procambarus clarkii以回应铬的挑战。鱼贝类免疫杂志2019;87:43-50。https://doi.org/10.1016/j.fsi.2018.12.055.
戴乐林,阿巴斯·曼,考萨·斯,周勇Procambarus clarkii多核糖苷多核胞苷酸(聚I:C)挑战。鱼类贝类免疫杂志2017;71:144-50。https://doi.org/10.1016/j.fsi.2017.10.010.
焦婷,杨婷婷,王东,高志强,王建林,唐培普,等。红沼泽小龙虾免疫相关基因的鉴定与表达分析Procambarus clarkii以应对脂多糖的挑战。鱼类贝类免疫杂志2019;95:140-50。https://doi.org/10.1016/j.fsi.2019.09.072.
沈刚,张旭,龚杰,王勇,黄鹏,水勇,等。转录组分析Procambarus clarkii受"黑梅病"的影响Sci众议员2020;10:1-13。https://doi.org/10.1038/s41598-020-78191-8.
张宇,李震,Kholodkevich S, Sharov A,冯宇,任宁,等。镉诱导的氧化应激、淡水小龙虾肝胰脏的组织病理学和转录组改变(Procambarus clarkii).科学通报,2019;666:944-55。https://doi.org/10.1016/j.scitotenv.2019.02.159.
Francesconi C, Makkonen J, Schrimpf A, Jussila J, Kokko H, Theissinger k丝囊霉属astaci提供了淡水小龙虾潜在感染和耐药性的额外证据。环保前沿,2021年。
克拉克KF,格林伍德SJ。下一代测序和甲壳类免疫系统:免疫基因注释替代方案的需要。综合综合生物学杂志2016;56:1113-30。
Calderón-Rosete G, González-Barrios JA, Lara-Lozano M, Piña-Leyva C, Rodríguez-Sosa L.小龙虾免疫系统相关蛋白的转录鉴定Procambarus clarkii.高通量。2018; 7:1-15。
无脊椎动物的酚氧化酶原激活系统。Immunol启2004;198:116-26。
Lai AG, Aboobaker AA。先天免疫的比较基因组分析揭示了甲壳类粮食作物物种中新颖和保守的成分。BMC基因组学。2017;18:1-26。
帕罗S,伊姆勒J-L。在昆虫免疫。免疫免疫学杂志2016;68:383-98。
Kawasaki T, Kawai T. toll样受体信号通路。Immunol前面。2014;5:1-8。
天然免疫识别。免疫学杂志2002;20:197-216。https://doi.org/10.1146/annurev.immunol.20.083001.084359.
刘志明,Söderhäll K.甲壳纲动物的免疫应答及其对疾病控制的意义。见:水产养殖中的传染病。费城:瑞斯出版;2012.p . 69 - 87。https://doi.org/10.1533/9780857095732.1.69.
李志军,李志军,Söderhäll K.无脊椎动物免疫系统的研究进展。趋势Immunol。2008;29:263 - 71。
Subramanian A, Tamayo P, Mootha VK, Mukherjee S, Ebert BL, Gillette MA,等。基因集富集分析:一种解释全基因组表达谱的基于知识的方法。中国科学(d辑:自然科学版)2005;
Söderhäll K,张志强。酚氧化酶原激活系统在无脊椎动物免疫中的作用。《免疫学评论》1998;10:23-8。https://doi.org/10.1016/s0952 - 7915 (98) 80026 - 5.
Jearaphunt M, Noonin C, Jiravanichpaisal P, Nakamura S, Tassanakajon A, Söderhäll I,等。caspase -1样对proPO系统的调控及ppA和proPO中caspase -1样裂解肽在先天免疫中的作用。公共科学图书馆Pathog。2014;10 (4):e1004059。https://doi.org/10.1371/journal.ppat.1004059.
Johansson MW, Holmblad T, Thörnqvist PO, Cammarata M, Parrinello N, Söderhäll K.细胞表面超氧化物歧化酶是小龙虾细胞粘附过氧化物酶——过氧化物素的结合蛋白。细胞科学1999;112(Pt 6): 917-25http://www.ncbi.nlm.nih.gov/pubmed/10036241.
林晓霞,李伯林,李伯林,Söderhäll K.髓过氧化物酶同源物异氧辛菌素的纯化及其对细胞粘附分子的活化。生物化学生物物理学报2007;1770:87-93。https://doi.org/10.1016/j.bbagen.2006.06.018.
Liang Z, Sottrup-Jensen L, Aspan A, Hall M, Soderhall K. Pacifastin,一种含有独特转铁蛋白链的155-kDa异二聚蛋白酶抑制剂。科学通报1997;94:6682-7。https://doi.org/10.1073/pnas.94.13.6682.
Söderhäll I,吴超,Novotny M, Lee BL, Söderhäll K.一种新的蛋白质在淡水小龙虾中作为酚氧化酶原激活和黑化的负调控因子种渐渐.生物化学杂志2009;284:6301-10。
德革,韩世杰,李文杰,白兆兆,Osaki T, Kawabata S,等。免疫应答蛇形蛋白调节黑化级联。Dros Dev Cell. 2002; 3:581-92。
小龙虾鼠疫菌丝氨酸蛋白酶基因的克隆与鉴定,丝囊霉属astaci.中华传染病杂志,2001;77:206-16。
赵永荣,徐永华,蒋宏生,徐松,赵晓峰,王建新。褐尾虾丝氨酸蛋白酶抑制剂1的抑菌活性研究日本囊对虾.《免疫与发展杂志》2014;44:61 - 9https://doi.org/10.1016/j.dci.2014.01.002.
节肢动物血青素及其相关蛋白的起源与演化。生物化学系统环境物理。2002;172:95-107。
戴克华,王晓燕,李晓燕,李晓燕,李晓燕。血液色素苷的研究进展。综合综合生物学杂志2007;47:631-44。
李青青,李伯林,Söderhäll K.小龙虾血色素苷亚基制备酚醛氧化酶的研究。生物化学与生物物理学报2004;322:490-6。https://doi.org/10.1016/j.bbrc.2004.07.145.
Ward DA, Sefton EM, Prescott MC, Webster SG, Wainwright G, Rees HH等。未测序的食用蟹卵巢和肝胰脏蛋白质的高效鉴定,癌症pagurus,通过质谱和基于同源的跨物种搜索。J蛋白质组。2010;73:2354 - 64。https://doi.org/10.1016/j.jprot.2010.07.008.
raratcliffe NA, Rowley AF, Fitzgerald SW, Rhodes CP.无脊椎动物免疫:基本概念和最新进展;1985.p . 183 - 350。https://doi.org/10.1016/s0074 - 7696 (08) 62351 - 7.
王晓燕,王晓燕,王晓燕。蛛形纲动物血淋巴中的气体转运-氧转运和血青素的生理作用。中华实验生物学杂志1994;188:25-46http://www.ncbi.nlm.nih.gov/pubmed/9317270.
崔宏,李德钊。抗真菌活性及其孔形成机制白色念珠菌.Biochimie。2014;105:58 - 63。https://doi.org/10.1016/j.biochi.2014.06.014.
凝集素:介导细胞识别的碳水化合物特异性蛋白质。化学启98:637 1998;74年。https://doi.org/10.1021/cr940413g.
金小坤,李松,郭小楠,程丽,吴明辉,谭世杰,等。两种来自甲壳类动物的抗菌c型凝集素,中华绒螯蟹,体外刺激细胞包封。Dev Comp Immunol 2013; 41:544-52。https://doi.org/10.1016/j.dci.2013.07.016.
史学智,王磊,徐松,张学伟,赵学峰,瓦斯塔GR,等。从Kuruma虾(日本囊对虾)是一种调理蛋白,促进细菌从血淋巴中清除。《公共科学图书馆•综合》。2014;9:e91794。https://doi.org/10.1371/journal.pone.0091794.
烟草角虫的免疫素和模式识别受体增强了细胞的包封和黑化Manduca sexta.免疫学杂志2006;30:289-99。https://doi.org/10.1016/j.dci.2005.05.005.
半乳糖素在感染中的作用。微生物学报。2009;7:424-38。https://doi.org/10.1038/nrmicro2146.
赵志勇,尹志祥,徐旭平,翁少平,饶兴耀,戴志祥,等。从虾中提取的一种新型c型凝集素方面对虾具有抗白斑综合征病毒活性。J微生物学报。2009;83:347-56。https://doi.org/10.1128/JVI.00707-08.
王晓燕,王晓燕,王晓燕,王晓燕,Söderhäll K.蛋白质水解级联蛋白在无脊椎动物免疫中的作用。生物化学,2010;35:575-83。
Yamakawa K. DSCAM:免疫球蛋白超家族中的一种新成员,位于唐氏综合征区域,与神经系统的发育有关。胡姆·摩尔·热内。1998;7:27 - 37。https://doi.org/10.1093/hmg/7.2.227.
吴宏,蒋亚,叶永春,王慧聪。dscam介导的虾和其他节肢动物免疫研究进展。《生物医学进展》2014;46:29 - 38。https://doi.org/10.1016/j.dci.2014.04.002.
吴th, Kumar R, Apitanyasai K, He ST, Chiu SP,王慧聪。第二次暴露于同一病原体的小龙虾幸存者中选择性表达Dscam的“正确云”。鱼贝类免疫杂志2019;92:430-7。https://doi.org/10.1016/j.fsi.2019.06.023.
周培华,张慧生,陈义天,李志伟,洪鸿彦,韩庆王建昌。中国对虾学名:Dscam (PmDscam)具有高度多样化的细胞质尾部,是第一个被报道的膜结合虾Dscam。鱼贝类免疫杂志2011;30:1109-23。https://doi.org/10.1016/j.fsi.2011.02.009.
Pees B, Yang W, Zárate-Potes A, Schulenburg H, Dierking K.无脊椎动物通过多样化的c型凝集素样结构域蛋白获得高先天免疫特异性。J Innate Immun. 2016; 8:129-42。https://doi.org/10.1159/000441475.
Liebl EC。分泌的蛋白汞合金及其跨膜受体neurotlon和Abelson酪氨酸激酶之间的相互作用影响轴突寻路。发展。2003;130(14):3217 - 26所示。https://doi.org/10.1242/dev.00545.
Zeev-Ben-Mordehai T, Mylonas E, Paz A, Peleg Y, Toker L, Silman I,等。果蝇神经元粘附蛋白汞合金的四元结构解释了它的双重粘附特性。Biophys j . 2009; 97:2316-26。https://doi.org/10.1016/j.bpj.2009.07.045.
Du秘密地太瓦。五催肽:结构、功能和在炎症中的作用。ISRN Inflamm。2013;2013:1-22。
Mantovani A, Garlanda C, Doni A, Bottazzi B.先天免疫中的戊二辛:从C反应蛋白到长戊二辛PTX3。中华临床免疫学杂志2008;28:1-13。
阿姆斯特朗PB。pentacin蛋白家族的比较生物学:先天免疫系统的进化保守成分。2015年爱思唯尔有限公司。https://doi.org/10.1016/bs.ircmb.2015.01.002.
马玉军,张建平。补体激活与调节中的五磷酸嘧啶。Immunol前面。2018;9:3046。
Pepys MB, Hirschfield GM. c反应蛋白:一个关键的更新。《临床投资杂志》2003;111:1805-12。https://doi.org/10.1172/JCI18921.
吴pml,金铮,谭肃,何斌,丁建龙。c反应蛋白:一种主要的lps结合急性期蛋白,对假单胞菌感染反应。内毒素杂志2004;10:163-74。https://doi.org/10.1179/096805104225004833.
Clark KF, Acorn AR, Greenwood SJ。美洲龙虾的差异表达(也的免疫相关基因草绿色气球菌属变种霍马里,Gaffkemia的病原体。中国病原生物学杂志,2013;https://doi.org/10.1016/j.jip.2012.11.005.
Clark KF, Acorn AR, Greenwood SJ。美洲龙虾的转录组学分析(也)感染碰碰车寄生虫时的免疫反应Anophryoides haemophila.《细胞免疫学杂志》2013;40:112-22。https://doi.org/10.1016/j.dci.2013.02.009.
Tassanakajon A, Somboonwiwat K, Amparyup P.无脊椎动物抗菌肽序列多样性与进化。Dev Comp Immunol. 2015; 48:24 - 41。https://doi.org/10.1016/j.dci.2014.05.020.
抗微生物蛋白质:从旧蛋白质,新技巧。摩尔Immunol。2015;68:383 - 98。https://doi.org/10.1016/j.molimm.2015.08.009.
李晓燕,李晓燕,李晓燕,Söderhäll 1 .小龙虾颗粒血细胞的胞吐和囊泡含量的蛋白质组学分析。Dev Comp Immunol. 2005; 29:1017-31。https://doi.org/10.1016/j.dci.2005.03.010.
贾艳萍,孙艳东,王志华,王强,王旭伟,赵旭峰,等。一种含有乳清酸性蛋白结构域(SWD)的肉质对虾肽,具有抗菌和蛋白酶抑制活性。水产养殖。2008;284:246-59。https://doi.org/10.1016/j.aquaculture.2008.07.046.
张烨,王建新,王晓伟。首次鉴定和表征含有蛋白质的三重WAP结构域Procambarus clarkii为甲壳类WAP蛋白的分类和进化提供了新的认识。鱼贝类免疫杂志2019;94:592-8。https://doi.org/10.1016/j.fsi.2019.09.023.
Becking T, Delaunay C, Cordaux R, Berjeaud JM, Braquart-Varnier C, Verdon J.揭示陆生等足类动物抗菌肽库:关注甲壳纲AMP新家族armadillidins。基因(巴塞尔)。2020; 11(1): 93。https://doi.org/10.3390/genes11010093.
孙超,徐炜炜,张华伟,董丽萍,张涛,赵晓峰,等。红沼泽小龙虾克氏原螯虾的抗脂多糖因子在体内外均具有抗菌活性。鱼贝类免疫杂志2011;30:295-303。https://doi.org/10.1016/j.fsi.2010.10.022.
de la Vega E, O’leary NA, Shockey JE, Robalino J, Payne C, Browdy CL,等。Anti-lipopolysaccharide因素方面对虾(LvALF):一种广谱抗菌肽,对虾对细菌和真菌感染的免疫必不可少。摩尔Immunol。2008;45:1916-25。https://doi.org/10.1016/j.molimm.2007.10.039.
d .间隙连接通道蛋白Innexin 2在果蝇胚胎上皮形态发生中起重要作用。分子生物学细胞。2004;15:2992-3004。https://doi.org/10.1091/mbc.e04-01-0056.
Sáez JC, Brañes MC, Corvalán LA, Eugenin EA, González H, Martínez AD,等。免疫系统细胞间隙连接:结构、调节和可能的功能作用。巴西医学生物学杂志2000;33:447-55。
王晓燕,王晓燕。间隙连接介导的免疫系统细胞间通讯。生物生理学与分子生物学进展。2007;94:207-18。
Furshpan EJ, Potter DD.小龙虾巨大运动突触的传输。杂志。1959;145:289 - 325。
亚当斯医学博士,基因组序列黑腹果蝇.科学(80 -)。2000; 287:2185 - 95。https://doi.org/10.1126/science.287.5461.2185.
Kandarian B, Sethi J, Wu A, Baker M, Yazdani N, Kym E,等。药用水蛭基因组编码21个内联蛋白基因:不同的组合由确定的中枢神经元表达。开发基因学报2012;222:29-44。https://doi.org/10.1007/s00427-011-0387-z.
Starich T, Sheehan M, Jadrich J, Shaw J.隐杆线虫的Innexins。细胞通讯杂志2001;8:311-4。https://doi.org/10.3109/15419060109080744.
shulti S, Schulz DJ, Lett KM, Marder E.螃蟹口胃神经节的电耦合和内联蛋白表达癌症北欧化工.J Neurophysiol。2014;112:2946-58。https://doi.org/10.1152/jn.00536.2014.
王斯普,陈永飞,董丽霞,张永强,陈海燕,乔凯,等。一种新型的内联蛋白2形成膜半通道,表现出免疫应答和细胞凋亡“锡拉”paramamosain.鱼类贝类免疫杂志2015;47:485-99。https://doi.org/10.1016/j.fsi.2015.09.028.
Güiza J, Barría I, Sáez JC,织女星JL。内联蛋白:表达、调节和功能。杂志。2018;9:1-9。
CCAAT/增强子结合蛋白:结构、功能和调控。j . 2002; 365:561 - 75。
王伟,夏霞,毛磊,王珊。CCAAT/增强子结合蛋白家族在MDSC扩展和功能中的作用。Immunol前面。2019;10:1804。
黄晓明,黄晓明,黄晓明,等。抗脂多糖因子ALFPm3和ALFPm6的调控作用中国对虾学名:.Sci众议员2017;7:1-13。
Amparyup P, Kondo H, Hirono I, Aoki T, Tassanakajon a .黑虎虾甲壳状抗菌肽的分子克隆、基因组组织和重组表达中国对虾学名:.摩尔Immunol。2008;45:1085 - 93。https://doi.org/10.1016/j.molimm.2007.07.031.
筑田J,吉田Y,高米纳托Y,奥隆PE。碱性亮氨酸拉链(bZIP)转录因子的CCAAT/增强子(C/EBP)家族是一个多面高度调控的基因调控系统。细胞因子。2011;54:6-19。https://doi.org/10.1016/j.cyto.2010.12.019.
Pollak NM, Hoffman M, Goldberg IJ, Drosatos K. Krüppel-like因素:致残和非致残代谢途径。科学通报2018;3:132-56。
zakai K, Leonhardt I, Dix A, Bonin M, Linde J, Einsele H,等。Krüppel-like因子4调节人树突状细胞体外刺激后白细胞介素-6的释放来自烟曲霉属真菌而且白色念珠菌.Sci众议员2016;6:1-9。
黄福生,陆顺生,杨树生,蔡培生,罗昌平,张立林。白斑综合征病毒的一早期基因调控作用方面对虾kruppel-like因子(LvKLF)。Dev Comp Immunol. 2014; 46:364-72。https://doi.org/10.1016/j.dci.2014.05.012.
刘文杰,罗春芳,寇光华,吕建华,赖永杰,常力龙,等。白斑综合征病毒一早期基因WSSV108的启动子被细胞KLF转录因子激活。Dev Comp Immunol. 2015; 49:7-18。
黄毅,任强。克鲁珀尔因子Macrobrachium rosenbergii(MrKLF)参与对病原体感染的先天免疫。鱼类贝类免疫杂志2019;95:519-27。https://doi.org/10.1016/j.fsi.2019.10.070.
Kim M, Lee JH, Lee SY, Kim E, Chung J. Caspar,果蝇抑菌免疫抑制因子。中国生物医学工程学报2006;103:16358-63。https://doi.org/10.1073/pnas.0603238103.
Balkwill FR,细胞因子。收录于:生命科学百科全书。约翰·威利父子有限公司:奇切斯特;2001.https://doi.org/10.1038/npg.els.0000929.
Guimarães-Costa AB, Nascimento MTC, Wardini AB, Pinto-Da-Silva LH, Saraiva EM. ETosis:细胞死亡之外的杀微生物机制。中国寄生虫学杂志2012;2012:929743。https://doi.org/10.1155/2012/929743.
果蝇损伤后晶体细胞破裂需要JNK途径、小GTPases和TNF同系物eiger。细胞科学杂志2007;120:1209-15。
Kulkarni A, Rombout JHWM, Singh ISB, Sudheer NS, Vlak JM, Caipang CMA,等。被截断的VP28作为对虾WSSV感染的口服候选疫苗:中肠吸收和加工的研究中国对虾学名:.鱼类贝类免疫杂志2013;34:59 - 66。https://doi.org/10.1016/j.fsi.2012.10.028.
Vabulas RM, Raychaudhuri S, Hayer-Hartl M, Hartl FU。细胞质中的蛋白质折叠和热休克反应。冷泉港展望生物学2010;2(12):a004390。https://doi.org/10.1101/cshperspect.a004390.
徐辉,闫芳,邓旭,王杰,邹涛,马旭,等。白斑综合征病毒包膜蛋白VP28与虾Hsc70的相互作用具有特异性和atp依赖性。鱼类贝类免疫杂志2009;26:414-21。https://doi.org/10.1016/j.fsi.2009.01.001.
曾燕,吕昌鹏。小龙虾血细胞差异表达基因的鉴定(Procambarus clarkii)通过抑制性消减杂交和cDNA微阵列感染白斑综合征病毒。鱼类贝类免疫杂志2009;26:646-50。https://doi.org/10.1016/j.fsi.2008.11.005.
Arya R, Mallik M, Lakhotia SC.热休克基因-整合细胞生存和死亡。J Biosci。2007;32:595 - 610。https://doi.org/10.1007/s12038-007-0059-3.
Jussila J, Francesconi C, Theissinger K, Kokko H, Makkonen J.失去耐力的Aphanomyces astaci:来自芬兰Venesjärvi湖的潜在小龙虾鼠疫病病原体。2021年,26(2):139 - 44。https://erepo.uef.fi/handle/123456789/26802.
马瑞诺,马瑞诺,马瑞诺,马瑞诺。无脊椎后生动物先天免疫记忆的研究。Immunol前面。2018;9:1915。
Barribeau SM, Schmid-Hempel P, Sadd BM。皇家法令:基因表达在跨代免疫启动大黄蜂工蜂模仿初级免疫反应。《公共科学图书馆•综合》。2016;11:e0159635。https://doi.org/10.1371/journal.pone.0159635.
表观遗传学在宿主-寄生虫共同进化中的作用:来自模型宿主昆虫的教训广场mellonella而且种有害castaneum.动物学。2016;119:273 - 80。https://doi.org/10.1016/j.zool.2016.05.004.
Norouzitallab P, Baruah K, Biswas P, Vanrompay D, Bossier P.在一项跨代研究中探索训练免疫在无脊椎动物中的现象,以卤虾Artemia为模型系统。Sci众议员2016;6:21166。https://doi.org/10.1038/srep21166.
Jussila J, Makkonen J, Vainikka A, Kortet R, Kokko H.小龙虾瘟疫困境:如何成为一个有礼貌的杀手?北方环境决议2014;19:35 - 44。
郭德昆斯特J, Andriantsoa R, Falckenhayn C, Hanna K, Stein W, Rasamy J,等。大理石纹小龙虾克隆基因组进化与快速入侵扩散。科学通报2018;2:567-73。https://doi.org/10.1038/s41559-018-0467-9.
古德昆斯特J, Maiakovska O, Hanna K, Provataris P, Horn H, Wolf S,等。大理石纹小龙虾来源的系统地理重建。Commun杂志。2021;4:1-7。
托里霍斯LM, Ríos分房,埃雷罗GC,亚当斯SB,杰克逊CR,乌里本多JD。追踪小龙虾鼠疫病原体的起源,丝囊霉属astaci到美国东南部。Sci众议员2021:1-11。https://doi.org/10.1038/s41598-021-88704-8.
黄涛,Cerenius L, Söderhäll K.小龙虾鼠疫菌遗传多样性分析,丝囊霉属astaci,通过随机扩增多态DNA。水产养殖。1994;126:1-9。https://doi.org/10.1016/0044 - 8486 (94) 90243 - 7.
葛朗让F, Vrålstad T, Diéguez-Uribeondo J, jeliic M, Mangombi J, Delaunay C,等。小龙虾鼠疫病原体直接基因分型的微卫星标记丝囊霉属astaci(卵菌)从受感染的宿主组织。兽医Microbiol。2014;170:317-24。https://doi.org/10.1016/j.vetmic.2014.02.020.
博茨扬季奇LL、博纳辛L、阿努西奇L、洛夫伦季奇L、贝森多夫五世、马奎尔一世等。的Pontastacus leptodactylus重复组提供了对基因组进化的洞察,揭示了卫星DNA的显著多样性。麝猫。2021;11。https://doi.org/10.3389/fgene.2020.611745.
谭明明,甘慧敏,李永平,Grandjean F, Croft LJ, Austin CM。巨型小龙虾的巨大基因组(Cherax quadricarinatus),深入了解了十足类基因组中的cox1假基因。麝猫。2020;11:201。https://doi.org/10.3389/fgene.2020.00201.
小井井K,小山T,铃木H,河野R,津田S,丰田A,等。单细胞rna序列分析揭示对虾血细胞亚群和细胞分化过程;2021.1-27页。
Schwenke RA, Lazzaro BP, Wolfner MF。繁殖——昆虫的免疫取舍;2017.239 - 56页。
boitjaniich LL, Francesconi C, Rutz C, Hoffbeck L, Poidevin L, Kress A,等。大理石纹小龙虾和高贵小龙虾肝胰脏转录组的从头组装和注释数据集。BMC研究笔记,2022。https://doi.org/10.1186/s13104-022-06137-6.
Patro R, Duggal G, Love MI, Irizarry RA, Kingsford C. Salmon提供了快速和偏见感知的转录表达量化。Nat方法。2017;14:417-9。
Srivastava A, Malik L, Sarkar H, Zakeri M, Almodaresi F, Soneson C,等。比对和映射方法影响转录本丰度估计。基因组医学杂志。2020;21:1-21。
Roberts A, Trapnell C, Donaghey J, Rinn JL, Pachter L.通过修正片段偏差改进rna seq表达估计。基因组医学杂志。2011;12:R22。https://doi.org/10.1186/gb-2011-12-3-r22.
Love MI, Huber W, Anders S.用DESeq2调节RNA-seq数据的折叠变化和色散估计。基因组医学杂志。2014;15:1-21。
Soneson C, Love MI, Robinson MD: RNA-seq的差异分析:转录水平估计提高基因水平推理。F1000Research。2015; 4:1521。https://doi.org/10.12688/f1000research.7563.1.
Blighe K, Rana S, Lewis M. EnhancedVolcano:带有增强颜色和标签的可供出版的火山图。2020.可以在:https://githubcom/kevinblighe/EnhancedVolcano;R包版本1.8.0。
朱a, Ibrahim JG, Love MI.序列计数数据的重尾先验分布:去除噪声并保留较大差异。生物信息学。2019;35:2084 - 92。https://doi.org/10.1093/bioinformatics/bty895.
Ritchie ME, Phipson B, Wu D, Hu Y, Law CW, Shi W,等。Limma为rna测序和微阵列研究提供差异表达分析的动力。核酸学报2015;43:e47。https://doi.org/10.1093/nar/gkv007.
于刚,王立国,韩燕,何启元。clusterProfiler:一个R包,用于比较基因簇之间的生物主题。中华生物医学杂志2012;16:284-7。https://doi.org/10.1089/omi.2011.0118.
确认
谨向Dr. Clement Schneider和Mr. Alexandra Schmidt提出的有益建议表示感谢。
我们也要感谢Jorg Rapp在服务器管理方面的支持和BIGEst平台在信息支持方面的支持。
资金
由Projekt DEAL支持和组织的开放获取资金。这项工作得到了法国政府“未来投资”项目框架下的IdEx Unistra的支持,以及国家科学研究中心和斯特拉斯堡Université提供的研究所资金。
K.T.和M.B.获得了LOEWE翻译生物多样性基因组学中心(TBG)的RNA测序种子基金。
作者信息
作者和联系
贡献
K.T, C.F, j.j., J.M.概念化;Lj.L.B。,一个.K., C.R. Data curation; Lj.L.B., C.F., C.R., L. H, L.P. Formal analysis; K.T., M.B. Funding acquisition; C.F., J.J., J.M., K.T. Investigation; Lj.L.B., O.L., C.R., L. H, L.P., B.F. Methodology; K.T. Project administration; K.T., O.L., M.B. Resources; A.K., Lj.L.B, C.R. Software; O.L., K.T., M.B. Supervision; O.L., K.T., K.S., C.F., Lj.L.B. Validation; Lj.L.B. Visualization; Lj.L.B., C.F. Roles/Writing - original draft; Lj.L.B., C.F., K.T., O.L., C.R., L.H., L.P., A.K., J.J., J.M., K.S., B.F., M.B. Writing - review & editing. All authors read and approved the final manuscript.
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者声明,他们没有已知的相互竞争的经济利益或个人关系,这些利益或关系已经或可能被认为影响了本文所报道的工作。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
补充信息
附加文件1:表S1。
用于鉴定高贵小龙虾和大理石纹小龙虾先天免疫基因的BLAST分析序列及其相应的基因登录号列表。表S2。通过BLAST搜索确定的先天免疫基因具有各自的匹配长度、%身份、e值和该死!注解在高贵的小龙虾。表S3。通过BLAST搜索确定的先天免疫基因具有各自的匹配长度、%身份、e值和该死!大理石纹小龙虾的注释。表S4。高贵小龙虾和大理石纹小龙虾的Illumina序列的原始和后期预处理数据统计和与Salmon的read伪对齐与从头组装的转录组组装的映射结果。表S5。高贵的小龙虾对挑战的反应的差异表达基因列表答:astaci.表S6。大理石纹小龙虾对细菌胁迫反应的差异表达基因及其注释列表答:astaci.图S1。(a)尊贵小龙虾和(b)大理石纹小龙虾在rlog转换数据集上的主成分分析(PCA)结果表明,批处理效应与尊贵小龙虾的雄性(蓝色)和雌性(红色)差异和大理石纹小龙虾的繁殖(繁殖-绿色,非繁殖-紫色)差异有关。使用在limma R包(Ritchie et al., 2015)中实现的removeBatchEffect()函数对(c)高贵小龙虾和(d)大理石纹小龙虾进行批量效应去除的PCA。图S2。(a) Hap a攻毒尊贵小龙虾(第3天)、(b) Hap a攻毒尊贵小龙虾(第21天)、(c) Hap b攻毒大理石纹小龙虾(第3天)、(d) Hap b攻毒大理石纹小龙虾(第21天)的基因集富集分析结果。调整p-值,和标准化浓缩分数(NES)显示。AMPs-抗菌肽,proo -酚氧化酶原途径。文件S1。FASTA序列用于BLAST分析,鉴定贵族小龙虾和大理石纹小龙虾的先天免疫基因。文件S2。通过BLAST分析,在尊贵小龙虾中鉴定出先天免疫相关转录物的FASTA序列。文件S3。通过BLAST分析,在大理石纹小龙虾中鉴定出先天免疫相关转录物的FASTA序列。
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
博茨扬尼基,l.l.,弗兰切斯科尼,C,鲁兹,C。et al。宿主-病原体共同进化驱动先天免疫应答丝囊霉属astaci淡水小龙虾的感染:转录组学证据。BMC基因组学23600(2022)。https://doi.org/10.1186/s12864-022-08571-z
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12864-022-08571-z
关键字
- 小龙虾瘟疫
- Astacus Astacus
- 无脊椎动物的免疫机制
- 先天免疫系统
- Procambarus virginalis
- 差异基因表达
- 新创组装
- 肝胰腺
- 小说的几种基因