摘要
背景
n6 -甲基腺苷(m6A)是最常见的RNA修饰,在肿瘤发生发展中起着关键作用。在这项研究中,我们评估了m6A甲基转移酶METTL3在fras1参与的非小细胞肺癌(NSCLC)细胞系的细胞增殖和集落形成中的作用。
方法
细胞计数试剂盒(CCK-8)检测细胞活力和菌落形成情况。通过M6A RNA免疫沉淀(IP)、核糖体免疫沉淀(Ribosomal immunoprecipitation, RIP)、RNA免疫沉淀(RNA immunoprecipitation, RIP)验证METTL3、FRAS1与YTHDF1的关系。拯救实验证实METTL3-FRAS1的调控机制通过协同YTHDF1通过CDON促进NSCLC细胞增殖。
结果
我们发现FRAS1与NSCLC患者的不良预后相关,其中转录本经过METTL3调控的m6A修饰。METTL3沉默降低了NSCLC细胞HCC827和NCI-H1975的细胞活力,可通过FRAS1过表达恢复。YTHDF1能够识别FRAS1的m6A修饰。FRAS1沉默或YTHDF1沉默可挽救METTL3过表达诱导的NSCLC细胞增殖、集落形成和肿瘤生长升高。
结论
我们的研究揭示METTL3-FRAS1通过协同YTHDF1调控CDON在NSCLC细胞增殖、集落形成和肿瘤生长中发挥重要作用。
简介
n6 -甲基腺苷(m6A)修饰已被证实在肿瘤发生中发挥重要作用[1,2,3.].m6A异常修饰被报道与胶质母细胞瘤(GBM)、卵巢癌、膀胱癌、胃癌、胰腺癌等有关[4,5,6].现有研究表明m6A修饰在癌症中起着双重作用。然而,m6A在肺癌中的作用、机制和临床价值尚不清楚。
M6A修饰由特定的甲基转移酶(称为“写入器”)、M6A识别蛋白(称为“读取器”)和去甲基化酶(称为“擦除器”)调控。METTL3是第一个被鉴定的甲基转移酶,它负责m6A修饰。越来越多的证据表明METTL3在肿瘤发生中起多种作用[7,8].例如,METTL3通过m6a依赖的方式调节SOCS2表达来促进肝癌进展[9].在胃癌(GC)中,METTL3通过增强m6A修饰和稳定性促进胃癌细胞增殖和肝转移HDGF[10].据报道,METTL3通过诱导m6A修饰的蛋白来加速结直肠癌的进展GLUT1激活mTORC1信号[11].METTL3还被发现通过调节Bcl-2促进乳腺癌肿瘤的发生[12].最近的研究表明METTL3在肺癌中上调[13].mettl3诱导lncRNA ABHD11-AS1 m6A甲基化可促进NSCLC细胞增殖和Warburg效应[14].这些研究表明,mettl3调节的m6A mRNA甲基化在包括肺癌在内的人类肿瘤中起着至关重要的作用。
YT521-B同源性(YTH)结构域含蛋白(YTHDFs) YTH可以识别和调控RNA m6A修饰的作用。YTHDF2是第一个报道的m6A阅读器,研究表明YTHDF2促进多种癌症的肿瘤发生[2].例如,YTHDF2可以通过保持胶质母细胞瘤的稳定性来促进胶质母细胞瘤生长MYC而且VEGFA依赖于m6a的转录本[15].在肝细胞癌(HCC)中,一项研究表明YTHDF2表达与HCC进展呈正相关[16]而另一项研究报告YTHDF2通过加速抑制HCC肿瘤生长表皮生长因子受体mRNA降解[17].除YTHDF2外,YTHDFs家族还包括YTHDF1、ythd3、YTHDC1。据报道,YTHDF1在多种癌症中发挥肿瘤启动子的作用,如胃癌[18], HCC [19,20.],非小细胞肺癌[21].迄今为止,YTHDF1在NSCLC中的作用尚不清楚。
Fraser细胞外基质复合物亚基1 (FRAS1)已被报道对胚胎上皮-间充质完整性至关重要[22].近期研究表明FRAS1参与了NSCLC的恶性表型[23]、胃癌[24]、结直肠癌[25].
在本研究中,我们探讨了FRAS1在NSCLC中的作用及其潜在的分子机制。我们的数据表明m6A甲基转移酶METTL3诱导FRAS1m6A修饰和蛋白稳定性,从而加速NSCLC细胞增殖。
方法
数据分析
FRAS1在非小细胞肺癌(NSCLC)中的总体生存分析使用在线生存分析工具Kaplan-Meier绘图仪(https://kmplot.com/analysis/index.php?p=background) [26],内载非小细胞肺癌患者的临床资料(https://kmplot.com/analysis/index.php?p=service&cancer=lung) [27].根据FRAS1的中表达将NSCLC患者分为两组。曲线上标注95%置信区间(ci)的危险比(HR)和log rank p值。分析使用FRAS1 (220910_at)的JetSet探针集。通过Pearson相关分析,鉴定与METTL3和YTHDF1相关的共表达基因,并将|Pearson R|> 0.3和PTCGA-LUAD&LUSC数据集< 0.05;根据METTL3的相关系数大于0.6,YTHDF1的相关系数大于0.45,P值小于0.001,筛选出交集基因,列在附加文件中1:表S1。
人体组织和细胞系
本研究采用来自太空中心医院的五对肺腺癌组织。这项研究的伦理批准来自太空中心医院(20,200,511-JJJHZ-01)。获得每位患者的书面知情同意书。4株NSCLC细胞株(A549、NCI-H1299、HCC827、NCI-H1975)和人支气管上皮细胞株HBEC均来自中国武汉普耐尔生命科技有限公司。A549细胞在DMEM (High glucose, Gibco, Grand Island, NY, USA, 11,965-092)中培养,加入10% FBS (Gibco)和1%青霉素/链霉素(P/S, Procell)。NCI-H1299、HCC827和NCI-H1975细胞在rmi -1640培养基(Gibco)中培养,含10% FBS (Gibco)和1%青霉素/链霉素(P/S, Procell)。HBEC细胞在支气管上皮生长培养基(BEGM, Lonza, CC-3170)中培养。所有细胞在37℃5% CO中培养2孵化器。
稳定细胞系
shMETTL3、shYTHDF1、shFRAS1和shScramble由中国广州RiboBio公司合成,克隆到载体pLKO中。1雪茄烟。通过感染这些相应的慢病毒,产生了shMETTL3、shYTHDF1、shFRAS1、shscramble等稳定细胞系。感染后2 d,加入嘌呤霉素(1 μg/mL)。shRNA序列见表1.
定量逆转录-聚合酶链反应(qRT-PCR)
使用Trizol (Beyotime,上海,中国)分离总RNA,使用EasyScript®第一链cDNA Synthesis SuperMix (Transgen,北京,中国)进行反转录。采用TransStart®Green qPCR SuperMix (Transgen)进行实时荧光定量PCR分析。用标准2分析各基因的相对表达量−ΔΔCt方法(28]并归一化为GAPDH。qPCR引物序列见表2.
免疫印迹
使用低温裂解缓冲液裂解细胞并提取蛋白质。等量蛋白质用6%或10% SDS-PAGE分离后转移到硝化纤维膜上。用5%脱脂牛奶在室温下阻塞1小时后,用相应的一抗在4℃下孵育过夜。然后用辣根过氧化物酶(HRP)偶联的二抗孵育该膜,并用增强化学发光(ECL)底物(Beyotime, Shanghai, China)进行检测。一抗为:anti-FRAS1 (#ab240583;Abcam,剑桥,英国),反mettl3 (#ab195352;, anti-YTHDF1 (#ab252346;Abcam), anti-RPL-22 (#ab77720;), anti-CDON (#ab227056;), anti-CCND1 (#ab16663; Abcam), anti-β-actin (#ab8226; Abcam), anti-α-tubulin (#ab7291, Abcam) and anti-GAPDH (#ab8245; Abcam).
CCK-8和菌落形成
使用细胞计数试剂盒-8 (CCK-8, Beyotime)分析细胞活力。细胞接种于96孔板(2 × 103./well)培养不同时间(0、1、2、3、4、5天)。用10 μL CCK-8溶液培养细胞1 h,用多模平板阅读器检测450 nm处的吸光度。
对于菌落形成实验,细胞以4 × 10的密度被镀3./孔在6孔板与完整的介质。2周后用多聚甲醛固定细胞,0.1%结晶紫染色。菌落图像是用相机确定的。
EDU公司
用聚d -赖氨酸和基质包被载玻片。将HCC827和NCI-H1975细胞分别接种于载玻片上。第二天,用si-CDON或si-NC质粒转染细胞。转染48 h后,EDU加入4 h后固定。细胞与固定液孵育15分钟,渗透20分钟。然后将反应混合物用于EDU荧光标记30分钟。细胞进行DAPI染色30分钟。之后,使用荧光显微镜、ImageJ软件和GraphPad Prism 8.0分析EDU阳性细胞。使用EDU染色增殖试剂盒(Abcam, ab222421)将EDU纳入。
RNA免疫沉淀(RIP)
使用EZ-Magna RIP rna结合蛋白免疫沉淀试剂盒(Millipore, Billerica, MA)进行RIP。用特制的RIP裂解缓冲液裂解细胞。细胞裂解液与所示抗体与混合蛋白A/ g珠一起在4℃下孵育过夜。采用qRT-PCR检测沉淀RNA。
RNA稳定性分析
用放线菌素D (5 μg/mL, Sigma)处理HCC827或NCI-H1975细胞0、2、4、6 h, TRIzol提取总RNA, qRT-PCR分析。
m6A RNA免疫沉淀试验(MeRIP)
用TRIzol (Beyotime)分离总RNA,然后超声处理成RNA片段。然后,RNA片段与抗m6A抗体(ab208577, Abcam)和蛋白A珠一起在4℃孵育10 h。蛋白-RNA复合物洗涤后用蛋白酶k处理,采用qRT-PCR检测免疫沉淀RNA。
核糖体免疫沉淀反应
用RPL22-Myc转染具有稳定shYTHDF1或shscr的HCC827或NCI-H1975细胞(Origene, Beijing, China)。48小时后,用RIPA缓冲液裂解细胞,然后用抗myc抗体(Abcam)与蛋白A珠混合在4℃下孵育8小时。以正常小鼠免疫球蛋白G (IgG)作为对照。蛋白-RNA复合物经蛋白酶k清洗处理后,采用qRT-PCR检测免疫沉淀RNA。
异种移植瘤模型
BALB/c裸鼠20只,6-8周龄,购自北京视固生物科技有限公司。小鼠随机分为四组(每组5只)。用慢病毒(Gene Pharma, Shanghai, China)感染并构建NCI-H1975/Vector + sh-NC、NCI-H1975/METTL3 + sh-NC、NCI-H1975/METTL3 + sh-YTHDF1、NCI-H1975/METTL3 + sh-FRAS1稳定细胞。各组采用皮下注射约1 × 10的方法建立异种移植6每只老鼠的细胞。每7天测量一次肿瘤体积。肿瘤体积计算为1/ 2 ×长×宽2.接种28 d后记录肿瘤重量。
统计分析
所有实验都独立重复至少三次。使用GraphPad Prism 8.0 (GraphPad Software, La Jolla, CA)分析数据。采用Student's t检验分析组间差异。通过starbase RNA-RNA模块检测FRAS1与CDON表达的相关性(https://starbase.sysu.edu.cn/index.php).P< 0.05为有统计学意义。
结果
n6 -甲基腺苷(m6A)修饰和蛋白水平FRAS1在NSCLC中上调
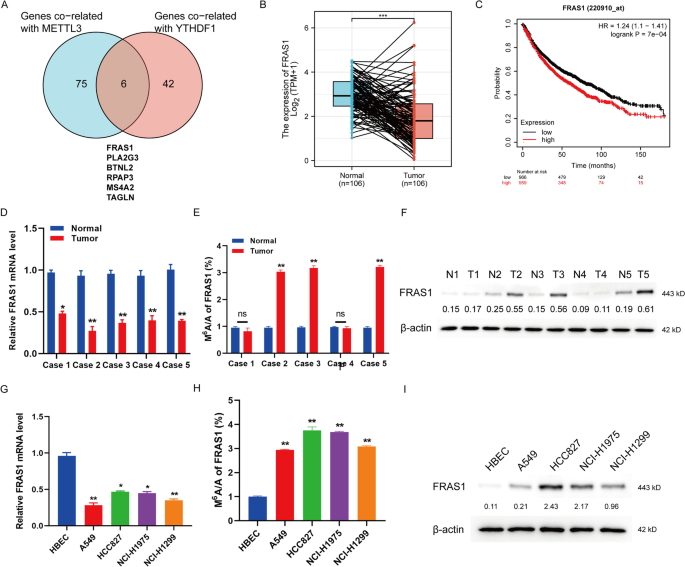
利用TCGA-LUAD/LUSC数据库分别对METTL3和YTHDF1进行相关基因分析。FRAS1被鉴定为非小细胞肺癌(NSCLC)中与METTL3和YTHDF1最相关的基因,如图所示。1(RMETTL3= 0.730, rYTHDF1= 0.452,P< 0.001,附加文件1:表S1)。接下来,我们发现了一个有趣的表型,在106对NSCLC肿瘤组织中,FRAS1的mRNA水平明显低于相应的正常组织(图2)。1B)而Kaplan-Meier绘图仪分析显示FRAS1高表达与NSCLC患者较短的总生存期相关(log rankP= 7 e-04,https://kmplot.com/analysis/,无花果。1C),提示FRAS1可能是NSCLC的危险预后生物标志物。我们想知道是否有m6A的修饰FRAS1肺癌中的mRNA。的表达式求值FRAS1以及我们收集的LUAD样本中的m6A水平。根据公共数据库的分析,FRAS1与正常组织相比,肿瘤组织中mRNA水平降低(图;1D).然而,m6a水平和蛋白水平FRAS13例肿瘤组织明显高于配对的正常组织(图;1E, F).在NSCLC细胞系中也观察到类似的结果。FRAS1与人支气管上皮细胞HBEC相比,NSCLC细胞株A549、HCC827、NCI-H1975和NCI-H1299的mRNA水平下降(图;1G).的m6A水平和蛋白水平FRAS1在NSCLC细胞系中的表达高于HBEC(图。1H, I).这些结果表明m6A修饰FRAS1mRNA及其蛋白水平在NSCLC肿瘤组织中明显升高。
NSCLC肿瘤组织和细胞系中n6 -甲基腺苷修饰和FRAS1蛋白表达增加。一个Venn图显示肺癌中与METTL3和YTHDF1共相关基因的交集。交集列表中有6个基因。FRAS1, PLA2G3, BTNL2, RPAP3, MS4A2和TAGLN。B通过TCGA分析配对NSCLC肿瘤组织和正常组织(n = 106)中FRAS1 mRNA的表达水平。C采用Kaplan-Meier绘图仪分析FRAS1表达的NSCLC患者的总生存期。风险比(HR) = 1.24, 95%可信区间(CI) = 1.1-1.41,日志级别P= 7 e-04。D采用qRT-PCR方法分析5对LUAD标本中FRAS1 mRNA水平的表达。N:正常组织。T:肿瘤组织。E采用MeRIP-qPCR检测5对LUAD样本中FRAS1的m6A水平。Fwestern blot检测5对LUAD标本中FRAS1蛋白水平。G采用qRT-PCR方法分析FRAS1在A549、HCC827、NCI-H1975、NCI-H1299等NSCLC细胞株和肺上皮细胞株HBEC中mRNA水平的表达。H在上述5个细胞系中分析FRAS1的m6A水平。我western blot检测FRAS1蛋白水平在A549、HCC827、NCI-H1975、NCI-H1299、HBEC中的表达。**P< 0.01, ***P< 0.001表示各组间有显著差异。NS,不显著
METTL3诱发FRAS1mRNA m6A修饰
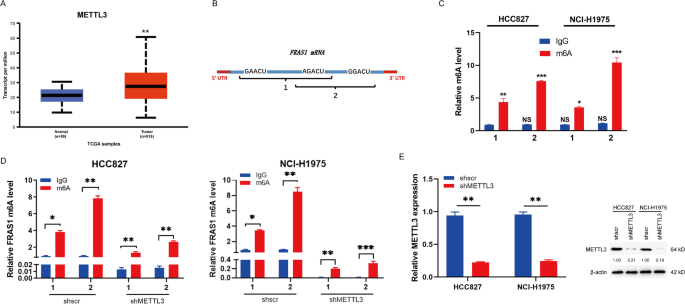
新兴研究表明,m6A在信使RNA (mRNA)中发挥着重要作用,通过调控mRNA的加工、翻译或衰变[3.].例如,m6A可以加速mRNA前体的处理时间,促进mRNA在细胞中的转运和成核速度[29,30.].目的:探讨m6A修饰的调控机制FRAS1mRNA,我们关注m6A“作者”METTL3。我们观察到,与正常组织相比,METTL3在NSCLC肿瘤组织中高表达(图2)。2A).的m6A修饰位点FRAS1mRNA表达量用条带预测(http://www.cuilab.cn/sramp/) [31],其中一致母题在终止符附近(图;2B).验证的存在FRAS1mRNA m6A甲基化,我们使用m6A抗体进行m6A免疫沉淀。采用qRT-PCR检测免疫沉淀RNA片段,如图所示。2C和2D。的m6A修改FRAS1在HCC827和NCI-H1975细胞中均检测到mRNA的表达。2此外,与shscr组相比,shMETTL3细胞(HCC827和NCI-H1975)的m6A甲基化水平显著降低(图。2D)。通过qPCR和western blot验证,shMETLL3的敲除效率为80%(图。2E).综上所述,这些结果表明METTL3可以促进FRAS1转录本m6A修改。
在NSCLC中,FRAS1 m6A甲基化位点发生在终止密码子附近。一个用UALCAN分析NSCLC中METTL3的mRNA水平(http://ualcan.path.uab.edu/).BFRAS1编码序列(CDS)中预测的m6A基序。针对FRAS1不同DNA片段设计了两种PCR引物,分别用PCR 1和PCR 2标记。C用m6A抗体免疫沉淀HCC827和H1975细胞后,qRT-PCR扩增FRAS1 DNA片段,归一化至HCC827的IgG对照。Dm6A免疫沉淀后,通过qRT-PCR检测mettl3敲除的HCC827和NCI-H1975细胞的m6A水平。E通过qRT-PCR和western blot检测shMETTL3蛋白的敲除效率。数值用平均值±标准差表示。*P< 0.05或**P< 0.01或***P< 0.001表示各组间有显著差异。NS,不显著
METTL3沉默导致FRAS1蛋白表达和细胞增殖下降
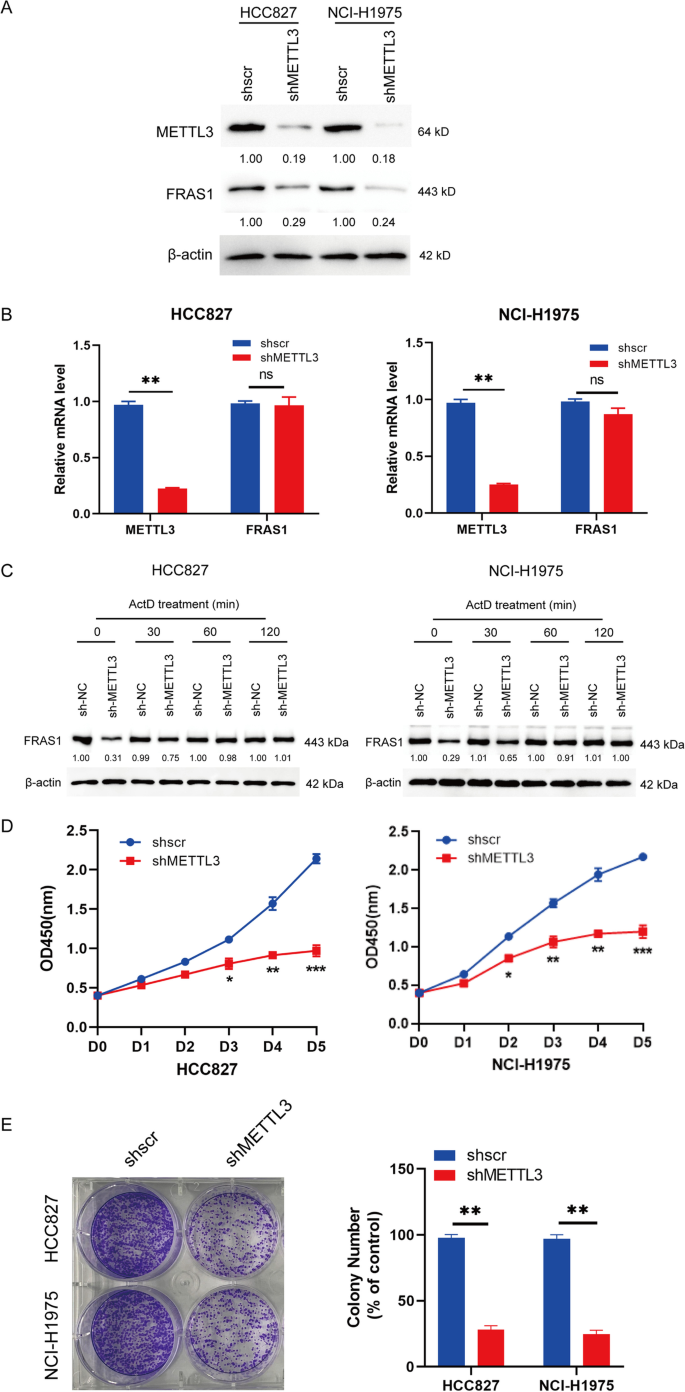
探讨mettl3调控的生物学功能FRAS1m6A修饰后,我们生成了两个稳定的mettl3沉默细胞(HCC827和NCI-H1975)。与shscr细胞相比,shMETTL3细胞的METTL3蛋白水平有效降低,FRAS1蛋白水平表达降低(图2)。3.A).对的改变没有影响FRAS1METTL3敲低后的mRNA(图;3.B)。此外,随着放线菌素D (ActD)治疗时间的延长,FRAS1蛋白水平不再降低,这表明METTL3依赖于m6A方式调节FRAS1的表达,但对FRAS1蛋白没有直接影响(图。3.C). CCK-8分析显示,稳定的mettl3沉默的HCC827和NCI-H1975细胞增殖下降(图。3.D),与菌落形成结果一致(图;3.E).这些结果表明,METTL3改变FRAS1蛋白水平,但不影响mRNA水平,对细胞增殖有抑制作用。
mettl3沉默细胞FRAS1蛋白而非mRNA水平降低。一个在METTL3敲除的HCC827和NCI-H1975细胞中检测METTL3和FRAS1蛋白水平。B通过qPCR检测shMETTL3 HCC827和NCI-H1975细胞中METTL3的mRNA水平。C在ActD处理后0、30、60、120 min,检测mettl3敲除的HCC827和NCI-H1975细胞中FRAS1蛋白水平。D对shMETTL3 HCC827和NCI-H1975细胞进行CCK-8检测。(E)在shMETTL3 HCC827和NCI-H1975细胞中进行集落形成,培养4天。*P< 0.05或**P< 0.01或***P< 0.001表示各组间有显著差异。Ns,不显著
YTHDF1在m6a修饰的FRAS1表达中起作用
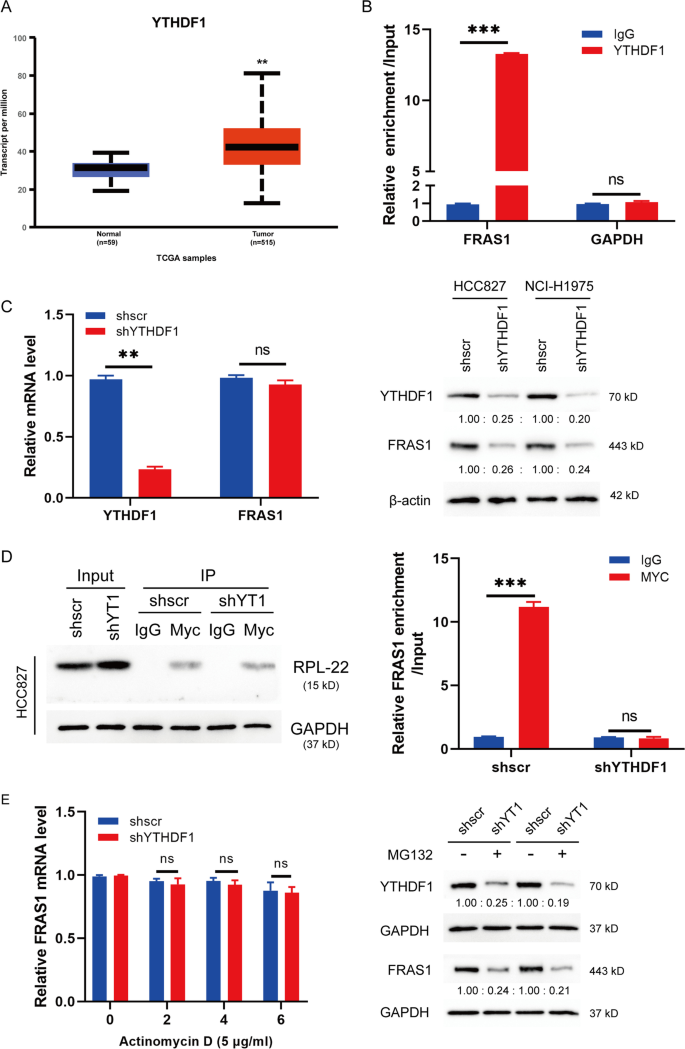
M6A修饰的rna可以被M6A阅读蛋白识别并传递到下游通路。YTHDF1在NSCLC增殖中起关键作用[21在本研究中,我们通过UALCAN发现,与正常组织相比,YTHDF1在NSCLC肿瘤组织中高表达(图2)。4A),表明YTHDF1可能在m6a调控的FRAS1表达中起关键作用。RIP实验验证了YTHDF1可以与FRAS1信使rna(无花果。4B).研究YTHDF1在m6a修饰调控中的作用FRAS1,我们构建了稳定的ythdf1沉默的HCC827和NCI-H1975细胞。qRT-PCR分析显示,YTHDF1在shYTHDF1细胞中表达明显下调FRAS1mRNA无明显变化,但蛋白水平明显下降(图;4C)。此外,我们进行了核糖体免疫沉淀,分析了ythdf1沉默对m6A修饰的核糖体占用的影响FRAS1信使rna。结果表明,核糖体占用FRAS1与对照细胞相比,ythdf1沉默细胞的mRNA水平降低。4D)。FRAS1YTHDF1缺失后,用ActD处理后mRNA的稳定性没有改变,说明YTHDF1不参与FRAS1RNA合成。接下来,为了研究YTHDF1是否参与FRAS1蛋白稳定性的调控,我们用蛋白酶体抑制剂MG132处理细胞。我们观察到,即使在MG132处理下,ythdf1沉默的细胞中,FRAS1蛋白仍然减少。4E),表明YTHDF1可以调节FRAS1蛋白的稳定性,而不依赖于蛋白质降解途径。这些结果进一步表明,m6A阅读蛋白YTHDF1可能识别通过METTL3增加的FRAS1的m6A修饰。
YTHDF1保持FRAS1 mRNA的稳定。一个通过UALCAN分析NSCLC中YTHDF1 mRNA的表达水平。BFRAS1在RIP试验中富集,采用YTHDF1抗体,qPCR定量。相对FRAS1富集归一化为输入。C通过qRT-PCR检测YTHDF1沉默的HCC827和NCI-H1975细胞中YTHDF1和FRAS1在mRNA水平上的相对表达(n = 3,左)。**P< 0.01。western blot检测了shYTHDF1基因的敲除效率(右)。D用Myc- rpl22质粒转染shYTHDF1稳定细胞48 h,用抗体Myc进行核糖体免疫沉淀。用qPCR检测FRAS1的相对表达量。E放线菌素D (5 μg/ml,左)处理shYTHDF1稳定细胞,分析FRAS1 mRNA水平。在添加MG132 (1 μM)和不添加MG132 (1 μM)的shYTHDF1细胞中检测FRAS1蛋白水平,以GAPDH作为内对照。数值用平均值±标准差表示。*P< 0.05或**P< 0.01或***P< 0.001表示各组间有显著差异。Ns,不显著
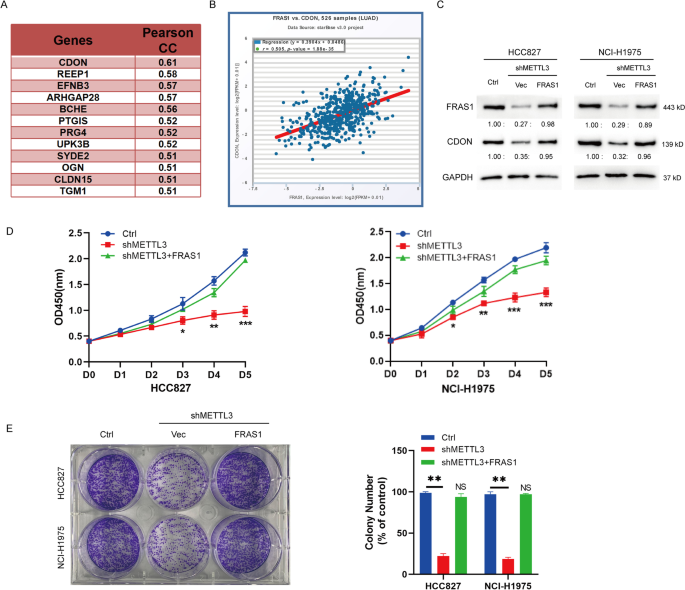
METTL3诱导FRAS1 m6A修饰调节CDON表达
通过在线生物信息学分析,我们发现细胞粘附相关,癌基因调控(CDON)与FRAS1有很强的正相关。pearson分析显示,在NSCLC中,CDON与FRAS1的相关性最强(R = 0.61,图。5A). Starbase在线数据库显示,在526对NSCLC样本中,FRAS1和CDON之间存在很强的相关性(r = 0.505,P< 0.001,图;5B).此外,FRAS1过表达可以挽救shMETTL3细胞中的CDON蛋白水平(图。5C). CCK-8分析和菌落形成分析显示,过表达FRAS1可逆转METTL3敲低导致的增殖下降(图5)。5D, E).这些数据表明METTL3通过FRAS1调节细胞增殖。
FRAS1过表达挽救了METTL3沉默和CDON表达诱导的表型。一个NSCLC中与FRAS1呈正相关基因(pearson相关r > 0.5)。BNSCLC中CDON与FRAS1的关系用星库(http://starbase.sysu.edu.cn/index.php).r = 0.505。P< 0.001。Cwestern blot检测FRAS1过表达或未过表达的shMETTL3 HCC827和NCI-H1975细胞及Ctrl细胞中FRAS1和CDON蛋白水平。D对FRAS1过表达或未过表达的shMETTL3 HCC827和NCI-H1975细胞或Ctrl细胞进行CCK-8检测。*P< 0.05。**P< 0.01, ***P< 0.001。E在FRAS1过表达或未过表达的shMETTL3 HCC827和NCI-H1975细胞或Ctrl细胞中分析集落形成
此外,我们还通过引入靶向CDON的siRNA实现功能缺失,初步探索了CDON在HCC827和NCI-H1975细胞中的生物学作用。如附加文件所示,在si-CDON转染的细胞中,CDON在mRNA和蛋白水平上的表达显著降低1:无花果。S1A和1B。CCK-8检测结果显示,CDON下调导致细胞增殖减少1:图S1C)。一致地,我们还观察到,当CDON被执行EDU合并敲低时,EDU阳性细胞减少(附加文件)1:图S1D)。这些结果表明CDON可能在HCC827和NCI-H1975细胞中起致癌基因的作用。
FRAS1是n6 -甲基ladenosine METTL3在NSCLC中的靶点
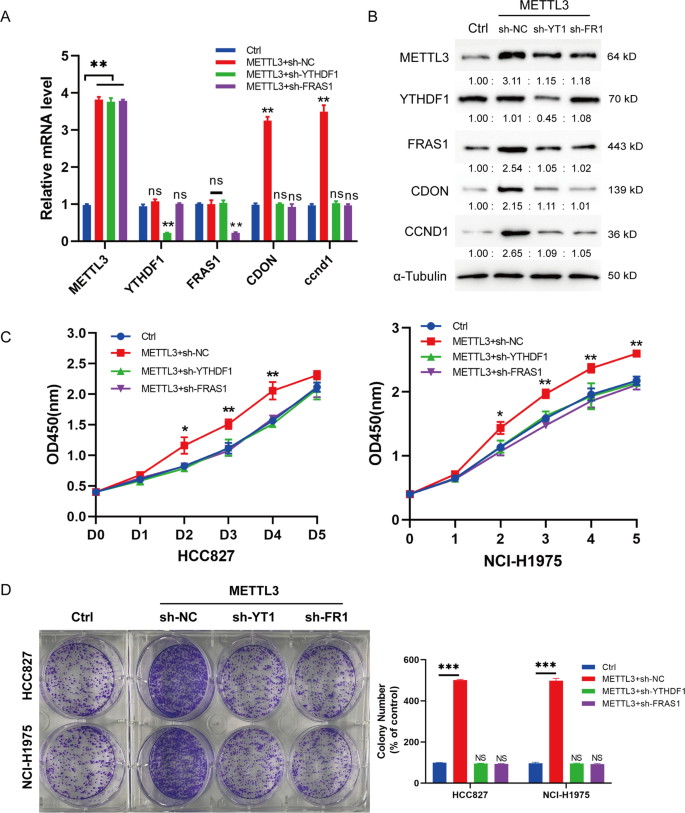
进一步探讨mettl3诱导FRAS1m6A修饰对NSCLC细胞增殖的影响,在稳定的ythdf1沉默、fras1沉默的细胞中过表达METTL3进行拯救实验。qRT-PCR结果显示,mRNA水平无明显变化FRAS1mettl3过表达组与sh-YTHDF1 + mettl3过表达组比较(图6A). mettl3过表达诱导的FRAS1和CDON蛋白水平上调可以通过沉默YTHDF1或沉默FRAS1来恢复(图。6B)。此外,我们还发现METTL3过表达引起的cyclin D1 (CCND1)表达升高可以通过敲低YTHDF1或敲低FRAS1来逆转。CCND1它属于高度保守的周期蛋白家族,在多种肿瘤中调节细胞周期G1/S转变,促进细胞增殖[32,33,34].我们还在收集的5个肿瘤样本中检测到了CDON、METTL3和YTHDF1蛋白的表达,如附加文件所示1:图S2。结果显示,在T1、T2、T3、T5肿瘤组织中,CDON的表达较相应的正常组织(T4样本)上调。五种肿瘤组织中YTHDF1和METTL3蛋白表达均高于配对正常组织。功能研究表明,通过CCK-8和集落形成试验分析,沉默YTHDF1或FRAS1也可以挽救mettl3过表达诱导的细胞增殖升高(图2)。6此外,我们还验证了CDON、YTDHF1和METTL3在收集的NSCLC肿瘤样本中的表达情况。观察到CDON、YTHDF1和METTL3在癌组织中较正常组织高表达(附加文件1:图S2),表明FRAS1、CDON与METTL3/YTHDF1之间存在正相关关系。总之,我们的数据表明FRAS1是METTL3调节NSCLC细胞增殖的主要靶点。
METTL3诱导的FRAS1 m6A修饰增强促进NSCLC细胞增殖。一个通过qPCR在以下组HCC827细胞中检测相关基因FRAS1、YTHDF1、CDON的mRNA水平。Ctrl, shscr + METTL3, shYTHDF1 + METTL3, shFRAS1 + METTL3。Bwestern blot检测以下各组HCC827细胞中上述基因的蛋白水平。Ctrl, shscr + METTL3, shYTHDF1 + METTL3, shFRAS1 + METTL3。C对以下组HCC827细胞进行CCK-8检测。数值用平均值±标准差表示。(D)在以下组HCC827细胞中分析集落形成。Ctrl, shscr + METTL3, shYTHDF1 + METTL3, shFRAS1 + METTL3。*P< 0.05或**P< 0.01或***P< 0.001表示各组间有显著差异。Ns,不显著
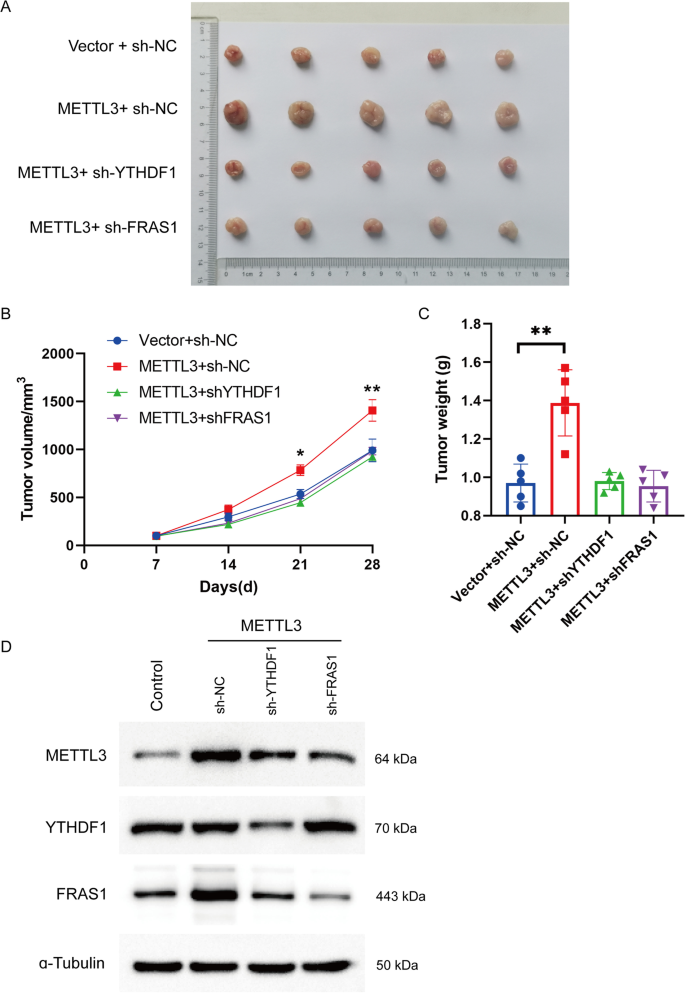
mettl3诱导的FRAS1促进体内NSCLC肿瘤生长
为了验证METTL3/FRAS1轴在体内的作用,我们利用异种移植瘤模型验证了其对肿瘤生长的影响。如图所示。7, METTL3上调诱导的肿瘤过度生长被FRAS1或YTHDF1下调阻断,包括肿瘤体积和肿瘤重量(图2)。7a - c)。同样,当FRAS1或YTHDF1沉默时,METTL3过表达引起的FRAS1表达增加减少。7D).综上所述,mettl3诱导的FRAS1促进了体内NSCLC肿瘤的生长。
METTL3诱导的FRAS1促进体内肿瘤生长。一个肿瘤的代表性图像来源于皮下注射稳定表达Vector + sh- nc、METTL3 + sh- nc、METTL3 + sh YTHDF1、METTL3 + sh- fras1的异种移植NCI-H1975细胞。B采用稳定表达Vector + sh- nc、METTL3 + sh- nc、METTL3 + sh YTHDF1、METTL3 + sh- fras1的H1975细胞构建异种移植瘤模型,分别于皮下注射后7、14、21、28天测定肿瘤体积。C28天后处死小鼠,对肿瘤组织进行称重。Dwestern blot检测METTL3、YTHDF1、METTL3蛋白表达。*P< 0.05或**P< 0.01表示各组间差异显著
讨论
肺癌被认为是世界上癌症相关死亡的主要原因。m6A修饰异常与各种肿瘤进展密切相关。m6A调控因子在多种肿瘤中的作用已被广泛报道。然而,我们对m6A修饰在肺癌中的影响还知之甚少。本研究探讨了METTL3/YTHDF1/FRAS1 m6A在NSCLC细胞增殖中的作用和功能。
在本研究中,我们发现了一个有趣的现象,采集的LUAD组织中FRAS1的mRNA和蛋白水平存在明显差异,这在NSCLC细胞系中是一致的。即在mRNA水平上无显著差异FRAS1而与正常组织相比,LUAD肿瘤中FRAS1蛋白水平上调。但我们的结果与TCGA分析不一致,其中肺癌肿瘤组织的mRNA水平低于正常组织。有三个可能的原因。第一个原因是我们收集的样本数量较少,只有5对样本。我们将收集更多的样本来鉴定的表达FRAS1肿瘤组织与正常组织之间的mRNA水平。第二,TCGA数据库中肿瘤样本与正常样本未配对。表达上的差异FRAS1肿瘤组织与正常组织之间的RNA水平不能准确反映。第三,肺癌TCGA数据库包括小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC)的数据。我们收集的样本均为NSCLC。肺癌的类型可能导致我们的研究结果与TCGA数据分析结果不一致。此外,FRAS1表达增加与NSCLC患者总生存期缩短有关。这些结果表明,FRAS1可能是NSCLC的肿瘤促进因子和潜在的预后因素。此前有报道称,FRAS1在发育过程中表皮基底膜粘附过程中起重要作用[35].近期研究表明FRAS1与肿瘤转移有关[24,25,36].FRAS1被报道通过激活EGFR和PI3K信号通路促进胃癌肝转移[24].在NSCLC中,研究发现FRAS1敲低可以通过抑制FAK信号通路来抑制HCC827细胞的迁移和侵袭[23].在HCC827和NCI-H1975细胞中,FRAS1过表达可以挽救METTL3敲除导致的细胞增殖下降。反过来,FRAS1沉默可以逆转NSCLC细胞中METTL3过表达引起的细胞增殖升高。这是首次确定FRAS1在肺癌中促进细胞增殖的作用。
我们发现在基因的终止密码子附近存在保守的甲基化位点FRAS1信使rna。METTL3被称为n6 -甲基转移酶复合物的关键成分,通过RNA甲基化介导肿瘤的发生[37].在这项研究中,我们发现METTL3在NSCLC肿瘤中高表达。甲基化RNA免疫沉淀显示FRAS1mRNA存在METTL3介导的m6A修饰。据报道,METTL3在一系列肿瘤中具有致癌或肿瘤抑制作用。例如,METTL3通过ythdf2依赖的方式调节SOCS2促进肝癌进展[9].METTL3依赖于m (6)A修饰,通过调节HDGF表达促进胃癌进展[38].在甲状腺乳头状癌(PTC)中,METTL3通过m6A/c-Rel/ il -8介导的中性粒细胞浸润抑制PTC进展[39].METTL3已被确定为肺癌的治疗靶点。YAP可促进mettl3 - m6a - ythdf3依赖性肺癌干细胞的生成[14], METTL3可逆转β-榄香烯对非小细胞肺癌吉非替尼的耐药性[40].由于其在肺癌中的重要性,研究其具体的机制至关重要。在本研究中,我们观察到MELLT3的下调抑制了NSCLC细胞系HCC827和NCI-H1975细胞的增殖和集落形成。这是关于FRAS1 m6A修饰与肺癌细胞增殖相关性的首次研究。
已知m6A修饰物以m6A方式影响肿瘤发生。例如,METTL3可以通过促进EGFR或TAZ转录本的翻译来促进肺癌肿瘤的生长和侵袭,而不依赖于其催化活性[13].在本研究中,我们发现METTL3上调引起的细胞增殖升高可以通过FRAS1沉默或YTHDF1沉默来恢复,这表明METTL3以m6a依赖性的方式影响NSCLC细胞增殖。然而,如果进行更多的研究,以确定其他转录者(如METTL4)是否可能对FRAS1 mRNA产生相互作用,或者是否涉及其他转录者(如YTHDF2),则会更加完整。
据报道,M6A读取器负责甲基化mRNA的命运。我们的数据首次验证了YTHDF1可以促进m6a修饰的翻译FRAS1信使rna。这些数据与之前的研究是一致的[41].然而,METTL3、YTHDF1和CDON在细胞和组织水平表达的一致性尚未得到验证。此外,ythdf1促进FRAS1蛋白稳定性控制的进一步生物学功能值得进一步研究。
m6A修饰是动态可逆的,可以被“擦除”m6A去甲基酶去除,如FTO、ALKBH5和去甲基酶等。有报道称FTO可通过触发PKM2去甲基化促进肝细胞癌的发生[42].一项研究报道ALKBH5可以通过维持FOXM1的表达来维持胶质母细胞瘤干细胞样细胞的致瘤性[43].在本研究中,我们主要关注“Writers”和“Readers”对FRAS1 m6A的修饰。研究FTO等擦除酶对FRAS1修饰的可能调控机制将是我们未来项目的研究方向,丰富FRAS1在NSCLC中的调控机制。
CDON(细胞粘附相关,癌基因调节)是一种激活SHH信号通路的细胞表面蛋白,在内皮细胞完整性中起重要作用[44,45].目前,CDON被证实参与肿瘤的进展。有报道称CDON参与前列腺癌肿瘤细胞的生长和侵袭[41].在本研究中,METTL3/YTHDF1提高FRAS1蛋白表达,从而加速细胞增殖和肿瘤生长(集落形成)。同时,我们观察到FRAS1可以调节CDON的表达。mettl3过表达细胞中CDON表达的增加通过FRAS1沉默或YTHDF1沉默被逆转。这些发现与之前的报道一致,即CDON对NSCLC癌细胞增殖和肿瘤发生至关重要[41].
综上所述,我们的研究首次证明了FRAS1在NSCLC中的肿瘤启动子作用,并通过METTL3提供了m6a依赖的调控机制。m6A甲基转移酶METTL3通过增强FRAS1 mRNA m6A修饰和FRAS1转录稳定性来促进FRAS1蛋白水平。“writer”METTL3、“reader”YTHDF1和“target”FRAS1的调控网络激发了对m6A依赖基因在癌症生物学中的调控机制的理解,这为m6A调控因子作为NSCLC中有前景的生物标志物提供了可能性。
数据和材料的可用性
在当前研究期间生成的数据集可根据合理要求从通讯作者处获得。
缩写
- m6A:
-
N6-methyladenosine
- 非小细胞肺癌:
-
非小细胞肺癌
- LUAD:
-
肺腺癌
- FRAS1:
-
弗雷泽细胞外基质复合物亚基1
- CDON:
-
细胞粘附相关,癌基因调控
- METTL3:
-
甲基转移酶3,n6 -腺苷-甲基转移酶复合物催化亚基
- YTHDF1:
-
YTH n6 -甲基腺苷RNA结合蛋白1
- 知识产权:
-
免疫沉淀反应
- 撕裂:
-
RNA免疫沉淀反应
- 存在:
-
定量逆转录-聚合酶链反应
- cd:
-
编码序列
- 人力资源:
-
风险比
- 置信区间:
-
置信区间
- 聚合酶链反应:
-
聚合酶链反应
- CCK-8:
-
细胞计数试剂盒
- EDU:
-
5-Ethynyl-2的脱氧尿苷
参考文献
马志,季娟。n6 -甲基腺苷(m6A) RNA修饰在癌症干细胞中的应用。《干细胞》2020;3:4470。
孙涛,吴瑞,明玲。m6A RNA甲基化在癌症中的作用。Biomed Pharmacother, 2019;112:108613。
顾超,石旭,戴超,等。RNA在癌症中的修饰:分子机制和潜在的临床应用。创新(N Y). 2020;1(3):100066。
刘涛,魏强,金杰,等。m6A读本YTHDF1通过增加EIF3C转译促进卵巢癌进展。中国生物工程学报,2020;48(7):3816-31。
韩俊,王建忠,杨霞,等。METTL3通过m6a依赖的方式加速pri-miR221/222的成熟来促进膀胱癌的肿瘤增殖。中华肿瘤杂志,2019;18(1):110。
张超,张敏,葛生,等。m6A修饰减少预测胃癌恶性表型,Wnt/PI3K-Akt信号通路增强。中华癌症杂志2019;8(10):4766-81。
陈华,高松,刘伟,等。RNA n6 -甲基腺苷甲基转移酶METTL3通过激活m6A-GLUT1-mTORC1轴促进结直肠癌,是一种治疗靶点。胃肠病学。2021;160 (4):1284 - 300. - e16天。
刘松,卓林,王杰,等。METTL3在生物过程中发挥多种功能。中华癌症杂志,2020;10(6):1631-46。
陈敏,魏林,罗春涛,等。RNA n6 -甲基腺苷甲基转移酶样3通过ythdf2依赖的SOCS2转录后沉默促进肝癌进展。肝脏病学。2018;67(6):2254 - 70。
吴丽萍,陈勇,等。n6 -甲基腺苷(m6A)形成酶METTL3控制正常造血细胞和白血病细胞的髓系分化。中国医学杂志,2017;23(11):1369-76。
崔强,史华,叶萍,等。m6A RNA甲基化调控胶质母细胞瘤干细胞的自我更新和肿瘤发生。Cell Rep. 2017;18(11): 2622-34。
董智,崔华。RNA修饰在胶质母细胞瘤中的作用。癌症(巴塞尔)。2020; 12(3): 2205。
林山,崔杰,杜鹏,崔波,李国强。m(6)A甲基转移酶METTL3促进人类癌细胞的翻译。中国生物医学工程学报。2016;36(3):335-45。
Jin D, Guo J, Wu Y, et al. METTL3启动m6A mRNA甲基化直接促进YAP翻译,通过调节MALAT1-miR-1914-3p-YAP轴提高YAP活性,诱导NSCLC耐药和转移。中华血液病杂志,2019;12(1):135。
李娟,孟S,徐敏,等。miR-493-3p介导的下调n6 -甲基腺苷结合YTHDF2蛋白通过升高n6 -甲基腺苷水平抑制前列腺癌。Oncotarget。2018;9(3):3752 - 64。
杨勇,范X,毛敏,等。n6 -甲基腺苷驱动环状rna的大量转译。中国生物医学工程学报,2017;27(5):626-41。
钟龙,廖东,张敏,等。YTHDF2在肝细胞癌中通过破坏EGFR mRNA的稳定来抑制细胞增殖和生长。癌症杂志2019;442:252-61。
白勇,杨超,吴锐,等。YTHDF1调控人结直肠癌的致瘤性和癌干细胞样活性。Front Oncol. 2019;9:332。
林霞,柴刚,吴勇,等。RNA m6A甲基化调控癌细胞上皮间充质转化和蜗牛翻译。自然科学进展。2019;10(1):2065。
赵旭,陈勇,毛青,等。YTHDF1过表达与肝细胞癌患者预后不良有关。癌症生物标志物,2018;21(4):859-68。
史勇,范松,吴敏,等。YTHDF1与缺氧适应与非小细胞肺癌进展相关。地理学报。2019;10(1):4892。
Short K, Wiradjaja F, Smyth I.让我们粘在一起:Fras1和Frem蛋白在表皮粘附中的作用。中国生物医学工程学报。2007;39(7):427-35。
詹强,黄rf,梁晓华,等。FRAS1的敲除通过下调FAK信号来减少A549细胞的迁移和侵袭。中华临床医学杂志,2014;7(7):1692-7。
梅田,王志强,等。Fraser细胞外基质复合物亚基1促进胃癌肝转移。中华肿瘤学杂志,2020;26(10):2865-76。
支强,万东,任瑞,等。环状RNA分析认为circ102049是结直肠癌肝转移的关键调节因子。中国生物医学工程学报,2017;15(2):623-41。
Lánczky A, gyzyrffy B.为医学研究量身定制的基于网络的生存分析工具(KMplot):开发和实现。中国医学网络学报,2021;23(7):e27633。
gyzyrffy B, Surowiak P, Budczies J, Lánczky A.利用转录组数据评估生物标志物在非小细胞肺癌中的预后价值。PLoS ONE。2013; 8 (12): e82241。
Livak KJ, Schmittgen TD。利用实时定量PCR和2(-Delta Delta C(T))方法分析相关基因表达数据。方法。2001;25(4):402 - 8。
张艳,耿霞,李强,等。RNA m6A修饰在胶质瘤中的作用。中国临床癌症杂志,2020;39(1):192。
张慧,石霞,黄涛,等。人类m6A甲基化的动态格局和进化。中国生物医学工程学报,2020;48(11):6251-64。
周勇,曾鹏,李艳华,张忠,崔强。基于序列衍生特征的哺乳动物n6 -甲基腺苷(m6A)位点预测。中国生物医学工程学报,2016;44(10):e91。
朱敏,张超,周鹏,陈松,郑慧。LncRNA CASC15在喉鳞癌中通过下调miR-365上调cyclin D1,促进细胞增殖。中华耳鼻喉头颈外科杂志。2022;51(1):8。
全玲,刘建勇,曲丽霞,等。基于Oncomine数据库的Cyclin D1基因在卵巢癌中的表达及沉默对卵巢癌细胞的影响生物工程。2021;12(2):9290 - 300。
Caudron-Herger M, Diederichs S. cyclin D降解机制在肿瘤细胞周期靶向治疗中的应用。信号传输目标,2021;6(1):311。
Smyth I, Du X, Taylor MS, Justice MJ, Beutler B, Jackson IJ。细胞外基质基因Frem1对胚胎表皮的正常粘附至关重要。中国科学(d辑),2004;29(4):366 - 366。
麦格雷戈L,马凯拉V,达林SM,等。FRAS1/ FRAS1编码一种假定的细胞外基质蛋白的突变引起弗雷泽综合征和小鼠泡状表型。中国科学。2003;34(2):203-8。
蔡勇,冯锐,陆涛,陈霞,周霞,王霞。m6A-RNA甲基转移酶METTL3在癌症中的新发现。生物标记Res. 2021;9(1):27。
王强,陈超,丁强,等。mettl3介导的m6A修饰HDGF mRNA促进胃癌进展,具有预后意义。肠道。2020;69(7):1193 - 205。
何娟,周敏,尹杰,等。METTL3通过m6A/c-Rel/ il -8介导的中性粒细胞浸润抑制甲状腺乳头状癌的进展。Mol Ther, 2021;29(5): 1821-37。
刘,李问,李G, et al。m6A甲基转移酶mettl3介导的自噬通过β-榄香烯逆转非小细胞肺癌吉非替尼耐药的机制细胞死亡,2020;11(11):969。
Tassinari V, Cesarini V, Tomaselli S,等。ADAR1是METTL3的新靶点,在胶质母细胞瘤中通过编辑无关机制发挥促癌作用。中国生物医学工程学报。2021;22(1):51。
李娟,朱玲,石艳,刘娟,林玲,陈霞。m6A去甲基酶FTO通过介导PKM2去甲基化促进肝细胞癌的发生。中国地理学报,2019;11(9):6084-92。
(6)去甲基化酶ALKBH5通过维持FOXM1表达和细胞增殖程序来维持胶质母细胞瘤干细胞样细胞的致瘤性。中国癌症杂志,2017;31(4):591-606.e6。
Bashamboo A, Bignon-Topalovic J, Rouba H, McElreavey K, Brauner R.与垂体柄中断综合征相关的hedgehog受体CDON无义突变。中国临床内分泌杂志,2016;21(1):12-5。
Chapouly C, Hollier PL, Guimbal S, Cornuault L, Gadeau AP, Renault MA。沙漠刺猬驱动的内皮完整性被gas1(生长抑制特异性1)增强,但被cdon(细胞粘附分子相关/癌基因下调)负调控。中国心血管病杂志。2020;40(12):e336-336e349
确认
N/A
资金
N/A
作者信息
作者及隶属关系
贡献
XD和ZW:项目设计、文献研究、临床研究、数据分析、稿件撰写和修改。WL、LM、YZ:文献研究、临床研究、数据分析、稿件起草。所有作者均已阅读并批准稿件。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
伦理批准并同意参与
本研究是按照相关的指导方针和规定进行的。空间中心医院伦理委员会伦理审定(20200511-JJJHZ-01)。获得每位患者的书面知情同意书。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:
补充数字和表格。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
豆,X,王,Z,陆,W。et al。METTL3以m6A-YTHDF1依赖的方式促进非小细胞肺癌(NSCLC)细胞增殖和集落形成。BMC Pulm医学22, 324(2022)。https://doi.org/10.1186/s12890-022-02119-3
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12890-022-02119-3
关键字
- METTL3
- 非小细胞肺癌(NSCLC)
- 细胞增殖
- 集落形成
- YTHDF1
- FRAS1
- CDON