摘要
过氧化物酶体是在许多代谢过程中发挥重要作用的细胞器,同时也在先天免疫、信号转导、衰老和癌症中发挥作用。过氧化物酶体的主要功能之一是将超长链脂肪酸加工成可定向到线粒体的代谢物。在这一过程中,一个关键的酶家族是过氧酶体酰基辅酶a氧化酶(ACOX1, ACOX2和ACOX3),其表达在某些癌症中被证明是失调的。然而,我们对该氧化酶家族在非小细胞肺癌(NSCLC)中的表达知之甚少。然而,ACOX2在超过10%的NSCLC中mRNA水平升高,在本研究中,我们使用标准和生物信息学方法表明,ACOX2在NSCLC中的表达显著改变。ACOX2 mRNA表达与许多突变基因有关,研究人员探索了ACOX2表达与肿瘤突变负担和免疫细胞浸润之间的关系。ACOX2表达与癌基因驱动突变(如KRAS)的候选疗法之间的联系也被确定。此外,研究人员还探讨了酰基辅酶a氧化酶和其他相关过氧化物酶体基因的水平,以进一步确定过氧化物酶体途径与NSCLC之间的联系。这项生物标志物驱动的研究结果表明,ACOX2可能在诊断、预后和患者分层方面具有潜在的临床应用价值,可用于各种靶向治疗方案。
简介
肺癌仍然是世界上最常见的恶性肿瘤,最近的Globocan分析表明,全世界估计将有1,930万例新癌症病例,其中11.4%将是肺癌,18%是癌症死亡的主要原因(估计有180万例死亡)[1,3.].肺癌本身可分为小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC)两种亚型,绝大多数(约85%)属于后者。非小细胞肺癌的治疗选择仍然有限,但最近免疫治疗的进展[4]、靶向治疗[5]和新的可操作突变的发现[6,7极大地增加了这种癌症的治疗选择。
自1954年被发现以来[8],过氧化物酶体已成为重要的代谢细胞器,具有许多不同的功能,从细胞脂质代谢和活性氧,到非代谢作用,如细胞应激反应和细胞信号分子的合成[9,10].这是通过与内质网和线粒体等其他细胞间室的相互作用来实现的[10].
将过氧化物酶体与NSCLC生物学联系起来的证据主要来自于早期研究,这些研究证明过氧化物酶体增殖物激活受体(ppar)在肺癌肿瘤发生中的作用[11].此外,过氧化物酶体通过其在癌症中的异常代谢和与线粒体的串扰(以及相关的线粒体功能障碍)中的作用与癌症有关[12].在肺癌中,异常代谢是有充分证据的[13,14],以及线粒体功能障碍[15,16].
过氧化物酶体的主要功能之一是通过α-或β-氧化将超长链脂肪酸(VLCFAs)加工成可指向线粒体的代谢物[12].过氧化物酶体酰基辅酶a氧化酶(ACOs)被描述为线粒体酰基辅酶a脱氢酶(ACADs)的过氧化物酶体等效物[17,18].ACOs属于同一个超家族,每个亚单位含有一个非共价结合的黄素腺嘌呤二核苷酸(FAD) [17,18].与线粒体ACADs类似,ACOs催化酰基辅酶a的α-、β-脱氢的形成,这是过氧化物酶体脂肪酸β-氧化途径的初始和速率决定步骤[17,18].根据超长链脂肪酸(VLCFA)的类型和/或其线性或分支状态,该步骤由ACOX1、ACOX2或ACOX3进行[12].ACOX1对不同链长直链脂肪酸进行氧化[12,19].ACOX2和ACOX3在支链脂肪酸的降解中具有已知的作用[19].然而ACOX2是唯一已知的与人类胆汁酸生物合成相关的ACO [19].
因此,这些不同的作用表明,过氧化物酶体本质上在许多全球重要的人类疾病中发挥着重要作用,包括肥胖、癌症和与年龄相关的疾病[9].在疾病背景下,过氧化物酶体最初与各种代谢疾病有关[20.,21],而最近已发现多种癌症均有过氧化物酶体基因/蛋白质的失调,包括前列腺癌、乳腺癌和肺癌[12,22,23,24,25].特别是乳腺癌中对过氧化物酶体脂肪酸β-氧化的改变进行了广泛的研究[12],虽然许多结果来自独立的个体研究,但癌细胞中ACOX1和该过程的其他成员的上调表明整个β-氧化代谢途径可能受到影响,并将整个β-氧化过程与乳腺癌的发生联系起来[12].
虽然有证据表明过氧化物酶体脂肪酸的β-氧化与NSCLC有关,但在NSCLC中尚未对这一途径进行如此详细的研究。在Zhang等人对NSCLC过氧化物酶体通路的分析中[25],从肿瘤基因组图谱(TCGA) NSCLC数据集分析中鉴定出38个差异表达基因,但所鉴定的基因均不属于ACOX家族。令人惊讶的是,ACOX2被描述为在包括NSCLC在内的多个TCGA癌症数据集中普遍上调的基因[12].
ACOX2在超过10%的NSCLC中mRNA水平升高[12],我们在NSCLC中对该基因进行了分析,以确定它是否在mRNA和蛋白质水平上作为肺癌的生物标志物具有任何潜在的用途。同时利用硅片分析,我们探索了NSCLC中所有过氧化物酶体ACOX家族成员。我们表明,与最初的数据相比[12ACOX2在NSCLC中主要在mRNA和蛋白水平下调。ACOX2表达的降低可能与ACOX2启动子中个别CpG残基的超甲基化有关。ACOX2的表达主要与肺腺癌(LUAD)亚群的预后相关。我们进一步将ACOX家族其他成员和与这些酶相关的其他过氧化物酶体蛋白的表达改变与NSCLC中的异常表达和预后价值联系起来,并且ACOX2表达改变可能与对某些药物的敏感性有关[12].
材料与方法
原发肿瘤样本
本研究使用22例手术切除化疗naïve新鲜冷冻肿瘤标本,取自2011-2016年期间都柏林圣詹姆斯医院的手术切除。切除后立即由病理学家对所有样本进行评估,肿瘤组织和匹配的正常组织被解剖以进行下游分析。本研究共涉及11例腺癌和11例鳞状细胞癌,其组织病理学和临床病理资料汇总见表1.研究人员从每位患者处获得知情同意,并在SJH/AMNCH医院伦理委员会(Ethics REC)正式批准后进行。: 041018/8804)。
固定福尔马林石蜡包埋样品
本研究共纳入204例1999-2007年间手术切除的NSCLC肿瘤标本。所有手术切除的肿瘤标本和对照标本均用10%福尔马林固定,石蜡包埋(FFPE)。采用国际癌症控制联盟肿瘤-节点-转移(TNM)恶性肿瘤分类第8版进行肿瘤分期[26,27],并根据世界卫生组织指南进行组织学分类[28,29].表中列出了所使用队列患者的组织病理学和临床病理学数据(包括年龄、性别、吸烟状况、组织学、TNM分期、手术程序、肿瘤分级和原发部位)的摘要2.
使用Beecher Manual Tissue Arrayer (Model MTA-1)生成组织微阵列(TMA),其中包含四份FFPE嵌入样品的核心(0.6 mm),随后使用4µm切片进行ACOX2的免疫组化(IHC)。
免疫组织化学
在TMA切片上进行免疫组化,采用标准方案对载玻片进行脱蜡、再水化和清洗。随后,使用ULTRA细胞调节(ULTRA CC1) pH9.1进行热诱导表位检索(HIER)。为了进行ACOX2抗体染色,将载玻片用兔多克隆一抗HPA038280 (Atlas antibody, Merck)在室温下用ventana抗体稀释液(Ref: 251-018)(1:50)稀释32分钟,并使用OptiView™DAB IHC检测试剂盒在ventana BenchMark XT处理器上进行染色。
免疫组化后,染色由两名不了解临床、病理和随访数据的病理学家独立评估。染色强度指定为0、1 +、2 +或3 +,每个肿瘤切片给予0到300之间的h评分= 3(3 +的%)+ 2(2 +的%)+ 1(1 +的%)。没有观察到H-Score为300的样本。
ACOX2高表达的肿瘤被定义为平均H评分高于中位数,低表达低于中位数的肿瘤。Kaplan-Meier分析使用Prism 5.01 (GraphPad)构建。
RNA分离和qPCR扩增
使用我们之前描述的方法将总RNA分离并转化为cDNA [30.,31,32].简单地说,根据制造商的说明,使用TRI试剂(Molecular Research Center, Montgomery Road, OH, USA)提取总RNA。然后根据制造商说明书,对250 ng该总RNA进行预处理,用扩增级DNase I (Sigma-Aldrich, St. Louis, MO, USA)去除污染的基因组DNA [30.,31,32].All-in-One cDNA Synthesis SuperMix (Bimake, W Sylvanfield Drive, Houston, TX, USA)然后根据制造商说明生成第一链cDNA [30.,31,32].
随后使用Illumina Eco qPCR和2 × SYBR Green qPCR Master Mix (Bimake, W Sylvanfield Drive, Houston, TX, USA)对这些样品进行ACOX2的qPCR(相对定量法),使用制造商协议进行2步qPCR程序,组蛋白H3作为内部对照,使用以下引物:
Acox2 fwd: 5 ' - ccaagtggacatggcaagaa - 3 '
Acox2 rev: 5 ' - gtgacttctgagcccactgga - 3 '
组蛋白H3 FWD: 5 ' - GGTAAAGCACCCAGGAAGCA - 3 '。
组蛋白H3 REV: 5 ' - CCTCCAGTAGAGGGCGCAC - 3 '。
使用以下循环参数:
聚合酶初始激活95°C 2分钟,然后95°C 15秒,35个循环,61°C退火/扩增1分钟。在每次PCR结束时分别用95°C 15秒、55°C 15秒和最终95°C 15秒进行熔解曲线分析。每次反应引物最终浓度均为200 nM。
数据分析使用默认内置的Eco软件或导入EcoStudy (Illumina),以ΔΔCq方法进行分析[33].
非小细胞肺癌酰基辅酶a氧化酶差异表达基因的鉴定
为了确定酰基辅酶a氧化酶在非小细胞肺癌中的表达是否显著改变,使用肺癌探测器(LCE)进行了系统分析[34]对基因表达的标准化平均差异(肿瘤与正常)进行meta分析,随后基于单变量Cox比例风险模型对生存和基因表达相关性进行meta分析。
酰基辅酶a氧化酶相关蛋白-蛋白相互作用网络的建立
STRING数据库[35]进行酰基辅酶a氧化酶的功能富集分析,以识别蛋白质-蛋白质相互作用网络,输出到Cytoscape [36和第一个邻居突出。随后使用LCE对所有确定的候选基因进行差异基因表达和生存相关性的调查[34].
与酰基辅酶a氧化酶相关的差异表达基因表达差异的验证
在TCGA NSCLC队列中使用LCE检验了ACOX2表达改变的有效性。使用LCE对其他基因表达数据集进行元分析[34].使用Hedges ' G作为效应量度量,通过标准化平均差异(肿瘤-正常)的meta分析,通过LCE计算肿瘤-正常基因表达差异。因此,所有纳入荟萃分析的研究必须在每组中至少有10个样本,并且仅对具有至少三个合格研究数据的基因进行荟萃分析。对肺腺癌和鳞状细胞癌分别进行分析[34].生存与基因表达的关联涉及基于单变量Cox比例风险模型的生存和基因表达关联的元分析。对于每个纳入的研究,在模型拟合之前,基因表达归一化到每个基因的平均值和单位方差为零。只有拥有至少10个样本生存数据的研究才被纳入荟萃分析,如果至少有3项合格研究的数据可用,则仅对基因进行荟萃分析[34].
使用UALCAN验证TCGA-LUAD中改变的蛋白表达[37]来查询CPTAC发现数据集。该数据集包括111个肿瘤(其中102个肿瘤与正常相邻组织样本配对),具有可供查询的全球蛋白质组和磷酸化蛋白质组数据[38].
酰基辅酶a氧化酶和其他相关差异表达基因的预后价值
为了检验预后价值,使用KM-Plot(微阵列和RNA-Seq)进行了五项单独的分析[39], lce [34], ualcan [37]和OncoLnc [40].LCE、UALCAN和OncoLnc都使用TCGA-LUAD和TCGA-LUSC数据集。所有分析均使用默认设置来评估预后生存,如下所示:KM-Plot(中位数);如冰(中位数);UALCAN(高vs中/低);肿瘤nc(50:50百分位)。
所有分析均使用Cox比例风险模型。
拷贝数变异(CNV)对酰基辅酶a氧化酶的影响
为了检验酰基辅酶a氧化酶(ACOX1-3)表达的改变是否与CNVs相关,我们通过cBioPortal分析了TCGA-LUAD和TCGA-LUSC的数据集[41,42].
与突变基因有关
为了从相关TCGA数据集中识别导致NSCLC中USO1表达变化的突变基因,以ACOX2为靶基因,突变流行率设定为2%,使用MuTarget平台进行分析[43].随后使用TIMER2.0上的相关分析对所有确定的目标进行了重新测试[44].
酰基辅酶a氧化酶甲基化分析
DNA甲基化和改变的ACOX2表达之间的相关性最初是使用UALCAN来检测的[37],然后使用MEXPRESS [45]和WANDERER [46]使用默认设置。
ACOX2表达与NSCLC免疫浸润的相关性
为了探究ACOX2表达的改变如何与NCSLC中肿瘤浸润免疫细胞(TIICs)相关,我们使用TIMER [47]或TIMER2 [44].计算基因表达水平对肿瘤纯度的影响,并根据纯度校正后的部分Spearman 's rho值进行评估。用于在GEPIA2中分析[48],采用了类似的策略,将ACOX2表达与选择Spearman相关系数作为默认设置的六基因t细胞衰竭签名相关联。GEPIA2采用非对数尺度计算显著性。最后,ESTIMATE分数[49]用于显示免疫评分和肿瘤纯度。
ACOX2表达与NSCLC细胞抗肿瘤药物敏感性的相关性
ACOX2在NSCLC细胞系中的相对表达及24种抗癌药物的相关药理资料从Cancer cell Line encyclopedia (CCLE)数据库下载[50].在n = 89株NSCLC细胞株中测定24种抗癌药物的一半最大抑制浓度(IC50)值以及ACOX2基因表达与IC50之间的非参数相关性(Spearman)。根据Xiang等人的研究,对于观察到相关性的任何药物,随后将细胞系分为“敏感”组和“耐药”组,使用药物IC50为8µM作为阈值。[51].ACOX2在这两组中的表达差异采用非参数Mann-Whitney检验进行评估。
一项基于ACOX2表达的潜在靶向NSCLC药物的进一步分析使用DepMap PRISM重新利用Primary Screen进行[52].
统计分析
除非另有说明,所有数据均以均数±SEM表示。使用Prism 5.01 (GraphPad, Ca, USA)进行统计学分析,采用配对双尾学生t检验或Mann-Whitney双尾t检验。采用Spearman非参数相关系数进行相关性分析。p < 0.05为差异显著。通过基于web的服务器进行的所有其他分析在每个实例中都使用默认设置。
结果
ACOX2作为非小细胞肺癌差异表达基因的鉴定。
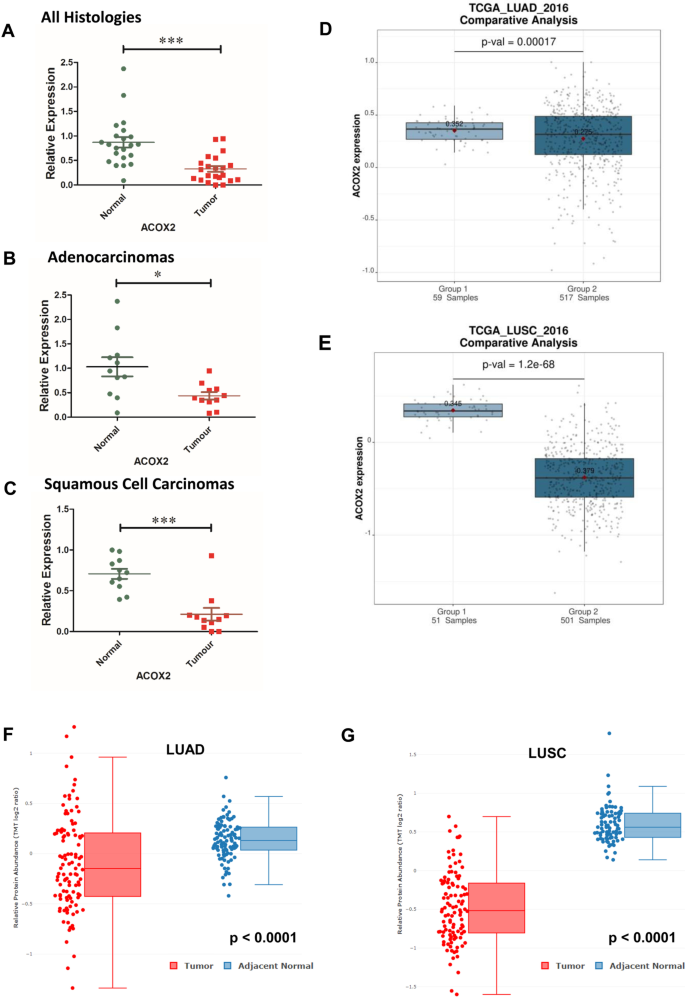
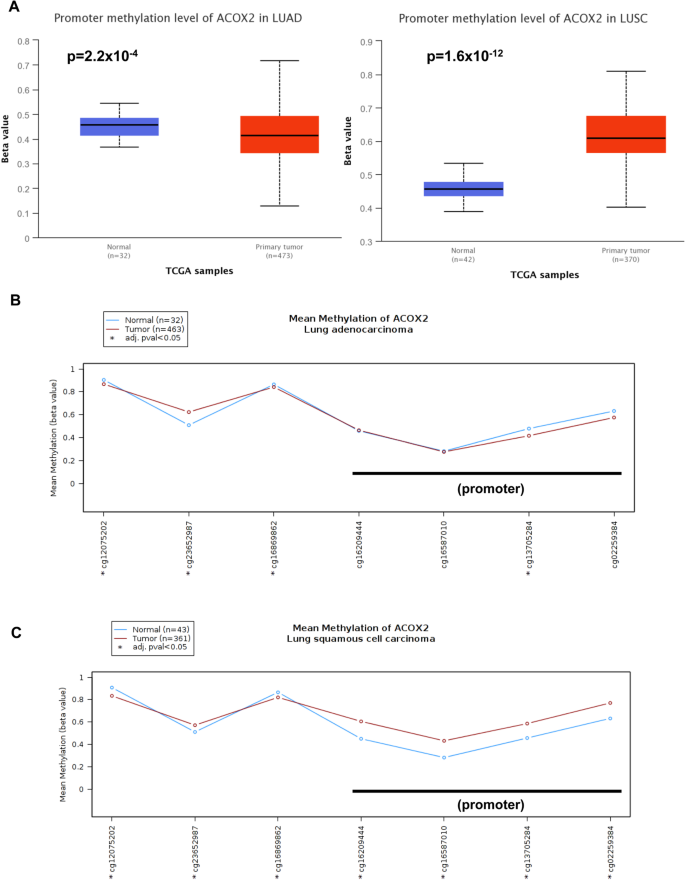
我们用qPCR方法评估了一组手术切除的新鲜冷冻的正常/肿瘤匹配的I期和II期患者样本中ACOX2 mRNA的表达。1A)。总体而言,ACOX2水平在所有样本中均显示显著降低(p < 0.0001)。根据组织学分层,ACOX2下调分别在腺癌(LUAD) (p = 0.0151)和鳞状细胞癌(LUSC) (p = 0.0008)中均显著(图。1a - c)。随后,我们检查了TCGA LUAD和LUSC数据集,以确定ACOX2表达的改变。与我们的数据一致,在两种LUAD中观察到ACOX2 mRNA的表达显著降低(图。1D;p = 1.7 × 104)和LUSC(图;1E;p = 1.2 × 10-68年分别)。其他酰基辅酶a氧化酶仅在LUSC样品中显著降低ACOX1 mRNA和ACOX3 mRNA的表达(附加文件)1:表S1)。
使用系统分析对大量基因表达数据集进行了进一步的元分析(附加文件)1:表s2 -肿瘤vs正常)。从这一分析中发现,ACOX2 mRNA表达的降低仅在LUSC的mRNA水平上有显著改变(附加文件)1:表S2-p = 0.0031)。对肿瘤/正常样本之间ACOX2 mRNA表达改变的相同数据集进行了荟萃分析,在该分析中,ACOX2 mRNA与任何mRNA差异总体上没有关联6:图S5A。然而,当根据组织学分离时,LUAD mRNA仍然不显著(附加文件7:图S6, p = 0.6),而LUSC仍有显著差异表达(附加文件7:图S6, p = 0.0014)。
我们随后查询了LUAD的CPTAC数据集(23),结果显示,与正常情况相比,肿瘤样本中的ACOX2蛋白水平显著降低(附加文件)1:表S1)。在编写LUSC的CPTAC数据时,UALCAN无法进行分析。然而,现在可以在cProSite上找到LUAD和LUSC的蛋白质组学数据。利用这种方法,我们评估了ACOX1-3在LUAD和LUSC中的表达,数据发表在附加文件中1:表S1。从这个分析来看,ACOX1水平在LUAD和LUSC中没有显著改变。然而,ACOX2在两种LUAD的蛋白水平上均显著下调(p < 0.0001,图;1F)和LUSC (p < 0.0001,图;1最后,ACOX3蛋白被发现在配对样本中LUAD显著下调,而非配对样本的整体蛋白水平没有显著变化,而ACOX3蛋白仅在LUSC中显著下调(附加文件)1:表S1)。
非小细胞肺癌中酰基辅酶a氧化酶和其他过氧化物酶体基因表达的改变
利用STRING,我们鉴定了酰基辅酶a氧化酶(ACOX1-3)的一系列蛋白质-蛋白质相互作用。生成的第一邻居网络在附加文件中给出2:图S1。使用LCE系统分析,我们检查了这些基因在肿瘤和正常肺之间表达的显著变化,结果发表在附加文件中1:表S2。本荟萃分析采用Hedges ' G作为效应量度量,呈现为肿瘤-正常基因表达的标准化平均差异[34].从该分析中观察到ACOX1的显著变化(p.adj-0.0011;LUAD);ACOX2 (p.adj - 0.0031;LUSC);ACOX3 (p.adj - 0.0011;LUSC)。ACOXL, ACAA1, ACADM, ACOT4, ACSL1, ACSL5, AMACR, CAT, CRAT, dec2, EHHADH, GNPAT, HSD17B4, PEX5, PEX14和SCP2(附加文件1:表S2)。其中,CAT、HSD17B4和ACAA1最近被确定在NSCLC中表现出表达改变或预后意义,或两者皆有[25].
酰基辅酶a氧化酶和其他过氧化物酶体基因在非小细胞肺癌中的潜在预后价值
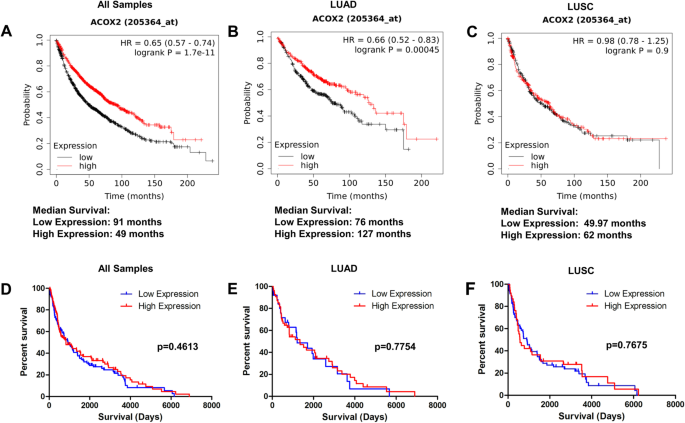
使用KM-Plot对ACOX2的预后价值进行了初步分析[39].ACOX2 mRNA的整体高表达与NSCLC中更好的总生存率(OS)相关(图。2A)。当根据组织学亚型进行分层分析时,这种OS获益仅局限于LUAD(图。2B),在LUSC中未见(图。2C).我们随后通过免疫组化检测患者样本中ACOX2的表达。在这方面,ACOX2整体或任何组织学亚型均未观察到OS益处(图2)。2D-F;额外的文件3.:图S2),表明观察到的OS益处仅限于mRNA表达(附加文件4:图S3)。
ACOX2在非小细胞肺癌中的预后价值。使用KM-Plotter评估ACOX2表达对总生存期(OS)的预后价值[39]和对TMA患者进行免疫组化。ACOX2 mRNA的高表达与总体上更好的OS相关(一个);根据肿瘤组织学划分仅限于LUAD亚型(B);而LUSC的OS无差异(C).相比之下,整体上ACOX2蛋白高表达的IHC未观察到显著的OS获益(D);或在LUAD (E);或LUSC (F).P < 0.05认为差异有统计学意义
使用LCE,我们对ACOX2 mRNA对OS的益处进行了系统分析。总的来说,ACOX2 mRNA在LUAD中有OS益处(p = 0.00049),但在LUSC中没有(附加文件)1:表S3),而ACOX1或ACOX2 mRNA无生存益处。然而,当评估无进展生存期(PFS)时,ACOX2 mRNA未发现显示任何显著的PFS益处(附加文件)5:图S4),而ACOX1和ACOX3 mRNA均与PFS显著相关,表明ACOX2 mRNA仅与OS获益相关。对ACOX2 mRNA相同数据集的元分析显示了所有组织学的表达差异(附加文件)6:图S5A),在本分析中,ACOX2 mRNA与OS相关(p < 0.01 -附加文件6:图S5B)。
为了评估酰基辅酶a氧化酶及其确定的第一邻居的潜在预后价值,最初使用LCE进行了系统分析,结果在附加文件中提供1:表S3。与Zhang等人的观点一致,我们证实ACAA1和CAT表达的改变与LUAD的预后价值相关[25].然而,与之前观察到的结果相比,LCE的系统分析并没有显示出HSD17B4的任何预后价值[25].除了这些基因,在我们的分析中显示出预后价值的其他基因包括ACOX2, ACOXL, ACOT4, ACSL5, AGPS, HADH和SCP2(附加文件)1:表S3)。我们随后比较了5个不同数据库分析的OS值(附加文件1:表S4)。那些显示显著预后OS价值的基因主要与LUAD亚型相关(附加文件)1:表S4),但一些分析表明,某些过氧化物酶体基因的表达改变与LUSC中OS预后价值相关(如附加文件中的ACOXL, ACSL5等)1:表S4)。ACOXL和AGPS在所有数据集/分析中对LUAD均显著,而CAT在五个数据集/分析中有四个显著(附加文件)1:表S4)。在此分析中,我们选择ACOX1, ACOX2, ACOX3, ACOXL, AGPS和CAT进行KM-Plot在LUAD中的进一步评价,结果见附加文件4:图S3。令人惊讶的是,ACOX2 mRNA没有发现与PFS有任何关联(附加文件5:图S4),而ACOX1和ACOX3 mRNA与PFS以及ACOXL、AGPS和CAT均有显著相关性(附加文件)1:表S5)。从这些分析中,所有6种mrna的高表达(基于中位数分层)与LUAD中明显更好的OS相关,并值得进一步评估。
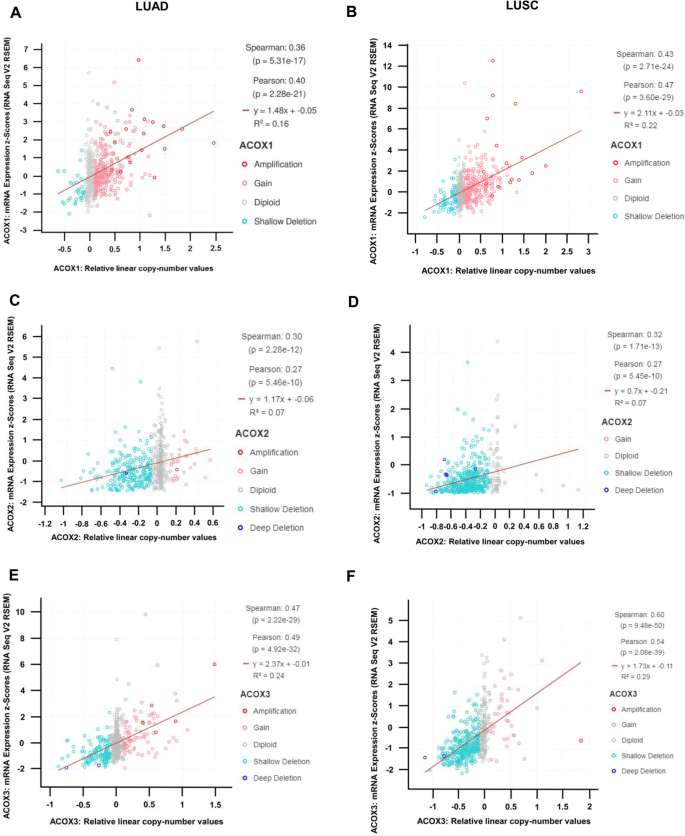
拷贝数变化对非小细胞肺癌酰基辅酶a氧化酶表达的影响
由于酰基辅酶a氧化酶在NSCLC中显著失调(附加文件)1:表S1),为了进一步研究这种失调的潜在影响,我们使用了cBioPortal [41]以评估TCGA -LUAD和-LUSC数据集中拷贝数变异(CNVs)与基因表达变化之间的相关性。如图所示。3.,两种LUAD中所有基因的CNV与基因表达均呈正相关(图;3.A, C, E)和LUSC(图。3.B, D, F)。
ACOX2表达与NSCLC突变的相关性
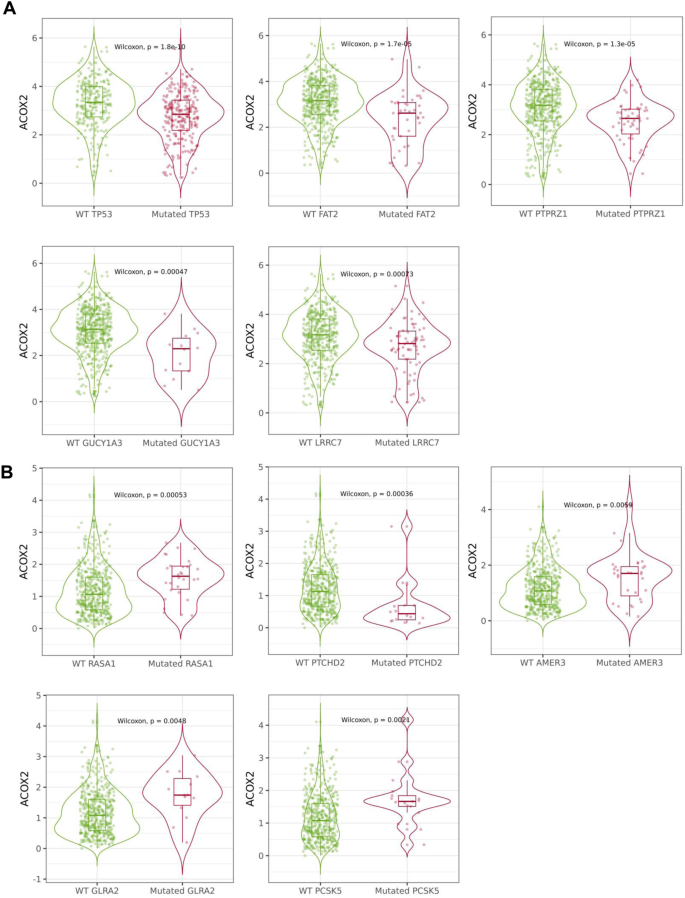
随后,我们评估了ACOX2的显著失调是否与肿瘤的突变状态有关,我们使用TIMER2.0检测了一些在肺癌中常见突变的基因(例如TP53),以确定这些关键基因的突变是否与ACOX2表达水平的改变相关,结果见表3..在检测的基因中,TP53、KRAS和CDKN2A的突变与LUAD和LUSC中ACOX2表达的改变显著相关。仅在LUAD中,ROS1突变与ACOX2表达改变显著相关,而在LUSC中,ERBB2和ALK突变与ACOX2表达改变相关。
最后,使用muTarget [43],然后我们分析了其他基因突变是否会影响LUAD和LUSC中ACOX2的表达。从该分析中,在LUAD中鉴定出244个基因,如果发生突变,将导致ACOX2表达的显著改变,而在LUSC中鉴定出35个基因(附加文件)1:表S6和表S7)以及muTarget定义的前5个影响ACOX2表达的突变基因的结果使用TIMER2.0进行验证,如图所示。4对于两种LUAD (TP53;FAT2;PTPRZ1;GUCY1A3和LRRC7-Fig。4A)和LUSC (RASA1;PTCHD2;AMER3;GLRA2和PCSK5-Fig。4B)。
ACOX2的甲基化分析
由于ACOX2在使用UALCAN的LUAD和LUSC中都显著下调,我们接下来研究了甲基化是否可能是该基因下调的重要因素。而两种LUAD均存在显著的甲基化(图。5A)和LUSC(图。5B),高甲基化所需的beta值截断值为(0.7-0.5)[53,54]表明DNA高甲基化是LUSC的一个重要因素,而不是LUAD(图2)。5).UALCAN甲基化分析采用Illumina 450 k Infinium芯片,相关CG探针具有显著性(CG16587010, CG13705284和CG02259384)。然后,我们使用MEXPRESS重新评估了该基因的甲基化[45].分析发现甲基化和基因表达之间存在显著的负相关,特别是在ACOX2启动子的CpG残基中(附加文件)1:表S8)。为了更详细地评估这一点,我们使用TCGA-Wanderer重新分析了甲基化[46].选择Illumina 450 K设置,分析发现LUAD数据集中的大多数探针都没有显示出显著性,除了cg13705284、cg12075202和cg23652987(图2)。5B和附加文件1:表S8),而在LUSC数据集中,所有探测都保持显著性(图S8)。5C和附加文件1:表S8)。这些结果表明,ACOX2的下调,特别是在LUSC中,可能部分是由于ACOX2启动子内DNA CpG甲基化的增加。
ACOX2表达降低对免疫浸润的影响
为了评估ACOX2表达降低对肿瘤免疫的潜在影响,使用TIMER对NSCLC中的肿瘤浸润免疫细胞进行了分析[47].经过纯度调整,生成了六种免疫细胞类型的spearman's rho和显著性,结果见表4a.结果提示ACOX2表达降低与LUAD中CD8 + T细胞和中性粒细胞浸润呈负相关(表2)4a),而相比之下,在所有六种免疫细胞类型中,LUSC中ACOX2表达的降低与免疫细胞浸润显著正相关(表4a).随后,当USO1表达和免疫细胞浸润与生存的相关性被检测时,只有b细胞和树突状细胞免疫浸润具有生存益处,这进一步仅限于LUAD(表2)4b)。
我们利用TIMER2重新评估了ACOX2对免疫浸润的影响[44],通过使用六种最先进的算法(TIMER, xCell, MCP-counter, CIBERSORT, EPIC和quanTIseq),为癌症基因组图谱(TCGA)数据集提供了更可靠的免疫浸润水平估计,结果在附加文件中呈现1:表S9和表S10。
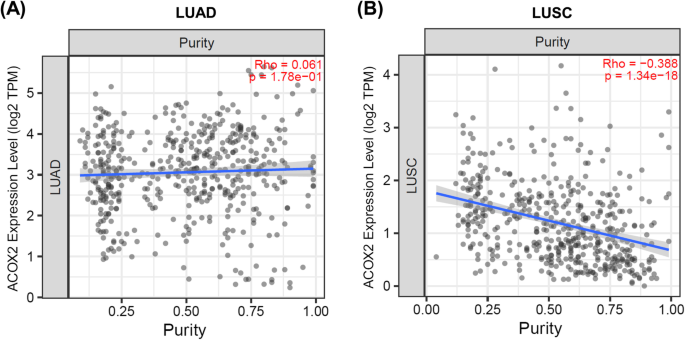
最后,ESTIMATE包[49]用于生成估计评分(推断与基因表达相关的肿瘤纯度)。评估分数(StromalScore, ImmuneScore, ESTIMATEScore, TumorPurity)在附加文件中提供1:表S11),使用TIMER2绘制的图形[44,55,如图所示。6.
ACOX2表达与肿瘤纯度的关系。肿瘤纯度与ACOX2表达之间的相关性是使用Timer2生成的[44]一个LUAD和BLUSC
ACOX2表达与免疫细胞衰竭的相关性分析
为了研究ACOX2之间的关系,我们使用TIMER2.0来评估其表达与T细胞衰竭重要标志物表达之间的相关性[44,56].选择的标记为PD-1 (PDCD1)、CTLA4、LAG3、TIM-3 (HAVCR2)和GZMB,分析结果见附加文件1:表S12。经纯度相关调整后,ACOX2表达与LUAD中PD-1、LAG3、GZMB的表达水平呈负相关(附加文件)1:表S12),而其在LUSC中的表达与PD-1、CTLA4、TIM-3呈正相关(附加文件1:表S12)。使用GEPIA2对T细胞衰竭进行了第二次评估[48]和一组预定义的T细胞衰竭标志物(PDCD1, HAVCR2, TIGIT, LAG3, CXCL13和LAYN)。与TIMER中观察到的模式相似,LUAD中这6个基因签名和ACOX2表达与T细胞衰竭呈负相关(r =−0.15,p = 0.001),而LUSC中则呈正相关(r = 0.23, p = 4.4 × 10)−07).
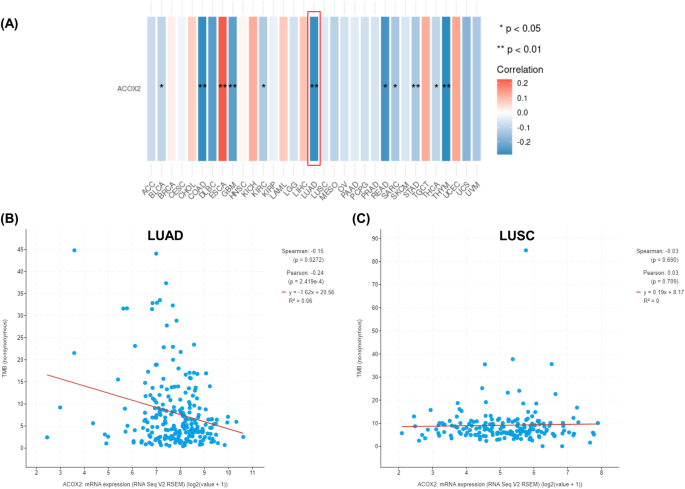
ACOX2表达与肿瘤突变负担的相关性分析
肿瘤突变负荷(TMB)被广泛认为是预测患者对免疫检查点抑制剂治疗的潜在反应的生物标志物[57,58].使用Feng和Shen所描述的方法[59],我们分析了ACOX2表达与肿瘤负荷突变的生物标志物之间的相关性,这些生物标志物与DNA损伤反应(DDR)途径或错配切除修复(MMR)途径相关的基因作为TMB的代理5).DDR通路的联合特征在LUAD和LUSC之间存在极显著的负相关(3.2 × 10-21年).MMR相关基因的特征在LUAD中无相关性,但在LUSC中亦有极显著的负相关(3.2 × 10-19年).
虽然这代表了评估ACOX2表达对TMB影响的代理,但我们随后使用UCSCXenaShiny中的函数重新评估了TCGA数据集,以确定ACOX2表达是否与TMB相关。60],也可以通过查询cBioPortal [41,42].如图所示。7在LUAD中,TMB与ACOX2表达显著相关,这反映在cBioPortal数据中(图2)。7B)。相比之下,TMB与ACOX2在LUSC中的表达无关(图。7C).然而,必须指出的是,cBioPortal并没有所有患者的TMB数据,所观察到的相关性只反映了一部分患者。TMB可能对LUSC中ACOX2的表达没有任何影响,这一事实可能反映了LUSC中DNA CpG甲基化导致ACOX2表达的缺失(图。5),或者TCGA-LUSC数据集中可用样本数量的限制。
综上所述,这些结果表明TMB可能与ACOX2的表达有关,尤其是在LUAD中。
ACOX2与NSCLC的抗肿瘤药物敏感性
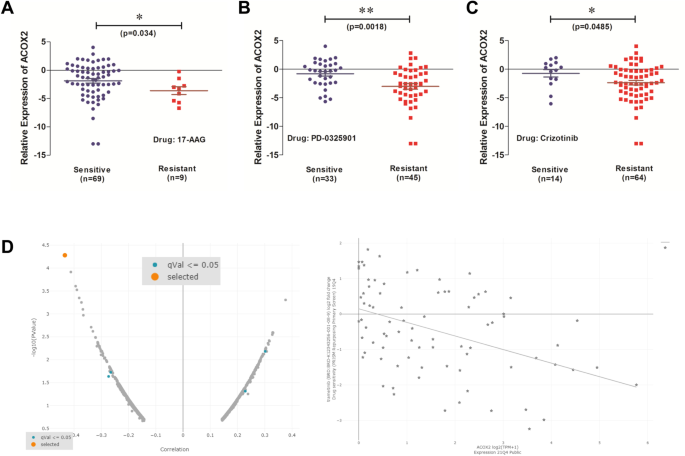
为了研究ACOX2表达与药物敏感性之间的任何关联,我们研究了ACOX2表达对来自CCLE数据库的24种抗癌药物的药理特征的影响[50].使用先前定义的药物敏感与耐药NSCLC的IC50参数[51],我们确定了三种低ACOX2 mRNA表达与对17-AAG (r =−0.2399,p = 0.0344) (HSP90抑制剂)、PD-0325901 (r = -0.3472, p = 0.0018) (MEK抑制剂)和克唑替尼(r =−0.2307,p = 0.0422) (c-MET/ALK抑制剂)耐药性相关的药物,如图所示。6.使用DepMap PRISM重新利用主屏幕的单独分析[52]证实了靶向MEK的潜力,因为它确定了Tramatenib (GSK1120212)是一种MEK1/2抑制剂,FDA批准用于治疗braf突变的晚期NSCLC [61],目前正处于KRAS突变NSCLC的I期试验中[62].
讨论
代谢途径重编程现在被认为是癌症的一个标志[63],是一个不断发展的治疗领域。过氧化物酶体是关键的代谢细胞器[9],在各种癌症中发挥重要作用[9,12].在这篇手稿中,我们发现酰基辅酶a氧化酶家族在NSCLC中显著失调。特别是,我们证明ACOX2在LUAD和LUSC的NSCLC中均显著下调(图。1a - c)。对现有TCGA数据集的重新分析证实,在更大的已建立的NSCLC数据集中,这种表达显著降低(图2)。1D),并进一步表明,在CTPAC数据集中,ACOX2蛋白水平发生了显著改变,用于NSCLC LUAD(图。1E)。然而,虽然ACOX2 mRNA的高表达被发现是总生存的潜在预后生物标志物,相反,ACOX2蛋白的表达未被发现具有任何总体预后价值(图。2).令人惊讶的是,ACOX2 mRNA没有发现与PFS有任何关联(附加文件5:图S4),而所有其他相关基因检测显示与PFS益处相关(附加文件1:表S5)。PFS常被用作临床获益的替代指标,特别是用于临床试验药物的批准[64],但交叉和进展后治疗可能会使替代终点(如PFS和OS)之间的关系产生偏差[65],而PFS与OS经常出现差异[66].然而,当临床试验由生物标志物驱动时,强有力的证据将PFS与缓解率和生存获益联系起来[67,68].
ACOX2基因突变导致的表达缺失已被证明在心脏癌中具有功能性作用[69],并伴有相关的代谢缺陷[70].在此基础上,我们确定了一系列额外的过氧化物酶体基因,这些基因在NSCLC中也发生了改变(附加文件)3.:图S2,附加文件1:表S2)。在这篇手稿的准备过程中,一篇出版物发现其他关键过氧化物酶体基因如acaa1在NSCLC中调控异常[25,59],我们的分析确认/验证了这些论文的观察结果(附加文件1:表S2和表S3)。另外的分析表明,ACOX2(和其他酰基辅酶a氧化酶)表达的改变至少在mRNA水平上对LUAD有重要的预后价值(附加文件)4:图S3)。其他显示预后价值的过氧化物酶体基因也主要与LUAD组织学亚型相关(附加文件)4:图S3;额外的文件1:表S3和S4)。
表观遗传学在癌症中许多基因的失调中发挥作用[71].发生这种情况的最佳机制之一是通过基因启动子区域的DNA CpG甲基化[72].对TCGA数据集中现有甲基化数据的分析表明,改变的甲基化确实发生在ACOX2的启动子上,特别是高甲基化主要发生在LUSC样本中的ACOX2启动子上(图2)。6).鉴于ACOX2在我们的患者LUSC样本中的表达减少(图。1C),并确认在TCGA LUSC数据集中与LUAD相比显著降低(图。1D),这可能表明异常的DNA甲基化在鳞状细胞亚型的ACOX2下调中起着更重要的作用。这反映在特定启动子特异性甲基化探针的DNA甲基化中,这在LUSC样本中主要显著,但在LUAD中不显著(附加文件)1:表S5),例如cg16587010。启动子甲基化的增加可能是LUSC中ACOX2表达缺失的原因,但它似乎不是LUAD中ACOX2表达缺失的因素。因此,多种因素可能在NSCLC中ACOX2的调控异常中发挥作用。在这方面,某些肺癌“驱动”基因如TP53、KRAS和CDKN2A的突变也与LUAD和LUSC中ACOX2表达的改变有关(表2)2),这表明具有这种突变的患者可能改变了过氧化物酶体通路,这可能在肿瘤发生中发挥作用。其他基因也被鉴定,当突变时,与改变的ACOX2表达相关。FAT2和LRRC7等例子在包括肺癌在内的各种癌症中都有已知的作用[73,74,75,76,77,78].
过氧化物酶体途径在癌症中发挥重要作用的一个新兴领域是调节细胞免疫反应[12].事实上,LUAD和LUSC的免疫浸润评分的相似观察最近已被确定,具有预后价值[79,80,81].在这篇文章中,我们将非小细胞肺癌中ACOX2表达失调与免疫细胞浸润肿瘤环境的改变联系起来。在这方面,在LUAD中ACOX2表达与CD8 + T细胞浸润呈负相关(表2)4a)发生,而在LUSC中观察到ACOX2表达与CD8 + T细胞浸润呈正相关(表2)4a).因此,鉴于CD8 +肿瘤浸润淋巴细胞与NSCLC更好的预后相关,这一观察结果可能对检查点抑制剂的患者管理具有潜在意义[82,83].此外,在结肠腺癌中,过氧化物酶体数量和相关酶活性降低,最近已确定一个高危亚人群,在CRC患者中,过氧化物酶体途径评分低与较差的临床结果和高免疫细胞浸润相关[84],并表明过氧化物酶体基因如ACOX2可能以类似的方式用于探索与检查点抑制剂分层或NSCLC预后的预测评分有关的进一步关联。
也有人认为过氧化物酶体在Warburg效应中发挥作用[85],癌细胞利用糖酵解作为主要的能量来源。因此,癌细胞和免疫细胞之间对营养物质的竞争被提议将Warburg效应的功能扩展为细胞-外在优势,在肿瘤微环境中消耗细胞外葡萄糖,从而使肿瘤浸润的T细胞功能失调[59,86].鉴于在本研究和其他研究中发现的大量过氧化物酶体相关基因表达的改变[25,59],以及胆固醇代谢改变可影响CD8(+) T细胞抗肿瘤反应的证明[87],本文提出的数据进一步将过氧化物酶体功能失调与NSCLC中T细胞浸润和活性的影响联系起来。
有人认为,有可能通过诱导过氧化物酶体的“去噬”或自噬细胞降解来靶向过氧化物酶体[12].然而,目前还没有开发出专门针对过氧化物酶体的药物[12].然而,也有可能利用抗脂解剂,或者靶向特定过氧化物酶体蛋白的小分子抑制剂等药物[12].
然而,由于绝大多数NSCLC患者在mRNA和蛋白水平上显示ACOX2降低(图。1),特异性靶向ACOX2治疗NSCLC患者可能是不可能的,也不具有临床意义。然而,基于ACOX2表达,有可能识别出对其他现有靶向治疗有反应的患者子集。在这方面,从我们的分析中,增加了对现有药物的敏感性,如Tanespimycin (HSP90-Fig。8A)和克唑替尼(c-MET/ ALK-Fig .;8C)与较高水平的ACOX2表达相关。此外,MEK被确定为与ACOX2表达相关的候选药物靶点(图。8B,D).MEK抑制剂目前被FDA批准用于BRAF突变的晚期NSCLC [61],并正在研究作为KRAS突变NSCLC的治疗选择[62].因此,将更大的KRAS突变患者队列中的ACOX2水平与数量相似的KRAS野生型NSCLC患者进行比较,以确定是否可能与MEK抑制剂敏感性存在任何功能或生物学联系,这将是非常有趣的。事实上,一组同时携带RASA1和NF-1突变的NSCLC患者已被证明对MEK抑制剂特别敏感[78,88],正如我们的分析发现突变的RASA1导致ACOX2增加(图。4)这进一步支持了过度表达ACOX2的癌症可能也对MEK抑制剂敏感的可能性。尽管ACOX2蛋白在NSCLC中整体下调(图。1F, G),有一部分患者表现出该基因的中高表达。鉴于我们已经在LUAD和LUSC中确定了ACOX2和突变KRAS之间的紧密联系(表2)2),有可能将MEK抑制剂的治疗方案扩大到包括那些ACOX2高表达的患者。因此,有可能根据该基因的表达水平对患者进行分层治疗或使用这些药物进行临床试验,但还需要进一步的研究来完全确定这些可能性。
然而,在通过(PPAR)-α/γ双激活剂(如SN158)表达降低的ACOX2的患者中,也有可能恢复ACOX2的水平,SN158被证明显著上调ACOX2 mRNA [89,尽管这些药物由于严重的副作用还没有进入临床。然而,体外和体内研究均表明,以PPAR为基础的激动剂,如吡格列酮,可能具有治疗NSCLC的潜力[90,91,92],但仍需谨慎,因为对此类激动剂的其他研究表明,当在肿瘤微环境的髓系细胞中被激活时,可能会加重和促进肺癌的进展[2].
总的来说,本研究的结果提出了关于ACOX2在NSCLC患者诊断/预后中的潜在应用的有趣可能性。此外,研究结果表明,ACOX2水平可能有助于将患者分层为可能对检查点抑制剂治疗有反应的亚组。此外,ACOX2的表达也可以潜在地用于对各种药物(包括Tanespimycin、Crizotinib和MEK抑制剂)有反应的患者进行分层。然而,还需要进一步的研究来阐明这些基因分别在LUAD和LUSC发病机制中的确切作用,并进一步描述使用ACOX2表达来分层或联系患者对MEK抑制剂的反应和潜在的具有可操作突变的患者亚群(如BRAF、KRAS、RASA1和NF-1)的潜力。
数据和材料的可用性
支持本研究中提出的发现的数据可在以下在线资源中查询:https://cistrome.shinyapps.io/timer/.TIMER2.0:http://timer.cistrome.org/.GEPIA2.0:http://gepia2.cancer-pku.cn/#index.特性:http://lce.biohpc.swmed.edu/lungcancer/.UALCAN:http://ualcan.path.uab.edu/index.html.Oncolnc:http://oncolnc.org.KM-PLOT:https://kmplot.com/analysis/index.php?p=background.cBioPortal:https://www.cbioportal.org/.TCGA流浪者:http://maplab.imppc.org/wanderer/#。MEXPRESS:https://mexpress.be/index.html.CCLE:https://portals.broadinstitute.org/ccle.MuTarget:https://www.mutarget.com/.DepMap:https://depmap.org/portal/.cProSite:https://cprosite.ccr.cancer.gov/# /。估计:https://bioinformatics.mdanderson.org/estimate/index.html.
参考文献
Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, Bray F. 2020年全球癌症统计:全球185个国家36种癌症的发病率和死亡率。中华癌症杂志。2021;71(3):209-49。
Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. 2018年全球癌症统计:全球185个国家36种癌症的发病率和死亡率。中华癌症杂志,2018;68(6):394-424。
Ackermann CJ, Adderley H, Ortega-Franco A, Khan A, Reck M, Califano R.晚期非小细胞肺癌的一线免疫检查点抑制:最新进展和未来发展方向药。2020;80(17):1783 - 97。
Mustachio LM, Roszik J.目前对抗非小细胞肺癌的靶向治疗。制药(巴塞尔)。2020.https://doi.org/10.3390/ph13110374.
Markham A. Pralsetinib:第一次批准。药。2020;80(17):1865 - 70。
Russo A, Lopes AR, McCusker MG, Garrigues SG, Ricciardi GR, Arensmeyer KE, Scilla KA, Mehra R, Rolfo C.肺癌的新靶点(不包括EGFR, ALK, ROS1)。2020;22(5):48。
Rhodin J(1954)小鼠肾脏正常和实验改变的近曲小管细胞超微结构组织和功能的相关性。博士论文。卡罗林斯卡医学院。Aktiebolaget Godvil(出版社),1-76
伊斯林格M,沃克尔A,法希米HD,施拉德M.过氧化物酶体:谜团2.0的更新。中国生物医学工程杂志,2018;30(5):443-71。
李丽娟,李丽娟。过氧化物酶体辅助因子转运。生物分子》2020。https://doi.org/10.3390/biom10081174.
拉克希米SP,雷迪AT,班诺A,雷迪RC。PPAR激动剂在肺癌防治中的应用。PPAR res 2017;2017:8252796。
Dahabieh MS, Di Pietro E, Jangal M, Goncalves C, Witcher M, Braverman NE, Del Rincón SV。过氧化物酶体与癌症:代谢专家在异常代谢疾病中的作用。生物化学学报,2018;1870(1):103-21。
史文森茹,肖RJ。脂质合成是非小细胞肺癌的代谢障碍。中国生物医学工程学报。2016;81:93-103。
道灵CM,张华,崇海乐TN,王家强。揭示非小细胞肺癌的代谢脆弱性。生物化学学报。2021;1875(1):188462。
马吉姆B,纳达尔E, Muñoz-Pinedo C.挖掘非小细胞肺癌的代谢脆弱性。中国生物医学工程学报(英文版);
吴基光福,Nicholson AG, Harrison CL, Hansbro PM, Adcock IM, Chung KF。线粒体功能障碍是否是COPD与非小细胞肺癌相关的驱动机制?Eur Respir Rev. 2017。https://doi.org/10.1183/16000617.0040-2017.
本正M,田村S,藤木。过氧化物酶体生物发生障碍。进:蜥蜴G,编辑。过氧化物酶体生物学:实验模型,过氧化物酶体疾病和神经系统疾病。湛:施普林格国际出版;2020.45 - 54页。
金俊杰,Miura R.酰基辅酶a脱氢酶和酰基辅酶a氧化酶机制异同的结构基础。中国生物医学工程学报。2004;26(3):489 - 497。
Ferdinandusse S, Denis S, van Roermund CWT, Preece MA, Koster J, Ebberink MS, Waterham HR, Wanders RJA。一个新的ACOX2缺乏症病例导致第三种人过氧化物酶体酰基辅酶A氧化酶的识别。生物化学学报,2018;1864(3):952-8。
Braverman NE, Raymond GV, Rizzo WB, Moser AB, Wilkinson ME, Stone EM, Steinberg SJ, Wangler MF, Rush ET, Hacia JG,等。齐薇格谱系中的过氧化物酶体生物发生障碍:当前诊断、临床表现和治疗指南的概述。中国生物医学工程学报,2016;29(3):326 - 326。
舒根斯RB,海曼斯HS,万德斯RJ,范登博世H,塔格JM。过氧化物酶体疾病:一组新认识的遗传疾病。中华儿科杂志。1986;44(5):430-40。
Bjørklund SS, Kristensen VN, Seiler M, Kumar S, Alnæs GI, Ming Y, Kerrigan J, Naume B, Sachidanandam R, Bhanot G,等。雌激素调节的过氧化物酶体支链脂肪酸氧化酶ACOX2在乳腺癌中的表达。BMC Cancer. 2015;15:524。
Ko HK, Berk M, Chung YM, Willard B, Bareja R, Rubin M, Sboner A, Sharifi N.雄激素失活和异构体特异性HSD17B4剪接形式的缺失使去势抵抗性前列腺癌的出现。Cell Rep. 2018;22(3): 809-19。
Zha S, Ferdinandusse S, Hicks JL, Denis S, Dunn TA, Wanders RJ, Luo J, De Marzo AM, Isaacs WB。前列腺癌中过氧化物酶体支链脂肪酸β -氧化途径上调。前列腺癌。2005;63(4):316 - 23所示。
张欣,杨红,张静,高峰,戴玲。过氧化物酶体通路中的HSD17B4、ACAA1、PXMP4在非小细胞肺癌中下调并具有临床意义。Front Genet, 2020;11:273。
Chansky K, Detterbeck FC, Nicholson AG, Rusch VW, Vallières E, Groome P, Kennedy C, Krasnik M, Peake M, Shemanski L,等。IASLC肺癌分期项目:第八版TNM肺癌分类中TNM分期分组修订的外部验证。中华外科杂志,2017;12(7):1109-21。
Detterbeck FC, Chansky K, Groome P, Bolejack V, Crowley J, Shemanski L, Kennedy C, Krasnik M, Peake M, Rami-Porta R. IASLC肺癌分期项目:在即将发布的(第八版)TNM肺癌分级中,NSCLC分期分级修订建议中使用的方法学和验证。中华胸内科杂志,2016;11(9):1433-46。
Travis WD, Brambilla E, Burke AP, Marx A, Nicholson AG。介绍2015年世界卫生组织肺、胸膜、胸腺和心脏肿瘤分类。中华胸内科杂志,2015;10(9):1240-2。
Travis WD, Brambilla E, Nicholson AG, Yatabe Y, Austin JHM, Beasley MB, Chirieac LR, Dacic S, Duhig E, Flieder DB,等。2015年世界卫生组织肺肿瘤分类:自2004年分类以来遗传、临床和放射学进展的影响。中华胸内科杂志,2015;10(9):1243-60。
贝尔德AM,格雷SG,欧伯恩KJ。IL-20在NSCLC中被表观遗传调控,并下调VEGF的表达。中华癌症杂志,2011;47(12):1908-18。
Cregan S, McDonagh L, Gao Y, Barr MP, O 'Byrne KJ, Finn SP, Cuffe S, Gray SG。KAT5 (Tip60)是恶性胸膜间皮瘤的潜在治疗靶点。中华肿瘤学杂志,2016;48(3):1290-6。
辛格,赫里R,格雷SG。在硅质和体外分析中,lncrna作为恶性胸膜间皮瘤(MPM)从上皮样组织型向肉瘤样组织型转变的潜在调节因子。国际Mol科学,2018。https://doi.org/10.3390/ijms19051297.
Livak KJ, Schmittgen TD。利用实时定量PCR和2(-Delta Delta C(T))方法分析相关基因表达数据。方法。2001;25(4):402 - 8。
蔡林,林松,Girard L,周勇,杨林,慈波,周强,罗东,姚波,唐华,等。LCE:一个探索肺癌基因表达和临床关联的开放门户网站。致癌基因。2019;38(14):2551 - 64。
Szklarczyk D, Gable AL, Lyon D, Junge A, Wyder S, Huerta-Cepas J, Simonovic M, Doncheva NT, Morris JH, Bork P,等。STRING v11:覆盖范围增加的蛋白质-蛋白质关联网络,支持全基因组实验数据集的功能发现。核酸研究,2019;47(D1): D607-13。
香农P, Markiel A, Ozier O, Baliga NS, Wang JT, Ramage D, Amin N, Schwikowski B, Ideker T. Cytoscape:生物分子相互作用网络集成模型的软件环境。基因组学报,2003;13(11):2498-504。
Chandrashekar DS, Bashel B, Balasubramanya SAH, Creighton CJ, Ponce-Rodriguez I, Chakravarthi B, Varambally S. UALCAN:促进肿瘤亚群基因表达和生存分析的门户。瘤。2017;19(8):649 - 58。
Gillette MA, Satpathy S, Cao S, Dhanasekaran SM, Vasaikar SV, Krug K, Petralia F, Li Y,梁ww, Reva B,等。蛋白质基因组学特征揭示肺腺癌的治疗漏洞。Cell. 2020;182(1):200-225 e235。
gyzyrffy B, Surowiak P, Budczies J, Lánczky A.利用转录组数据评估生物标志物在非小细胞肺癌中的预后价值。PLoS ONE。2013; 8 (12): e82241。
Anaya J. OncoLnc:将TCGA生存数据与mrna、mirna和lncrna联系起来。计算机学报。2016;2:e67。
Cerami E, Gao J, Dogrusoz U, Gross BE, Sumer SO, Aksoy BA, Jacobsen A, Byrne CJ, Heuer ML, Larsson E,等。cBio癌症基因组学门户:探索多维癌症基因组学数据的开放平台。癌症杂志,2012;2(5):401-4。
高杰,Aksoy BA, Dogrusoz U, Dresdner G, Gross B, Sumer SO, Sun Y, Jacobsen A, Sinha R, Larsson E,等。使用cBioPortal对复杂癌症基因组学和临床资料进行综合分析。科学通报,2013;6(6):1。
Nagy Á, gyzyrffy B. muTarget:实体瘤中连接基因表达变化和突变状态的平台。国际癌症杂志,2021;48(2):502-11。
李涛,付杰,曾震,科恩D,李娟,陈强,李波,刘小霞。TIMER2.0用于肿瘤浸润免疫细胞分析。Nucleic Acids res 2020;48(W1): W509-14。
Koch A, Jeschke J, Van Criekinge W, Van Engeland M, De Meyer T. MEXPRESS更新2019。核酸研究。2019;47(W1): W561-5。
Díez-Villanueva A,马洛纳I,佩纳多MA。漫游者,探索人类癌症中的DNA甲基化和基因表达数据的交互式查看器。表观遗传学染色质。2015;8:22。
李涛,范俊,王波,Traugh N,陈强,刘建军,李波,刘小生。TIMER:一个用于全面分析肿瘤浸润免疫细胞的网络服务器。癌症研究,2017;77(21):e108-10。
唐志,康斌,李超,陈涛,张哲。GEPIA2:一种用于大规模表情分析和交互分析的增强web服务器。核酸研究,2019;47(W1): W556-60。
吉原K, Shahmoradgoli M, Martínez E, Vegesna R, Kim H, Torres-Garcia W, Treviño V, Shen H, Laird PW, Levine DA,等。从表达数据推断肿瘤纯度、基质和免疫细胞混合物。Nat Commun. 2013;4:2612。
Barretina J, Caponigro G, Stransky N, Venkatesan K, Margolin AA, Kim S, Wilson CJ, Lehár J, Kryukov GV, Sonkin D,等。癌细胞系百科全书能够对抗癌药物敏感性进行预测建模。大自然。2012;483(7391):603 - 7。
项震,宋松,朱震,孙伟,礼品杰,孙松,李启启,于勇,李kk。lncrna GIHCG和SPINT1-AS1是泛癌细胞对拉帕替尼敏感性的关键因素。前热内。2019;10:25。
Corsello SM, Nagari RT, Spangler RD, Rossen J, Kocak M, Bryan JG, Humeidi R, Peck D, Wu X, Tang AA,等。通过系统活力分析发现非肿瘤药物的抗癌潜力。中华癌症杂志,2020;1(2):235-48。
男C,柴红,宋霞,李艳,杜红,任强。DNA甲基化与基因表达的系统综合分析鉴定子宫内膜癌DNA甲基化相关基因特征。妇科杂志,2017;28(6):e83。
Sturm G, Finotello F, Petitprez F, Zhang JD, Baumbach J, Fridman WH, List M, Aneichyk T.基于转录组的细胞类型定量方法在免疫肿瘤学中的综合评价。生物信息学,2019,35 (14):i436-45。
whry EJ, Kurachi M.对T细胞衰竭的分子和细胞见解。中华免疫杂志2015;15(8):486-99。
Goodman AM, Kato S, Bazhenova L, Patel SP, Frampton GM, Miller V, Stephens PJ, Daniels GA, Kurzrock R.肿瘤突变负荷作为不同癌症免疫治疗反应的独立预测因子。中华肿瘤杂志,2017;16(11):2598-608。
孟G,刘旭,马涛,吕东,孙刚。肿瘤突变负担对非小细胞肺癌免疫治疗的预测价值:系统综述和荟萃分析。PLoS ONE。2022年,17 (2):e0263629。
非小细胞肺癌中ACAA1是生存预测因子,与T细胞浸润相关。Front Oncol. 2020;10: 564796。
王松,熊勇,赵玲,顾凯,李勇,赵峰,李俊,王敏,王宏,陶喆,等。UCSCXenaShiny:用于UCSC xena数据交互分析的R/CRAN包。生物信息学。2021;38(2):527 - 9。
Odogwu L, Mathieu L, Blumenthal G, Larkins E, Goldberg KB, Griffin N, Bijwaard K, Lee EY, Philip R, Jiang X,等。FDA批准摘要:Dabrafenib和Trametinib用于治疗携带BRAF V600E突变的转移性非小细胞肺癌。肿瘤学家。2018;23(6):740 - 5。
林士华,林海燕,Verma V, Xu-Welliver M, Thall PF,姚林,Kim PY, Gombos DS, Kawedia JD, Komaki R,等。确定同步放化疗和曲美替尼治疗kras突变非小细胞肺癌的I期试验癌症治疗杂志。2022;30:100514。
Hanahan D, Weinberg RA。癌症的特征:下一代。细胞。2011;144(5):646 - 74。
Hess LM, Brnabic A, Mason O, Lee P, Barker S.肿瘤靶向和生物制剂随机临床试验中无进展生存期和总生存期的关系。中华癌症杂志,2019;10(16):3717-27。
Hashim M, Pfeiffer BM, Bartsch R, Postma M, Heeg B.在不允许交叉或报道平衡进展后治疗的研究中,替代终点是否与总生存期更好地相关?在晚期非小细胞肺癌中的应用。价值健康。2018;21(1):9-17。
Shinawi T, Hill VK, Krex D, Schackert G, Gentle D, Morris MR, Wei W, Cruickshank G, Maher ER, Latif F.长期和短期胶质母细胞瘤幸存者的DNA甲基化谱。表观遗传学。2013;8(2):149 - 56。
范勇,尹军。一致性指数:无进展生存期替代总生存期。conp临床试验。2021;104:106353。
Schwaederle M, Zhao M, Lee JJ, Eggermont AM, Schilsky RL, Mendelsohn J, Lazar V, Kurzrock R.精准医疗对不同癌症的影响:II期临床试验的荟萃分析。中华临床肿瘤学杂志,2015;33(32):3817-25。
Schwaederle M, Zhao M, Lee JJ, Lazar V, Leyland-Jones B, Schilsky RL, Mendelsohn J, Kurzrock R.基于生物标志物的治疗策略与难治性恶性肿瘤的缓解率和无进展生存期的相关性:一项meta分析。中国医学杂志,2016;2(11):1452-9。
周欣,王慧。原发性心脏恶性肿瘤ACOX2缺乏的研究。中国科学(d辑),2017;26(3):344 - 344。
周欣,徐敏,曾伟,陈铮,陆刚,龚颖,Finnell RH,肖华,乔波,王慧。FH (E404D)和ACOX2 (R409H)联合作用导致原发性心脏恶性肿瘤代谢缺陷。细胞死亡发现。2018;4:18。
Portela A, Esteller M.表观遗传修饰与人类疾病。生物技术学报。2010;28(10):1057-68。
Loaeza-Loaeza J, Beltran AS, Hernández-Sotelo D. DNMTs和CpG含量、转录因子、共识基序、lncRNAs和组蛋白标记对DNA甲基化的影响。基因(巴塞尔)。2020.https://doi.org/10.3390/genes11111336.
桑东尼MJ,卡什亚普R,卡莫因L,博格JP。身患癌症的Scribble家族:二十周年纪念。致癌基因。2020;39(47):7019 - 33所示。
胡敏,谭娟,刘震,李玲,张慧,赵丹,李波,高旭,车宁,张涛。青年和老年肺癌患者分子综合比较特征。前沿工程。2021;11:806845。
袁峰,卢磊,邹强。基于机器学习算法的肺癌亚型基因表达谱分析。生物化学学报,2020;1866(8):165822。
Mohammadoo Khorasani M, Karami Tehrani F, Parizadeh SMR, Atri M.可溶性鸟苷酰环化酶GYCY1a3和GUCY1b3基因在乳腺恶性和良性肿瘤中的差异表达。一氧化氮。2019;83:65-71。
夏铮,欧阳东,李强,李强,邹强,易伟,周娥。PTPRZ1的表达、功能、相互作用及预后价值:综述及生物信息学分析。中华癌症杂志,2019;10(7):1663-74。
北岛S,芭比DA。RASA1/ nf1突变型肺癌:冲向临床?临床癌症杂志2018;24(6):1243-5。
杨欣,石勇,李敏,陆涛,奚娟,林志,姜伟,郭伟,詹超,王强。预测肺腺癌患者生存的免疫细胞浸润评分的鉴定与验证。中华医学杂志2019;17(1):217。
张玲,陈娟,程涛,杨红,李红,潘超。肺腺癌(LUAD)和肺鳞状细胞癌(LUSC)关键基因的鉴定及肿瘤免疫微环境的特征。中华癌症杂志,2020;11(17):4965-79。
Theelen W, Krijgsman O, Monkhorst K, Kuilman T, Peters D, Cornelissen S, Ligtenberg MA, Willems SM, Blaauwgeers JLG, van Noesel CJM,等。在鳞状非小细胞肺癌中,34个基因标记的存在是一个有利的预后标志物。中华医学杂志2020;18(1):271。
Khagi Y, Kurzrock R, Patel SP.免疫检查点抑制的下一代预测生物标志物。中国癌症杂志,2017;36(1):179-90。
Schalper KA, Brown J, Carvajal-Hausdorf D, McLaughlin J, Velcheti V, Syrigos KN, Herbst RS, Rimm DL。目的测定非小细胞肺癌中TILs的表达及临床意义。中华泌尿外科杂志2015。https://doi.org/10.1093/jnci/dju435.
尹杰,王辉,洪艳,任安,王辉,刘玲,赵强。基于过氧化物酶体通路和TIM3的结直肠癌高免疫浸润高危亚人群的鉴定。BMC癌症杂志,2022;22(1):44。
斯泰恩泽,舒格ZT,萨尔维诺JM, Dang CV。精准肿瘤学时代的靶向癌症代谢。中国医药科学,2022;21(2):141-62。
曾伟,尹霞,姜艳,金玲,梁伟。PPARα在肿瘤代谢免疫调节中的十字路口。2021年2月。https://doi.org/10.1111/febs.16181.
杨伟,白勇,熊勇,张娟,陈松,郑旭,孟x,李林,王娟,徐超,等。通过调节胆固醇代谢增强CD8(+) T细胞的抗肿瘤反应。大自然。2016;531(7596):651 - 5。
Hayashi T, Desmeules P, Smith RS, Drilon A, Somwar R, Ladanyi M. RASA1和NF1优先共突变,并定义了吸烟相关非小细胞肺癌对MEK抑制敏感的一个独特的遗传亚群。临床癌症杂志2018;24(6):1436-47。
郑勇,曹勇,保德尔S,尹庚,千晟,裴求,金龙,金玉凯,金森。通过PPARα/γ双激活SN158在ob/ob小鼠中的抗糖尿病作用。化学生物互动。2017;268:24-30。
Kiran A, Kumari GK, Krishnamurthy PT.吡格列酮联合塞来昔布治疗非小细胞肺癌的抗癌疗效初步评价。投资新药。2022;40(1):1 - 9。
致KKW,吴WKK,龙HHF。PPARgamma激动剂通过诱导自噬使pten缺乏的耐药肺癌细胞对EGFR酪氨酸激酶抑制剂敏感。欧洲药物学杂志,2018;823:19-26。
Kim TW, Hong DW, Park JW, Hong SH. CB11是一种新型嘌呤基PPARɣ配体,通过调节ATM信号和EMT来克服人类非小细胞肺癌细胞的无线电抵抗。中华肿瘤学杂志,2020;23(12):457 - 457。
Sippel TR, Johnson AM, Li HY, Hanson D, Nguyen TT, Bullock BL, Poczobutt JM, Kwak JW, Kleczko EK, Weiser-Evans MC,等。骨髓细胞中PPARγ的激活通过TGFβ1促进上皮性肺肿瘤的进展。中华肿瘤杂志2019;17(8):1748-58。
确认
本出版物中使用的数据由临床蛋白质组学肿瘤分析联盟(NCI/NIH)生成。
资金
本文中的研究得到了圣詹姆斯医院基金会(N/C: 2657)的支持。
作者信息
作者及隶属关系
贡献
JSYS, PM(1)和SGG设计实验并撰写论文;LR、JSYS、PM(1)、PM(2)和SGG进行了实验。SN、SC、SPF、RR、GJF和VY有助于样本收集、临床和组织病理学支持。PM(2)和PÓB协助进行了一些生物信息学分析。AK和SPF分别进行免疫评分和IHC TMA评分。SPF、JSYS和SGG阅读并批准了最终稿的出版。所有作者都审阅了手稿。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
这项研究是根据《赫尔辛基宣言》进行的,符合国家和国际准则,并得到了作者机构委员会的批准。研究人员从每位患者处获得知情同意,并在SJH/AMNCH医院伦理委员会(Ethics REC)正式批准后进行。: 041018/8804)。
发表同意书
发表同意书不适用。
相互竞争的利益
作者声明没有利益竞争。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1
.分析TCGA-LUAD和-LUSC数据集在mRNA和蛋白质水平上酰基辅酶a过氧化物酶的变化。
附加文件3
:图S2.ACOX2免疫组化。ACOX2蛋白在非小细胞肺癌中的表达。(A)阴性染色(B)阳性染色。图像以40x拍摄。
附加文件4
:图S3.酰基辅酶a氧化酶和其他过氧化物酶体基因在非小细胞肺癌中的预后价值。使用KM-Plotter评估ACOX2、其他酰基辅酶a氧化酶和其他关键过氧化物酶体相关基因对总生存期(OS)的预后影响[38].对LUAD基因芯片数据集进行分析。(A) ACOX1、(B) ACOX2、(C) ACOX3、(D) ACOXL、(E) AGPS和(F) CAT mRNA的高表达与LUAD患者较好的OS相关,p<0.05为显著性差异。
附加文件5
:图S4.无进展生存期评估非小细胞肺癌酰基辅酶a氧化酶mRNA表达的预后价值。无进展生存期(PFS)定义为第一进展期(FP), KM-Plot用于分析整个NSCLC的ACOX1-3。结果如下:(A) ACOX1 -所有组织学;(b) acox1 - luad;(c) acox1 - lusc;(D) ACOX2 -所有组织学;(e) acox2 - luad;(f) acox2 - lusc;(G) ACOX3 -所有组织学; (H) ACOX3 – LUAD; (I) ACOX3 – LUSC.
附加文件6
:图S5.ACOX2在多个NSCLC数据集中表达的meta分析对LCE进行荟萃分析[33]用于大量基因表达数据集,生成森林图,总结(a)肿瘤与正常元分析的肿瘤-正常标准化平均差,(B)所有NSCLC数据集的OS元分析的风险比。
附加文件7
:图S6.ACOX2在多个NSCLC数据集中表达的meta分析对LCE[32]进行元分析,生成森林图,总结(A) LUAD和(B) LUSC特定数据集中OS的风险比。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
Sui, J.S.Y, Martin, P., Keogh, A.。et al。ACOX2在非小细胞肺癌中的表达改变。BMC Pulm医学22, 321(2022)。https://doi.org/10.1186/s12890-022-02115-7
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12890-022-02115-7
关键字
- 过氧物酶体
- ACOX2
- 酰coa氧化酶
- 非小细胞肺癌
- 总生存期