摘要
背景
Dupilumab是一种抗il -4α受体抗体,是一种治疗严重或难治性哮喘的新方法。然而,关于dupilumab对轻至中度支气管哮喘患者疗效的实际证据缺乏。
方法
我们回顾性评估了在日本一个中心接受dupilumab治疗嗜酸性鼻窦炎合并哮喘的62例患者的dupilumab的效果。2型炎症标志物、ACT、呼吸功能试验和强迫振荡技术(FOT)在dupilumab给药前、给药后3个月和给药后1年进行分析,主要针对轻度至中度哮喘患者。
结果
dupilumab治疗3个月后,FEV1、%FEV1、%FVC、哮喘治疗步骤和ACT显著改善。FeNO明显降低,而IgE和嗜酸性粒细胞计数无明显变化。治疗前后呼吸阻力(Rrs)和呼吸阻抗(Xrs)与FEV1显著相关。在dupilumab治疗前,%FEV1的改善与较高的FeNO和较高的血清IgE相关。
结论
Dupilumab治疗鼻窦炎可改善呼吸功能,哮喘症状,减少哮喘治疗,即使相关支气管哮喘并不严重。
介绍
在过去的几年里,难治性哮喘的治疗取得了巨大的进展,特别是随着针对分子效应和与2型气道炎症相关的信号传导的生物疗法的发展[1,2,3.,4,5]。Dupilumab是一种完全人源化的IgG4单克隆抗体,可结合IL-4受体α链(IL-4Rα)并阻断IL-4和IL-13信号传导。Dupilumab在多种与2型炎症相关的疾病中显示出疗效,包括哮喘、特应性皮炎和慢性鼻窦炎伴鼻息肉(CRSwNP) [6]。几项大型临床试验表明,dupilumab可减少哮喘加重,提高阻塞性肺损伤和哮喘控制测试的评分,并减少口服皮质类固醇(OCS)的使用,而不考虑严重哮喘患者的外周血嗜酸性粒细胞计数[7,8,9]。
上气道,如鼻腔和鼻窦,下气道,如支气管和肺,在解剖学上是相连的,被认为是“联合气道”[10]。上、下气道易受炎症介质通过血液、经支气管和神经调节通讯的功能相互作用的影响[11,12,13]。因此,这两条气道很可能同时发生炎症。据报道,40%至60%的嗜酸性鼻窦炎及鼻息肉患者合并哮喘[14,15]。Tanaka等人的研究表明,13 - 20%嗜酸性鼻窦炎患者在没有哮喘诊断的情况下,呼吸功能检查显示低FEV1/FVC(< 70%),这表明asthma在CRS患者中可能被误诊。在us -24和us -52试验中[16],虽然哮喘的诊断是通过自我报告确定的,并排除了严重气流阻塞的患者,但哮喘并发症发生率为60%,进一步支持了实际哮喘并发症发生率可能要高得多的观点[15]。最近的报道显示鼻息肉和鼻窦炎的治疗可以改善哮喘症状。Ahmed等人已经证明,CRS患者往往有较少明显的下气道疾病,内窥镜鼻窦手术(ESS)有效地改善了这种疾病[17]。在来自us -24和us -52试验的CRSwNP合并哮喘患者中,dupilumab改善了一秒用力呼气量(FEV1)和哮喘控制问卷(ACQ-6)评估的患者报告的哮喘症状[16]。该研究纳入了所有患者,无论哮喘严重程度如何。由于dupilumab仅被批准用于严重或控制不佳的哮喘,因此之前没有报告专门分析dupilumab对轻度至中度哮喘患者的疗效,特别是在现实生活中。
强迫振荡技术(FOT)是近年来用于呼吸功能测试的一种非侵入性、不需要费力的方法,由于它可以在潮汐呼吸期间进行,因此预期对儿童和老年人尤其有益[18,19]。然而,它尚未被广泛使用,其在哮喘治疗中的有效性尚未得到充分证实。此外,以前没有报道使用FOT来监测dupilumab对哮喘患者的治疗效果。
本研究旨在从2型炎症标志物、ACT、呼吸功能测试和强迫振荡技术(FOT)的变化方面,回顾性评估dupilumab治疗CRSwNP患者共病轻中度哮喘的实际影响。
方法
研究设计
本研究是一项在单中心(品川松崎诊所耳鼻咽喉呼吸内科)进行的回顾性观察性研究。回顾性分析了2020年5月至2021年7月62例连续接受dupilumab治疗嗜酸性鼻窦炎合并鼻息肉合并哮喘的成人患者。所有哮喘患者均由呼吸内科医生根据日本指南进行诊断[20.]或全球哮喘倡议(GINA)指南[21]。所有患者每两周接受300 mg Dupilumab皮下注射。哮喘治疗步骤和严重程度评估基于2021年更新的全球哮喘倡议(GINA)战略[22]。在给药前、用药后3个月和1年分别评估血嗜酸性粒细胞计数、IgE、呼吸功能、呼吸阻抗和ACT(哮喘控制试验)。采用视觉模拟量表(VAS)主观上量化CRSwNP症状的严重程度。CRS的CT表现采用Lund-Mackay系统进行分期[23]。鼻息肉评分(NPS)定义为鼻内窥镜评估的左右鼻孔评分(0-8范围)的总和(评分降低表明改善)。本研究经智庆大学伦理委员会批准[33,34,35]。我们在Matsuwaki诊所网站上以选择退出的形式获得了知情同意,本研究按照赫尔辛基宣言进行。
测定NO、肺功能和FOT
呼气分数一氧化氮浓度(FeNO)采用电化学传感器NO分析仪(NO Breath, Bedfont科学有限公司,英国),流速为50 mL/s,按照美国胸科学会/欧洲呼吸学会的推荐,使用肺活量计(HI-801, CHEST,日本东京),评估1秒内的用力呼气量(FEV1)、FEV1/FVC和FEV1/用力肺活量(FVC)比。使用MostGraph-02 (Chest MI Co., Ltd, Japan)宽带FOT测量呼吸阻抗。在潮汐呼吸过程中,将扬声器产生的脉冲振荡信号通过吹口作用于气道约30 s。
在本研究中,我们测量并分析了5 Hz (R5)和20 Hz (R20)时的呼吸阻力(Rrs),以及5 Hz (X5)时的电抗(Xrs)和谐振频率(Fres)。
统计分析
使用Prism 8 (GraphPad Software Inc., La Jolla, CA, USA)分析数据。以p < 0.05为具有统计学意义的阈值。All的值表示为平均值±标准差(SD)。使用配对t检验分析dupilumab开始前和开始后三个月的个体变量数据。采用非配对t检验和卡方检验分析与患者特征相关的因素。采用Pearson相关系数考察FEV1与FOT值之间的相关性。
结果
临床特点
在观察期内,62例患者在dupilumab治疗3个月后接受了呼吸、耳鼻喉和血液检查,23例患者在治疗1年后接受了检查。在观察期间,所有接受dupilumab治疗的患者均有哮喘病史或正在接受哮喘治疗。
所有患者在过去3个月内均未发生哮喘发作,目前哮喘治疗控制良好(ACT平均评分22-23分)或无治疗。在接受dupilumab治疗的62例患者中,58例(93.5%)将其作为哮喘的首次抗体治疗,其余4例(6.5%)在接受dupilumab治疗前立即接受抗体治疗(omalizumab = 1, mepolizumab = 2, benralizumab = 1)。在这项研究中,大多数患者接受约5毫克的口服皮质类固醇(强的松)治疗控制不佳的鼻窦炎。所有患者血清IgE和FeNO均轻度高于正常水平,但重度和轻中度哮喘患者之间无显著差异。无论严重程度如何,平均血清嗜酸性粒细胞计数均在正常范围内。虽然肺活量测定指标、呼吸阻力和抗抗在FOT中均有轻度升高,但这些指标在轻、中、重度患者间无显著差异,说明本研究在开始使用dupilumab前哮喘治疗得到了很好的控制。轻中度哮喘患者50例,占全部患者的80%,dupilumab对重症患者的疗效已经确立(ref)。因此,我们进行了一系列的评估,主要集中在轻至中度病例(表2)1)。
轻中度哮喘患者的临床参数评价
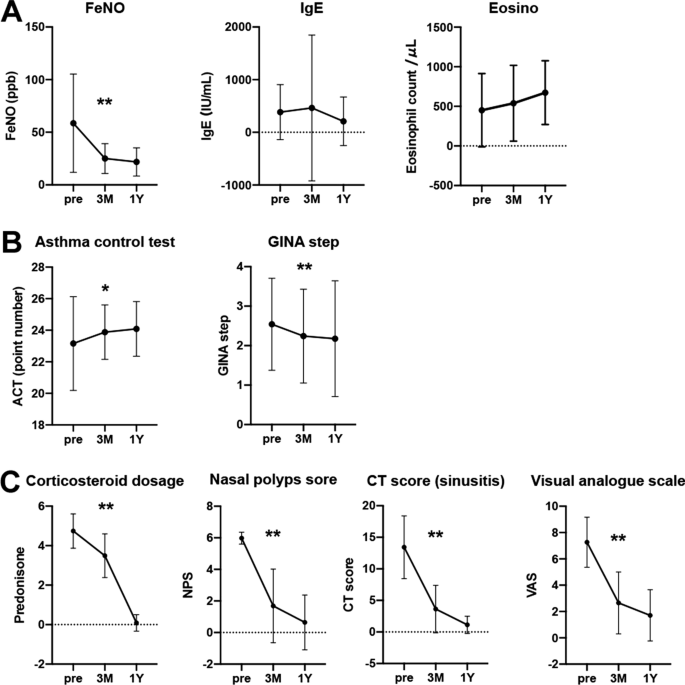
数字1A表示轻中度哮喘患者2型炎症标志物的变化。FeNO在dupilumab治疗后3个月显著下降,并在1年后维持。IgE在3个月时没有变化,但在1年后呈下降趋势(图2)。1A)。一年后,外周血嗜酸性粒细胞计数略有升高,但无明显意义(图2)。1一个)。
在轻中度哮喘中,治疗前ACT评分一般较好(平均评分:22.9)。尽管如此,三个月的dupilumab治疗显著提高了ACT评分,并在一年后保持不变。此外,基于GINA策略的哮喘治疗步骤在3个月和1年后也显著降低(图2)。1B)。在crswnp相关评估方面,dupilumab在三个月时显著改善了鼻息肉评分、CT评分和气味评分(VAS),一年后进一步改善(图2)。1此外,CRSwNP的类固醇治疗在3个月时显著减少,大多数患者在dupilumab治疗一年后成功退出(图3)。1C)。
轻至中度哮喘患者呼吸功能和阻抗的评估
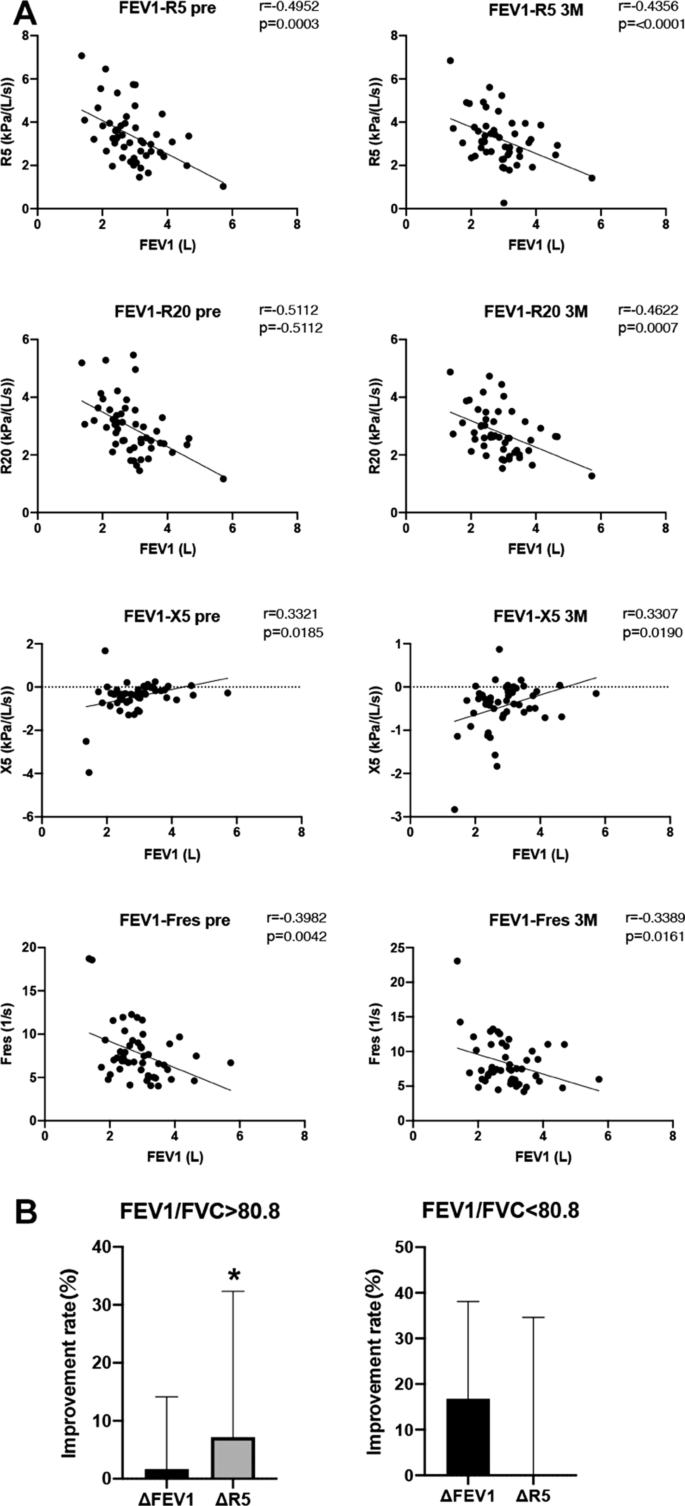
呼吸功能方面,采用肺活量测定法测定1 s用力呼气量(FEV1)、1 s用力呼气量预测百分比(%FEV1)、用力肺活量预测百分比(%FVC)、FEV1/FVC比值(FEV1%)。dupilumab治疗前FEV1、%FEV1和%FVC值在3个月时显著改善,且改善维持1年,而FEV1%无明显变化(图1)。2一个)。
呼吸阻抗测量R5和R20为呼吸阻力(Rrs), X5和Fres为呼吸电抗(Xrs)。呼吸阻力(R5, R20)有改善的趋势,但在3个月时变化并非没有意义(图2)。2B)。此外,所有呼吸阻抗指标(R5、R20、X5、Fres)在1年后均有进一步改善,提示1年的杜匹单抗治疗可能通过积累更多患者而显著改善这些指标(图2)。2B)。
呼吸功能试验(FEV1)与呼吸阻抗试验的相关性分析
为了检验ft在监测dupilumab疗效方面是否与肺活量测定法一样实用,我们评估了dupilumab治疗前和治疗后3个月FEV1与呼吸阻抗指数(R5、R20、X5和Fres)之间的相关性。FEV1和呼吸阻抗在dupilumab治疗轻中度哮喘前和治疗后3个月显著相关,表明FEV1在阻塞性疾病方面与肺活量测定具有相似的趋势(图3)。3.A)。然而,当我们关注个别病例时,我们发现一定数量的病例在肺活量测定法和FOT治疗三个月后的改善率存在差异。Kanda等人报道,FOT可用于检测呼吸系统的病理生理变化,即使在FEV1/FVC正常的哮喘患者中也是如此[24]。因此,我们比较了FEV1/FVC高于和低于平均值(80.8%)的患者在dupilumab治疗3个月后FEV1和R5的改善率。在FEV1/FVC高于平均水平的患者中,R5的改善率明显大于FEV1。相反,在FEV1/FVC高于平均水平的患者中,FEV1的改善率往往大于R5。
根据疾病严重程度比较dupilumab治疗的疗效。
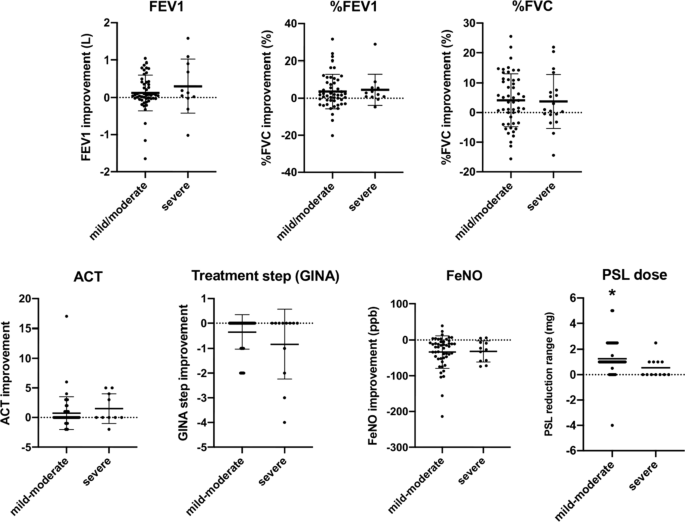
在本研究中,大多数患者为轻中度哮喘,dupilumab的疗效主要建立在重度哮喘。虽然所有的参与者,包括那些有严重症状的患者,在dupilumab治疗后都得到了临床控制,但我们比较了轻度至中度和重度哮喘患者在dupilumab治疗三个月后呼吸功能、ACT、治疗步骤和FeNO的改善。肺活量测定指标(FEV1、%FEV1、%FVC)两组均有改善趋势,差异无统计学意义(图2)。4)。在ACT评分、治疗步骤、FeNO、轻中度哮喘方面,轻中度哮喘与重度哮喘无显著差异(图2)。4)。总体而言,在临床对照病例中,轻中度和重度哮喘患者对dupilumab治疗3个月的反应相似。三个月的dupilumab治疗减少了大多数难治性鼻窦炎患者口服皮质类固醇(强的松:PSL)的剂量,有趣的是,轻度至中度哮喘患者的减少幅度明显大于严重哮喘患者。
呼吸功能改善预测因素的研究
为了确定dupilumab对轻度至中度哮喘患者呼吸功能改善的患者特征,我们比较了%FEV改善低于3.8 L组和%FEV改善高于3.8 L组与哮喘和CRSwNP相关的9个因素。本研究将参考值设为3.8 L,这是所有患者在dupilumab治疗3个月后%FEV1改善的平均值。在这9个因素中,两组患者剂量前FeNO和血清IgE差异显著,提示FeNO和IgE值越高,dupilumab治疗后呼吸功能改善程度越高(表1)2)。此外,在开始dupilumab之前更高的治疗步骤有助于%FEV1的改善。两组患者CRS严重程度(CT评分、VAS评分、鼻息肉嗜酸性细胞计数)差异无统计学意义。
讨论
Dupilumab被批准用于不受控制的CRSwNP、严重或不受控制的支气管哮喘和特应性皮炎,在抗2型炎症的抗体产品中具有最广泛的用途。虽然在CRS治疗过程中可能会发生无意给药dupilumab以控制哮喘的情况,但在耳鼻喉科的临床实践中很少监测哮喘控制的呼吸功能试验。LIBERTY ASTHMA QUEST试验是一项3期试验,显示dupilumab可显著改善支气管哮喘患者的呼吸功能,包括中度和重度哮喘患者[8,25]。类似地,在严重CRSwNP患者中使用dupilumab的双盲、随机、对照试验SINUS发现,在全球哮喘倡议(GINA)指南中,65.9%的患者在治疗第3步或第4步时患有中度哮喘[16]。然而,迄今为止,dupilumab的治疗效果尚未得到评估,主要针对轻度至中度哮喘,包括治疗步骤1和2中的哮喘。同样,也没有研究dupilumab在控制良好的哮喘中的疗效的报告。
本研究显示,dupilumab在给药3个月后显著改善CRSwNP相关临床控制的轻度至中度哮喘患者的呼吸功能(FEV1, %FEV1, %FVC)。此外,开始使用dupilumab后,哮喘治疗步骤显著减少(图2)。1B)。患者的主观症状(ACT)在开始dupilumab之前相当好,但在治疗三个月后显示进一步改善(图2)。1B)。考虑到crswnp相关指标的显著改善(图2)。1C),改善上呼吸道通气有助于改善呼吸道症状是合理的。事实上,有大量证据表明,手术治疗上呼吸道可降低FeNO和血清嗜酸性粒细胞计数,改善共病哮喘患者的呼吸功能和呼吸症状[17,26,27]。作为潜在的机制,CRSwNP的治疗通过抑制上呼吸道和全身的2型炎症来影响哮喘控制。此外,在QUEST研究中,合并CRS的患者比未合并CRS的亚组在哮喘控制方面有更显著的改善[28]。因此,本研究中CRSwNP控制较差的患者,即使合并症哮喘为轻至中度且临床控制,也可能是dupilumab治疗哮喘的易感人群。
LIBERTY ASTHMA QUEST试验的一项事后分析显示,在过敏性和非过敏性哮喘患者中均观察到dupilumab的有益作用(严重加重率,改善FEV1和哮喘控制,抑制2型炎症生物标志物)[25]。然而,在dupilumab治疗前,2型生物标志物(血嗜酸性粒细胞或FeNO)升高的患者的治疗效果更为显著。此外,有几篇论文报道,Th2炎症标志物(如FeNO、eotaxin-3、periostin、胸腺、活化调节趋化因子(TARC))和总IgE水平的降低可以作为监测dupilumab治疗反应的参数[7,8,9]。在本研究中,三个月的dupilumab治疗降低了FeNO,是Th2标志物中最多的,FeNO也改善了本研究中%FEV1(表1)2)。这些结果表明,FeNO可能是一个重要的2型炎症标志物,它可能反映了CRSwNP相关哮喘对dupilumab治疗的易感性。
强迫振荡技术(FOT)是一种呼吸功能测试,通过在静息通气时施加空气通过口的压力振荡来测量呼吸系统阻抗(Zrs)。5 Hz阻力(R5)反映气道总阻力,20 Hz阻力(R20)反映中央气道阻力。呼吸阻抗(Xrs)被认为是肺顺应性指数,但可以解释为周围气道的动态阻塞指数,反映了空气捕获的增加[29]。过去只发表过几篇关于使用FOT监测哮喘生物药物治疗效果的论文。Antonicelli等人报道,18例嗜酸性哮喘患者的FOT参数在mepolizumab治疗的第3个月有统计学意义的变化[30.]。我们首次使用FOT联合肺活量测定法监测dupilumab的效果,并评估两种方法之间的相关性。R5、R20、X5和Fres与dupilumab给药前和给药后3个月的FEV1显著相关,表明这两种方式都可用于监测疗效(图2)。3.)。但从第3个月开始,FOT各项指标均有改善趋势,但无统计学意义(图2)。2B). Higaki等人认为,在轻中度哮喘患者中,长期哮喘病程与支气管扩张剂降低气道阻力可逆性(R20)有关[31]。因此,我们需要结合肺活量测定法来评估肺活量,因为我们可能低估了长期哮喘患者肺活量的价值。FOT被认为是检测哮喘周围气道阻塞的敏感指标[32,33]。Hsiao等人报道,呼吸系统症状正常的哮喘患者可能有较小的气道功能障碍(SAD),而IOS(尤其是电抗)比肺活量测定法更敏感地识别SAD [34]。此外,在本研究中,FEV1/FVC良好的患者经dupilumab治疗3个月后R5的改善率明显高于FEV1。相反,FEV1/FVC较低的患者FEV1的改善率往往高于R5。综上所述,由于肺活量测定法和肺活量测定法的检测灵敏度因哮喘病程和呼吸功能的不同而存在差异,因此需要将肺活量测定法和肺活量测定法结合起来进行治疗评估。
这项研究有几个局限性。由于是回顾性观察性研究,本研究不能与安慰剂对照进行比较。此外,虽然本研究主要评估了50例患者在三个月内的治疗效果,但仍有23例患者在一年后进行了评估测试。TRAVERSE研究对已完成dupilumab临床试验的哮喘患者进行了较长时间的随访,结果显示,即使将dupilumab治疗时间延长至148周,dupilumab对严重哮喘患者的安全性和有效性仍然保持[35]。在目前的研究中,涉及与CSRwP相关的轻中度哮喘,有必要在更长的时间内跟踪呼吸功能和症状的结果。
这项研究的独特之处在于它检查了控制良好的哮喘患者对治疗的反应,不像以前的研究检查了dupilumab治疗对严重哮喘患者的影响。这项研究的独特之处在于,所有患者都有鼻窦炎,在鼻窦炎手术后控制不佳,这在通常的呼吸医学实践中是不可能的。综上所述,dupilumab治疗不仅对CRSwNP有显著作用,而且即使合并症哮喘不严重且临床得到控制,也可能改善呼吸功能和症状,减少哮喘治疗剂量。
数据和材料的可用性
由于保密问题和为了保证数据解释的准确性,当前研究中生成和/或分析的数据集不会公开,但如果通讯作者提出合理要求,可以向其提供。
参考文献
Numata T, miagawa H, Nishioka S, Okuda K, Utsumi H, Hashimoto M,等。benralizumab对严重嗜酸性粒细胞哮喘患者的疗效:一项回顾性、现实研究中华医学杂志,2020;20(1)。
Numata T, Araya J, Miyagawa H, Okuda K, Fujita Y, Utsumi H,等。日本重度哮喘患者改用生物制剂的有效性:一项单中心回顾性研究[J] .中华哮喘与变态反应杂志,2013;14:6 9 - 18。
张晓明,张晓明,张晓明,等。生物制剂治疗哮喘的临床疗效及免疫调节作用。中国生物医学工程学报,2011;39(4):389 - 396。https://doi.org/10.1016/j.resinv.2021.03.003.
王晓明,王晓明,王晓明。细胞自噬与细胞死亡的关系。《细胞生物学》,2018。https://doi.org/10.1016/j.tcb.2018.12.007.
Dragonieri S, Carpagnano GE。重度哮喘的生物治疗。哮喘防治杂志,2021;7(1)。
彼得斯MC,温泽尔SE。生物学和治疗学的交叉:成人哮喘的2型靶向治疗。柳叶刀》。2020;395(10221):371 - 83。https://doi.org/10.1016/s0140 - 6736 (19) 33005 - 3.
Wenzel S, Castro M, Corren J, Maspero J,王磊,张斌等。Dupilumab在成人不受控制的持续性哮喘患者中的疗效和安全性,尽管使用中至高剂量吸入皮质类固醇加长效β2激动剂:一项随机双盲安慰剂对照关键2b期剂量范围试验柳叶刀》。2016;388(10039):31-44。https://doi.org/10.1016/s0140 - 6736 (16) 30307 - 5.
Castro M, Corren J, Pavord ID, Maspero J, Wenzel S, Rabe KF,等。Dupilumab在中重度未控制哮喘中的疗效和安全性。中华医学杂志,2018;37(6):1286 - 1296。
Rabe KF, Nair P, Brusselle G, Maspero JF, Castro M, Sher L,等。dupilumab治疗糖皮质激素依赖性严重哮喘的疗效和安全性。中华医学杂志,2018;37(6):1245 - 1245。
王晓明,王晓明,王晓明,王晓明,等。联合气道疾病中上、下气道相互作用的研究进展。医学科学,2019;7(2):27。
李建军,李建军,李建军,等。选择性鼻腔过敏原激发诱导p物质介导的支气管高反应性。[J] .中华呼吸科学杂志,2011;44(4):517 - 523。
brunstahl GJ, Overbeek SE, KleinJan A, Prins JB, Hoogsteden HC, Fokkens WJ。鼻变应原激发诱导上、下气道黏附分子表达和组织嗜酸性粒细胞增多。变态反应症临床杂志,2001;10(3):469 - 476。
Higashi N, Taniguchi M, Mita H, Kawagishi Y, Ishii T, Higashi A,等。哮喘患者尿白三烯E4排泄量增高(白三烯高尿症)的临床特征:慢性增生性鼻窦炎伴鼻息肉病。[J] .中华过敏症杂志,2004;13(2):779 - 783。
John Staniorski C, Price CPE, Weibman AR, Welch KC, Conley DB, Shintani-Smith S,等。慢性鼻窦炎人群哮喘发作模式和患者结局。国际变态反应杂志,2018;8(4):495-503。
leidlaw TM, Bachert C, Amin N, Desrosiers M, Hellings PW, Mullol J,等。Dupilumab改善慢性鼻窦炎伴鼻息肉和哮喘患者的上、下气道疾病控制。[j] .中华口腔医学杂志,2013;31(5):584 - 592。https://doi.org/10.1016/j.anai.2021.01.012.
韩建军,韩建军,李世生,等。dupilumab在重度慢性鼻窦炎合并鼻息肉患者中的疗效和安全性(LIBERTY NP - SINUS-24和LIBERTY NP - SINUS-52):来自两项多中心、随机、双盲、安慰剂对照、平行组的3期试验的结果。柳叶刀》。2019;394(10209):1638 - 50。https://doi.org/10.1016/s0140 - 6736 (19) 31881 - 1.
Youssef AM, Abdel-Naby Awad OG, Taha M.慢性鼻窦炎患者肺功能及内镜鼻窦手术的影响。http://oto-open.org
引用本文:Cavalcanti JV, Lopes AJ, Jansen JM, Melo PL.强迫振荡技术检测哮喘气道阻塞程度增加引起的呼吸力学变化。中华呼吸医学杂志,2006;31(2):397 - 397。
王晓明,王晓明,王晓明,等。压力和流量对压力振荡技术精度的影响。生物医学工程,2011;10:2-5。
Ichinose M, Sugiura H, Nagase H, Yamaguchi M, Inoue H, Sagara H等。日本成人哮喘指南2017。中华医学杂志,2017;36(2):163-89。
全球哮喘倡议:哮喘管理和预防,2019年。2019; 49(5)。
吉娜。全球哮喘管理和预防战略(2021年更新)。2021;
隆德VJMI。鼻窦炎分期。鼻科学,1993,31(4):183 - 4。
李建军,李建军,李建军,李建军。呼吸阻抗对慢性阻塞性肺病患者呼吸阻抗的影响。实习医学,2010;49(1):23-30。
Corren J, Castro M, O 'Riordan T, Hanania NA, Pavord ID, quice S,等。Dupilumab在未控制的中重度过敏性哮喘患者中的疗效。变态反应临床与免疫杂志,2020;8(2):516-26。https://doi.org/10.1016/j.jaip.2019.08.050.
Hamada K, Oishi K, Chikumoto A, Murakawa K, Ohteru Y, Matsuda K,等。鼻窦手术对哮喘患者2型气道及全身炎症的影响。中华哮喘病杂志,2011;31(6):755 - 758。https://doi.org/10.1080/02770903.2020.1729380.
Soler ZM, Jones R, Le P, Rudmik L, Mattos JL, Nguyen SA,等。鼻窦手术后的22个结果:一项系统回顾和荟萃分析。喉镜。2018;128(3):581 - 92。
Maspero JF, Katelaris CH, Busse WW, Castro M, Corren J, Chipps BE,等。Dupilumab在自我报告慢性鼻窦炎的未控制的中度至重度哮喘中的疗效。变态反应临床与免疫杂志,2020;8(2):527-39。https://doi.org/10.1016/j.jaip.2019.07.016.
Kelly VJ, Sands SA, Harris RS, Venegas JG, Brown NJ, Stuart-Andrews CR,等。呼吸系统电抗是哮喘控制的独立决定因素。中国生物医学工程学报,2013;31(9):1390 - 1390。
Antonicelli L, Tontini C, Marchionni A, Lucchetti B, Garritani MS, Bilò MB.强迫振荡技术记录和监测mepolizumab治疗严重嗜酸性粒细胞哮喘的疗效。变态反应症临床与临床[J] .中华变态反应杂志,2015;32(2):336 - 336。
东垣N, Iwamoto H,山口K,坂本S,堀正Y,增田T,等。哮喘患者强制振荡支气管扩张剂反应与气道炎症和病程的相关性。中华呼吸外科杂志,2011;15(1):48-55。
Crisafulli E, Pisi R, Aiello M, Vigna M, Tzani P, Torres A,等。不同GOLD分期COPD患者小气道功能障碍的患病率及其在疾病影响中的作用呼吸。2016;93(1):32-41。
李建军,李建军,李建军,李建军。成人哮喘小气道疾病的患病率:系统文献综述。中华呼吸医学杂志,2016;16(1):19 - 27。https://doi.org/10.1016/j.rmed.2016.05.006.
萧耀华,苏克成,李耀成,高宏,彭大伟。有症状的肺功能保留患者小气道功能障碍的脉冲振荡测量。变态反应临床与免疫杂志,2020;8(1):229- 235.3。
Wechsler ME, Ford LB, Maspero JF, Pavord ID, Papi A, Bourdin A,等。dupilumab在中重度哮喘患者中的长期安全性和有效性(TRAVERSE):一项开放标签扩展研究柳叶刀呼吸医学杂志2021;https://www.sciencedirect.com/science/article/pii/S2213260021003222
致谢
我们要感谢Mizobe Ayaka, Shoko Suzuki和Asami Abe对数据组织的帮助。
资金
这项研究没有从公共、商业或非营利部门的资助机构获得任何具体的资助。
作者信息
作者及单位
贡献
S.M计划,分析数据,撰写稿件。N.W, S,F, J.W和Y.M对哮喘和鼻窦炎的治疗做出了贡献,并帮助登记了临床资料。A.J, h.h., T.N和K.K修改了稿件并参与了数据分析。所有作者都阅读并批准了最终的手稿。
相应的作者
额外的信息
出版商的注意
伟德体育在线施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
Minagawa, S., Araya, J.,渡边,N.;et al。dupilumab在轻度至中度支气管哮喘合并CRSwNP患者中的实际疗效BMC内科22, 258(2022)。https://doi.org/10.1186/s12890-022-02046-3
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12890-022-02046-3
关键字
- 支气管哮喘
- 慢性鼻窦炎
- Dupilumab
- 强制振荡技术
- 鼻息肉