摘要
背景
杨树davidiana×p . bollena杨树是产于中国东北的一种杨树,具有抗寒性和生长快的特点,但现在受到病原菌的感染。叶枯萎病引起的主产杨树病害已成为一种常见的造成严重经济影响的病害,但其分子机理如何答:alternata在p . davidiana×p . bollena仍不清楚。
结果
在本研究中,转录组反应p . davidiana×p . bollena来答:alternata通过RNA-Seq检测感染。从四个时间点(接种后0、2、3和4 d)的三个生物重复中分离出的RNA中生成了12个cDNA文库,共检测到5930个差异表达基因(DEGs)(|日志)2|≥1,FDR值< 0.05)。功能分析表明,DEGs主要富集于“植物激素信号转导”途径,其次是“苯丙类生物合成”途径。此外,还发现了编码防御相关蛋白和与ROS代谢相关的DEGs。许多转录因子,如bHLH, WRKY和MYB家族,也被诱导答:alternata感染。在这些DEGs中,与JA生物合成和JA信号转导相关的DEGs被持续激活。因此,脂氧合酶基因PdbLOX2,参与JA生物合成,被选为功能表征。过度的PdbLOX2增强了抗p . davidiana×p . bollena来a . alternata而沉默这个基因增强了对答:alternata感染。
结论
这些结果为研究杨树抗病性的分子机制提供了新的思路答:alternata利用基因工程技术为育种抗病品种提供候选基因。
背景
为了抵御病原体,植物发育了一套复杂的防御系统,根据被识别的病原体分子,通常分为模式触发免疫(PTI)和效应者触发免疫(ETI) [1].通常,PTI可被病原体相关分子模式(PAMPs)激活,导致活性氧(ROS)的积累,丝裂原激活蛋白激酶(MAPK)级联和Ca2 +信号、免疫相关基因的转录以及次生代谢物的积累[2,3.,4].在这些次生代谢产物中,如酚类、生物碱、倍半萜、氧脂素、皂苷、多胺和异黄酮类化合物,有助于通过预先形成的或诱导的物理屏障或化学屏障抵抗病原体感染[5,6,7].此外,其他信号分子,包括水杨酸(SA)、茉莉酸(JA)和乙烯(ET)也在PTI中被激活,这些植物激素作为信号触发和介导了一系列不同的防御反应,而其他激素,如生长素、赤霉素酸、油菜素内酯和脱落酸,也通过进入免疫信号回路的SA-JA-ET主干,积极参与植物免疫[8,9,10].为了对抗PTI,微生物分泌效应蛋白,可被植物抗性(R)蛋白识别,进而激活植物中的ETI [11,12].ETI的特征是SA的诱导、防御基因的转录以及超敏反应(HR),其中R基因,包括CC-NBS-LRR基因(CNL基因)和TIR-NBS-LRR基因(TNL基因)发挥了重要作用,如帮助识别致病效应因子或模拟病原靶点等[13,14,15,16].此外,转录因子(TF)也在PTI和ETI中发挥作用,包括抵抗成分的基础表达、受体蛋白的直接TF活性和受体起始下游的激活[17,18,19].一般来说,植物的防御机制是复杂的,有各种各样的方法来应对不同的病原体。因此,有必要研究不同类型植物对不同病原菌侵染的作用机制,为提高植物抗病能力和抗病基因的选择提供理论依据。利用RNA-seq,人们可以描述植物-病原体相互作用过程中全基因组基因表达的动态模式,并帮助确定基因和蛋白质的功能。最近,在许多作物和其他经济上重要的植物中,对病原体响应的转录组进行了研究柑橘jambhiri[20.]苹果21,22,番茄23,24],玉米[25),烟草benthamiana[26].然而,对杨树-病原相互作用的研究主要集中在杨树-锈病[27,28],人们对杨树对抗其他病原体的防御机制知之甚少。
链格孢属是一种世界性真菌属,其成员通常作为植物病原体,侵染广泛的植物,包括谷类作物、蔬菜和水果,导致叶片坏死和落叶,水果和新芽坏死,生长周期缩短和采后腐烂[29].到目前为止,控制方法链格孢属主要依赖化学杀虫剂,如代森锰锌、达康和卡塔福,但长期使用杀菌剂导致对化学杀菌剂产生抗药性和环境污染[30.].因此,更好地了解植物的防御机制的反应链格孢属可能有助于设计更安全的防治策略,并有助于抗性品种的开发。到目前为止,已经在不同的植物物种中进行了一些转录组研究,以了解植物防御反应的机制链格孢属sp.感染。在菊花中,活性氧(ROS) Ca2 +SA/JA或ET信号通路被诱导来防御链格孢属sp。31,32].ET - /小时2O2-介导的程序性细胞死亡(PCD)和解毒过程已被证明在梨和答:alternata[33].此外,在感染过程中,致病相关基因(PRs)和细胞壁增强相关基因均出现下调,提示其易感性一个.alternata可能是由于其细胞壁防御的脆弱性和PR蛋白的下调[21].这些调查显示宿主和链格孢属杨树(sp。杨树Spp .)是一种快速生长的高产树种,对世界生态和社会经济福祉至关重要。杨树叶枯病引起答:alternata已成为一种对中国经济造成严重影响的常见病[34,35].然而,尚未有详细的分析阐明杨树响应的分子调控机制答:alternata感染。在这项研究中,我们进行了全球转录分析p . davidiana×p . bollena为了应对答:alternata利用RNA-Seq技术,探索与病原菌耐药相关的差异表达基因(DEGs)和显著富集通路。多个潜在的候选基因参与了对答:alternata并鉴定了感染和脂氧合酶基因的功能PdbLOX2在转基因杨树中进行了鉴定。这些结果为研究杨树抗病性的分子机制提供了新的思路答:alternata今后将有利于培育耐久、广谱抗病杨树品种。
结果
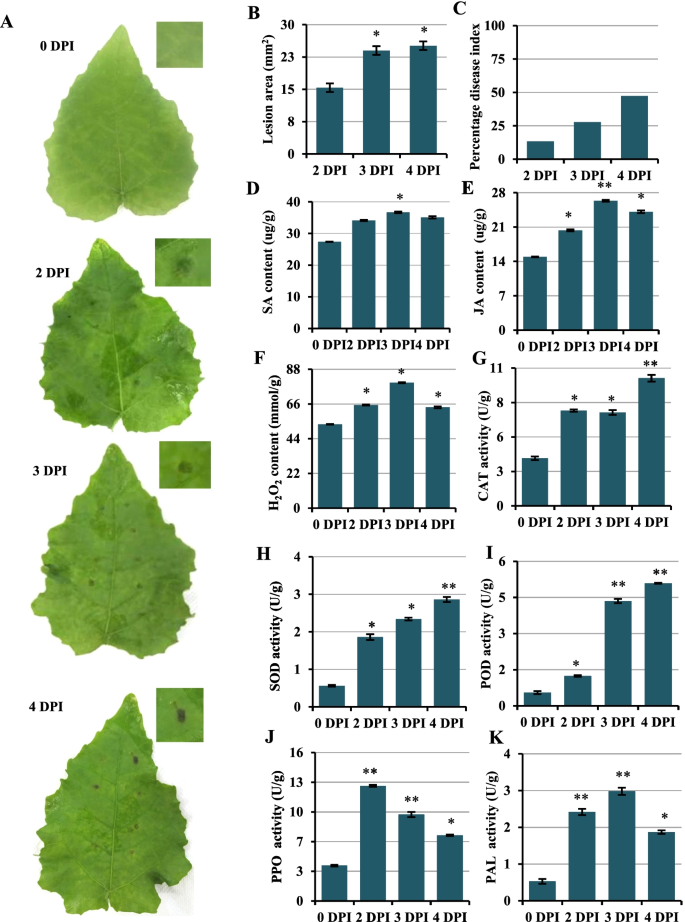
叶片后的症状和生理变化主产感染
观察了接种叶片上疾病的进展(图。1a - c)。接种区被2 DPI浸水,浸水效果不明显。损伤组织组成的斑点呈弱棕色,斑点大小增大3 DPI。然后,在随后的24小时内,观察证实斑点大小没有进一步增加,但颜色进一步加深。测定叶中激素和活性氧含量p . davidiana×p . bollena回应答:alternataSA、JA和过氧化氢(H2O2)测定。结果表明,大豆中SA、JA和H的含量显著提高2O2其中JA含量在侵染过程中较对照显著增加(图1)。1D-F)。此外,还检测了与植物抗病原感染有关的酶,如POD、SOD、PPO、PAL和CAT,这些酶的活性均显著高于对照(图1)。1G-K)。这些数据表明防御系统在p . davidiana×p . bollena是回应答:alternata感染。
疾病进展过程中RNA-Seq和差异表达基因(DEGs)的鉴定
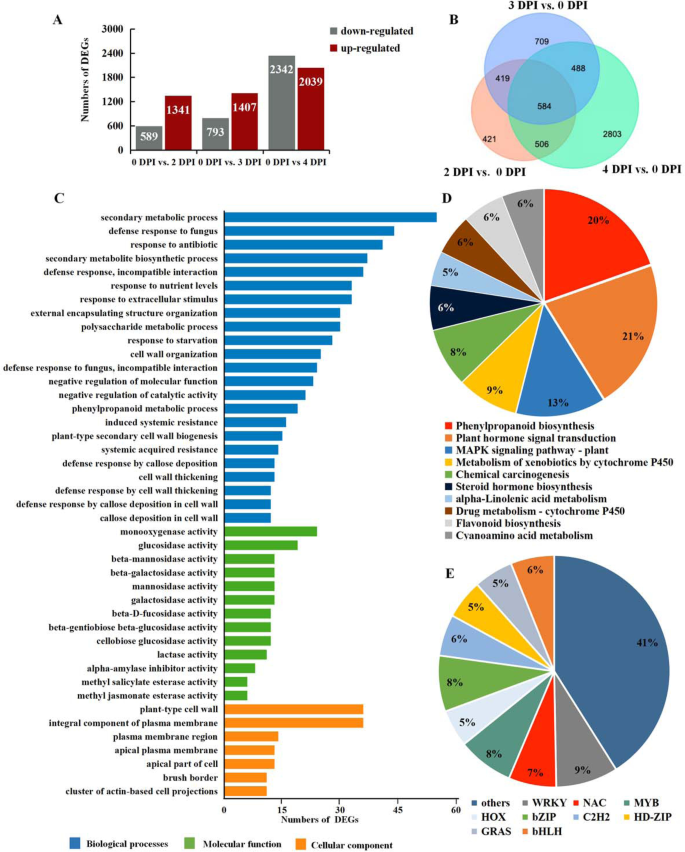
在宏观观察的基础上,选取0 d、2 d、3 d和4 d 4个时间点,在Illumina HiSeq 2500平台上进行3个生物重复分析。共构建了12个cDNA文库,获得了58.1 GB的clean reads。原始reads的Q20和Q30平均值分别为97.17%和92.23%。约72.13%的reads被映射到参考基因组序列(表S1).
为研究杨树致病性感染过程中DEGs的变化,利用DESeq2 R包分析和鉴定表达变化大于单一且P≤1e−4显著性水平的基因。比较病原菌感染与对照样品的基因表达情况;比较2和0 DPI库,鉴定出1930个DEGs,其中1341个上调,589个下调;3和0 DPI的比较产生2200个deg,其中1407个上调,793个下调。在所有的比较中,当比较4和0 DPI库时,发现了最多的deg, 4381个;在分析中,2039个基因被上调,2342个基因被下调,这表明这个时间对杨树的响应特别重要答:alternata感染(图。2A).然后,将上述结果用维恩图表示,唯一的和共享的deg都发生在对之间(图1)。2B)。例如,2 DPI与0 DPI中的421个(占总数的21.81%),3 DPI与0 DPI中的709个(占总数的32.22%),4 DPI与0 DPI中的2803个(占总数的63.98%)仅在其文库中存在差异表达。此外,在所有比较中共有584个deg。以上结果提示,在病原体感染进展过程中,参与防御反应的基因较多,在不同的感染进展过程中,参与防御反应的基因可能不同。
RT-qPCR验证RNA-Seq数据
为了验证RNA-Seq数据的准确性和可重复性,随机选取20个DEGs的转录本进行RT-qPCR分析。这些基因的表达与RNA-Seq结果一致,且相关系数较高(R2= 0.969,P< 0.05),证明了我们的RNA-Seq数据的可靠性(图S1).
DEGs的GO富集及KEGG通路分析
通过GO富集和KEGG分析获得致病感染诱导的DEGs的功能分类。氧化石墨烯富集分析通过eggNOG-mapper进行(Fisher精确测试,P值≤0.05)。最显著的富集生物过程是“次生代谢过程”和“真菌防御反应”。相比之下,最显著的细胞成分(CC)项与“植物型细胞壁”和“质膜整体成分”有关,而分子功能(MF)项与“-葡萄糖苷酶活性”和“葡萄糖苷酶活性”有关(图)。2C).显示显著变化的路径(P值≤0.05)通过KEGG数据库进行鉴定。显著富集的KEGG通路共有17条,其中“植物激素信号转导”(ko04075)、“苯丙类化合物生物合成”(ko00940)、“MAPK信号通路-植物”(ko04016)和“类黄酮生物合成”(ko00941)表达最多。“植物激素信号转导”(ko04075)和“苯丙类化合物生物合成”(ko00940)均表现出许多DEGs,说明在杨树中,植物激素和苯丙类化合物在抵抗病原菌感染中发挥着重要作用。“MAPK信号通路”(ko04016)中出现的DEGs数量居第三位,说明在病原菌侵染过程中,杨树内部基因的表达受到多种信号物质的调控(图5)。2D)。此外,涉及“植物-病原相互作用通路”(ko04626)或“ras信号通路”(ko04014)的抗病基因,如RPM,RGA而且DRL实验室,主要在病原体感染后上调(图S2).综上所述,这些结果表明杨树已经进化出一系列不同的分子防御策略,这取决于病原体的感染阶段。此外,在这些deg中,有380个TF可分为34个TF家族,如bHLH、MYB、NAC、bZIP(碱性亮氨酸拉链)、WRKY和HSF家族(表S2).此前有报道称,其中一些转录因子与植物对生物胁迫的抗性反应密切相关。例如,病原体诱导的转录因子中最大的一组属于WRKY家族,该家族在植物防御方面非常有名,在感染过程中也诱导了一些MYB、NAC和bHLH家族成员(图1)。2E).这一结果表明,tf也在抗p . davidiana×p . bollena来答:alternata感染。
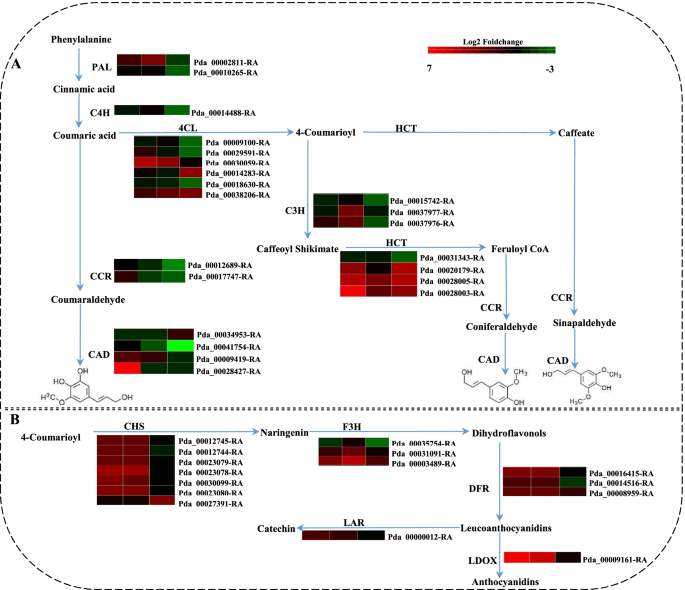
DEGs参与苯丙烷通路
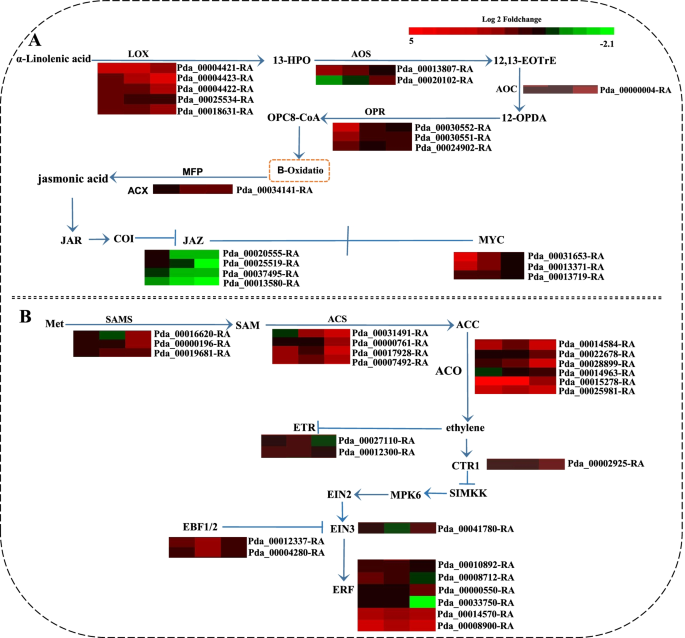
次生代谢物通过形成物理或化学屏障参与植物对病原体的防御。在本研究中,与次生代谢相关的DEGs在病原体感染过程中发生了显著变化,尤其是“苯丙类生物合成”(ko00940)和“类黄酮生物合成”(ko00941)的变化。总共有超过100个在32个不同的生物合成途径中有显著表达的DEGs被富集在这些途径中。苯丙氨酸解氨酶基因(朋友) (Pda_00002811-RA)在3 DPI时被上调,Pda_00002811-RA参与苯丙烷生物合成的第一步并催化木质素的积累。其他参与木质素生物合成的基因,如4-香豆酸辅酶a连接酶(4 cl)和石草酸o -羟基肉桂基转移酶(HCT)基因表达上调,而反式肉桂酸4-单加氧酶(C4H)基因下调。导致木质素形成的关键基因,包括对香豆酸3-羟化酶(摘要:)、肉桂醇脱氢酶(计算机辅助设计)和肉桂酰辅酶a还原酶(CCR),在本研究的不同时间点上调或下调(图。3.A).此外,查尔酮合成酶基因(CHS黄酮3-羟化酶(F3H),从而导致槲皮素衍生物的形成,被下调或上调。此外,编码白花色素双加氧酶(LDOX)和白花色素还原酶(守护神),它们分别参与原花青素的合成和延伸,在2 DPI和3 DPI处均上调(图。3.B)。
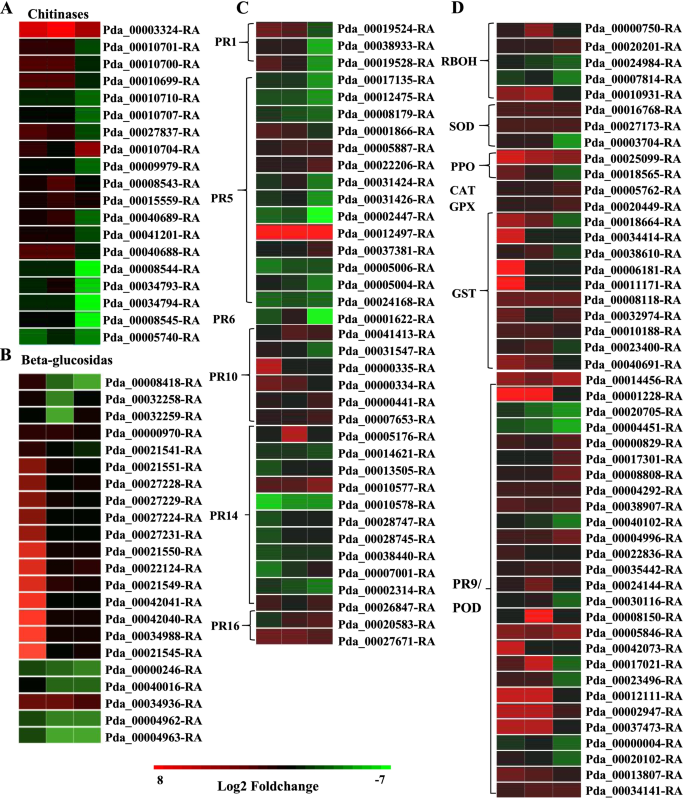
与ROS积累和清除相关的DEGs
随着H2O2叶片中活性氧含量以及与活性氧清除有关的酶活性在侵染后发生变化,鉴定出与活性氧积累和清除有关的DEGs。三个基因编码呼吸爆裂氧化酶同源物(RBOH)蛋白,这种蛋白通过产生ROS对病原体作出反应,在感染过程中被上调。此外,编码ROS清除相关酶的基因也出现了显著变化。基因的表达水平如草皮,PPO,猫,圆荚体谷胱甘肽过氧化物酶(GPX)主要上调,特别是PPO而且圆荚体,在感染过程中呈高表达(图。4D).此外,谷胱甘肽s -转移酶(消费税)主要在2 DPI时上调,而仅GSTFB(Pda_00008118-RA)在感染过程中持续激活。
与国防有关的蛋白质
病原相关蛋白(PR)是植物固有免疫不可或缺的组成部分,在植物抵御病原体方面发挥着重要作用。在此研究,杨树不少公关基因被诱导响应答:alternata感染;的表达PR-1在2 DPI和3 DPI上均上调,但大部分的桃红蛋白样蛋白(PR-5)的基因均下调,只有一个基因在病原体感染期间转录水平较高(图。4C).我们的结果也证明了PR-9(氧化酵素),PR-10(核糖核酸酶),PR-14年代(脂质转运蛋白)和PR-16s(发芽样蛋白)在整个感染期间上调或下调(图。4C, D)几丁质酶2 DPI和3 DPI的转录水平都很高,但在4 DPI的转录水平下调(图1)。4A),而一些glucusidas在2 DPI时上调,然后下调(图。4B)。
与植物激素和信号转导有关的DEGs
植物激素,尤其是水杨酸(SA)、茉莉酸(JA)和乙烯(ET),是植物-病原体相互作用的关键调节因子;其中JA/ET信号通路参与了对坏死性病原体感染的应答。本研究发现了与JA/ET合成和信号转导相关的DEGs,且大多数DEGs在感染过程中上调。参与JA合成的基因,包括亚油酸脂氧合酶(液态氧)、丙烯氧化物合酶(先进的)、烯氧化物环化酶(重获)、12-氧植二烯酸还原酶(超载比)和酰基辅酶氧化酶(ACX),在感染过程中诱导。的表达水平液态氧,重获,AOS3(Pda_00013807-RA)和ACX的表达持续上调,而OPR3(Pda_00030552-RA)在2dpi时上调,在4dpi时下调。此外,表达水平MYC参与JA信号转导的s在2dpi和3dpi均上调。而JAZ含有保守的TIFY结构域,是JA信号转导的负调控因子,其表达主要在病原体感染过程中下调(图1)。5A).同样,ET合成相关酶的基因,包括s -腺苷甲硫氨酸合成酶(地空导弹)、1-氨基环丙烷-1-羧酸合成酶(ACS)和1-氨基环丙烷-1-羧酸氧化酶(华),均在感染期间上调。ET信号转导通路相关基因也被显著诱导。五个乙烯响应转录因子(小块土地)上调,而1小块土地(Pda_00033750-RA)表达下调。在这些小块土地年代,两个ERFC3s (Pda_00014570-RA和Pda_00008900-RA)在所有时间点均高度诱导(图。5B). SA反应途径经常被证明与植物对生物营养性和半生物营养性病原体的抗性有关。同时还鉴定出与SA积累和信号转导相关的DEGs。增强疾病易感性的基因EDS1)及其辅助调节因子植物抗毒素缺乏4 (PAD4),它们与SA积累相关,在感染过程中都被下调。然而,少数参与SA信号转导通路的基因被诱导。的TGA1基因Pda_00012927-RA在2 DPI时转录1.03倍美国国家公共电台基因在4 DPI时上调(图S3.).
亚油酸13 -脂氧合酶基因(PdbLOX2)P.davidiana×P.bollena与抵抗有关一个.alternata
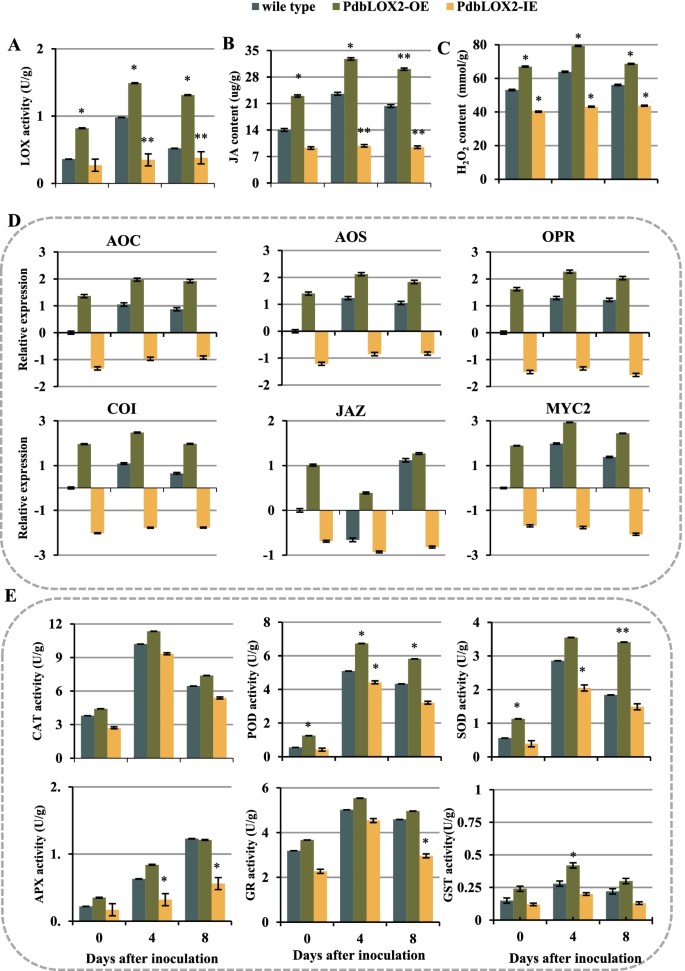
脂氧合酶(LOX)是JA生物合成途径中的一种关键酶,参与了植物对多种病原体的防御反应。根据KEGG分析和基因表达数据,我们发现脂氧合酶基因在杨树叶片侵染过程中被强烈诱导答:alternata,特别是PdbLOX2(Pda_00004421-RA);因此,我们推测这具体液态氧基因在调控中起着基础性作用p . davidiana×p . bollena防御答:alternata感染。过表达转基因杨树PdbLOX2(PdbLOX2oe)和RNAi-silencedPdbLOX2(PdbLOX2-IE)通过农杆菌感染获得PdbLOX2RT-qPCR分析。PdbLOX2表达水平显著高于PdbLOX2 -OE系比野生型(WT)低,但在PdbLOX2即行(无花果。6B).接下来,将转基因杨树和WT杨树的叶子接种答:alternata.接种后,WT叶片上的病斑呈深色、粗大、不规则状PdbLOX2 -OE植株呈浅色圆形,且比WT植株更小PdbLOX2 -IE植株比WT植株颜色深,植株体积大。6A, C)。以上结果均被百分比疾病指数进一步证实(图。6D)。
分析了转基因杨树和WT在侵染过程中的脂氧合酶活性和茉莉酸含量。结果表明,在感染过程中,过表达系的脂氧合酶活性和JA含量均高于WT,而两种过表达系的含量均低于WTPdbLOX2-IE线比WT高(图。7解析:选BPdbLOX2 -OE植物,ja相关基因,包括重获,先进的,超载比,细胞色素氧化酶,JAZ而且MYC,在感染过程中相对表达量显著高于WT,而在感染过程中相对表达量低于WTPdbLOX2比如植物(图。7D).脂氧合酶(LOX)也参与植物对生物和非生物胁迫反应中的脂质过氧化过程。与野生植物相比,在PdbLOX2-过表达线,H2O2显著诱导其积累,而抑制其积累PdbLOX2即行(无花果。7C)。此外,过表达系的抗氧化酶活性高于WT,但在rnai沉默植物中较低(图1)。7E).这些结果表明PdbLOX2参与了杨树对答:备用通过调控JA的合成、信号通路以及ROS的积累等作用。
讨论
最近,杨树叶枯病引起答:alternata已成为一种常见病,对中国的经济造成了严重影响,但人们对这种疾病耐药性的分子机制知之甚少答:alternata在杨树感染。在本研究中,我们探讨了转录反应的机制p . davidiana×p . bollena引起的答:alternata感染。通过对病原感染叶(2 DPI、3 DPI、4 DPI)和模拟接种叶(0 DPI)的转录组学分析,共鉴定出5930个deg,其中20.15%的deg在公共数据库中没有同源基因,这可能表明这些基因尚未在其他植物中被鉴定出来。为了确定致病感染诱导的DEGs的功能类别,我们进行了GO和途径富集分析。结果表明,大多数DEGs参与“植物激素信号转导”(ko04075)和“苯丙类生物合成”(ko00940),或富集于“真菌防御反应”和“植物型细胞壁”,均参与植物对病原体的防御。这些结果与植物在病原体感染的不同阶段可能进化出的一系列分子防御机制是一致的。
苯丙类化合物被用于防御答:alternata感染
通过苯丙类生物合成途径形成的次生代谢产物在植物防御中起作用,从预先形成的或诱导的物理和化学屏障到参与局部和系统信号传导的信号分子,以诱导其他防御基因[7,36,37].在这些次生代谢物中,木质素已被证明在植物抵抗病原体感染时形成机械屏障,参与木质素催化的基因,如朋友,HCT, CCR而且计算机辅助设计,影响植物抗病能力[5,38].例如,在小麦中,沉默基因编码的单木酚生物合成酶,如朋友而且计算机辅助设计,导致叶片组织对真菌病原体的敏感性Blumeria茎f . sp。tritici[39].而在拟南芥,的计算机辅助设计基因已被证实参与木质素的生物合成,作为防御细菌病原体的致命和无毒菌株的基本成分p .两pv。番茄[40].的PtHCT2基因被证明对病原体的感染有反应Sphaerulina musiva在耐药p . trichocarpa品种与敏感品种的比较[41].在我们的研究中,杨树木质素生物合成相关基因,如朋友,4 cl,HCT,CCR而且CAD、是在与答:alternata(无花果。3.A),这表明木质素生物合成途径对病原体感染有反应。
此外,包括花青素、黄酮醇、黄酮和原花青素在内的类黄酮也被证明在保护植物抵御病原体方面发挥作用。特别是与这些代谢物的生物合成有关的基因CHS而且F3H,在病原体感染过程中诱导产生。例如,的表达式CHS在真菌和细菌病原菌感染过程中,大豆蛋白表达上调[42].过度的OxF3H水稻对细菌性叶枯病的耐受性增加[43].在本研究中,与类黄酮生物合成相关的DEGs,包括CHS,F3H,DFR而且LDOX,被诱导答:alternata感染,特别是在感染早期(图。3.B),这表明杨树防御答:alternata通过诱导黄酮类化合物的产生。
ROS信号通路参与了抵抗答:alternata感染
病原体感染诱导ROS快速积累,从而限制病原体的进入或引起病原体的氧化损伤[44].同时,过量的ROS会导致酶促和非酶促抗氧化剂水平的增加。参与氧化爆发和清除的酶,如POD、GST、APX、SOD和RBOH,在植物中被病原体感染而激活和诱导。例如,编码抗氧化和解毒酶的基因,包括销售税年代和仓,在抗病基因型26中有显著诱导,而在易感基因型26 M中无明显诱导b .灰质感染(45].同样,番茄丛矮病毒感染显著影响了番茄中负责ROS积累平衡的酶,如CAT和SODn benthamiana[46].Pyricularia oryzae感染诱导的表达OsRBOHB并改变其在水稻中的定位,导致ROS在侵入菌丝周围的局部聚集,有效抑制病原体感染[47].在本研究中,参与ROS清除的酶包括SOD、POD、PPO和CAT的活性在感染过程中被显著诱导,这与相关基因的表达模式一致。其他与ROS产生相关的基因,如RBOH而且液态氧H2O2含量在感染过程中显著增加(图。1f j,无花果。4D).这些结果表明杨树可能通过积累ROS来抵抗感染。
JA/ET信号通路激活后答:alternata感染
植物对生物胁迫的反应也通过控制广泛生理过程的信号转导通路网络来协调。通常,SA反应途径被证明与植物对生物营养性和半生物营养性病原体的抗性有关。在本研究中,大部分与SA信号相关的基因被下调。然而,TGA1而且美国国家公共电台在感染期间呈上升趋势(图S3.).在其他转录组研究中也观察到类似的结果,如菊花和梨的相互作用链格孢属sp。32,48],Physcomitrium金属盘,番茄与玫瑰相互作用葡萄孢菌[49,50,51].结果表明,矫正性大动脉转位而且美国国家公共电台也许还涉及到其他的防御方法答:alternata在杨树感染。此外,JA/ et依赖的信号通路通常参与植物对坏死性病原体的基础或诱导防御机制[9,10].MYC蛋白是JA信号通路中的正调控蛋白,通过整合JA和ET信号通路在植物防御中发挥作用。例如,在番茄抗病过程中,MYC2及其下游的MYC2靶向转录因子(MTFs)可以形成一个转录模块,直接调控ja诱导的晚期防御基因的转录b .灰质[52].过度的OsMYC2在水稻中导致了早期ja响应基因的上调,以及对细菌枯萎病的抗性[53].此外,许多小块土地基因已经被证明参与了ja介导的防御反应;这些基因包括AtERFs在拟南芥[54,55,56,57,58],TaERF3而且TaPIEP1在小麦59,60),而OsERF年代和OsEREBP1在水稻61,62,63].在本研究中,涉及JA/ET信号和生物合成的基因,如液态氧,先进的,MYC,小块土地, JA含量在感染过程中显著增加(图。1,无花果。5).这些结果表明p . davidiana×p . bollena可能会抵制答:alternata主要通过JA/ET信号通路感染。
PdbLOX2通过介导JA信号通路和ROS产生参与杨树抗性和防御
脂氧合酶在植物抗性中起作用,包括启动JA或MeJA等信号分子的合成,或改变细胞内的代谢,导致ROS含量高,最终导致细胞死亡[64,65,66,67,68].例如,早期激活液态氧基因和其他JA生物合成基因与玉米抗性有关ZmLOX3玉米中可能通过介导氧脂素代谢参与真菌发病;的损失ZmLOX3功能导致易感性黄曲霉而且答:nidulans玉米的感染[69,70].在棉花,GhLOX2正向调节对黄萎病dahliae通过JA信号通路感染,同时沉默GhLOX2抑制H2O2积累损害棉花抗性[71].在本研究中,我们获得了过表达的转基因杨树植株PdbLOX2以及RNAi植物.的PdbLOX2-OE植物对一个.alternata而WT植株的感染率较低PdbLOX2-IE系对一个.alternata与WT相比(图。6).此外,过度表达PdbLOX2增加JA信号相关基因的转录,促进JA积累。此外,H2O2含量显著增加,活性氧清除酶被激活PdbLOX2oe线。而大鼠的生理变化则相反PdbLOX2比如植物(图。7).总的来说,这些结果表明PdbLOX2涉及到杨树的抗病答:备用通过调控JA的合成、信号通路以及ROS的积累等作用。
结论
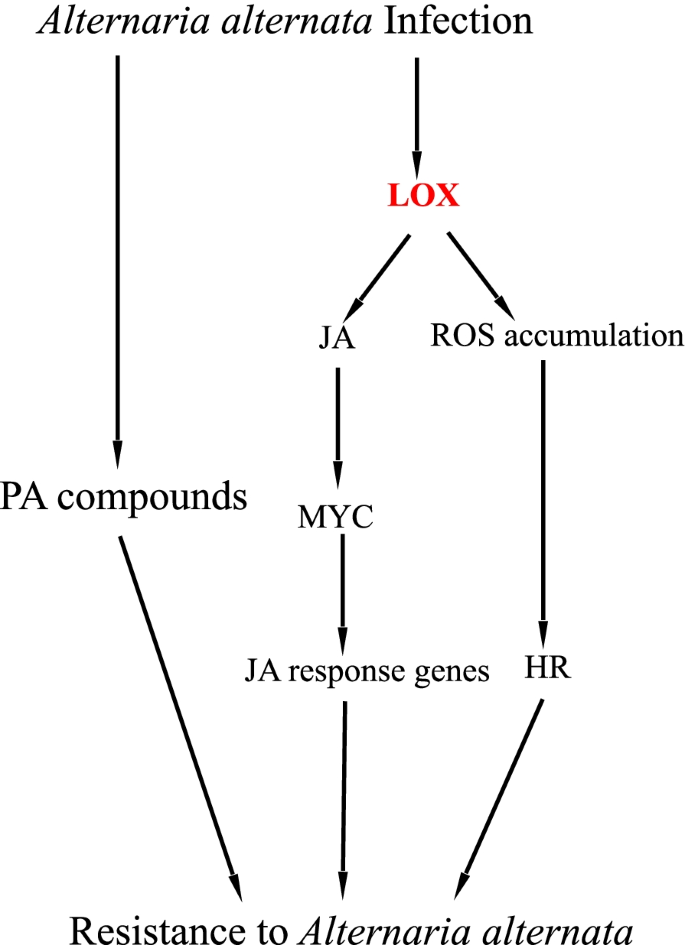
综上所述,我们使用RNA-Seq技术对p . davidiana×p . bollena为了应对答:alternata感染和脂氧合酶基因PdbLOX2被选入进一步研究;该分析有助于我们更好地了解杨树对答:alternata感染和在未来培育持久的,广谱抗病作物。通过RNA-Seq共获得5930个DEGs,功能注释表明,通过ROS积累、苯丙类化合物(PA化合物)产生和JA/ET信号通路介导的多种防御反应被激活。然后,PdbLOX2被证实与杨树对答:备用通过基因工程调控JA合成、信号转导途径以及ROS积累等途径来抑制侵染。结果表明,JA/ET信号通路、ROS代谢途径和PA化合物构成了一个协同防御网络,参与了杨树对黄萎病的响应答:alternata感染(图。8).
方法
植物材料、病原培养及接种方法
植物病原真菌的主产用马铃薯葡萄糖琼脂(PDA)培养基在黑暗中培养10天,然后用无菌水稀释至1 × 106孢子/毫升。幼苗的杨树davidiana×p . bollena在温室25°C光照16小时/黑暗8小时条件下生长3个月。然后用10 μl孢子悬液接种健康叶片,未接种叶片作为模拟对照(0 DPI)。实验设计遵循了Yang的方法。[72].所有处理都在收获日之前的不同计算时间开始,所有样品都被设计成在同一时间收获。接种后每天观察叶片的症状发展情况。分别在接种后2、3、4 d进行疾病分级和生化测定。利用ImageJ软件测量叶片损伤面积[73,74].根据Pandey方法分配和计算感染评分75].三个生物重复,每个重复包含十个不同植物的十个平行叶片,用于每个处理时间点或对照。然后将样品迅速放入液氮中,并在- 70°C保存。
生化检测
样品用于测定植物激素、H2O2酶的活性,包括过氧化物酶(POD)、多酚氧化酶(PPO)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和苯丙氨酸解氨酶(PAL)。采用酶联免疫吸附试验(ELISA)试剂盒(中国上海,分别为BYE97056和RJ-21830)测定植物激素(SA和JA)含量2O2通过过氧化氢法测定其含量(中国南京A064)。采用Liu [76].PPO活性测定采用Hammerschmidt [77].每次试验使用3个生物重复。
RNA提取,文库构建和测序
使用RNeasy Plant Mini Kit分离总RNA,并用RNase-free DNase I (Qiagen, Hilden, Germany)处理。通过琼脂糖凝胶电泳检查RNA的质量,以确保清晰的条带可见。RNA样本的完整性和数量使用NanoDrop2000分光光度计(Thermo Fisher Scientific, Wilmington, DE, USA)和Agilent生物分析仪2100 (Agilent Technologies, Santa Clara, CA, USA)进行测定。RNA- seq cDNA文库是根据制造商的说明使用NEB Next UltraTM RNA文库准备试剂盒为Illumina (NEB, USA)从mRNA构建的。最后构建12个cDNA文库(0 DPI时3个,2 DPI时3个,3 DPI时3个,4 DPI时3个)进行测序。RNA-Seq在Illumina HiSeq 2500平台上进行,以获得配对端读数。RNA-Seq数据存入NCBI序列读取档案数据库(http://www.ncbi.nlm.nih.gov/sra/),项目注册号为PRJNA649854。
差异表达基因分析及功能注释
为了获得干净的读取,适配器读取、低质量的读取(Q-value < 20)和包含超过10%模糊“N”碱基的读取都被丢弃。的干净读取被映射到杨树davidiana基因组(GenBank: GCA_014885075.1)使用Tophat2软件,默认参数设置[78].鉴定杨树中的DEGs对一个.alternata接种后不同时间点的感染,根据FPKM(片段/ kilobase of exons / million mapped reads)计算各转录本的表达量,使用软件包Cufflinks [79].使用DESeq2 R包对两个样本进行差异表达分析。|日志2以折叠变化|≥1和错误发现率(FDR)值< 0.05作为DEGs的截断标准。利用eggNOG-mapper软件对DEGs进行基因本体(GO)富集分析和京都基因与基因组百科全书(KEGG)通路分析[80].
表达谱的实时定量PCR验证
从3个月大的植株和转基因植株的叶片中提取总RNA答:alternata0(对照),2,3和4 d使用RNeasy Plant Mini Kit (Qiagen, Hilden, Germany),根据制造商的方法,使用TransScript single - step gDNA Removal and cDNA Synthesis SuperMix Kit (AT311, TransGen Biotech, Beijing, China)合成cDNA用于定量实时PCR (RT-qPCR)。RT-qPCR采用SYBR®Green Real-time PCR Master Mix (QPK-201, Toyobo, Osaka, Japan)在CFX96 TouchTM实时PCR检测系统(Bio-Rad, Hercules, CA, USA)中进行。每个样品使用三个生物重复,每个重复有三个技术重复。管家基因PdbEF而且Pdbactin作为内控,用于RT-qPCR分析的引物见表S3..相对基因表达量用2−ΔΔCt方法(81].
转基因植物的生成
的完整ORFPdbLOX2被克隆到KpnI而且XbaI在CaMV 35S启动子和NOS终止子的控制下,pROKII的限制性内切酶位点产生过表达构建pROKII-PdbLOX2.和一个203 bp的截断反向重复CDSPdbLOX2插入RNAi载体pFGC5941 (pFGC::PdbLOX2)使沉默:使…的表情沉默PdbLOX2.然后,将构建物导入农杆菌EHA105菌株中,转化为p . davidiana×p . bollena通过农杆菌属-介导的叶盘转化。用卡那霉素(50 mg/L)对过表达植株(PdbLOX2-OE),或草甘膦(1mg /L)用于RNA沉默植物(PdbLOX2-IE),所有转基因杨均通过基因组PCR和RT-qPCR进行验证。用于转化的引物如表S所示3..
主产转基因植物的抗性测定
从三个月大的转基因植株和野生型植株的叶片中接种答:alternata插头(5毫米),然后放在透明的方形培养皿中,在上述条件下。接种4 d和8 d后分别对叶片进行观察和取样。在三个独立的实验中重复了病原耐药性测定。每个独立实验包括3个生物重复,每个重复有3个技术重复,来自至少9个单株植物的叶片被汇集在一起作为一个生物重复。用样品测定叶片中的JA和H2O2内容;脂氧合酶(LOX)、POD、CAT、SOD、抗坏血酸过氧化物酶(APX)、糖肽还原酶(GR)等酶活性;和RT-qPCR。JA和H的含量2O2的测定方法如上所述。测定小鼠体内CAT、SOD、POD和APX活性。使用脂氧合酶(LOX)活性测定试剂盒(BC0320, Beijing Solarbio Science & Technology, Beijing, China)测定和计算LOX活性。GR活性的测量方法为Ge [82].GST活性的测量方法参见Horváth [83].RT-qPCR采用上述方法,用于分析的引物见表S3..对于每个检测,分析三个生物重复。
统计分析
采用SPSS v.20软件进行统计分析。数据比较采用学生t检验。两组数据之间的差异被认为具有统计学意义p< 0.05。*表示差异显著。
数据和材料的可用性
用于支持本研究结果的数据可根据要求从通讯作者处获得。本研究的数据可从NCBI序列读取档案数据库中获得,登录号为PRJNA649854。
参考文献
植物免疫系统。大自然。2006;444:323-9。
激发子的复兴:模式识别受体对微生物相关分子模式和危险信号的感知。植物生物学,2009;60:379-406。
唐波,刘超,李振,等。水稻模式触发免疫的多层调控景观。中国生物技术学报(英文版);
张文华,张文华。模式触发免疫(PTI)的信号机制。摩尔。2015;8(4):521 - 39。
Sattler SE,漏斗哈里斯DL。改性木质素以改善生物能源原料:加强对病原体的屏障?植物科学进展2013;4:1-8。
van Loon高级代表,Pieterse高级代表。诱导防御相关蛋白在感染植物中的意义。植物酚,2006;44:35 5 - 62。
刘佳杰,王磊。苯丙类途径与植物防御的基因组学视角。植物病理学杂志2002;3:371-90。
Boutrot F, Segonzac C, Chang KN, Qiao H, Ecker JR, Zipfel C,等。乙烯依赖性转录因子EIN3和EIL1对拟南芥免疫受体FLS2的直接转录调控中国生物医学工程学报,2010;29(6):673 - 676。
Robert-Seilaniantz A, Grant M, Jones jg。植物病害和防御中的激素串扰:不仅仅是茉莉酸-水杨酸盐的拮抗作用。植物酚,2011;49:317-43。
梅泽T,中岛K,宫川T,黑森T,田仓M,筱崎K,等。ABA反应核心调控网络的分子基础:传感、信号转导和转运。植物细胞学报2010;51(11):1821-39。
崔浩,Tsuda K, Parker JE。效应者触发免疫:从病原体感知到强大的防御。植物生物学杂志2015;66:487-511。
模式触发和效应者触发免疫的信号机制比较。植物学报,2010;13:459-65。
杨文华,李文华,李文华,等。PRRs和nb - lrr:从信号感知到植物固有免疫的激活。国际分子科学杂志2019;20(8):1882-903。
Marone D, Russo M, Laidò G, Leonardis AD, mstrangelo A.植物核苷酸结合位点富含亮氨酸重复序列(NBS-LRR)基因:宿主防御反应的积极监护人国际分子科学,2013;14:7302-26。
Cesari S, Thilliez G, Ribot C, Chalvon V, Michel C, Jauneau A,等。水稻抗性蛋白对RGA4/RGA5通过直接结合识别稻瘟病效应器AVR-Pia和AVR1-CO39。植物细胞。2013;25(4):1463 - 81。
Elmore JM, Lin ZJD, Coaker G. Plant NB-LRR信号:上行和下行。植物生物学杂志,2011;14(4):365-71。
梅拉·塔,傅娟,马拉扎,朱超,王强。转录因子通过介导次生代谢调节植物的胁迫反应。基因。2020;11(4):346 - 64。
王亮,冉亮,侯勇,田强,李超,刘锐,等。转录因子MYB115调节杨树原花青素的生物合成,增强杨树抗真菌能力。新植醇。2017;215:351 - 67。
蒋军,马松,叶楠,蒋敏,张军。WRKY转录因子在植物逆境响应中的作用。植物生物学杂志,2016;59(2):86-101。
Gomi K, Yamamato H, Akimitsu K.环氧化物水解酶:一种由粗糙柠檬(柑橘jambhiri lush)上交替的真菌病原alternaria诱导的mrna。植物分子生物学,2003;53(1-2):189-99。
朱亮,倪伟,刘珊,蔡斌,韩旭,王珊。苹果叶片对交替型病菌感染的转录组学分析。植物科学进展2017;8:22-38。
Michele G, Cesare G, Broggini GAL, Mingliang X.通过Rna-seq分析,发现了在雄鼠-文氏尿病系统中存在个体耐药的候选基因。PLoS ONE。2013; 8: e78457。
贾超,张亮,刘亮,王杰,李超,王强。番茄植株对番茄黑枯病菌易感性的多重激素信号通路研究。中国生物医学工程学报,2013;32(2):637-50。
刘刚,刘杰,张超,尤鑫,赵涛,姜杰,等。通过生理和rna-seq分析,揭示了cf-10介导的番茄对黄枝孢菌感染的抗性反应机制。植物分子生物学杂志,2018;96(8):403-16。
穆松古,王晓燕,王晓燕,王晓燕。玉米与黄曲霉相互作用的系统生物学分析。Microbiol前面。2020;11:853 - 72。
李凯,吴刚,李敏,马敏,江东,苗松,等。烟草卷曲芽病毒侵染本氏烟草的转录组分析。j . 2018; 15(1): 138 - 53。
Miranda M, Ralph SG, Mellway R, White R, Heath MC, Bohlmann J,等。杂交杨树(Populus trichocarpa x P. deltoides)对melamsora medusae叶锈病感染的转录响应包括诱导类黄酮途径基因,导致原花青素的积累。植物与微生物的相互作用。2007;20(7):816-31。
peter B, Morin E, Tisserant E, Hacquard S, Silva CD, Poulain J,等。早期被锈病病原体lariciy -populina感染的杨树叶片的RNA-Seq揭示了真菌诱导的宿主硫酸盐转运蛋白PtSultr3;5。PloS one。2012; 7: e44408。
Francesca G、Leonardo S、Ilenia S、Isabella PM、Davide S、Anna DG等。地中海地区柑橘相关链孢菌的特征。PLoS ONE。2016; 11: e0163255。
杨丽宁,何明明,欧阳海红,朱伟,詹杰。病原菌链孢菌对不同作用模式杀菌剂的交叉抗性研究。BMC Microbiol。2019;19(1):205 - 15所示。
赵旭,宋林,姜林,朱勇,高强,王东,等。转录组学和转基因分析的整合揭示了SA反应通路参与了菊花对坏死性真菌Alternaria sp. Hortic Res. 2020;7(1): 1744-57的防御。
刘勇,辛杰,刘亮,宋阿,关铮,方伟,等。菊花叶片感染互交星病菌的时间基因表达图谱揭示了不同阶段的防御机制。Hortic杂志2020;7(1):2404 - 17所示。
王辉,林杰,常勇,蒋长忠。比较转录组学分析表明,乙烯/ h2o2介导的超敏反应和程序性细胞死亡决定了沙梨与互生稻的亲和互作。植物科学进展2017;15(8):195。
王yl,陆琪,Decock C,李yx,张xy。中国杨树和柳属植物的胞孢属植物种类及植物生物学杂志。2015;119(5):420-32。
peter B, Saunders DGO, Sklenar J, Lorrain C, Win J, Sébastien D,等。锈病病原菌白杨三角霉的候选效应蛋白靶向不同的植物细胞隔间。植物生物学报,2015;28(6):689-700。
马琳,何静,刘红,周浩。苯丙酸途径影响苹果果实对灰葡萄孢的抗性。J Phytopathol。2018;166:206-15。
Ranjan A, Westrick NM, Jain S, Piotrowski JS, Ranjan M, Kessens R,等。大豆对菌核病的抗性涉及苯丙类途径的重编程和针对麦角甾醇生物合成的抗真菌活性的上调。植物生物技术学报2019;17(8):1567-81。
李明明,全海生,金士豪,郑志华,Roppolo D,李海杰,等。木质素屏障将病原体限制在感染部位,并在植物中产生抗性。EMBO j . 2019; 38: e101948。
bbhuyan NH, Selvaraj G, Wei Y, King J.基因表达谱分析和沉默分析表明单木酚生物合成在小麦抗白粉病侵袭渗透防御中起着关键作用。科学通报,2009;60(2):509-21。
Tronchet M, Balagué C, Kroj T, Jouanin L, Roby D.肉桂醇脱氢酶-C和D是木质素生物合成的关键酶,在拟南芥抗病中发挥重要作用。植物病理学杂志2010;11(1):83-92。
张军,杨勇,郑凯,谢明,冯凯,Jawdy SS,等。全基因组关联研究和基于表达的定量性状位点分析揭示了HCT2在杨树中咖啡酰奎宁酸生物合成及其防御响应转录因子调控中的作用。新植醇。2018;220(2):502 - 16。
梅娜E,斯图尔特S,蒙特萨诺M, León IPD。黄豆茎腐烂病的研究病原多样性、定植过程与植物防御激活。植物学报(英文版)2019;
Jan R, Khan MA, Asaf S, Lubna, Park JR, Lee IJ,等。黄酮3-羟化酶通过过量积累抗氧化类黄酮和诱导防御基因和激素来缓解水稻细菌性叶枯病胁迫。中华生物学报(英文版);22(11):6152-71。
Rossi FR, Krapp AR, Bisaro F, Maiale SJ, Carrillo N.叶绿体中产生的活性氧有助于坏死性真菌灰葡萄孢(Botrytis cinerea)感染烟叶。工厂j . 2017, 92(5): 761 - 73。
杨燕,王旭,陈平,周凯,薛伟,阚安,等。抗性黄瓜基因型和易感突变株之间的氧化还原状态、JA和ET信号通路调节对灰霉病的反应。植物科学进展2020;11:1467-84。
叶加利耶夫,吴晓燕,吴晓燕,吴晓燕。活性氧醛氧化酶在植物对tombusv病毒反应中的作用。植物生理与生物学报2016;109:36-44。
陈勇,丹哥勒山,王杰,杰瓦NS。ROS的局部积累可以阻断稻瘟菌效应因子bas4的表达,防止水稻感染。国际分子生物学杂志2020;21(17):6196-202。
阚杰,刘涛,马宁,李宏,李旭,王杰,等。梨树的转录组分析揭示了一个完整的信号网络响应Alternaria alternata。PLoS ONE。2017; 12 (9): e0184988。
Reboledo G, Agorio AD, Vignale L,等。转录谱分析揭示了小绒泡菌与灰葡萄孢相互作用过程中保守的和物种特异性的植物防御反应。植物分子生物学,2021;107:365-85。
Blanco-Ulate B, Vincenti E, Powell AL, Cantu D.番茄转录组和突变分析表明植物胁迫激素在果实和灰葡萄孢相互作用中起作用。植物科学,2013;4:142。
高鹏,张辉,闫辉,王强,闫斌,简辉,等。RcTGA1和硫代葡萄糖苷生物合成途径参与玫瑰对坏死性真菌灰葡萄孢的防御。植物生物学杂志。2021;21(1):223。
杜梅,赵娟,曾德涛,刘艳,李晨。番茄Myc2转录级联调控茉莉素介导的植物免疫。植物细胞。2017;29 (8):tpc.00953。
Uji Y, Taniguchi S, Tamaoki D, Shishido H, Akimitsu K, Gomi K. OsMYC2的过表达导致水稻早期ja - r响应基因的上调和白叶枯病抗性。植物细胞物理学报2016;57(9):1814-27。
孟X,徐静,何勇,杨ky, Mordorski B,刘勇,等。拟南芥MPK3/MPK6的ERF转录因子磷酸化调节植物防御基因的诱导和真菌抗性。植物细胞学报,2013;25(3):1126-42。
McGrath KC, Dombrecht B, Manners JM, Schenk PM, Edgar CI, Maclean DJ,等。通过对拟南芥转录因子基因表达的全基因组筛选,发现抑制因子和激活因子型乙烯响应因子在茉莉酸信号和抗病性中的作用。植物杂志。2005;139(2):949 - 59。
Brown RL, Kazan K, Mcgrath KC, Manners MJM。gc -box在茉莉酸介导的PDF1激活中的作用。拟南芥2基因。植物杂志。2003;132(2):1020 - 32。
Onate-Sanchez L, Anderson JP, Young J, Singh KB。AtERF14是转录因子ERF家族的一员,在植物防御中起着非冗余的作用。植物杂志。2007;143(1):400 - 9。
Pre M, Atallah M, Champion A, Vos MD, Pieterse CMJ, Memelink J. AP2/ERF结构域转录因子ORA59在植物防御中整合了茉莉酸和乙烯信号。植物杂志。2008;147(3):1347 - 57。
那东,辛丽,陆勇,杜丽萍,徐辉,等。小麦病原菌诱导的ERF基因TaPIEP1的过表达增强了寄主对真菌病原菌Bipolaris sorokiniana的抗性。功能集成工程学报,2010;10(2):215-26。
张铮,姚伟,董楠,梁红,刘红,黄锐。一种新的小麦ERF转录激活因子及其在病原和激素处理后的诱导动力学。实验学报2007;58(11):2993-3003。
Jisha V, Lavanya D, Jyothilakshmi V, Axel M, Saivishnupriya K, Rajeshwari R,等。过表达AP2/ERF型转录因子OsEREBP1使水稻具有生物和非生物的抗胁迫能力。PLoS ONE。2015; 10: e0127831。
刘东,陈旭,刘军,叶军,郭卓。水稻ERF转录因子OsERF922负调控水稻对稻瘟病菌的抗性和耐盐性。中国生物医学工程学报(英文版);
卢杰,鞠华,周刚,朱超,尔布明,王旭,等。含有ear基序的ERF转录因子影响水稻植食性动物诱导的信号转导、防御和抗性。植物j . 2011; 68(4): 583 - 96。
玉米13-脂氧合酶重复基因受昼夜节律、冷应激、伤害、病原体感染和激素处理的不同调控。科学通报,2006;57(14):3767-79
Christensen SA, Nemchenko A, Park YS, Borrego EJ, Kolomiets MV。新的单孢真菌特异性9-脂氧合酶ZmLOX12是茉莉酸介导的对玉米黄萎病镰刀菌的有效防御所必需的。植物学报。2014;27(11):1263-76。
强超,波志,强卓,曾勇,王敏,黄敏。两个新的脂氧合酶基因在三角杨中的表达谱。植物科学。2006;170(6):1027 - 35。
morutto M, Duby F, Adam A, Bureau C, Dommes J.恶臭假单胞菌BTP1在番茄中诱导系统性耐药涉及到两种脂氧合酶异构体的刺激。植物生物学杂志,2011;11(1):29-29。
胡涛,曾辉,胡智,青霞,陈刚。番茄13-脂氧合酶基因TomloxD过表达增加内源茉莉酸的生成和对枝孢霉和高温的抗性。植物分子生物学学报2013;31(5):1141-9。
Maschietto V、Marocco A、Malachova A、Lanubile A在玉米自交系中对黄萎病菌和伏马菌素积累的抗性与脂氧合酶(LOX)基因的提前和增强表达有关。植物生理学报,2015;38(2):388 - 388。
高X, Brodhagen M, Isakeit T, Brown SH, Kolomiets MV。脂氧合酶ZmLOX3失活增加玉米对曲霉的敏感性。植物与分子微生物相互作用。2009;22(2):222-31。
Shaban M, Khan AH, Noor E, Malik W, Ali H, Shehzad M,等。13-脂氧合酶GhLOX2通过ja介导的途径正向调控棉花对黄萎病的耐受性。基因。2021;5:796-7。
杨超,魏浩。现代植物基因组学中更大系统生物学发现的微阵列和rna seq实验设计。摩尔。2015;8(2):196 - 206。
周凯,胡琳,李勇,陈旭,马芳。mdugt88f1介导的菌啉素生物合成调控苹果发育和抗腐烂性。植物杂志。2019;180(4):2290 - 305。
耿东,沈旭,谢颖,杨颖,关强。MdMYB88和MdMYB124调控苯丙类化合物生物合成对苹果抗病性和抗旱性的影响。Hortic杂志2020;7(1):102。
Pandey KK, Pandey PK, Kalloo G, Banerjee MK。番茄早疫病流行各参数的抗性研究。植物病理学杂志,2003;69(6):364-71。
刘红,姜伟,杨斌,罗颖。采后BTH处理对桃(Prunus persica L. cv.)抗性的影响。九宝)果实对膨胀青霉菌侵染的抑制作用增强了果实防御机制的活性。采后医学杂志。2005;35(3):263 - 9。
杨建军,张建军,张建军,等。木质素化诱导黄瓜系统抗性的机理研究。植物病理学杂志1982;20(1):61-71。
高希,陈家强。利用顶帽和袖扣分析RNA-Seq数据。方法Mol Biol. 2016; 1374:339-61。
Trapnell C, Roberts A, Goff L, Pertea G, Kim D, Kelley DR.用TopHat和袖扣进行RNA-seq实验的差异基因和转录本表达分析。Nat Protoc。2012;7:562 - 78。
Jaime HC, Kristoffer F, Pedro CL, Damian S, Juhl JL, von Mering C,等。蛋奶酒图谱通过矫形学赋值的快速全基因组功能注释。Mol Biol evl 2016;34(8): 2115-22。
Livak KJ, Schmittgen TD。利用实时定量PCR和2(-Delta Delta C(T))法分析相关基因表达数据。方法。2001;25:402-8。
葛颖,毕颖,嘉宾DI。受炭疽菌感染的抗性和易感甜瓜品种叶片的防御反应。植物学报(自然科学版)2013;
Horváth E, Brunner S, Bela K, Papdi C, Szabados L, Tari I,等。外源水杨酸引发的谷胱甘肽转移酶和过氧化物酶的变化是拟南芥盐胁迫驯化成功的关键因素。功能植物学报,2015;42(12):1129-40。
确认
不适用。
资金
国家自然科学基金项目(No. 31870665)和东北林业大学林木遗传育种国家重点实验室创新项目(No. 2014B03)的资助。
作者信息
作者和联系
贡献
王超设计了这些实验。黄颖、马慧君和朱振宇进行了实验。Yuanzhi Yue和Tianchang Zhou分析了数据。黄颖、王超对手稿进行了起草和修改。作者(们)阅读并批准了最终稿。
相应的作者
道德声明
伦理批准和同意参与
所有的方法都是按照相关的指导方针和规定进行的。收集植物样本不需要现场许可。
同意出版
不适用。
相互竞争的利益
作者声明没有竞争利益。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
补充信息
附加文件1:图S1。
RT-qPCR验证RNA-Seq数据。
附加文件2:图S2。
与防御相关的deg热图。
附加文件3:图S3。
参与SA信号转导的DEGs的热图。
补充文件4:补充表S1。
12个样本的RNA-seq数据总结。
补充文件5:补充表S2。
度之间的样本。
附加文件6:补充表S3。
本研究所用引物序列。
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
黄燕、马宏、岳燕。et al。综合转录组和转基因分析揭示了杨树抗病性的潜在机制主产感染。BMC植物杂志22413(2022)。https://doi.org/10.1186/s12870-022-03793-5
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-022-03793-5
关键字
- RNA-Seq
- 杨树
- 链格孢属交替
- 防御反应
- 脂氧合酶基因