摘要
背景
热休克转录因子(Hsfs)在真核生物中高度保守,在植物的逆境响应中起着至关重要的作用。然而,Hsfs在玉米中的作用和机制还很有限。
结果
在这项研究中,一个HSF基因ZmHsf11克隆自玉米,是B类Hsfs中的一员,经热处理后表达上调。ZmHsf11在酵母中是一种无转录自激活活性的核蛋白。过度的ZmHsf11基因拟南芥热激处理显著降低转基因植株的成活率,降低转基因植株对ABA的敏感性。在热胁迫下,转基因水稻的H2O2与野生型相比,细胞死亡增加,脯氨酸含量降低。此外,RT-qPCR分析显示ZmHsf11负调控部分氧化应激相关基因APX2、DREB2A、HsfA2e、NTL3、GR而且HSP17正在接受热应激治疗。
结论
我们的结果表明ZmHsf11通过负向调节氧化胁迫相关基因的表达,增加ROS水平和降低脯氨酸含量,降低植物对热胁迫的耐受性。它是参与高温应激反应的负调控因子。
背景
植物作为无柄生物,通常会暴露在不利的环境中,高温胁迫对其生长、发育和繁殖有很大的影响[1].在高温胁迫下,植物可以感知温度变化,激活细胞信号和代谢途径,以适应新的环境条件[2].这涉及到一些基因或蛋白质的表达,包括植物激素或信号转导相关基因Ca2 +信号通路、活性氧物种相关基因、热休克转录因子(Hsfs)和热休克蛋白[3.,4,5,6,7].热休克转录因子(Hsfs)在热应激调节途径中发挥重要调节作用[8].
热休克转录因子(Hsfs)作为热应激信号通路中的主要转活元件,在热休克作用下激活相关基因的表达,调控植物热应激反应过程[9].根据DNA结合域(DBD)和寡聚结构域(OD)的结构特征和类特异性基序的存在,将Hsfs分为A、B和C类[10].HsfA基因在热应激反应中起关键作用,其成员大致可分为A1-A9 [11].在拟南芥,四个HsfA1s(a/b/d/e)是功能冗余的,而它们的hsfa1a / b / d三,hsfa1a / b / d / e四倍突变体暴露于HS后存活率显著降低。HS响应基因,包括分子伴侣和转录因子的表达也受到了损害,并且在三倍和四倍突变体中对HS胁迫的耐受性都很大[12].温度依赖性抑制(TDR)域AtHsfA1d抑制的转激活活性HsfA1d通过与HSP70而且一半,过表达HsfA1d缺乏TDR结构域可诱导热休克蛋白的表达,从而增强植物的耐高温能力拟南芥[13].过表达和小RNA干扰HsfA1在番茄体内阐明了其热休克功能[14].HsfA2作为热响应基因子集的调节放大器,增加热响应基因的表达APX2而且HSP增强获得性耐热性拟南芥[15,16,17].在番茄,HsfA2是重要的辅激活剂吗HsfA1a,并通过控制一些具有重要发育功能的基因来维持花粉的耐热性[18].组蛋白H3赖氨酸4 (H3K4)甲基化的持续积累依赖于此HSFA2并在热休克后高度诱导相关基因的表达,以及含有这两种基因的异质复合物HSFA2而且HSFA3通过积极影响H3K4的高甲基化,有效促进转录记忆[17,19].在拟南芥,HsfA3是否存在热休克诱导基因DREB2A,DREB2A本身是一个hs诱导基因,在热休克和缺水应激反应中发挥了重要作用[20.,21].在番茄,HsfA3可以与MAP激酶相互作用,调节对热应激的反应[22].百合的过度表达HsfA3s在拟南芥通过改变脯氨酸分解代谢提高耐温性和盐敏感性[23].LlHsfA4通过调节ROS代谢增强百合的基础耐热性[24].然而,HsfA5特别干扰了的寡聚状态HsfA4,从而干扰其dna结合能力[25].过度的TaHsfA6b通过改变一些胁迫相关基因的表达增强作物的耐热性[26].AtHsfA8作为应激反应转录网络中的氧化还原反应转录因子,和AtHsfA9是由种子特异性转录因子调控的吗ABI3只在种子发育的后期表达[27,28,29].
与A类Hsfs相比,B类Hsfs的功能不太明确。B类Hsfs与A类Hsfs在蛋白结构上有显著差异,包括B1-B4。它们不包含核输出信号和激活结构域,因此本身不具有转录激活活性[30.].在拟南芥,HsfB1而且HsfB2b在非应激细胞和应激恢复过程中作为HSR基因的抑制剂,但在热应激下是热应激诱导的热休克蛋白基因表达所必需的,hsfb1-hsfb2b敲除突变体表现出比野生型更高的基础耐热性[31,32].HsfB1是热应激反应的核心调节因子,并发挥双重作用,作为转录辅激活因子和一般抑制因子HsfA1a在tomato中[33].HsfB2b对非生物应激反应的生物钟通过抑制PRR7[34].而HsfB3而且HsfB4只报告了细胞死亡拟南芥[35].C类Hsfs包括C1和C2。关于HsfC的研究较少,如过表达FaHsfC1b基因提高了植物的耐热性拟南芥[36].
玉米作为农业种植的粮食和饲料作物之一,在适宜的生长环境下有利于其高产优质[37,38].因此,对玉米耐高温机理的研究显得尤为重要。的Hsf基因家族在玉米对高温胁迫的响应中起着重要的调控作用,但对其功能的研究较少HsfB基因,只增强了敏感度ZmHsfB1盐害和干旱已被报道[39].在本研究中,来自玉米的B类Hsfs成员被称为ZmHsf11克隆并鉴定了其对高温胁迫的响应功能。我们发现高温诱导表达上调ZmHsf11,该蛋白定位于细胞核内,无转录自激活活性。尤其是过度表达ZmHsf11在拟南芥和水稻显著提高了转基因植株的高温胁迫敏感性,降低了ABA敏感性,降低了氧化胁迫相关基因的表达,降低了脯氨酸含量,增加了H2O2大米的含量,暗示ZmHsf11负调节植物耐高温能力。
结果
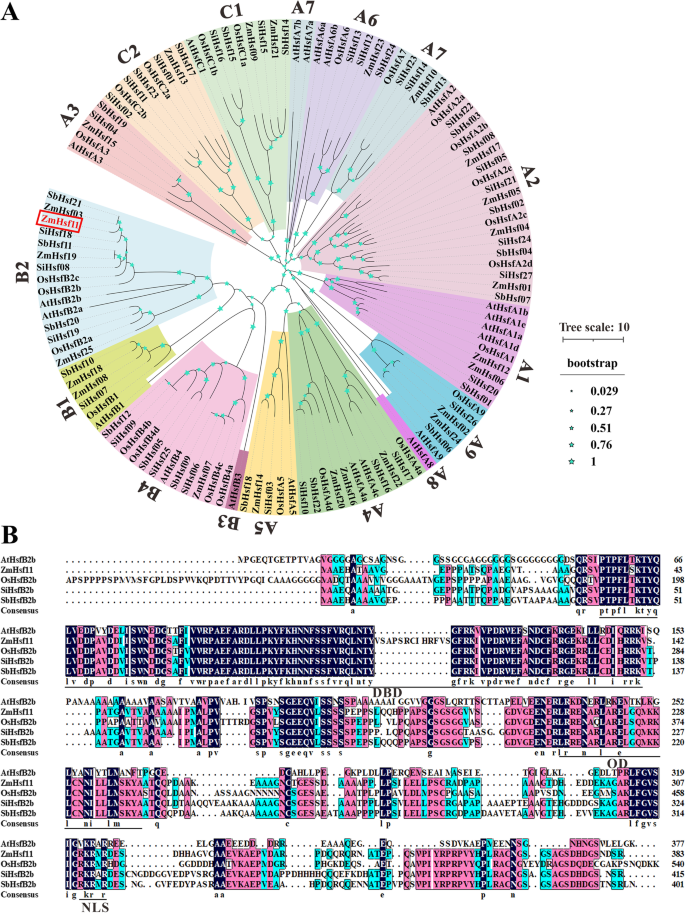
的鉴定和序列分析ZmHsf11
的全长cDNAZmHsf11该基因从玉米自交系B73中获得,包含1113 bp的开放阅读框。该ORF编码370 aa蛋白,预测分子量为39.56 kDa,等电点为5.89。系统发育分析Hsf基因家族拟南芥大米、高粱、小米和玉米揭示了这一点ZmHsf11属于HsfB2亚家族,与ZmHsf03而且SbHsf21(SbHsfB2b)(图。1A).多次序列比对表明ZmHsf11与其他同源基因的保守结构域高度相似拟南芥和其他单克隆体(图5)。1B). Lin等认为ZmHsf11蛋白分别含有n端DNA结合域(DBD)、寡聚化域(OD)和核定位信号域(NLS)(图4)。1B) (40].这些结果表明ZmHsf11是玉米中HsfB2的一个成员。
表达分析ZmHsf11在玉米
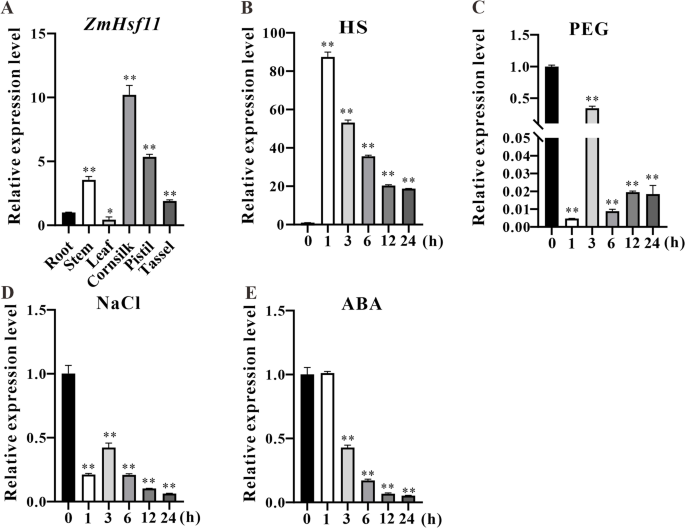
许多研究已经证明了这一点Hsf基因在应激反应中起着广泛而重要的作用。因此,要探讨的功能ZmHsf11我们研究了基因的表达模式ZmHsf11在不同组织和不同胁迫处理下进行RT-qPCR分析。选取不同生育期玉米的根、茎、叶、玉米丝、雌蕊和穗等组织。组织特异性表达分析显示ZmHsf11该基因在玉米6个组织中均有表达,但在玉米茎、玉米丝和雌蕊中的表达量显著高于其他组织,在叶片中的表达量显著低于其他组织(图5)。2A).随后的表达模式ZmHsf11在不同的应力下进行了研究。在热处理下,表达ZmHsf11先增加后减少(图5)。2B). ZmHsf11在热应激1 h时表达量最高,是未处理组的85倍,之后表达量逐渐下降(图1)。2B).在PEG、NaCl和ABA处理下ZmHsf11基因含量基本低于未处理组(图。2C, D和E).以上结果表明ZmHsf11潜在参与非生物应激途径,如HS。但其如何参与这些途径的调控机制还有待进一步探索。
ZmHsf11的亚细胞定位
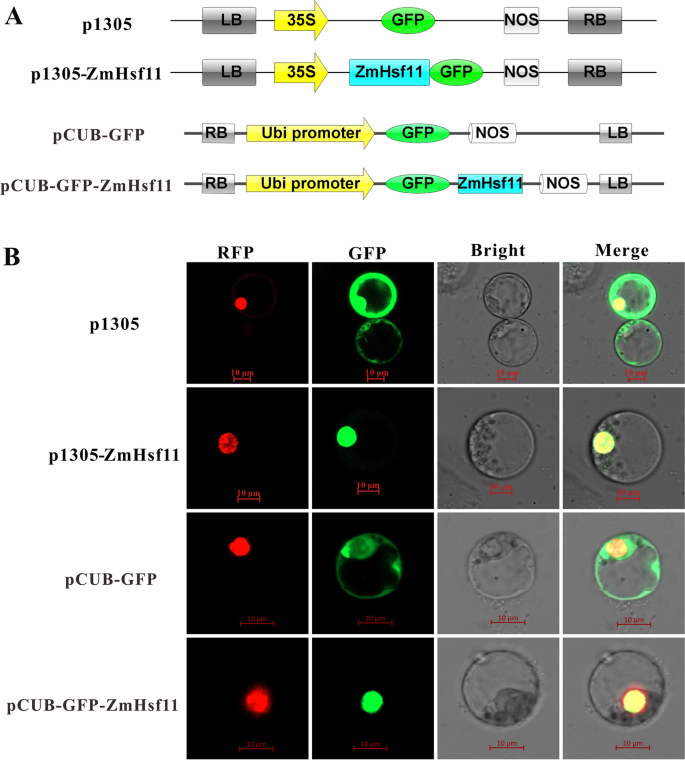
有报道称热休克因子(Hsf)含有细胞核定位信号(NLS), ZmHsf11蛋白被预测为位于细胞核的蛋白。为了研究ZmHsf11的亚细胞定位,我们构建了包含c端和n端绿色荧光蛋白(GFP)和GFP对照蛋白的融合蛋白,这些蛋白分别与核定位标记pSAT6:mCherry (RFP):VirD2NLS (mCherry)共转染。GFP信号仅在含有ZmHsf11-GFP和GFP- zmhsf11融合蛋白的细胞核中观察到(图1)。3.B).对于GFP控制蛋白,在整个细胞中发现了GFP信号。结果表明,ZmHsf11蛋白定位于细胞核。
转录自激活活性ZmHsf11
根据以前的报道,ZmHsf11为HsfB家族成员,无转录自激活活性。因此,我们使用GAL4体系重组pGBKT7ZmHsf11基因,以确定其是否具有转录自激活活性。含有酵母的ZmHsf11在缺陷培养基SD/Trp−His - Ade−/X-α-gal上生长良好,在缺陷培养基SD/Trp−His - Ade−/X-α-gal上生长不良,与阴性对照一致,阳性对照空斑在缺陷培养基SD/Trp−His - Ade−/X-α-gal上生长呈蓝色。4).这些结果表明ZmHsf11在酵母中无转录自激活活性。
过度的ZmHsf11在拟南芥降低对热应激的耐受力
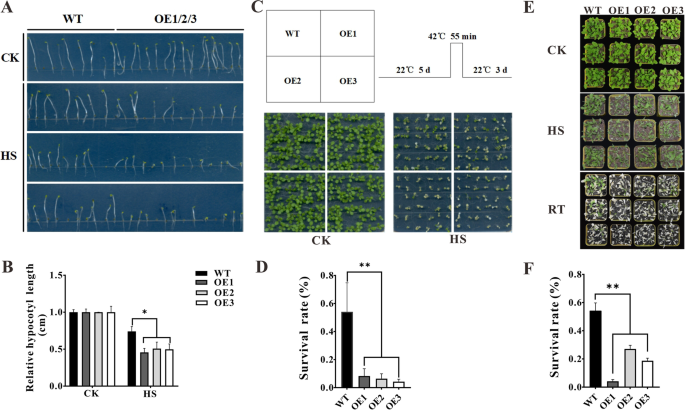
确定…的作用ZmHsf11我们改造了植物对热胁迫反应的基因ZmHsf11过表达式向量拟南芥,得到三个过表达拟南芥线(OE1, OE2, OE3)(图S1).过表达的下胚轴ZmHsf11对品系和野生型植株进行热休克处理。过表达的下胚轴ZmHsf11系和野生型植株在MS培养基中22℃暗培养40 h, 45℃热休克培养1 h, 22℃暗光恢复培养4 d。热处理后,下胚轴长度过表达ZmHsf11株系明显低于野生型(图5)。5A和B)。进一步研究过表达的植物是否ZmHsf11在拟南芥对热敏感的幼苗,分别对生长5 d和20 d的幼苗进行热处理。结果表明,过表达植株的存活率明显低于野生型(图5)。5C, D, E和F)。因此,这些结果提示过表达ZmHsf11在拟南芥降低了公差拟南芥热应激。
过度的ZmHsf11在水稻中减少对热胁迫的耐受性
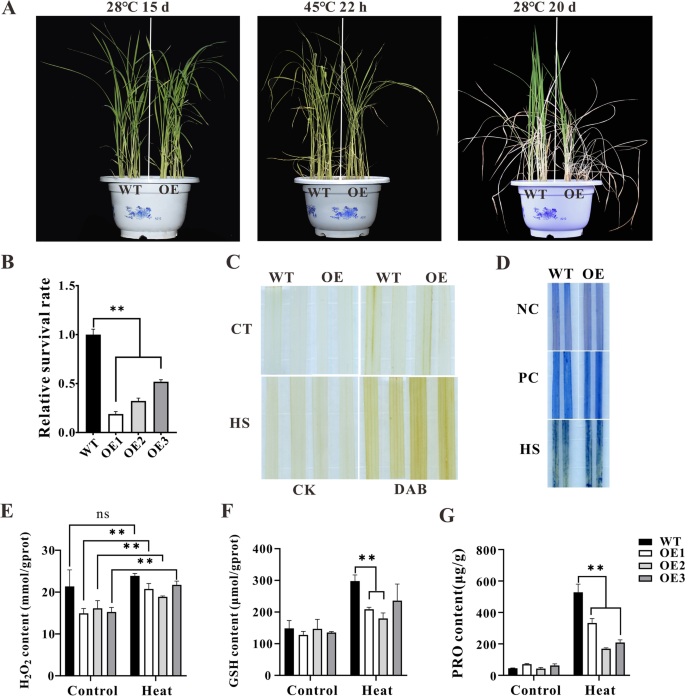
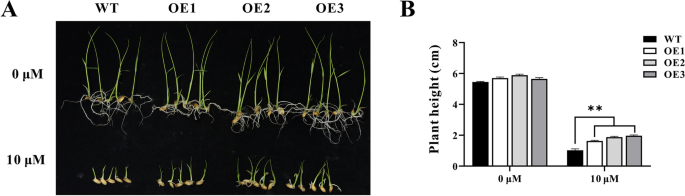
进一步研究ZmHsf11在植物的热敏感性上,我们继续过度表达ZmHsf11获得3个转基因阳性水稻株系OE1, OE2, OE3(图S2).首先,在正常和热胁迫条件下进行种子萌发实验。热胁迫发芽3 d, 28℃恢复5 d后,测定株高,评价转基因和野生型水稻在萌发期的耐热性。以28℃萌发8 d的种子作为对照。结果表明,在对照条件下,只有o1型水稻株高显著低于野生型水稻。而在HS处理下,3株转基因植株的株高均显著低于野生型植株,说明过表达ZmHsf11基因增加了水稻植株在萌发过程中对热胁迫的敏感性(图S3.).为了进一步研究过表达水稻对高温的敏感性,我们对转基因植株在苗期进行了热处理。在正常条件下,转基因和野生型植株幼苗之间无显著差异。过表达和野生型水稻株系在28°C生长15 d后,在45°C热处理22 h,在28°C恢复20 d后,结果表明,过表达水稻株系的相对存活率明显低于野生型(图1)。6A和B)。考虑到胁迫会导致植物体内ROS的积累,我们研究了H2O2经DAB染色后,野生型和转基因植株的H2O2含量和谷胱甘肽含量测定。正常条件下,H含量无显著差异2O2野生型与转基因植物之间的含量。在热胁迫下,转基因植株积累的H2O2与野生型相比(图。6C, E和F).热应激可在一定程度上导致细胞膜损伤和细胞死亡。台盼蓝染色实验显示,在热胁迫下,转基因植株比野生型植株的细胞死亡增加(图1)。6D)。此外,我们还测试了野生型和转基因植物的脯氨酸(PRO)含量,经过热处理后转基因植物的脯氨酸(PRO)含量明显低于野生型(图5)。6G).高温胁迫下,光合速率和气孔导度等光合属性降低。结果表明,热处理后转基因植株的净光合速率和气孔导度均低于野生型,但无显著差异。(无花果。4).以上结果与前面的结果一致拟南芥,表明过表达ZmHsf11基因降低了水稻植株对高温胁迫的耐受性。
过度的ZmHsf11转基因植物对ABA胁迫的敏感性降低
植物激素ABA在植物对高温等非生物胁迫的响应中起着重要作用。调查是否ZmHsf11是通过ABA途径调节植物的热敏性的,我们处理种子发芽ZmHsf11过表达拟南芥分别为0.75 μ M和10 μ M ABA的水稻植株。结果表明,种子发芽率ZmHsf11基因拟南芥过表达系高于野生型,过表达系株高显著高于野生型,说明ZmHsf11基因可能通过参与ABA通路来调控植物的热胁迫反应(图5。年代5而且7).
胁迫相关基因表达分析ZmHsf11在转基因水稻中
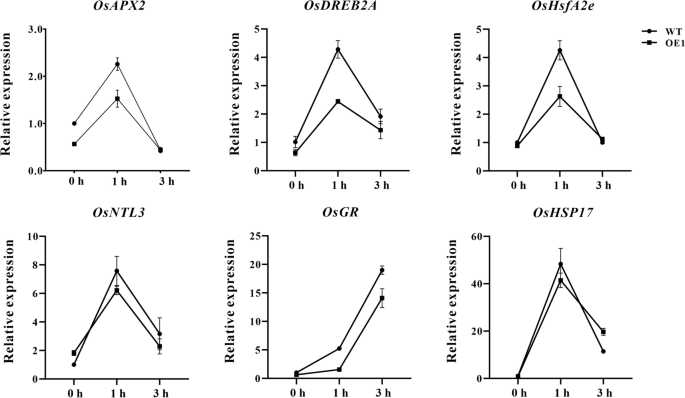
进一步探讨其功能分子机制ZmHsf11在热应激下,检测氧化应激相关基因的表达DREB2A, HsfA2e, NTL3, HSP17, HSP18, GR, APX2而且Rab7RT-qPCR法测定。在正常生长条件下,这些基因的表达无显著差异ZmHsf11过表达和野生型水稻。然而,在热处理下,表达水平APX2、DREB2A、HsfA2e、NTL3、GR而且HSP17转基因水稻中的蛋白质含量明显低于野生型水稻(图5)。8).另外两个基因的转录水平(HSP18而且Rab7)没有显著变化(数据未显示)。这些结果表明ZmHsf11负调控氧化应激相关基因APX2、DREB2A、HsfA2e、NTL3、GR而且HSP17在热应激下。
讨论
植物通过复杂的信号网络响应各种环境胁迫,热休克转录因子(Hsfs)在植物对非生物胁迫的响应中起着至关重要的作用。A类Hsfs在c端含有AHA激活域,已被报道为应激耐受的正向调节因子[10,41].然而,B类Hsfs在c端含有BRD抑制域,而没有AHA激活域,被认为是应激耐受的负调节因子[42].例如,HsfB1而且HsfB2b有抑制活性和负调节的应激耐受拟南芥大豆[32,43].在玉米方面,目前的研究报告显示,这种情况很少Hsf基因成员,如A类成员ZmHsf01, ZmHsf05而且ZmHsf06非生物胁迫下的耐受性和B类成员ZmHsf08这是对盐和干旱的敏感性[39,44,45,46].在本研究中,我们报道了ZmHsf11是玉米B类Hsfs中的一种。我们的数据表明ZmHsf11可能是一个与耐高温应力有关的负调节因子。
系统发生树分析表明ZmHsf11共享同源性HsfB2其他物种的成员(图。1A),揭示ZmHsf11属于HsfB2亚科。对ZmHsf11和其他同源蛋白的氨基酸序列进行多次比对发现,ZmHsf11含有一个保守的DNA结合域(DBD)、一个中间寡聚结构域(OD)和一个核定位信号域(NLS),缺乏核输出信号域(NES)和激活结构域(AHA)(图)。1B).这可能导致其结构和功能发生变化,从而对a类构件的相反功能起到负调节作用。通过酵母转录自激活实验和原生质体瞬时表达亚细胞定位实验进一步验证了该结构。其AHA结构域的缺失使得该基因缺乏转录自激活活性,而NLS的存在使得该基因能够定位于细胞核(图。3.而且4).以上结果表明,ZmHsf11是一种高度保守的Hsf蛋白,可能需要与其他蛋白相互作用才能激活其转录能力。
研究表明hsf参与多种非生物胁迫途径和aba介导的胁迫途径。过度的FaHsfA2c高羊茅通过诱导体内热胁迫相关基因的高表达和增强光合作用能力来增强植物对热胁迫的耐受性[47].过度表达ZmHsf04转基因拟南芥对热和盐胁迫的耐受性增强[48].的HsfA6b在拟南芥通过aba介导途径增强植物对热、盐和干旱胁迫的耐受性[49].的MdHSFA8a促进类黄酮的积累,去除活性氧,从而提高植物的耐旱性[50].拟南芥HsfB1而且HsfB2b调节防御素基因的表达Pdf1.2 a / b在植物中明显增强了抗病能力hsfb1-hsfb2b双突变体[31].在本研究中,我们观察了ZmHsf11在不同的非生物胁迫和ABA激素处理下ZmHsf11对不同组织进行了调查。和其他成员一样hsf,ZmHsf11表达量也受到热应激的强烈诱导,但随着热处理时间的增加,表达量逐渐降低(图5)。2B).然而,表达ZmHsf11在NaCl、PEG和ABA处理下,其活性受到抑制(图。2C, D和E)。因此,结果表明ZmHsf11潜在地参与不同的生物过程作为负调控hsf在植物。的表达水平ZmHsf11利用组织表达模式对玉米基因进行了鉴定,结果表明ZmHsf11基因在茎、玉米丝和雌蕊中均有高表达。2A),这可能表明ZmHsf11基因参与植物生长发育,调控生殖器官组织对热胁迫的响应。
确定…的功能ZmHsf11植物对热胁迫反应的基因,ZmHsf11基因在拟南芥和米饭。与野生型相比,过表达ZmHsf11基因降低了转基因植物对热胁迫的耐受性(图5。5而且6A, B和S3.).这可能与热胁迫后植物体内ROS的积累有关[51].活性氧(ROS)在植物适应非生物胁迫中发挥关键作用[52].ROS在细胞内增加,对细胞膜、蛋白质、RNA和DNA分子造成氧化损伤,甚至对细胞造成氧化损伤[53].因此,高温胁迫下活性氧的调控至关重要。脯氨酸是一种重要的抗氧化剂,可以减少压力条件下的氧化损伤[54].在本研究中,转基因水稻积累了更多的H2O2热处理后(图。6C、E和F),脯氨酸含量显著低于野生型(图1)。6G).同时,热应激可在一定程度上引起细胞膜损伤和细胞死亡。台盼蓝染色显示,热胁迫下转基因植物的细胞死亡明显增加(图4)。6D).因此,这些结果解释了ZmHsf11可能在植物对热胁迫的反应中起负调控作用。ABA信号通路已被报道与干旱、盐和高温等非生物胁迫有关[55,56].在本研究中,诱导表达模式分析表明ZmHsf11对热休克和ABA有相似的表达趋势(图。2B和E),和ZmHsf11转基因植物在种子萌发过程中对ABA也不敏感。7和图S4).这些结果可能揭示了高温和ABA等非生物胁迫的串联作用,从而调节了胁迫条件下植物的内稳态。这种猜测还有待进一步的实验来探索。
探讨过表达植物耐热性降低的分子机制ZmHsf11,我们研究了一些氧化应激相关基因的表达DREB2A, HsfA2e, NTL3, HSP17, HSP18, GR, APX2而且Rab7在大米。含有DREB基因在干旱、高盐和低温响应基因的表达中发挥了积极作用[57].OsHsfA2e转基因植物的耐热和耐盐性增强[58].OsNTL3调节参与ER蛋白折叠等过程的基因表达,从而调节植物的耐热性[59].过度的OsHsp17而且OsHsp18增强水稻对非生物胁迫的抗性[60,61].OsGR提高酵母菌株的耐热性[62].APX2是一种多效蛋白参与了H2O2体内平衡、叶绿体保护、植物形态和育性的维持[63].过度的OsRab7基因提高了水稻的耐旱性和耐热性,从而提高了水稻产量[64].在热应激下,表达水平APX2、DREB2A、HsfA2e、NTL3、GR而且HSP17在转基因水稻中减少了,这表明ZmHsf11可能会负调控氧化应激相关基因(图。8).这些结果表明ZmHsf11通过抑制氧化应激相关基因的表达水平负向调节热应激反应。
结论
玉米HsfB2成员,ZmHsf11,被克隆并鉴定。过度的ZmHsf11基因拟南芥水稻通过负向调节氧化应激相关基因的表达来降低植物对热胁迫的耐受性,这也与ROS水平的积累和脯氨酸含量的降低有关。
材料与方法
植物材料和胁迫处理
玉米B73自交系在28℃/24℃光照条件下16/8 h的温室中萌发生长14 d,然后在42℃、200 mM NaCl、20% PEG6000和100µM ABA处理。每个处理分别在0 h、1 h、3 h、6 h、12 h和24 h采集样品。同时取根、茎、叶样品,生长到开花期分别取玉米丝、雌蕊、流苏,每个样品3株混合取样,液氮速冻,-80℃保存,提取RNA。
转基因水稻中花11号与大棚玉米生长一致。哥伦比亚型用于转基因拟南芥在22℃/20℃,16/8 h光/暗条件下生长。拟南芥种子在MS培养基上生长和鉴定,然后在14 d时转移到泥炭和蛭石的混合物上。
克隆及序列分析ZmHsf11
植物基因组数据库网站(https://phytozome.jgi.doe.gov/pz/portal.html)、玉米CDS全长序列和氨基酸序列ZmHsf11获得基因。的氨基酸序列ZmHsf11同源基因从NCBI网站(https://www.ncbi.nlm.nih.gov/).的氨基酸序列ZmHsf11由ExPASy网站(https://web.expasy.org/protparam/),和的序列ZmHsf11及其同源基因用DNAMAN软件比较[65].氨基酸序列Hsf基因家族拟南芥、水稻、高粱、小米和玉米,均使用Phytozome (https://phytozome-next.jgi.doe.gov/pz/portal.html)及Pfam网站(http://pfam.xfam.org/).利用MEGA X软件,采用NJ方法构建系统发育树,并进行自举分析,共1000次重复[66].根据获得的全长cDNA序列ZmHsf11的特异性引物ZmHsf11基因用Primer5软件进行设计,得到全长ZmHsf11PCR法扩增基因。PCR产物被纯化并克隆到pasy - blunt简单载体中进行测序。ZmHsf11-F和ZmHsf11-R的引物见补充表S1.
定量实时PCR和半实时PCR分析
用RNA分离器Total RNA Extraction Reagent (Vazyme R401-01)用Trizol法提取总RNA,用HiScript III RT SuperMix for qPCR (+ gDNA wiper) (Vazyme R323-01)合成RT-qPCR的cDNA,用HiScript III 1st Strand cDNA Synthesis Kit (+ gDNA wiper) (Vazyme R312-01)合成RT-qPCR的cDNA。RT-qPCR使用LightCycler480仪器(Roche)上的AceQ qPCR SYBR Green Master Mix (Vazyme Q111-02)进行。用GAPDH和Actin基因作为玉米的内控基因。相对表达量用2−ΔΔCT方法(67].RT-qPCR所用引物均见补充表S1。
ZmHsf11蛋白的亚细胞定位
的编码序列ZmHsf11采用双消化法(Xba I/Sma I)将无终止子的基因连接到p1305-GFP载体上ZmHsf11采用同源重组法将基因连接到pCUB-GFP载体上,引物见补充表S1。利用瞬时转化技术将p1305-ZmHsf11-GFP、pCUB-GFP- ZmHsf11重组质粒和p1305-GFP、pCUB-GFP空载体与核定位信号质粒pSAT6:mCherry (RFP):VirD2NLS共转化为原生质体。在28°C黑暗培养18小时后,用激光扫描显微镜(LSM800,卡尔蔡司,耶拿,德国)观察原生质体。
酵母转录自激活活性测定
的编码序列ZmHsf11利用EcoR I限制性内切酶和ClonExpress II One Step Cloning Kit (Vazyme C112-01)将基因同源重组到pGBKT7载体中,引物见补充表S1。采用PEG/LiAc法将重组质粒pGBKT7-ZmHsf11转化为酵母菌株Y2H Gold。阳性对照为pGBKT7-53和pGADT7-T,阴性对照为pGBKT7载体。将转化后的酵母细胞分别在SD/Trp−和SD/Trp−Leu - Ade−/X-α-Gal平板上连续稀释,30°C暗处培养3 d。
一代的ZmHsf11转基因植物
为构造过表达向量,将编码序列ZmHsf11通过双消化法(Kpn I/Pst I)将基因与本实验修饰的p1301a载体连接,得到重组质粒p1301a-ZmHsf11.将重组质粒转入拟南芥用农杆菌介导的方法获得转基因T0一代植物。转基因T1代植株经湿霉素、GUS染色和半实时PCR法筛选,获得多个阳性系。三种过度表达拟南芥选择OE1、OE2、OE3水稻株系进行培养,获得T3.纯合子过表达植物用于后续实验。
热应力耐受性试验
T的种子3.生成三种过表达菌株和野生型拟南芥放在MS板上并密封。每块平板垂直放置,用锡箔包裹,在22°C/20°C的黑暗条件下生长2 d,然后在黑暗的人工气候箱中45°C热处理1 h,再用锡箔包裹,放置在温室中黑暗生长3-4 d。观察不同菌株的下胚轴长度并统计数据。
T的种子3.生成三种过表达菌株和野生型拟南芥放在MS板上并密封。每个盘子水平放置,每个种植点放置36颗种子。种子在22°C /20°C的16/8 h明暗温室中生长5 d, 42°C水浴55 min,冷却至室温后放回温室约3 d,观察不同品系幼苗的成活率并进行统计。
三个拟南芥过表达线T3.代种子和野生型在MS板上22°C/20°C, 16/8 h,明暗温室培养10 d,然后移栽到蛭石:黑土= 2:1的花盆中,继续生长10 d,采用人工气候室,在45°C光照条件下,6.5 h处理,更换在温室中恢复培养4-5 d,观察不同品系幼苗的成活率,并进行统计数据。
T的种子3.将3个过表达水稻株系和中华11号野生型种子充分膨大,置于35°C中温处理3 d, 28°C恢复5 d。用直尺测量不同株系水稻种子株高。
T的种子3.一代大米和三行超表达的野生型的种子Zhonghua11后被移植到小圆锅8 d的萌发,被安置在一个28°C / 24°C, h, 16/8光明/黑暗温室15 d。在一个人工气候箱,光条件下45°C,治疗22 h,然后放在温室恢复培养20 d。水稻幼苗的存活率不同的观察和收集统计数据的行。
植物对热胁迫反应的生理学分析
将15日龄水稻幼苗在45°C下热处理22 h,分别测定过表达型和野生型水稻的生理特征。如Zhang等人所述,对未经处理和热处理的水稻叶片的相同部分进行DAB和台虫蓝染色。[68].过氧化氢(H2O2)、还原型谷胱甘肽(GSH)和脯氨酸(PRO)按南京建成生物工程研究所方案测定。利用光合仪CIRAS-3测定了净光合速率和气孔导度。
ABA敏感性分析
在进行春化处理拟南芥种子在含0.75 μM ABA的MS培养基上播种,每株36粒,置于拟南芥培养8 d,观察种子发芽情况,计算种子发芽率。将灭菌后的水稻种子置于无菌水中,30°C,黑暗培养2 d。然后选取大小相同的水稻种子,在28℃的温室中,在含10 μM ABA的无菌水中培养8 d,测量不同株系的高度并统计数据。
胁迫相关基因的分析ZmHsf11
氧化应激相关基因表达水平DREB2A, HsfA2e, NTL3, HSP17, HSP18, GR, APX2而且Rab7利用RT-qPCR对过表达和野生型水稻系进行分析。对于过表达系OE1和野生型水稻,分别在45°C下孵育0 h、1 h和3 h。其他步骤与上面相同。
数据和材料的可用性
在这项研究中产生或分析的所有数据都包含在这篇发表的文章及其补充信息文件中。
然而,本研究的序列数据也可以在https://www.ncbi.nlm.nih.gov/gene/?term=GRMZM2G098696.
此外,本研究使用的所有数据库均对外开放,连结如下:
Phytozome:https://data.jgi.doe.gov/refine-download/phytozome?q=Arabidopsis+thaliana
ExPASy:https://web.expasy.org/cgi-bin/protparam/protparam1?A0A804NZV2@noft@。
缩写
- Hsf:
-
热休克转录因子
- 阿坝:
-
脱落酸
- ROS:
-
活性氧种类
- H2O2:
-
过氧化氢
- 谷胱甘肽:
-
谷胱甘肽
参考文献
李普曼R, Babben S, Menger A, Delker C, Quint M.全球变暖条件下野生和栽培植物的发育。草本生物学报2019;29(24):R1326-38。
米特勒R,芬卡A,戈鲁比诺夫P.植物是如何感受到热量的?生物化学进展,2012;37(3):118-25。
Atkinson NJ, Urwin PE。植物生物和非生物胁迫的相互作用:从基因到田间。中国科学(d辑:自然科学版)2012;
曲爱莲,丁艳芳,蒋强,朱春。植物热胁迫响应的分子机制。生物化学与生物物理学报,2013;432(2):203-7。
植物ROS调控系统与其他信号在不同类型热反应调控中的整合。国际分子科学杂志2018;19(11):3370。
Cortleven A, Leuendorf JE, Frank M, Pezzetta D, Bolt S, Schmulling T.植物细胞分裂素对非生物和生物胁迫的响应。植物细胞环境学报2019;42(3):998-1018。
Albertos P, Dundar G, Schenk P, Carrera S, Cavelius P, Sieberer T, Poppenberger B.转录因子BES1与HSFA1互作促进植物耐热性EMBO J. 2022;41(3): e108664。
大滨平,佐藤红,王晓燕,王晓燕。植物热胁迫反应的转录调控网络。植物科学进展2017;22(1):53-65。
Kotak S, Larkindale J, Lee U, von Koskull-Doring P, Vierling E, Scharf KD。植物热应激反应的复杂性。植物生物学杂志2007;10(3):310-6。
Nover L, Bharti K, Doring P, Mishra SK, Ganguli A, Scharf KD。拟南芥与热应激转录因子的世界:我们需要多少热应激转录因子?细胞应激伴侣。2001;6(3):177-89。
植物热胁迫转录因子(Hsf)家族的结构、功能和进化。生物化学学报2012;1819(2):104-19。
吉田T,大滨N,中岛J,木大五郎S,水井J,中岛K,丸山K,金JM,关木M,户田d,等。拟南芥HsfA1转录因子是热休克反应基因表达的主要正调控因子。中国生物医学工程学报,2011;28(5-6):381 - 381。
大滨N,草部K,水井J,赵H, Kidokoro S,小泉S,高桥F,石田T,柳泽S,筱崎K,等。拟南芥热胁迫响应中的转录级联在转录因子表达水平上受到严格调控。植物学报,2016;28(1):181-201。
Mishra SK, Tripp J, Winkelhaus S, Tschiersch B, there K, Nover L, Scharf KD。在复杂的热胁迫转录因子家族中,HsfA1作为番茄耐热性的主调控因子具有独特的作用。基因开发2002;16(12):1555-67。
Schramm F, Ganguli A, Kiehlmann E, Englich G, Walch D, von Koskull-Doring P.热应激转录因子HsfA2在拟南芥热应激反应中作为一个基因亚群的调节放大器。植物分子生物学,2006;60(5):759-72。
张媛媛,刘慧聪,刘宁宁,迟伟,王春宁,常硕,王婷婷。拟南芥获得性耐热性的扩展需要一个热诱导转录因子,HsfA2。植物生理学报,2007;43(1):251-62。
Lamke J, Brzezinka K, Altmann S, Baurle I.打了就跑的热休克因子控制持续组蛋白甲基化和转录应激记忆。Embo j . 2016;35(2): 162-75。
Fragkostefanakis S, Mesihovic A, Simm S, Paupiere MJ, Hu Y, Paul P, Mishra SK, Tschiersch B, ' SK, Bovy A,等。HsfA2控制番茄雄性生殖组织发育和应激调节热应激保护机制的活性。植物生理学报,2016;17(4):469 - 476。
Friedrich T, Oberkofler V, Trindade I, Altmann S, Brzezinka K, Lamke J, Gorka M, Kappel C, Sokolowska E, Skirycz A等。异体HSFA2/HSFA3复合体驱动拟南芥热胁迫后的转录记忆。通信学报。2021;12(1):3426。
佐久间Y, Maruyama K,秦F, Osakabe Y, Shinozaki K, Yamaguchi-Shinozaki K.拟南芥转录因子DREB2A在水胁迫响应和热胁迫响应基因表达中的双重功能。中国科学(d辑:自然科学版),2006;32(4):369 - 369。
Schramm F, Larkindale J, Kiehlmann E, Ganguli A, Englich G, Vierling E, von Koskull-Doring P.转录因子DREB2A和热应激转录因子HsfA3级联调控拟南芥热应激反应植物学报。2008;32(2):366 - 366。
Link V, Sinha AK, Vashista P, Hofmann MG, Proels RK, eshrer, Roitsch T.番茄热激活MAP激酶:热应激反应的可能调节因子。中国生物医学工程学报,2002;531(2):179-83。
吴Z,梁J,王C,赵X, X中,曹X,李G,他J,易建联的莉莉HsfA3s m .过度拟南芥可以提高耐热性和盐敏感性通过改变脯氨酸分解代谢。J Exp Bot 2018;69(8): 2005-21。
王超,周勇,杨旭,张斌,徐峰,王勇,宋超,易敏,马宁,周旭,等。热应激转录因子LlHsfA4通过调节百合ROS代谢增强其基本耐热性国际分子科学杂志,2022;23(1):572。
Baniwal SK, Chan KY, Scharf KD, Nover L.热应激转录因子HsfA5作为HsfA4特异性抑制因子的作用。中国生物化学杂志2007;282(6):3605-13。
Poonia AK, Mishra SK, Sirohi P, Chaudhary R, Kanwar M, Germain H, Chauhan H小麦转录因子(TaHsfA6b)的过表达提供了大麦的耐热性。足底。2020;252(4):53。
吉斯古斯M,萨姆A,西蒙S,迪茨KJ。拟南芥热休克转录因子AtHSFA8从胞浆到细胞核的氧化还原依赖易位。中国生物医学工程学报2015;589(6):718-25。
郭德康,王晓燕,王晓燕,等。拟南芥种子发育过程中热胁迫蛋白表达的转录级联调控。植物细胞学报2007;19(1):182-95。
Tejedor-Cano J, Prieto-Dapena P, Almoguera C, Carranco R, Hiratsu K, Ohme-Takagi M, Jordano J. HSFA9种子长寿程序功能的丧失。植物细胞环境学报,2010;33(8):1408-17。
Kotak S, Port M, Ganguli A, Bicker F, von Koskull-Doring P.拟南芥热胁迫转录因子(Hsfs) c端结构域的表征和植物A类Hsfs与激活因子功能和细胞内定位所必需的AHA和NES基序的新特征组合的鉴定。植物学报(英文版);2004;
Kumar M, Busch W, Birke H, Kemmerling B, Nurnberger T, Schoffl F.热休克因子HsfB1和HsfB2b参与调节拟南芥Pdf1.2的表达和病原耐药性。植物学报,2009;2(1):152-65。
拟南芥HsfB1和HsfB2b作为热诱导Hsfs表达的抑制因子,但正向调节获得性耐热性。植物生理学报,2011;37(3):369 - 369。
Fragkostefanakis S, Simm S, El-Shershaby A, Hu Y, Bublak D, Mesihovic A, Darm K, Mishra SK, Tschiersch B, hers K,等。抑制因子和辅激活因子HsfB1调控番茄主要热胁迫转录因子。植物细胞环境学报2019;42(3):874-90。
Kolmos E, Chow BY, Pruneda-Paz JL, Kay SA。hsfb2介导的PRR7抑制指导生物钟的非生物应激反应。中国生物医学工程学报(自然科学版),2014;38(4):447 - 447。
Zhu X, Thalor SK, Takahashi Y, Berberich T, Kusano T.序列保守的上游开放阅读框对拟南芥HsfB1转录本主开放阅读框翻译的抑制作用植物细胞环境学报,2012;35(11):2014-30。
庄亮,曹伟,王娟,于军,杨铮,黄斌。拟南芥热耐性植物圆蕨FaHsfC1b的表达及功能分析。国际分子生物学杂志2018;19(9):2702。
刘张王H,顾L, X, M,江H, Cai R,程赵Y, b .全球转录组和加权基因co-expression网络分析揭示hybrid-specific模块和相关候选基因玉米株高发展。植物分子生物学杂志,2018;98(3):187-203。
董强,徐强,孔杰,彭旭,周伟,陈亮,吴娟,向勇,蒋辉,程斌。ZmbZIP22基因过表达改变玉米和水稻胚乳淀粉含量和组成。植物科学2019;283:407-15。
王杰,陈亮,龙勇,司伟,程斌,江华。玉米热激转录因子ZmHsf08负调控盐和干旱胁迫响应。国际分子生物学杂志,2018;22(21):11922。
林玉云,蒋海燕,褚忠祥,唐晓丽,朱士伟,程炳杰。玉米热休克转录因子家族的全基因组鉴定、分类与分析。BMC基因组学,2011;12:76。
Baniwal SK, Bharti K, Chan KY, Fauth M, Ganguli A, Kotak S, Mishra SK, Nover L, Port M, Scharf KD,等。植物的热应激反应:伴随物和20多个热应激转录因子的复杂博弈。生物科学学报2004;29(4):471-87。
czarneca - verner E, Pan S, Salem T, Gurley WB。植物B类hsf抑制转录,并表现出对TFIIB和TBP的亲和力。植物生物学杂志2004;56(1):57-75。
卞晓红,李伟,牛春芳,魏伟,胡勇,韩建强,卢鑫,陶俊杰,金敏,秦辉,等。在大豆驯化过程中选择的B类热冲击因子通过促进类黄酮的生物合成有助于大豆的耐盐性。新植物学报,2020;225(1):268-83。
PeerJ。2020; 8: e8926。
李桂莲,张海宁,邵辉,王桂英,张媛媛,张玉军,赵丽宁,郭晓玲,Sheteiwy MS:玉米(Zea mays L.)热休克转录因子ZmHsf05改善拟南芥的耐热性,弥补了突变体athsfa2的耐热性缺陷。植物生态学报,2017,32(3):379 - 379。
李慧聪,张恩恩,李桂莲,刘志华,张艳梅,张慧敏,郭晓丽。玉米热休克转录因子基因ZmHsf06的表达增强了转基因拟南芥的耐热性和抗旱性。功能植物学报,2015;42(11):1080-91。
王鑫,黄伟,刘军,杨铮,黄斌。高羊茅耐热性新基因FaHsfA2c的分子调控和生理功能。植物学报。2017;15(2):237-48。
蒋丽丽,郑庆青,陈丽,梁茵,吴金江:玉米热休克转录因子基因ZmHsf04异位过表达增强了转基因拟南芥的耐热和耐盐能力。植物生理学报2018,40(1)。
黄永春,牛春春,杨春荣,金立林。热应激因子HSFA6b与ABA信号通路和ABA介导的热应答有关。植物学报(英文版);2016;
王楠,刘伟,于玲,郭铮,陈铮,蒋森,徐辉,方辉,王勇,张铮,等。热冲击因子A8a调节黄酮合成和抗旱性。植物生理学报,2020;38(3):369 - 369。
热应激和病原体攻击下ROS调控系统与其他途径的协调。植物科学,2018;9:49。
Choudhury FK, Rivero RM, Blumwald E, Mittler R.活性氧种类,非生物胁迫和胁迫组合。植物学报(英文版);2017;
氧化应激、抗氧化剂与应激耐受性。植物学报,2002;7(9):405-10。
刘静,王云云。热胁迫下Avicennia marina红树林Am P5CS脯氨酸代谢及分子克隆生态毒理学。2020;29(6):698 - 706。
王勇,常红,胡松,陆旭,袁春,张春,王鹏,肖伟,肖林,薛培平,等。质体酪蛋白激酶2敲除降低脱落酸(ABA)敏感性、耐热性和ABA-和热应激反应核基因的表达。中国生物医学工程学报(英文版);2014;
Huque A, So W, Noh M, You MK, Shin JS。拟南芥双功能核酸酶AtBBD1过表达增强aba介导的干旱胁迫信号调控基因表达国际分子科学与分子生物学杂志,2017;22(6):2936。
Dubouzet JG, Sakuma Y, Ito Y, Kasuga M, Dubouzet EG, Miura S, Seki M, Shinozaki K, yamaguchi Shinozaki K.水稻OsDREB基因编码干旱、高盐和冷响应基因表达的转录激活子。植物学报。2003;33(4):751-63。
横谷N,市川T, Kondou Y,松井M, Hirochika H, Iwabuchi M, Oda k。转基因拟南芥中水稻热胁迫转录因子OsHsfA2e的表达增强了对环境胁迫的耐受性。足底。2008;227(5):957 - 67。
刘晓红,吕云云,杨伟,杨忠涛,卢世杰,刘建新。水稻耐热性与膜相关的NAC转录因子OsNTL3有关。植物工程学报,2020;18(5):1317 - 1329。
邹娟,刘超,刘阿,邹东,陈旭。水稻过表达OsHsp17.0和OsHsp23.7增强了耐旱耐盐能力。植物生理学报,2012;29(6):629 - 634。
邝健,刘健,梅娟,王超,胡辉,张颖,孙敏,宁欣,肖亮,杨亮:一类小热休克蛋白OsHsp18.0在水稻生物和非生物防御反应中均发挥积极作用。科学通报,2017,7(1):11333。
金IS,金YS,尹HS。来自水稻的谷胱甘肽还原酶增加了转基因酿酒酵母菌株对非生物胁迫的获得性耐受性。微生物学报。2012;22(11):1557-67。
吴斌,李玲,邱涛,张旭,崔松。胞质APX2是一种多效性蛋白,参与H2O2稳态、叶绿体保护、植株结构和育性维持。植物细胞学报2018;37(6):833-48。
El-Esawi MA, Alayafi AA:水稻Rab7基因的过表达提高了水稻的耐旱性和耐热性并提高了产量。基因学报,2019,10(1)。
Duvaud S, Gabella C, Lisacek F, Stockinger H, Ioannidis V, Durinx C. Expasy,瑞士生物信息学资源门户,由其用户设计。核酸条例2021;49(W1): W216-27。
Kumar S, Stecher G, Li M, Knyaz C, Tamura K. MEGA X:跨计算平台的分子进化遗传学分析。分子生物学与生物学报2018;35(6):1547-9。
Vandesompele J, De Preter K, Pattyn F, Poppe B, Van Roy N, De Paepe A, Speleman F:通过多个内控基因的几何平均对实时定量RT-PCR数据进行精确归一化。中国生物医学工程学报,2004,23(6):1563 - 1566。
张旭,王玲,王海华,文辉,范勇,赵军。玉米ABP9通过调节ABA信号和活性氧水平增强转基因拟南芥对多种胁迫的耐受性。植物分子生物学杂志,2011;75(4-5):365-78。
确认
不适用。
资金
本研究得到了国家科技部(2021YFF1000300)和国家自然科学基金(31771805)的资助。
作者信息
作者和隶属关系
贡献
Q.Q、Y.Z、J.Z和L.C进行实验,Q.Q和Y.Z分析数据并撰写手稿,W.S.修改手稿,H.J.构思并监督项目。所有作者都对文章做出了贡献,并批准了最终稿件。
相应的作者
道德声明
伦理批准和同意参与
所有关于植物的实验研究都符合相关的机构、国家和国际指导方针和立法。
发表同意书
不适用。
相互竞争的利益
作者声明他们没有竞争利益。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
补充信息
附加文件1:
图1所示。原图像半定量RT-PCR分析ZmHsf11WT、p1301a和3个T1拟南芥的转基因系。图2。原图像半定量RT-PCR分析ZmHsf11WT和三个T的表达水平1在水稻中产生转基因系。
附加文件2:
图S1。的识别ZmHsf11过表达阳性转基因拟南芥。(A)包含zmhsf11的过表达转换矢量示意图。(B)阳性系不同组织的GUS染色,包括种子、叶和茎、花序和角果。(C)半定量RT-PCR分析ZmHsf11野生型、p1301a载体和三个T1拟南芥的转基因系。AtActin(AtUBQ5)被用作内部控制。图S2。的识别ZmHsf11过表达阳性转基因水稻。(A)阳性系根、茎、叶不同组织的GUS染色。(B)半定量RT-PCR分析ZmHsf11野生型和三种T1在水稻中产生转基因系。OsActin(OsUBQ5)被用作内部控制。图S3。在种子萌发过程中增强热敏性ZmHsf11转基因大米。(A)野生型和转基因植物在35°C处理3 d和在28°C处理5 d后的种子萌发状态。(B)野生型和转基因植物在萌发期间的株高测量ZmHsf11转基因种子。数据为平均值±标准差(n= 15)。**P< 0.01。图S3。在种子萌发过程中增强热敏性ZmHsf11转基因大米。(A)野生型和转基因植物在35°C处理3 d和在28°C处理5 d后的种子萌发状态。(B)野生型和转基因植物在萌发期间的株高测量ZmHsf11转基因种子。数据为平均值±标准差(n= 15)。**P< 0.01。图S4。生理指标ZmHsf11热胁迫下转基因和野生型水稻。(A)净光合速率。(B)气孔导度。数据为三个独立样本重复的平均值±SDs。*,P< 0.05。图S5。拟南芥中ZmHsf11对ABA的敏感性降低。野生型和转基因植株在含0.75 μM ABA的MS培养基上生长8 d后的生长性能ZmHsf11转基因幼苗。数据为平均值±SDs (n= 36)。*,P< 0.05;**P< 0.01。表S1。本研究使用的引物序列。
权利与权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
秦,问赵,Y。,J。et al。玉米热冲击因子ZmHsf11负向调节转基因植物的热胁迫耐受性。植物生物学22, 406(2022)。https://doi.org/10.1186/s12870-022-03789-1
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-022-03789-1
关键字
- 玉米
- ZmHsf11
- 热冲击系数
- 热应力
- 氧化应激