摘要
背景
梅(李属却已)是该属唯一的木本植物李属具有花香,但香气化合物生物合成的潜在机制尚不清楚,尽管这是一个相当有趣的问题。
结果
香气差异显著的两个品种花瓣挥发物含量;李属却已“小爱”和李属却已采用气相色谱-质谱法对不同花期的香雪工粉进行了鉴定,共检测到44种挥发性化合物。其中,形成典型香气的主要物质为p .却已鉴定为丁香酚、乙酸肉桂酯、乙酸己酯和乙酸苄酯,它们的相对浓度不同导致了两种品种的感官香气差异。我们建立了两个品种花香形成关键阶段的转录组数据库,并结合花挥发物的差异分析,构建了关键香气化合物生物合成的调控网络。结果表明:PmPAL酶和PmMYB4转录因子在调节这些化合物的关键生物合成前体的积累中起着重要作用。细胞色素p450和短链脱氢酶/还原酶也可能通过调节苯甲醛和苯甲醇等关键前体的产生来影响乙酸苄酯的生物合成。此外,通过类比,在拟南芥,我们预测了三个PmCAD基因,两4 cl基因,三CCR基因和二IGS这些基因对肉桂酸酯和丁香酚的合成都有重要的贡献p .却已.这一分析还表明,下游基因PmBGLU18-like,PmUGT71A16和PmUGT73C6参与的矩阵约束和波动状态的调节p .却已芳香化合物。
结论
这些发现为进一步探索植物中花香化合物的生物合成途径提供了潜在的新支点p .却已,为木本植物香气诱导及调控机制的研究提供新的思路。
背景
花卉释放的香气是观赏植物品质的一个重要方面[1],并由植物挥发性有机化合物(VOCs)的存在引起。这些是植物次生代谢物[2],主要由芳香化合物、萜烯、脂肪酸衍生物及其他低分子量挥发性化合物组成[3.].迄今为止,已在90多个植物科中鉴定出1700多种挥发性有机化合物[4].这些化合物在吸引传粉者和作为抵御其他动物和微生物的防御机制方面发挥着宝贵的作用[3.,5],还可以提高观赏植物的审美价值,有益于人体健康,并可作为化妆品、香精和调味品的组成部分[6,7].然而,香气原本是典型的李属却已通过与具有抗寒性的李、杏等亲缘品种杂交,增强其抗寒性。于是,花香扑鼻而来p .却已经常被探索[8],最近的研究集中在时间和空间的变化p .却已芳香化合物,以及这些挥发性有机化合物的分子调控机制[9,10,11].
这个物种p .却已梅花,俗称中国梅,是一种传统的观赏植物李属(蔷薇科这种花在中国的早春开花。它在中国和其他东南亚国家也是一种重要的果树,具有很高的经济价值,是唯一已知的成员李属能散发出浓郁的花香[12,13].而不同品种间的香气类型和组成有很大的差异,典型的香气物质p .却已好像是丁香酚,醋酸苄酯和醋酸己酯[14].目前的研究似乎主要集中在鉴定花的香气成分及其动态时空变化[j]。15,16].例如,乙酸苄酯和丁香酚的生物合成途径都属于更广泛的苯丙烯代谢途径,这在模式植物牵牛花和丁香花中得到了更好的表征拟南芥[17,18用苯甲醇乙酰转移酶(BEAT)催化合成乙酸苄酯,以苯甲醇和乙酰辅酶a为底物[19].
虽然一些研究已经探讨了不同植物调控花香味的分子机制p .却已品种(20.],很少有人关注不同品种花中挥发性有机化合物的差异[21,22].此外,据我们所知,目前还没有比较和分析不同基因的转录组的报道p .却已不同花期的品种。因此,我们认为研究不同植物挥发性成分的多样性很重要p .却已品种,以及利用顶空挥发物和内源提取物比较香气成分的差异[23].为了清楚地阐明挥发性有机化合物生物合成的分子机制,并在不同品种间进行比较,我们采用了转录组学和代谢组学联合分析的方法,因为这种方法已经被确立为一种有效的方法,并已在许多植物中得到应用,包括Chimonanthus早熟[24),睡莲属colorata[25].在本研究的样本收集中,花瓣采自p .却已“小爱”(LE)和p .却已“香学工分”(GF)的三个发育阶段(图2)。1a)顶空固相微萃取(HS-SPME)结合气相色谱-质谱(GC-MS)分析顶空挥发物和内源提取物。然后使用变量重要预测(VIP)评分筛选两种香气类型中的差异化合物作为生物标志物。对三个发育阶段收集的花瓣进行RNA-Seq分析,以筛选与花香合成相关的差异表达基因。此外,使用气味活性值(oav)的进一步分析能够筛选出对两种香气类型有重要贡献的几种生物标志物。最后,我们在分子水平上比较分析了两种品种香气相关成分差异表达的机制,并寻找了两种品种香气化合物的合成途径p .却已-旨在为分子育种实现特异性提供理论依据李属花香,并能提高精油的产量。
结果
主要花香成分及定性和定量分析p .却已品种
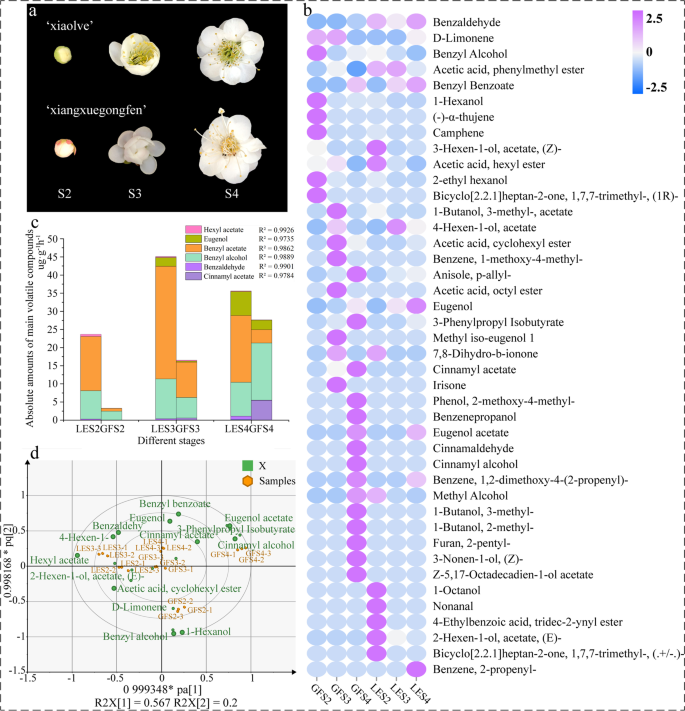
在GF的三个发育阶段共检测到36种化合物,包括12种酯类、9种醇类、4种酚类、3种萜类和2种醛类。对于LE,共检测到28种化合物,包括12种酯类、6种醇类、3种萜类、2种醛类和2种酚类。在鉴定的化合物中,15个是GF独有的,7个是LE独有的(图2)。1b和表S1).每种香气化合物在释放的总挥发性物质中所占的百分比在两者之间有所不同p .却已品种(无花果。1c).根据两者的顶空挥发物相对含量建立了OPLS-DA模型p .却已结果表明,这两种品种的顶空挥发物的差异生物标志物得到了鉴定,预测能力(Q2= 0.967),表明模型的可行性。1d) 2个品种的挥发性有机化合物中,桂皮乙酸酯、丁香酚、苯甲醇、苯甲醛和苯甲酸苄酯在开花发育各阶段的含量差异较大,这可能是造成花香差异的重要因素。结合OAV分析(表1)1),这证实了在共有芳香化合物中,乙酸苄酯、丁香酚、苯甲醛、苯甲醇和乙酸己酯的含量相对较高,这与前人对植物的特征芳香化合物的研究一致p .却已[26].
两株发育花的RNA-Seq分析p .却已具有不同花香的品种
为了探索LE和GF之间不同香味形成的分子机制,我们对在S2、S3和S4发育阶段采集的两个品种的花瓣样本进行了RNA-Seq分析,每个样本重复3次(N= 3)。因此,总共构建和分析了18个库,产生了58.49 GB的clean reads。超过97%的碱基高于Q20阈值,GC含量高于46%(表5)2),表明整体测序质量较高。
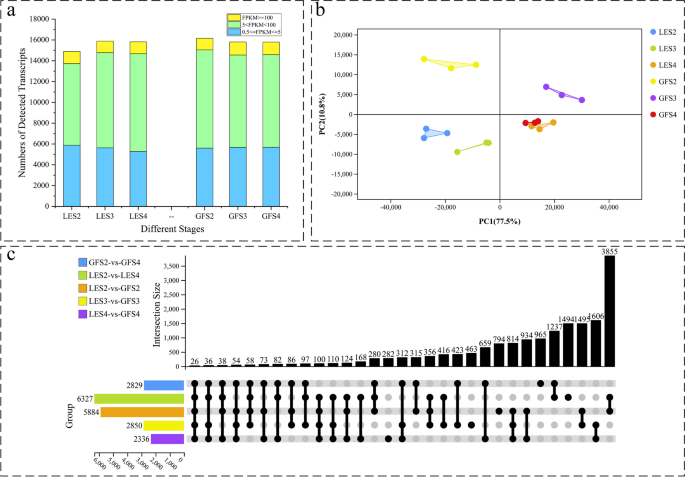
在去除FPKM < 0.5的规范化reads基因后,每个样本中表达的转录本数量如图所示。2a. GF在S2、S3和S4花期分别检测到16160、15804和15796个转录本。同样,在LE的等效样本中鉴定出14,900,15,894和15,857个转录本。大约36%的表达基因在0.5-5 FPKM范围内,57%的表达基因在5-100 FPKM范围内。RNA-Seq数据上传到国家生物技术信息中心(BioProject ID: PRJNA786063)的序列读取档案(SRA),供科学界查阅。
为了研究LE和GF开花期间转录组动力学的全球差异,我们对不同时期样本的RNA-Seq数据进行了主成分分析(PCA)。2b),可明确分为3组,分别为S2、S3和S4。S2和S3的数据在LE和GF之间聚类差异显著,说明这些花期的转录程序在不同品种之间存在较大差异。与GF相比,LE的S2和S3的分组更接近,这表明前者这两个发育时期的转录相关性更密切。在S4阶段,LE和GF的数据聚集在一起,表明它们在该阶段的转录程序高度相似;因此,在S2和S3上观察到的更大的转录差异可能解释了两者不同的花香p .却已品种。
差异表达基因的鉴定和富集分析
两两比较各发育阶段的生长量和生长量。在每个比较中,以FPKM > 5、FDR < 0.01、log为限制条件筛选差异表达基因(deg)2Fold change > 1或<−1。结果显示,LE和GF在S2、S3和S4期分别有5884、2850和2336个基因的差异表达(图2)。2c).为了进一步筛选与花香气形成相关的基因,对S2和S4两个重要花期进行两两比较,鉴定出GF和LE在这两个花期之间分别有2829和6327个基因。
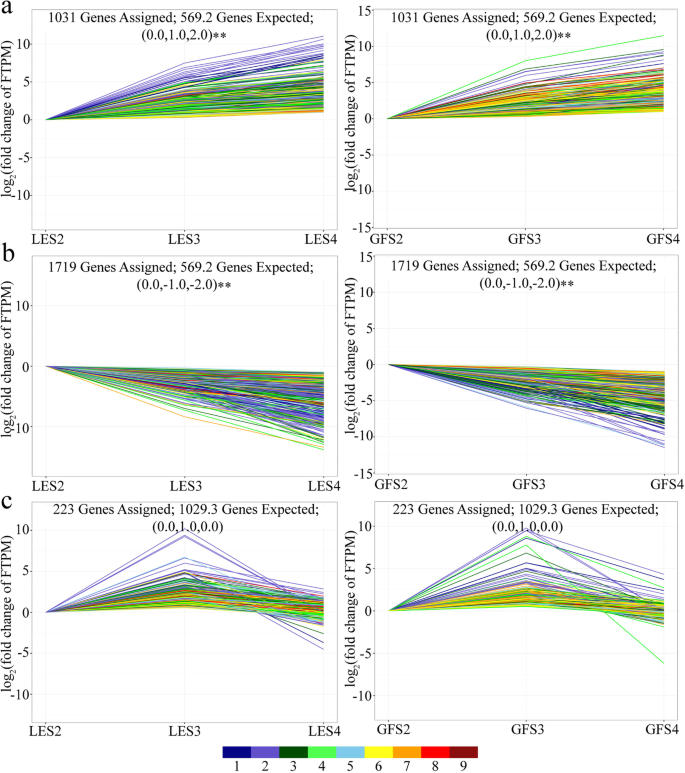
根据其表达谱,2973个deg被分配到三组(I, II, III)之一,分别由1031,1719和223个个体基因组成。前两组的基因随着开花阶段的进展而上调(I组)或下调(II组),而III组的基因在S2和S3之间上调,但在S3和S4之间下调(图2)。3.).
此外,对鉴定的deg进行基因本体(GO)富集分析,主要GO类别如图5所示1.在生物过程、分子功能和细胞成分三个功能类别中,共获得了8980个deg的50个GO注释。主要术语(括号中有相关的基因数量)包括代谢过程(5667)、催化活性(5310)、细胞过程(4945)、单一组织过程(3880)、结合(3800)、细胞(2901)和细胞部分(2901)。这些基因的氧化石墨烯注释可能有助于确定花香气产生和释放的分子机制。
为了鉴定代谢或信号通路中显著富集的相关基因,我们将S2、S3和S4期的deg分别映射到KEGG数据库中。在三个花期,KEGG PATHWAY数据库中分别富集了1618、1095和1059个deg。其中,不同时期deg注释较多的代谢途径是代谢途径、次生代谢物生物合成、核糖体、氨基酸生物合成、植物激素信号转导、苯丙素生物合成、戊糖和葡萄糖酸盐相互转化(图5)2).
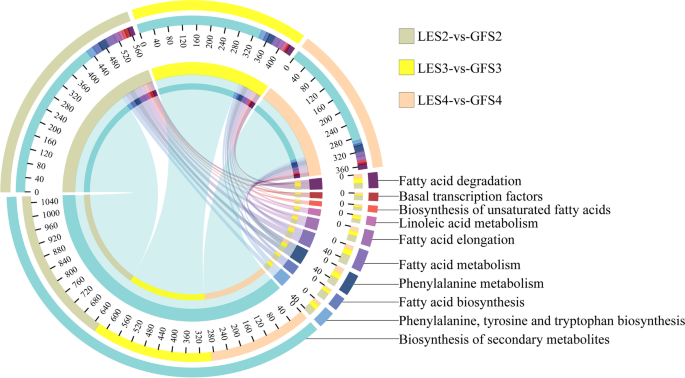
如上所述,植物香气成分主要包括萜类、芳香类和脂肪族化合物。根据已知的与这三种物质合成相关的代谢途径,在GF和LE的S2、S3和S4时期分别鉴定出了739、614和504个与13种代谢途径相关的degs(图2)。4).在三个花期,与芳香化合物生物合成相关的代谢途径是:次生代谢物的生物合成;phenylpropanoid生物合成;脂肪酸代谢;苯丙氨酸,酪氨酸和色氨酸的生物合成。
不同发育阶段与花香气代谢调控相关基因的鉴定
然后对GF和LE三个花期进行了更详细的比较。通过与S3和S4的比较,进一步筛选S2阶段各品种间表达有显著差异的基因(表S)3.), S2富集的DEGs的通路分类如图所示。5a.在这个花期,两个品种中大量的转录因子(TFs)和与花挥发物代谢相关的基因都高度富集,包括苯丙氨酸代谢、脂肪酸生物合成和苯丙氨酸生物合成的蛋白质编码基因,这表明包括苯丙氨酸生物合成和脂肪酸代谢的调控网络控制着两种品种香气化合物的合成李属品种。类似的分析发现,基因在S3处显著过表达(图2)。5b、表53.)和S4(图4)。5c、表53.);筛选出三个花期品种间表达差异较大的deg,并对其进行功能富集和分类(图2)。5d、表53.).
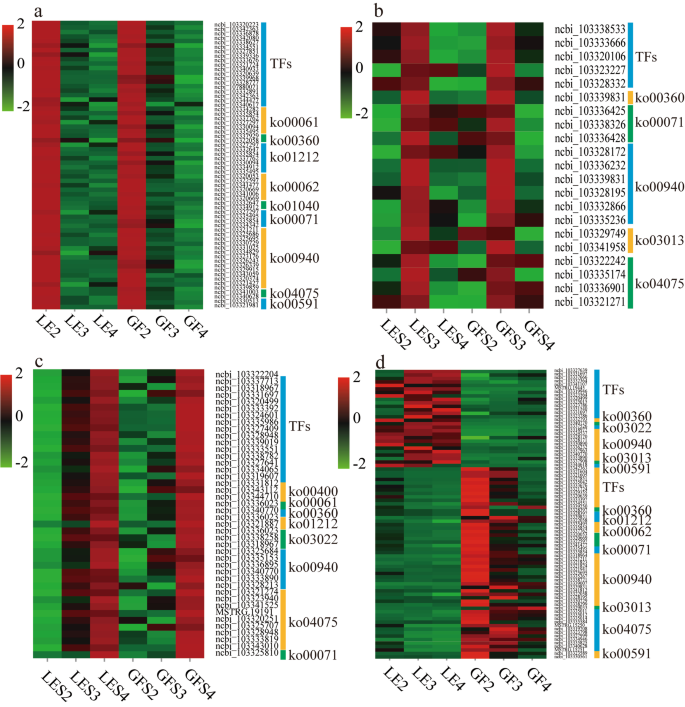
不同花期通过富集分析鉴定出的deg热图图,显示了S2 (一个), s3 (b)、s4 (c);在LE与GF (d).与每个KEGG术语相关的路径名称见补充表4.热图的颜色范围为自然对数刻度,从绿色(值,−2)到红色(值,+ 2)
基因共表达网络构建
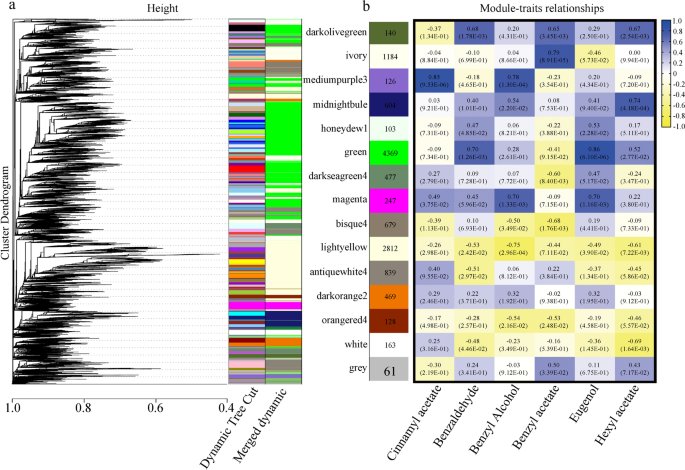
利用加权基因相关网络分析(Weighted gene correlation network analysis, WGCNA)全面了解GF和LE在不同发育阶段表达的基因,并鉴定与花挥发物合成相关的特定基因。筛选低表达基因(FPKM < 0.05)后,WGCNA保留了12401个基因。基于所有样本中基因表达的两两相关,构建了共表达网络。该分析确定了15个不同的共表达模块(图2)。6a),其中七种颜色(中等颜色3、淡黄色4、绿色、浅黄色、象牙色、午夜蓝和白色)与开花期间花挥发物含量的变化显著相关(图2)。6b).更具体地说,肉桂乙酸酯和苯甲醇含量与medium - people3模块基因表达高度正相关;乙酸肉桂酯和乙酸苄酯与bisque4模块基因表达呈负相关;苯甲醛和丁香酚与绿色模块基因转录丰度呈正相关;乙酸苄、苯甲醛、苯甲醇和丁香酚与淡黄色模块呈负相关;乙酸苄酯与象牙模块基因表达呈高度正相关。最后,乙酸己酯与午夜蓝色模块呈高度正相关,与白色模块呈负相关。基于这7个模块的基因与花挥发物的相关性,以及上文所述的花香气化合物合成代谢的KEGG PATHWAY富集结果,我们共鉴定出957个可能与花挥发物生物合成相关的结构基因。这些基因的表达模式与其他重要香气化合物含量的变化相关,以找到可能对这些挥发物的生物合成重要的特定结构基因(补充图5)3.).例如,人们发现基因液态氧,抗利尿激素,计算机辅助设计,HPL和BAHD可能参与合成醋酸己酯,这是一种重要的挥发性有机化合物p .却已.
已知花挥发物生物合成相关基因的分析
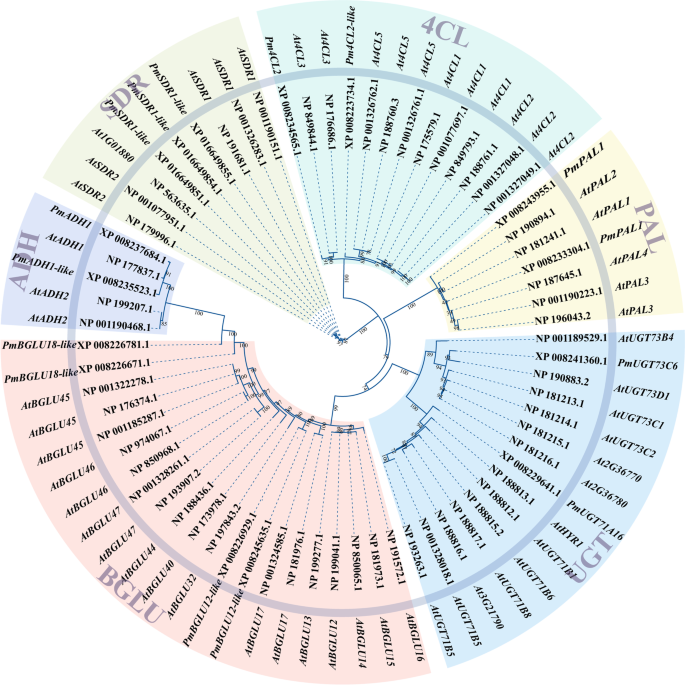
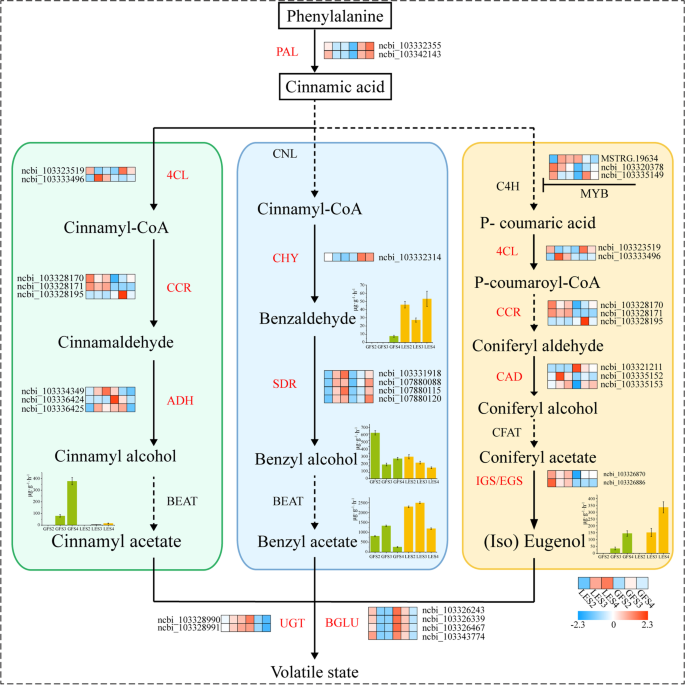
结合GO富集、KEGG PATHWAY富集和DEGs的WGCNA分析结果,获得了一组可能直接参与生物合成的101个基因p .却已芳香化合物。专门研究醋酸肉桂酯、醋酸苄酯和(异)丁香酚的生物合成途径,并找到在这些途径中起重要作用的基因p .却已-利用HMMER 3.0的phmmer功能搜索关键编码酶。植物中含苯芳香化合物的生物合成通常从莽草酸开始,莽草酸通过莽草酸途径(涉及芳香化)转化为苯丙氨酸;跨越初级代谢和次级代谢界限的过程。在此,通过比较推定的必需基因的蛋白质序列,构建了一个系统发育树p .却已香味形成与他们验证的同系物拟南芥(无花果。7).结果表明,两者P. mume ADH(PmADH2个基因拟南芥(AtADH)基因属于同一分支;这三个PmSDR1-like和AtSDR1蛋白质序列非常相似;和序列之间的相似性Pm4CL2和At4CL3是很高的。同时,朋友基因之间普遍具有较高的序列同源性李属和拟南芥物种。的基因PmUGT73C6-like和AtUGT73D簇生在一枝上,然而PmBGLU18-like与AtBGLU45和AtBGLU46与花的香气挥发有关的基因已被证实拟南芥[27].
苯丙氨酸解氨酶(PAL)催化苯丙氨酸脱氨生成反式-肉桂酸,苯丙类生物合成的主要和关键步骤。有两个PmPALncbi_103332355和ncbi_103342143基因的比较转录组差异显著(表5)5).此外,苯丙氨酸的利用分为两种不同的途径来合成苯丙氨酸相关化合物或其他苯化合物。我们使用了特征答:芥基因从这些途径作为诱饵来搜索p .却已基因组发现了三个PmCAD,两个Pm4CL,两个PmCCR,两个PmADH,四个PmSDR和三个PmCYP基因(表5)5).其中,的表达模式PmCCR与挥发性苯化合物含量呈高度正相关,且PmCCR1在LE中显著高于GF。
众所周知,β-葡萄糖苷酶(BGLU)广泛存在于各种植物组织中。其作用主要是对芳香化合物进行预水解,将植物体内的芳香物质由结合(糖基化)形式转化为游离状态,从而释放出芳香挥发物。相反,udp -糖基转移酶(UGT)的作用方向相反。目前的转录组学数据显示,总共有四种β-葡萄糖苷酶(PmBGLU)和两个udp -糖基转移酶(PmUGT)在LE和GF中的表达差异有统计学意义(表5)5).与LE相比,在S3期GF中这6个基因的表达均显著上调。
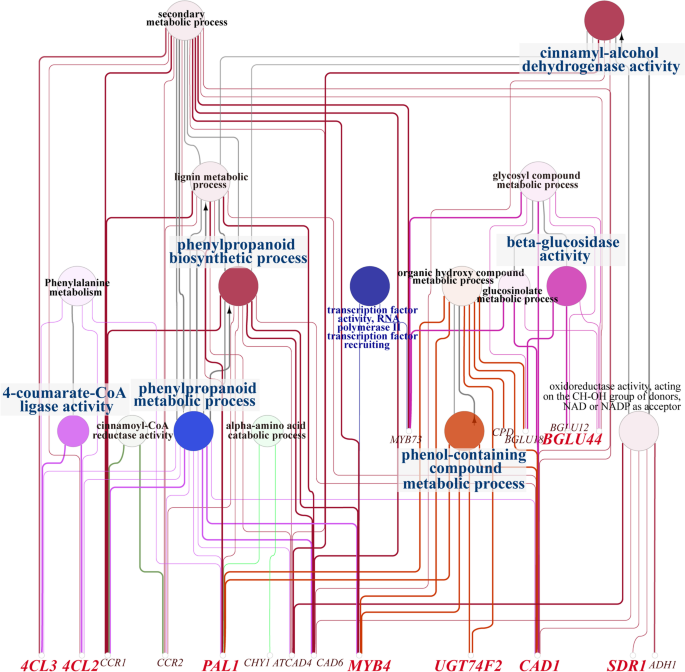
利用Cytoscape进一步分析这些基因的富集网络表明4 cl和CCR主要富集于花香上游合成过程,包括苯丙素代谢、肉桂酰辅酶A还原酶(CCR)活性和4-香豆酸辅酶A连接酶(4CL)活性(图2)。8).这两个朋友和计算机辅助设计(编码肉桂醇脱氢酶)在更广泛的过程中明显富集,包括苯丙素代谢、苯丙素生物合成过程、有机羟基化合物代谢和硫代葡萄糖苷代谢。此外,UGT和BGLU主要富集于花化合物合成的下游阶段、含酚化合物代谢过程和β-葡萄糖苷酶活性等花香气形成的关键功能。从更广泛的角度来看,在此分析中鉴定的基因和tf的GO注释有望帮助确定生物合成中关键基因之间可能的关系p .却已芳香化合物及花香化合物合成和挥发的分子机制。
结合GO富集、KEGG PATHWAY富集筛选出的关键基因[28用Cytoscape进一步分析WGCNA分析。9个关键基因MYBTFs在18个代谢过程中显著富集
关键转录因子的探索
转录因子被认为对许多次生代谢过程的适当控制至关重要。在我们的比较转录组研究中p .却已结果显示,从PlantTFDB数据库中分类的76个家族中鉴定出613个tf(包括转录调控因子)。构建差异表达tf与关键基因的互易网络(图2)8),我们惊讶地发现MYB4转录因子在含酚类化合物代谢、有机羟基化合物代谢、苯基丙烷类生物合成和苯基丙烷类代谢中富集,表明这些转录因子可能在调节挥发性化合物的生物合成中起重要作用[29].为了支持这种可能性,PmMYB4tgf在GF中表达上调。此外,MYB73硫代葡萄糖苷代谢和糖基化合物代谢显著富集PmMYB73在LE中转录下调,而在GF中转录持续上调。
考虑到这一发现涉及核心tf,特别是MYB在挥发性有机化合物的合成中,花香气形成的机理p .却已被进一步审问。结合对TFs的观察和对已验证蛋白功能的结构基因的比较,我们构建了一个潜在的花香组成基因调控网络(图2)。9),为揭示LE和GF中苯类化合物的生物合成途径奠定基础;尤其是醋酸肉桂酯、醋酸苄酯和丁香酚。
基因表达验证
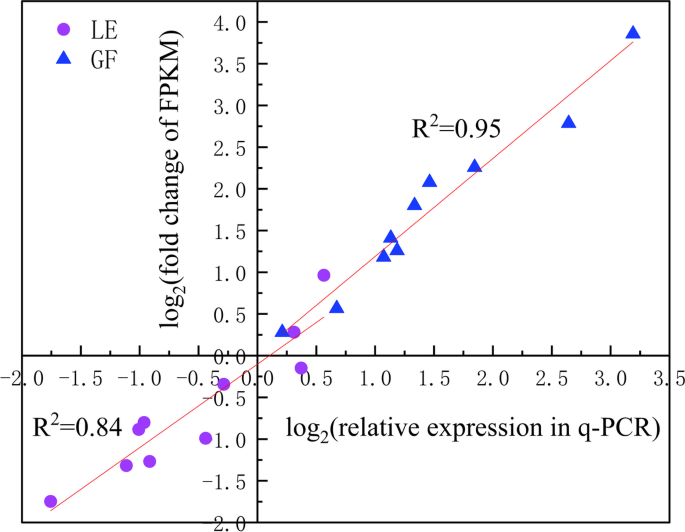
为了确认RNA-Seq结果的完整性,我们选择了花香气化合物代谢途径中的5个关键基因和1个管家基因(PP2A),并通过qRT-PCR分析了三个花期样品中GF和LE的相对表达水平(图2)。10).采用Pearson相关分析评价不同发育阶段(S2、S3和S4) RNA-Seq和qRT-PCR结果之间的关系。从一段原木中2(FPKM的折叠变化)从RNA-Seq对log2(2−ΔΔCq), GF和LE的Pearson相关系数分别为0.95和0.84,说明RNA-Seq数据可靠。
讨论
GF和LE主要花化合物的动态变化
花香是观赏植物的一个重要特征,而这种香气的关键成分是多种次生代谢物。这些挥发性化合物的相对组成、数量和相互作用决定了特定的花香[8],其特点是气味值(含量/嗅觉阈值)较高[30.].在本研究中,我们采用气相色谱-质谱法对44种主要挥发性代谢物进行了相对定量分析p .却已并根据外部标准对六种相对浓度差异很大的挥发性有机化合物进行绝对量化。鉴定出的主要挥发物是苯类化合物,尤其是苯甲醇和苯甲醛是形成典型的花香化合物的重要前体p .却已[13,18].其独特香气的主要成分是芳香烃(丁香酚、醋酸肉桂酯和醋酸苄酯)[31],同样,许多植物的花香含有芳香酯,这些芳香酯是由相应的芳香醇和酰基供体通过酰基转移酶催化的反应合成的[32,33].在所有三个花期,LE的乙酸苄释放量都高于GF(图2)。1C),气味阈值较低,有水果和茉莉花的香气[31].LE释放的苯甲醛(具有甜美的花朵和水果香气)和丁香酚(具有辛辣的丁香香气)的数量也高于GF,因此这三种挥发物的相互作用可能解释了为什么前者的香气比后者更甜美和水果香味。而GF花期后期,肉桂乙酸酯、肉桂醇和苯甲醇含量较高,香气呈奶油状、甜味,散发香气更浓郁、更浓烈。所有这些花香化合物的生物合成主要受生物合成途径中相关基因表达、酶活性和底物利用的影响。挥发性芳香化合物的多样性和丰度p .却已因此,种质资源为开发各种香气产品提供了物质基础。
肉桂酸生物合成的关键调控基因
如前所述,PAL是苯丙素代谢序列的第一个也是关键酶,参与高等植物的次生代谢途径[34].通过莽草酸途径产生的苯丙氨酸被PAL降解产生反式-肉桂酸,然后进入苯丙酸途径[35].在这项工作中,比较转录组分析揭示了两个PmPALS2期间LE中的基因表达量明显高于GF, S4期间反之亦然(表5)6).的高表达PmPAL在S2时期,LE会产生更多反式-肉桂酸,一种挥发性化合物合成的前体,因此可以解释为什么在这个阶段,LE的挥发性有机化合物的测量量明显高于GF(图2)。1c)。
少数植物tf先前已与花香的形成有关。矮牵牛花有四个MYB成员调节苯类挥发物[36],并通过过度表达MYB基因答:芥在矮牵牛花中,已经证明调节苯丙素代谢前体的流动会影响挥发性合成[37].myb样转录因子PhMYB在矮牵牛花中发现间接抑制的合成p通过抑制上游酶肉桂酸-4-羟化酶(C4H) [21].转录组学数据分析鉴定出aPmMYB4基因(表5)6),在GF中表达量显著高于LE,并在含酚类化合物代谢和苯丙类生物合成的代谢过程中富集。这些观察结果表明PmMYB4也可能是一个重要的TFp .却已,是造成品种间花香组成差异显著的原因。因此,如果要充分阐明这些香气化合物生物合成的分子机制,就需要进一步探索TFs在李树挥发物合成中的调节作用。
诱导肉桂乙酸酯和丁香酚生物合成的关键基因
4-香豆酸辅酶A连接酶(4CL)催化苯丙酸代谢途径的第三步也是最后一步。因此,它在植物代谢网络中占据中心位置,在丁香酚和肉桂乙酸酯的生物合成中发挥重要作用[38].尽管苯甲醛是生物合成类苯化合物的关键中间体,但其生物合成途径仍未得到解决p .却已香味挥发物。在矮牵牛花中,同位素标记证实苯甲醛来源于苯丙氨酸[39];然而,如果表达Ph4CL基因被抑制了,这表明Ph4CL并不是调节该物种醋酸苄生物合成的主要因素[40].如上所述,以及先前的研究表明,4CL是苯丙类和萜类生物合成途径的入口和控制点[41];例如,它在罗勒中的蛋白质和mRNA表达谱被证明与分离的腺毛细血管中苯丙素和萜类物质的产生一致[42].在这里,我们的比较转录组学数据和香气化合物测定结果之间的相关性分析显示了两个Pm4CL这些基因在LE中的表达明显高于GF,这意味着它们可能参与了挥发性化合物肉桂酯和丁香酚的合成。
肉桂醇脱氢酶(CAD)通过nadph依赖的氧化还原反应催化肉桂醛转化为相应的肉桂醇[qh]43],这也是木质素前体生物合成的最后一步[44].有趣的是,同一物种的不同CAD蛋白成员的功能差异很大[45].两个cad的特征是答:芥, AtCAD4和AtCAD5,它们表现出不同的底物特异性,但后者通常催化木质素单体的合成[46].的微分表达式的比较计算机辅助设计LE和GF基因鉴定出三个关键基因(表5)6),可能参与了植物中芳香化合物的合成p .却已.将转录组学数据与香气化合物测定结果相关联,假设PmCAD1,在LE中高度表达,更有可能参与肉桂醇的合成。
在早期阶段,苯丙素类丁香酚和异丁香酚的生物合成与g型木质素单体具有相同的途径,直到CAD产生木质素单体松柏醇,此时苯丙素途径与木质素途径分道扬镳[47].随后的酯化反应产生醋酸松柏酯,然后由两种酶——丁香酚合成酶(EGS)或异丁香酚合成酶(IGS)中的一种分别转化为丁香酚或异丁香酚,这两种酶本质上属于同一类化合物[25].目前对这些花挥发物分子方面的研究主要集中在(iso)丁香酚合成代谢的最后一步,其中18EGS和IGS已在包括罗勒和矮牵牛在内的10种植物中鉴定出基因[48,49,50,51].本研究获得的转录组学数据分析显示,两个被注释为异丁香酚合成酶的基因在LE中的表达水平均高于GF,这与在代谢物中观察到的趋势一致,表明这两个基因PmIGS基因(表5)6)是异丁香酚生物合成的最后一步所必需的。
诱导乙酸苄酯生物合成的关键基因
短链脱氢酶/还原酶(特别提款权)基因参与初级和次级代谢的许多方面,并在羰基醇氧化还原中显着[52].的特别提款权家族对苯丙氨酸衍生的一些化合物的生物合成很重要,如苯丙氨酸罗莎damascena花,其中2-苯乙醇(2PE)由苯丙氨酸通过苯乙醛作为中间体合成。后者还原为2-PE是由SDR家族成员苯乙醛还原酶(PAR)催化的[53].在这项研究中,有四个PmSDR在LE和GF的转录组中检测到基因(表5)6),并被发现参与醋酸苄的生物合成。它们的表达持续上调,在S4期间,两个品种都检测到更多的苯甲醇。的显著表达PmPAL和PmCNL最近的一项研究在苯甲醛生产阶段检测到基因p .却已表明内源性苯甲醛可能有两种来源途径[25].在p .却已结果表明,两个p450共表达产生了由苯丙氨酸和苯甲醛作为生物合成中间体衍生而来的氰苷prunasin和amygdalin。植物细胞色素P450基因家族在植物初级和次级代谢中催化大量的单氧化/羟基化反应[54],因此p450作为类苯途径的组成部分,可能对苯甲醛合成途径也有重要影响[27].深入研究特别提款权和CYP基因家族p .却已因此可能有助于解开醋酸苄酯的合成和苯甲醇的积累,因为它发生在这些物种中。
影响香气化合物挥发的关键基因
植物小分子糖基化是一种非常普遍的生理现象,是植物细胞维持代谢稳态的主要机制之一[55].以往的研究UGT基因家族研究的重点是其在植物生物胁迫反应中的作用[56].通过比较转录组学分析,我们发现了三个UGT基因(PmUGT71A16,PmUGT73C6,PmUGT74F2),可能参与的生物合成和挥发p .却已芳香化合物。其中,PmUGT74F2在含酚类化合物代谢和有机羟基化合物代谢中显著富集,提示其参与调节p .却已芳香化合物。
在LE和GF中共检测到5个注释为β-葡萄糖苷酶的deg(表5)6),随着开花的进行均呈下调趋势,且GF中的表达量显著高于LE。β-葡萄糖苷酶广泛存在于植物组织中,与ugt不同的是,β-葡萄糖苷酶主要参与芳香化合物的预水解,将植物中的芳香物质从束缚状态转化为游离状态,并释放香气挥发物[57,58].发现用β-葡萄糖苷酶水解肉桂可以释放“隐藏”的香气化合物,并显著提高香气浓度[27].两个答:芥糖苷酶AtBGLU45和AtBGLU46聚集在一起松果体contorta系统发育分析表明它们都能水解丁香酚和肉桂基糖苷[59].有趣的是,虽然香味p .却已从S2期到s4期逐渐增强,LE期的香气挥发性含量始终高于gf期PmBGLU基因在两个品种的三个发育阶段中逐渐下调,GF中表达量显著高于LE。这些观察结果可能反映了一系列上游过程,在LE中合成了更多的香气化合物,为预水解反应提供了更多的底物。另外,我们发现PmUGT71A16在LE中持续上调,而在GF中持续下调,这意味着GF中产生的更多芳香化合物的糖基化,从而降低了这些化合物在挥发状态下的水平。这可能是LE比GF释放更多芳香化合物的主要原因,也推测糖基化优先于预水解p .却已.
结论
在本研究中,OPLS-DA和OAV分析鉴定了这两种植物的6种主要花香成分p .却已品种跨越三个发展阶段:乙酸苄酯、丁香酚、苯甲醛、苯甲醇、乙酸己酯和乙酸肉桂酯。这种挥发性有机化合物的组成可以定义特定的香气特征p .却已.结合这些挥发性化合物测量和转录组分析,我们发现PmPAL酶和PmMYB4TFs可能在调节关键前体底物的积累中发挥重要作用(反式肉桂酸和p-香豆酸衍生物)的主要p .却已芳香化合物。此外,我们获得的证据支持参与PmCYP基因和PmSDRs在控制苯甲醛和苯甲醇等关键前体在乙酸苄合成途径中的生物合成。转录组学数据与关键香气物质的关联分析揭示了三个计算机辅助设计基因,两4 cl基因,三CCR基因和二IGS基因可能是重要的合成肉桂酯和异丁香酚。最后,PmUGT71A16和PmUGT73C6基因被认为是控制芳香化合物形态(结合态和挥发态)的关键因素。这些结果为进一步探索植物香气化合物形成的调控机制奠定了实践基础p .却已.
方法
植物材料
两个p .却已以具有不同花香的品种‘小爱’(LE)和‘香雪工分’(GF)为试验材料。这两个p .却已品种不是野生植物;我们于2019年3月至4月在九峰国家森林公园梅园(39°54 ' N, 116°28 ' E)采集植物材料。我们还获得了有关我们的收集和实验的机构批准的特定许可。在一个晴朗的日子,上午10点提前从枝条的上部采摘花朵,并在三个开花阶段(花瓣开放,初花和盛开)中选择标本作为样品,剪断,然后用铝箔包裹,液氮冷冻直到花瓣测试。转录组测序分析(RNA-Seq)对LE和GF的花瓣脱落(S2)、花期早(S3)和花期全(S4)对应的样品进行分析(图2)。1a).每个实验一组重复,共分析18个样本,后续分析默认取重复的平均值。
花香散发及定量分析
对于GF和LE,每个发育阶段选择3朵完整的鲜花。只有花瓣被摘下来,每个样品中的花瓣被放置在一个15毫升密封良好的顶空小瓶中,静置30分钟。采用二乙烯基苯/羧烷/聚二甲基硅氧烷(50/30 μm DVB/CAR/PDMS)包覆的2 cm固相微萃取纤维(SPME)收集挥发物。首先将萃取头置于Shimadzu GCMS-QP2010 (Shimadzu, Kyoto, Japan)耦合器的进样口,并在250°C下老化3分钟。然后将提取头插入样品顶空瓶中,并在顶空中30°C水浴30分钟。然后,将SPME纤维插入GC进样口进行解吸(5分钟,250℃)并进行后续分析。GC-MS分析采用Shimadzu QP2010仪器,配备DB-5 ms石英毛细管柱(30 m × 0.25 mm, 0.25 μm膜厚;日本京都岛津)。运行参数:载气纯度99.999%,入口温度250℃,分式进样,总流量27.2 mL min−1,分裂比20,离子源温度200℃,界面温度250℃。总运行时间为36.17分钟,初始温度为50°C,保持1分钟,然后在5°C min下上升到120°C−1,然后在8°C min下加热至200°C−1,然后在12℃min下加热至250℃−1保持7分钟。将质谱仪的电子电位设置为1 kV,质量扫描范围为m / z全扫描模式30-500。
通过与NIST11文库(国家标准与技术研究所,2011年,岛津,日本)的比较,结合人工分析来确定单个化学成分,确定未知化合物。采用外标法对主要挥发性化合物进行定量分析[31].将浓度≥98%的苯甲醛、苯甲醇、丁香酚、乙酸苄酯、乙酸己酯、乙酸肉桂酯等标准品,以甲醇(色谱纯)为稀释溶剂,逐级稀释,浓度梯度为0.05、0.1、0.25、0.5、0.8 μg−1.采用与挥发性化合物相同的气相色谱-质谱分析条件,对每个参比溶液测定1 μL。根据标准品的峰面积和浓度绘制标准曲线,采用线性回归模型对样品中相同挥发性成分进行定量分析。化合物的OAV是根据文献[60,61,62].气味描述亦可从文献[63].
RNA-Seq和数据处理
RNA提取使用Trizol试剂盒(Invitrogen, Carlsbad, CA, USA)。然后使用琼脂糖凝胶电泳分析RNA降解和污染,并使用Agilent 2100生物分析仪评估RNA纯度。
在对RNA样品进行质量验证后,使用寡聚(dT)磁珠富集具有多a尾的真核mRNA,同时使用核糖零™磁性试剂盒(细菌)(Epicentre, Madison, WI, USA)通过去除原核rRNA进一步富集mRNA。将富集的mRNA片段用片段缓冲液转化为短片段,然后随机反转录为cDNA。利用DNA聚合酶I、RNase H、dNTPs和缓冲液合成第二链cDNA。使用QiaQuick PCR提取试剂盒(Qiagen, Venlo, Netherlands)进行末端修复,然后加入poly(A),将片段连接到Illumina测序适配器上。使用Illumina HiSeq 2500进行扩增和测序。如上所述,每个样品制备3个生物重复。
通过去除带连接器的reads、含有10%以上未知核苷酸(N)的reads和含有50%以上低质量碱基(Q值≤20)的reads获得高质量reads。使用Bowtie2(版本2.2.8)将读取片段映射到核糖体RNA (rRNA)数据库[64],然后删除rrna映射的读段。剩余的clean reads进一步用于组装和基因丰度计算。使用HISAT 2.2.4进行参考基因组的搜索和比对,使用“——rna-strandness”选项,所有其他参数设置为默认值[65].
数据分析
应用OPLS-DA模型对两者进行区分p .却已品种,使用SIMCA 14.1。采用DESeq (2012) R软件包进行差异基因表达分析。为了识别deg,两两比较采用以下约束条件:FPKM > 5, FDR < 0.01, log2Fold change > 1或<−1。采用基于超几何分布的DESeq (2012) R软件包对DEGs进行主成分分析(PCA)和基因本体(GO)富集分析。使用京都基因与基因组百科全书(KEGG)分析来探索deg的途径[28,66].WGCNA分析依据Langfelder和Horvath [67].利用Cytoscape 3.8.2对相互作用网络进行分析p .却已(序列数据来自https://www.ncbi.nlm.nih.gov/,版本p .却已_V1.0)和答:芥(序列数据来自https://www.arabidopsis.org/,版本TAIR 10)与MEGA7 (https://doi.org/10.1093/molbev/msw054).在EMBL-EBI数据库(http://pfam.xfam.org/).使用MUSCLE工具进行序列比对,使用FastME工具构建系统发育树。Adobe Illustrator CC 2021用于图形的视觉呈现。
中存在的验证
采用实时定量反转录聚合酶链反应(qRT-PCR)方法检测LE和GF花瓣中6个花生物合成相关基因的表达情况(表5)7),使用基于荧光的定量PCR仪,ABI Step One Plus (Applied Biosystems, USA)。根据反转录试剂盒(Novizan R223,中国)提供的说明书,用50 ng-2 μg总RNA建立每个反应,体积为20 μL。扩增过程如下:95°C预变性90 s,然后95°C 5 s, 65°C 30 s(退火),72°C 20 s的40个循环。在65 ~ 95°C范围内记录解离曲线。每个反应重复三次。目的基因的相对表达量采用2−ΔΔCq用SPSS 26.0和Origin 8软件对数据进行分析。用于qRT-PCR分析的引物序列列于补充表7.
数据和材料的可用性
在本研究过程中生成和/或分析的数据集可从NCBI数据库(BioProject ID: PRJNA786063) (https://www.ncbi.nlm.nih.gov/nuccore/)(表8) [68].对上述数据库的公共访问是开放的,访问和使用数据不需要管理权限。材料样本可从作者。
缩写
- 朋友:
-
苯丙氨酸解氨酶
- MYB:
-
髓母细胞病病毒致癌基因
- CYP:
-
细胞色素P450
- 计算机辅助设计:
-
肉桂醇脱氢酶
- 4 cl:
-
香豆酸酯:辅酶A连接酶
- CCR:
-
Cinnamoyl-CoA还原酶
- BGLU:
-
β葡糖苷酶
- UGT:,
-
UDP-glycosyltransferase
- 抗利尿激素:
-
乙醇脱氢酶
- 特别提款权:
-
短链脱氢酶/还原酶
- TF:
-
转录因子
- C4H:
-
Cinnamate-4-hydroxylase
- 补偿中子测井:
-
Trans-cinnamate:辅酶a连接酶
- EGS:
-
丁香酚合酶
- IGS:
-
异丁子香酚合酶
参考文献
张建军,张建军。转基因技术在植物育种中的应用。植物学报,2007;26(4):169-97。
李建平,李建平。植物次生代谢产物的遗传与生物化学研究。植物科学进展,2000;5(10):439-45。
Armstrong L, Marcal Vieira Vaz MG, Genuario DB, Fiore MF, Debonsi HM。从红树林环境中分离的蓝藻产生的挥发性化合物。中华微生物学杂志,2019;36(5):575-82。
付旭,周勇,曾磊,等。植物挥发性化合物生物合成中代谢产物的分析方法。海洋生物学报,2017;7(31):19363-72。
阿特金森RG。苯丙烯:在水果中的发生、分布和生物合成。农业食品化学学报,2018;66(10):2259-72。
赵海,罗迪克S,藤井E,宫崎Y,朴宝杰,等。对花香的生理和心理反应。Hortscience。2013年,48(1):82 - 8。
Kanani M, Nazarideljou MJ。甲基jasmonateα -氨基- β -苯基丙酸改变苯丙氨酸解氨酶活性,影响切花仙丹的寿命和花香。园艺与环境,2017;58(2):136-43。
张涛,霍涛,丁安,郝荣,王杰,等。丁香酚合成相关松柏醇乙酰转移酶基因的全基因组鉴定、表征、表达及酶活性分析李属却已.科学通报,2019;14(10):e0223974。
Pichersky E, Dudareva N.气味工程:朝向控制花的气味的目标。生物技术进展,2007;25(3):105-10。
Picone JM, cleery RA, Watanabe N, MacTavish HS, Turnbull CGN。花挥发物有节奏地散发罗莎damascenasemperflorens简历。“四点适用”。足底。2004;219(3):468 - 78。
Morinaga S-I, Kumano Y, Ota A, Yamaoka R, Sakai S.花香味昼夜波动及其对繁殖成功的影响百合auratum.中国生物医学工程学报,2009;51(1):187-95。
史涛,罗伟,李宏,黄霞,倪忠,等。植物开花时间与气候适应的关系李属却已.生态学报,2020;10(1):292-306。
郝荣军,张强,杨文荣,王军,程廷荣,等。散发和内源性花香化合物李属却已和混合动力车。生物化学学报,2014;54:23-30。
郝荣,杜东,王涛,杨伟,王杰,等。梅花及其近缘种特有花香化合物的比较分析。中国生物医学工程学报,2014;38(10):1644 - 1644。
Matsuda H, Morikawa T, Ishiwada T, Managi H, Kagawa M,等。药用花卉。8从花中清除自由基的成分李属却已:果仁的结构;医药学报,2003;51(4):440-3。
郝荣,杨生,张志,张勇,常军,等。花香相关ABCG基因的鉴定及其在花器官中的特异表达模式李属却已.植物科学学报,2011;28(1):1158 - 1158。
乔舒亚R, Widhalm N,等。一个熟悉的环:植物苯甲酸的生物合成。植物学报,2015;8(1):83-9。
刘海涛,刘海涛,刘海涛,等。通过苯丙氨酸生物合成网络影响通量分布的可塑性苯丙氨酸出口物的鉴定。学报。2015;6:8142。
方F, Oliva M, Ovadia R,等。底物利用率的提高揭示了麝香花在生产芳香苯-苯丙素方面的潜力。植物物理学报,2020;32(1):19-28。
郝荣军,杨世涛,张志强,张玉军,常军,等。梅子花香相关ABCG基因的鉴定及其在花器官中的特异表达模式植物科学,2013;28(1):10。
赵凯,杨伟,周勇,张健,李勇,等。比较转录组揭示了苯类化合物在木本植物李梅中作为花香诱导剂的生物合成调控作用。植物科学,2017;8:319。
鲍峰,张涛,丁安,等。代谢、酶活性和转录组学分析揭示了杏梅品种缺乏特征花香的机制。植物科学,2020;11:574 - 982。
赵玉青,潘海涛,张秋霞,潘宝丽,蔡明李属却已花。Guihaia。2011;31:554-8。
尚军,田军,程华,等。染色体水平的腊梅(Chimonanthus praecox)基因组提供了对花香生物合成和冬季开花的见解。中国生物医学工程学报。2020;21(1):200。
张磊,陈飞,张旭,等。睡莲基因组与开花植物的早期进化。大自然。2020;577(7788):1 - 6。
张腾勋,费波,等。种内栽培品种花香化合物的比较分析李属却已用不同的花冠颜色。分子(巴塞尔,瑞士)。2019; 25(1): 145。
夏佩尔A,莫瑞尔K,等。缺乏茎特异性β-葡萄糖苷酶对木质素和单脂醇的影响。植物生理学报,2012;16(2):1104 - 1104。
Kanehisa M, Goto S. KEGG:京都基因与基因组百科全书。核酸学报。2000;28:27-30。
Colquhoun TA, Clark DG。揭示花香生物合成的调控。植物信号学报,2011;6(3):378-81。
El Hadi manm,张芳娟,吴芳芳,周春华,陶杰。水果香气挥发性研究进展。分子。2013;18(7):8200 - 29。
张涛,鲍峰,杨勇,胡磊,丁安,等。种内栽培品种花香化合物的比较分析李属却已用不同的花冠颜色。分子。2020;25(1):145。
Gopalam R, Tumaney AW。选择性催化三叶草苷形成的鼠尾草酰基转移酶的功能表征。植物化学。2021;186:112712。
杜达雷瓦,张建军,张建军,等。植物香味产生过程中苯基醇乙酰转移酶的研究进展山字草breweri.植物学报,1998;14(3):297-304。
香港J-Q。苯丙氨酸解氨酶的代谢工程研究[J]。生态学报,2015;5(7):62587-603。
董宁强,林红霞。苯丙素代谢对植物发育和植物与环境相互作用的贡献。植物遗传学报,2013;33(1):1 - 4。
李建军,李建军,李建军,等。植物挥发物的生物合成与功能研究。植物学报,2014,37(8):1936-49。
Ben Zvi MM, Florence N-Z, Masci T, Ovadis M, Shklarman E,等。相互关联的艳丽性状:花中气味和颜色生物合成的协同工程。植物学报,2008;6(4):403-15。
王晓明,王晓明,王晓明,等。番茄4-香豆酸辅酶a连接酶的抗变构反馈抑制。植物科学学报,2012;39(1):57-69。
陈晓东,陈晓东,陈晓东,王晓东,王晓东,等。了解矮牵牛花瓣组织体内苯类代谢。植物生理学报,2004;35(4):393 - 391。
Klempien A, Kaminaga Y, Qualley A, Nagegowda DA, Widhalm JR,等。的贡献我看矮牵牛花中苯类生物合成的连接酶。植物细胞,2012;24(5):2015-30。
徐超,魏辉,莫瓦赫迪A,孙伟,马旭,等。评估,表征,表达谱,和功能分析dx和DXR毛杨基因。植物生理学报。2019;42(2):94 - 105。
谢忠,Kapteyn J, Gang DR. A甜罗勒腺毛代谢调控的MEP/萜类和shikimate/苯丙类途径的系统生物学研究。植物学报,2008;35(3):349 - 361。
李磊,程晓峰,Leshkevich J, Umezawa T, Harding SA,等。被子植物紫丁香醇脱氢酶编码基因调控紫丁香醇单脂醇合成的最后一步。植物学报,2001;13(7):1567-86。
童震,李辉,张锐,马磊,董军,等。shikimate hydroxycinnamoyl- coa: shikimate hydroxycinnamoyl transferase and coumarate 3-hydroxylase的共下调显著提高了纤维素含量转基因苜蓿(紫花苜蓿l .)。植物科学,2015;39(3):230 - 7。
Preisner M, Kulma A, Zebrowski J, Dyminska L, Hanuza J,等。控制肉桂醇脱氢酶(CAD)在亚麻中的表达会影响纤维的组成和性能。植物学报,2014;39。
马Q-H。参与小麦木质素生物合成的肉桂醇脱氢酶的功能分析。实验学报,2010;61(10):2735-44。
郭德华。苯丙烯合成酶途径及其在植物挥发性苯丙素工程中的应用。植物学报,2014;31(5):401-7。
Koeduka T, friedman E, Gang DR, Vassao DG, Jackson BL,等。丁香酚和异丁香酚是香料特有的芳香成分,通过还原松柏醇酯生物合成。中国科学:自然科学进展,2006;30(6):1033 - 1033。
Koeduka T, Louie GV, Orlova I, Kish CM, Ibdah M,等。多种苯丙烯合成酶在克氏酵母和佩妮矮牵牛代表两种不同的蛋白质谱系。植物学报,2008;34(3):362 - 364。
刘建军,刘建军,刘建军,等。草莓果实的瘦果和花托中的丁香酚生产是由具有不同动力学的合成酶催化的。植物生理学报,2013,32(2):946 - 958。
Gupta AK, Schauvinhold I, Pichersky E, Schiestl FP。丁香酚合成酶基因在裸子属植物花香变异中的作用。函数集成基因组学,2014;14(4):779-88。
王晓明,王晓明,王晓明,等。植物短链脱氢酶(SDR)超家族的研究进展。植物化学学报,2012;12(2):591。
陈晓明,小林H, Sakai M, Hirata H, Asai T,等。玫瑰苯乙醛还原酶(PAR)的功能表征,一种参与气味化合物2-苯乙醇生物合成的酶。植物生理学报,2011;32(2):391 - 391。
杨建军,杨建军,杨建军,等。l -苯基丙氨酸衍生氰苷生物合成中CYP79D16和CYP71AN24的鉴定与活性分析梅花,李属却已摘要。调查。植物化学学报,2014;26(1):359 - 361。
Weis M, Lim E-K, Bruce NC, Bowles DJ。两种糖基转移酶的工程和动力学表征拟南芥.Biochimie。2008;90(5):830 - 4。
王晓明,王晓明,王晓明。水杨酸代谢的研究进展。大豆糖苷转移酶突变体ugt74f1和ugt74f2的遗传特性拟南芥.植物物理学报,2008,32(4):417 - 425。
唐辉,侯军,沈勇,徐磊,杨华,等。酿酒酵母分泌大量的β -葡萄糖苷酶,提高了同时糖化和发酵过程中纤维素酶水解和乙醇生产的效率。微生物学报,2013;23(11):1577-85。
尹强,沈刚,狄思,范超,常忠,等。甘氨酸max类黄酮生物合成相关udp -葡萄糖基转移酶基因的全基因组鉴定和功能表征。植物生理学报,2017;58(9):1558-72。
Escamilla-Trevino LL,陈伟,Card ML, shim - c, Cheng C-L,等。拟南芥-葡萄糖苷酶BGLU45和BGLU46水解单醇葡萄糖苷。植物化学。2006;67(15):1651 - 60。
范杰明特LJ。水和其他介质中风味阈值的汇编(第二次扩大和提供版)。北京:科学出版社;2015.
朱静,肖忠。气相色谱-嗅觉、定量测定及感官分析表征桃中主要香气成分[J]。食品科学与技术,2019;24(1):129-41。
张涛,鲍峰,杨勇,等。不同花冠颜色梅李种内品种花香成分的比较分析。分子。2019;25(1):145。
孙斌,何杰。香精简介:生产、配方及应用。北京:化学工业出版社;2006.
张建军,张建军,张建军,等。一种新型的快速定位方法[j]。网络学报,2012;9(4):357-U354。
李建军,李建军,李建军,等。一种低内存要求的快速拼接对准器。地理学报,2015;12(4):357-U121。
金久久M,古文道M,佐藤Y,石冈-渡边M,田边M. KEGG:整合病毒和细胞生物。中国生物医学工程学报(英文版);2011;33(5):545 - 551。
王志强,王志强。一种加权相关网络分析方法。生物医学工程学报。2008;9:559。
国家生物技术信息中心。https://www.ncbi.nlm.nih.gov/.2020年10月10日访问。
致谢
作者感谢李强的质谱分析,樊永明和吕陈飞的数据分析和讨论建议。
资金
国家重点科技发展计划(2020YFD1000500)。
作者信息
作者及单位
贡献
所有作者都对研究的构思和设计做出了贡献。实验和论文的整个过程由QL负责,材料准备、数据收集和分析由XW和ZS负责。YT和KM分别协助实验和数据分析。所有作者都对以前的手稿版本进行了评论,所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
我们已经获得了九峰国家森林公园梅园对我们的收集和实验的特定许可。本研究包括材料收集和实验,符合中国有关植物养护和利用的收集和实验的相关规定。
发表同意书
不适用。
相互竞争的利益
所有作者都已阅读并批准了这篇文章的版本,并采取了适当的措施来确保作品的完整性。投稿过程中不存在利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。
补充信息
附加文件1:图S1。
KEGG途径在GF和LE三个花期差异表达基因的富集。(|log2FC| > 1, FDR < 0.01)。图S2。GF和LE三个花期差异表达基因的基因本体途径富集。图S3。其他重要挥发性化合物与关键基因的相关性分析。热图的颜色在自然对数刻度上从紫色(值,−2.5)到黄色(值,+ 2.5)。
附加文件2:表S1。
从两者中鉴定出香气化合物李属却已品种。表S2。GF和LE花瓣样本转录组测序数据集和图谱统计概述。表S3。在不同花期通过富集分析鉴定出关键的deg,显示出在S2、S3、S4和LE与GF中显著过度代表的deg的功能类别。表S4。与每个KEGG术语相关联的路径名称。表S5。可能直接参与生物合成的101个基因列表p .却已芳香化合物。表S6。肉桂酸、肉桂乙酸酯、丁香酚、乙酸苄酯生物合成的关键调控基因及影响香气化合物挥发的关键基因列表。表S7。用于实时定量PCR的基因引物序列。表S8。上传至NCBI的样本信息摘要。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
王秀军,吴振琦,孙玉静,王玉静。et al。与关键挥发物相关的比较转录组分析揭示了植物香气化合物生物合成的分子机制李属却已.BMC Plant Biol22, 395(2022)。https://doi.org/10.1186/s12870-022-03779-3
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-022-03779-3
关键字
- 李属却已
- 花的香味
- 转录组
- 转录因子
- 基因表达与调控