摘要
背景
目前,黄芪mongholicus市场上的产品表现为两种增长模式:模仿野生答:mongholicus(WAM)和栽培答:mongholicus(凸轮).6岁的WAM (A6)和2岁的CAM (B2)产品经常作为商品出售。本研究旨在探讨上述生长方式对大豆异黄酮积累的生物合成机制的影响答:mongholicus产品。
结果
本文对毛蕊异黄酮-7-的含量进行了研究O高效液相色谱法测定,6岁WAM (A6)中-β- d -葡萄糖苷含量显著高于2岁CAM (B2)。组织解剖表明,A6韧皮部纤维发达,次生壁增厚,血管系统比B2更发达。UHPLC-ESI-Q-TOF-MS/MS分析发现,A6和B2中存在13种差异积累代谢物,其中异黄酮在A6中富集显著。通过结合转录组学和代谢组学分析,我们发现A6和B2的代谢组学特征与转录组学特征相同。通过BLAST和RNA-Seq和Iso-Seq功能注释,共分离到11个新的异黄酮相关基因。综合分析、短时间序列表达Miner分析和Pearson相关分析结果表明,肉桂酸4-羟化酶、6-脱氧查尔酮合成酶、查尔酮还原酶和查尔酮异构酶4种关键酶的调控导致了A6中异黄酮的大量积累。此外,我UFGT (c778119)和我预测UCGT (c303354)为7-O-糖基转移酶的系统发育分析;这些基因分别催化刺芒柄花素和毛蕊异黄酮。
结论
本研究结果将阐明A6和B2在异黄酮积累的生物合成机制上的差异,为其培养提供指导答:mongholicus.
介绍
黄芪是黄芪的干根黄芪(费)。知母。或黄芪(费)。知母。var。mongholicus(。)小,属于豆科[1]。黄芪是最常用的传统中药之一,被用于虚弱、慢性疾病和脾虚[2]。此外,在日常生活中,这种植物的干根被添加到煎剂中以预防疾病和保持健康[3.]。随着中医药的现代化,黄芪已被中华人民共和国国家卫生健康委员会列为“药食一根”[4]。目前,答:mongholicus占据了黄芪的大部分市场,是正品产地答:mongholicus中国的山西省在哪里?5]。
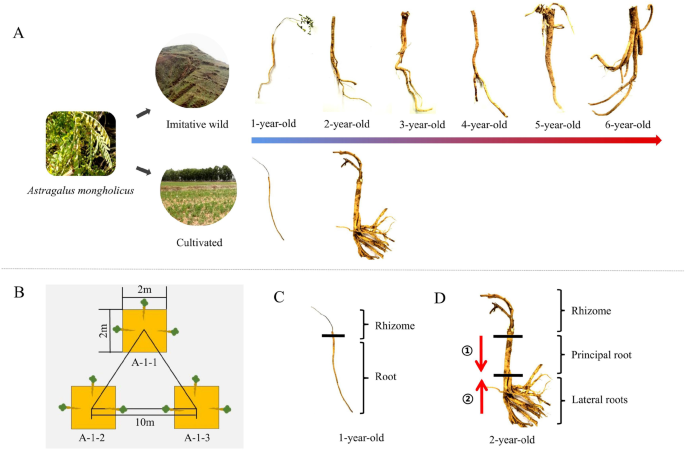
答:mongholicus是一种异花授粉的植物,自交不亲和[6]。到了20世纪80年代,资源转为野生答:mongholicus模仿野生动物答:mongholicus(WAM)供不应求,这导致了急需栽培的出现答:mongholicus(凸轮)7]。虽然两种产品都属于答:mongholicus,它们的生长模式是不同的。WAM的种植主要是通过人工将种子播种在半晴朗的山坡上,让植物自然生长。在收获WAM之前,生长期不进行人工管理。此外,在播种前对半晴坡进行翻耕和除草,有利于WAM的生长[7]。WAM的根垂直生长,根长可达1 m [7]。WAM主要分布在中国山西衡山山脉中部,海拔1300-1800米。这些植物主要生长在半晴朗的斜坡上,那里的土壤是沙质壤土,具有很强的物理风化作用,颗粒较粗,砾石较多。土层厚度大于5m。WAM的成长期至少为4年,也可达6年以上,甚至超过十几年。相比之下,CAM主要种植在沙质壤土的农田上,土壤疏松,厚度约为60-90厘米(图2)。1) (8]。CAM的种子主要采自野外答:mongholicus和/或WAM,需要手动操作,包括播种、浇水和施肥[7]。通常,CAM主要生长2年,但不能超过3年。若生长期超过3年,姜的根茎会腐烂及/或空心[9]。侧根明显增厚,主根生长缓慢。这些特性将影响亩产的持续提高。大多数CAM的根是横向生长的,移植一年后即可收获[7,8]。6年的WAM (A6)和2年的CAM (B2)产品在中药市场上经常作为商品销售,B2占商品药材总交易量的80%以上。另一方面,A6和B2的主根直径差不多,而A2的主根长度和直径都不成熟。我们的研究旨在澄清两种产品之间的差异,并探讨WAM和CAM在生长期间异黄酮的变化(图2)。1一个)。
由于不同的栽培模式,WAM和CAM也出现了一些不同的物理特征,例如主根的长度和直径以及浓郁气味的强度[10]。此外,一些研究表明,WAM和CAM具有不同的药理作用,如抗疲劳作用[11,12]。化学成分方面,WAM中刺芒柄花素和毛蕊花素的含量高于CAM [13,14]。此外,毛蕊花苷、毛蕊花苷-7-O-β- d -葡萄糖苷(CG)和黄芪甲苷III在WAM中的含量显著高于CAM [13,14]。此外,黄酮类化合物,如CG和草皮苷答:mongholicus随年岁增长而增加[14]。以往的研究主要集中在WAM和CAM的传统药理作用和代谢物的差异上。然而,在WAM和CAM中异黄酮积累的生物合成机制仍有待明确。
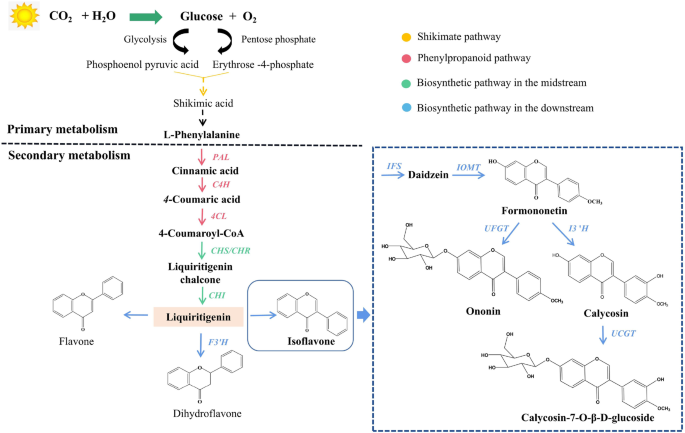
在活的有机体中,特别是在植物、藻类和某些细菌中,二氧化碳(CO2)和水(H2转化为葡萄糖和氧(O)2)通过光合作用(图2)2).在植物中,磷酸烯醇丙酮酸(PEP)和磷酸红-4-磷酸(E4P)是通过糖酵解和戊糖磷酸途径产生的[15]。PEP和E4P主要通过莽草酸途径的酶促反应转化为莽草酸和苯丙氨酸骨架(C6-C3) [16,17]。一般来说,异黄酮的生物合成途径是从l -苯丙氨酸开始的。随后,通过苯丙氨酸解氨酶(PAL)、肉桂酸4-羟化酶(C4H)和以l -苯丙氨酸为基础的4-香豆酸辅酶A连接酶(4CL)的连续催化生成4-香豆醇辅酶A。上述三个步骤也称为苯基丙烷途径。4-香豆醇基辅酶a形成后,6-脱氧查尔酮合成酶(CHS)或查尔酮还原酶(CHR)催化合成利尿素查尔酮,查尔酮异构酶(CHI)生成利尿素[18,19]。甘草原素常在随后的反应中用作形成黄酮类化合物的前体,如黄酮类化合物、二氢黄酮类化合物和异黄酮。其中,二氢黄酮主要由类黄酮3′-羟化酶(f3′h)催化[20.,21]。在答:mongholicus异黄酮合成酶(IFS)将甘草原素转化为大豆苷元,在异黄酮的催化下生成芒柄花素O甲基转移酶(IOMT)。异黄酮3′羟化酶(i3′h)以芒柄花素为底物合成毛蕊花素[2,22]。最后,糖基化修饰发生在异黄酮生物合成途径的最后一步,在此过程中,udp -葡萄糖醛酸糖基转移酶(UGT)将糖基转移到异黄酮受体[23,24,25]。为答:mongholicusUFGT和UCGT分别将刺芒柄花素和毛蕊异黄酮糖基化生成芒柄花素和CG。
迄今为止,对WAM和CAM的研究仅限于其化学成分,如异黄酮和黄芪甲苷,而上述生物合成机制尚未探索。代谢组学和转录组学从多个方面反映了植物中基因向代谢物传递信息的过程[26]。利用代谢组学方法探讨了不同栽培模式下黄芪的代谢组学差异答:mongholicus与相关基因的变化趋势一致。通过转录组学验证相关基因的表达是否与上述代谢物的变化趋势一致。
因此,我们专注于两个主要的商业产品答:mongholicus(A6和B2)。首先,采用高效液相色谱法测定WAM和CAM之间的CG含量。其次,通过组织解剖学比较WAM和CAM的各营养器官的结构特征。探讨异黄酮化合物的差异答:mongholicus采用Iso-seq和RNA-seq进行转录组学测序,采用UHPLC-ESI-Q-TOF-MS/MS进行代谢组学测序。此外,还进行了实时定量聚合酶链反应(qRT-PCR)来验证转录组学得出的结论。最后,对基因表达和代谢物数据进行综合分析、Pearson相关分析和短时间序列表达分析器(Short Time-series Expression Miner,简称STEM)分析,以全面了解WAM和CAM之间的生物合成机制。本研究结果将进一步阐明A6与B2间异黄酮积累的生物合成机制,对栽培具有指导意义答:mongholicus.
材料与方法
植物材料和处理
WAM(1 ~ 6年)和CAM(1 ~ 2年)鲜根采自中国山西省。所有样本的信息列在表S中1.所有样品鉴定为答:mongholicus秦雪梅教授所著,保存于中国山西大学现代中医药研究中心。以反映异黄酮的生产实践和整体格局答:mongholicus,在同一地区采集了两批样品。第一批样本(No.20180628)于2018年6月28日采集,用于对WAM和CAM的转录组学和代谢组学总体特征进行差异分析。此外,为了进一步验证上述数据和结果的准确性,我们于2018年10月23日采集了另一批样品(编号20181023)。
每个生长期采集的样品,选取3个样方作为3个生物重复,每个样方的长度和宽度均为2 m。每个样方之间的距离为10 m。从每个样方中选择三株植物,以减少组内差异(图2)。1B)。
选取A1和B1的根进行后续检验;为了反映根样品的整体情况,将根茎去除(图2)。1C).对于A2-A6和B2,的主根的长度答:mongholicus在30厘米至70厘米之间[27]。基部(根茎下主根)直径较粗,与植株生长年龄相同,而顶端(主根末端)直径较小,生长年龄较年轻。根尖是最近1-2年才长出来的。为了真实地反映一个样品的成长岁月,将底座和尖端分开答:mongholicus分别剪出,混合后作为单个植物的最终实验样品,用于后续相关实验(样品处理的详细步骤如图5 - 2所示)1).
高效液相色谱法分析CG
不同生长模式下蒙古冬青的直径
根径数据使用频率分布图显示(或绘制),以尽量减少年内的变化[28]。目前,单生长期药材样品根样直径组内方差较大。本方法的目的是为了选择更能代表生长年份的药材样品,以保证结果的可信度。
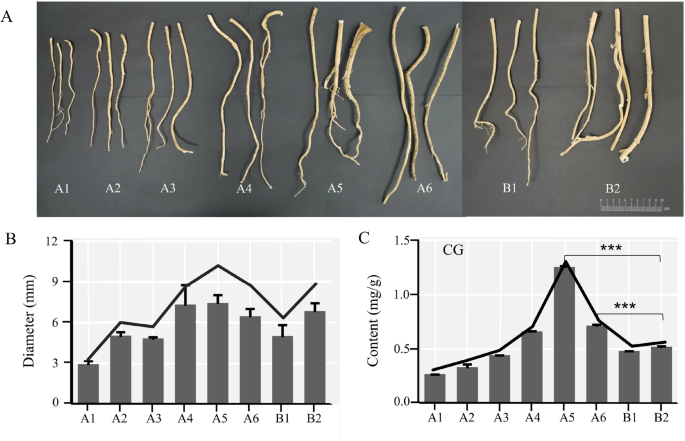
首先,根状茎和多余的侧根答:mongholicus切开切除,记录切口下3.5 cm处的直径(图2)。3.A).接下来,通过SPSS 16.0 (International Business Machines Co., Ltd, USA)对散点图和频率分布图进行分析,评估WAM和CAM在不同生长年份的直径范围。直径范围由频率分布直方图计算,其中覆盖整个频率分布60%的值被保留。取上述直径范围内的样品进行后续实验。
参考解决方案
精确称量标准品CG,加入甲醇配制50 μg/mL参比溶液[1]。
测试解决方案
称重约1 g粉末(粒径≤250±9.9 μm),放入圆底烧瓶中。在圆底烧瓶中加入50ml甲醇,称圆底烧瓶的重量。将粉末提取到回流装置中4 h,提取后冷却后再次称圆底烧瓶,在圆底烧瓶中加入甲醇,补充失去的重量。然后,精确测量后续滤液25ml,回收滤液直至完全干燥。最后,将残留物溶解在甲醇中,将测试溶液转移到容量瓶中(5ml) [1]。
色谱条件
Venusil MP C18色谱柱(250 mm × 4.6 mm, 5µm)。流动相为乙腈(A)-0.2%甲酸水溶液(B),条件为:0-20min, 20-40%A;20-30 min, 40% a,检测波长260nm。
主根解剖答:mongholicus
将WAM(1 ~ 6岁)和CAM(1 ~ 2岁)的主根切成合适的大小。所有样品在FAA中固定24小时以上。脱水、透明蜡、包埋后,用LEICA RM2265切片机切片至8 μm厚度。然后用藏红花耐晒绿染色,用中性香脂密封。最后用LEICA DM2500显微镜对石蜡切片进行观察和拍照。
代谢物提取与分析
样品制备
将1 g粉末在回流装置中浸泡在15倍体积的75%甲醇中,提取两次;每次提取1 h,然后用0.22 μm Millipore过滤器过滤。最后,进样3 μL,进行UHPLC-ESI-Q-TOF-MS/MS分析[29]。
色谱条件
采用ACQUITY™UPLC HSS T3色谱柱(100 mm × 2.1 mm, 1.8 μm, Waters Corporation, USA),在35°C下分离。流动相为0.1%甲酸水溶液(A)和0.1%甲酸乙腈水溶液(B)。流动相设置条件为:0.01 ~ 3 min, 1% ~ 10% B;3-9分钟,10%-30% B;9-18分钟,30%-100% B;18-22分钟,100%-100% B;b为100% ~ 0.01%,流速保持0.4 mL/min,注射量设置为3 μL。在此基础上,将所有样品设置为相同的体积,并与质量控制(QC)样品混合[29]。
质谱分析条件
在正极模式(POS)下,离子喷雾浮动电压(ISVF)设置为5500 V;ESI加热器温度保持在600℃;雾化器气体(GS 1)、辅助气体(GS 2)和幕帘气体(CUR)分别设置为55、55和30 psi;将聚类势(DP)和碰撞能(CE)分别设为100 V和10 V。设定TOFMS的积累时间为0.15 s。在阴性模式(NEG)下,将ISVF设置为- 4500 V,其他参数与POS相同。在阳性和阴性采集模式下,通过信息依赖采集(IDA)模式同时采集MS和MS/MS数据。在IDA-MS/MS实验中,CE设置为40±20 V,每个周期最多监测10个候选离子。此外,采用动态背景相减模式,分析过程中每4次注射进行连续校准[29]。
代谢组学数据处理
代谢组学数据通过One-MAP-PTO 2.0进行转化。删除组中缺失值超过50%的代谢物,以确保样品和代谢物之间的平行性,并按质量归一化数据。其次,将数据导入SIMCA-P 14.1(瑞典Umetrics)中,经Pareto缩放后进行模式识别,并进行多维统计分析。在此基础上,VIP > 1和P< 0.05筛选鉴定为差异积累代谢物(DAMs)。
非参考转录组学的Iso-Seq和RNA-Seq联合分析
非参考转录组学数据库的构建
下一代数据文件是bam文件。首先,对下一代数据进行井内校正,获得感兴趣读数(ROI);然后根据5’引物/3’引物/Poly A是否完整嵌合进行ROI分类。得到了全长非嵌合序列。最后,对全长非嵌合序列进行聚类,得到非冗余亚型。
从原始数据(RNA-Seq)中提取和过滤子序列,去除适配器和低质量序列。将过滤后的reads与同种异构体序列进行比较。此外,使用Trinity软件对与同种异构体不具有可比性的clean reads进行拼接,获得转录本,并进行后续分析。
通过CD-HIT将非冗余的同工异构体和剪接的转录本组合并聚类,获得统一基因并用于后续分析。转录组测序,包括cDNA构建,由上海个人生物技术有限公司(中国)承担。
异黄酮生物合成途径相关基因的鉴定
候选酶的全称答:mongholicus在国家生物技术信息中心(National Center for Biotechnology Information, NCBI)的核苷酸文库中检索,记录所有具有全长编码序列(full-length coding sequences, cds)和相应GenBank id的序列。此外,通过功能注释数据搜索候选酶的名称。然后,去除短的候选序列,剩余的序列在NCBI中通过Nucleotide BLAST进行BLAST。然后,保留高查询覆盖率和高识别率的序列。最后,通过DNAMAN (Lynnon Biosoft Co., Ltd, USA)的多序列比对,将上述序列与NCBI上发表的CDSs进行比较。
异黄酮相关基因的qRT-PCR
鲜根答:mongholicus用于RNA提取。纯度和浓度采用1.5%琼脂糖凝胶电泳,使用SpectraMax®QuickDrop™分光光度计(Molecular Devices, LLC, USA)。用qRT-PCR从总RNA (500 ng)中扩增cDNA。反应体系为20 μL,包括10 μL SYBR Premix Ex Taq II 2x (Takara Biomedical Technology (Beijing) Co., Ltd, China), 0.8 μL引物F (10 μM), 0.8 μL引物R (10 μM), 2 μL cDNA, 6.4 μL ddH2O.所有反应均在96孔板上进行,采用Heal Force Real-Time PCR系统(Heal Force CG-05,杭州晶乐科学仪器有限公司)。qPCR方案包括95°C退火60 s,随后95°C退火15 s,引物58°C退火15 s,延伸72°C退火45 s的40个循环。在每个qPCR分析中,每个引物对都有一个无模板的阴性对照。每个样品使用3个生物重复。用2计算基因表达量−△△Ct[30.]。qRT-PCR引物如表5所示2.候选基因序列在附加文件中2.
统计和系统发育分析
统计分析
采用SPSS 16.0进行统计学分析。数据间的相关性采用Pearson相关系数(r)计算。
系统发育分析
ugt的氨基酸序列采集自NCBI (http://www.ncbi.nlm.nih.gov).表S3列出了这些序列的信息。通过ClustalW分析进行序列比对。进化距离使用MEGA7.0 (https://www.megasoftware.net).为了进行系统发育分析,使用MEGA7.0生成了一个无根邻居连接(NJ)树。每个分支显示1000个重复的引导值[31]。
结果
不同的CG内容跨越答:mongholicus有着不同的生长模式
CG是主要的活性成分答:mongholicus是一种异黄酮。利用散点图和频率分布图直观地显示了WAM和CAM在不同生长年份的直径范围(图2)。3.一个,图S2和S3).的直径答:mongholicus在不同的生长模式下,WAM的直径随着时间的推移而增加,其中A5的直径最大。CAM直径的变化也随着时间的推移而增加。A6和B2的直径相同(图2)。3.B、表54).同样,在所有样品中,A5的CG含量最高。A5和A6的CG含量显著高于B2(图2)。3.此外,直径与CG含量之间的Pearson相关性答:mongholicus不同生长模式间差异显著(r = 0.83);P= 0.01)。因此,CG含量的变化与直径的变化是一致的答:mongholicus.
的主根解剖特征答:mongholicus
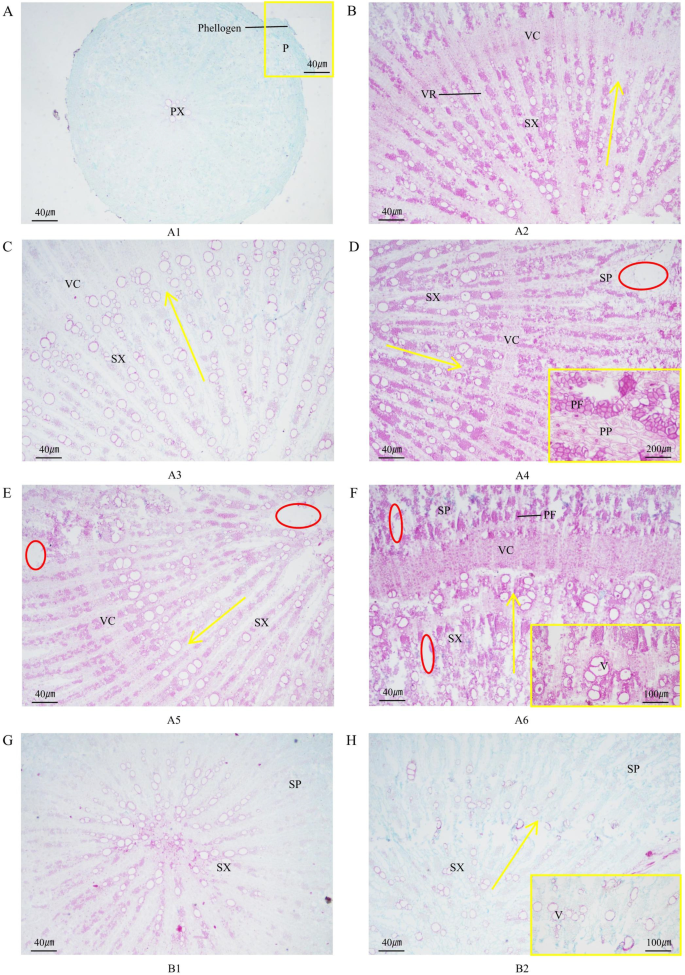
的主根答:mongholicus由周皮和次生维管组织组成(图2)。4A / B)。根周由外到内依次为软木层、木栓层和木栓层。软木层细胞沿径向排列整齐紧密,部分软木层细胞被压碎(图2)。4A).次生维管组织由次生韧皮部、维管形成层和次生木质部组成。次生韧皮部主要由韧皮部薄壁组织和韧皮部纤维组成。韧皮部薄壁染色深,细胞内含有丰富的梭形器官(图2)。4D)。然而,主根的维管射线由1-2行细胞组成(图2)。4B).韧皮部纤维呈束状排列,而筛管和伴生细胞仅出现在维管形成层附近的次生韧皮部。维管形成层呈环状排列,有5-7层韧皮部薄壁细胞,这是次生木质部和次生韧皮部的分界线(图2)。4D)。
A1的主根中只发现初生木质部和周皮,A2的主根中开始出现次生维管组织(图2)。4A / B)。根据黄色箭头的方向测量血管,黄色箭头表示每条射线的血管数量。A2每条射线约有10条血管,A3-A4每条射线约有20条血管,A5-A6每条射线约有15条血管。4B / C / D / E / F)。丰富的维管组织能够保证植物体内水分、矿物质和有机营养物质的运输和分配。A3-A4主根血管最高,说明这一时期WAM生长旺盛,而A5-A6生长缓慢。主根维管射线在a4 ~ a6开始出现间隙,维管射线中的薄壁细胞排列紧密。然而,切片的厚度可能不够,从而导致在切片过程中出现间隙。
除了初生木质部外,B1还有次生木质部。B2中次生韧皮部的比例增加,次生木质部的导管数量也增加(图2)。4G / H)。与B2相比,A6次生韧皮部的韧皮部纤维发育良好,次生壁明显增厚(图2)。4F / H)。A6主根维管形成层更为明显,维管束发育良好,排列紧密,呈环形连接。A6主根有较多直径较大的血管,而B2主根仅有约10条血管(图2)。4F)。
代谢组学分析答:mongholicus有着不同的生长模式
主成分分析
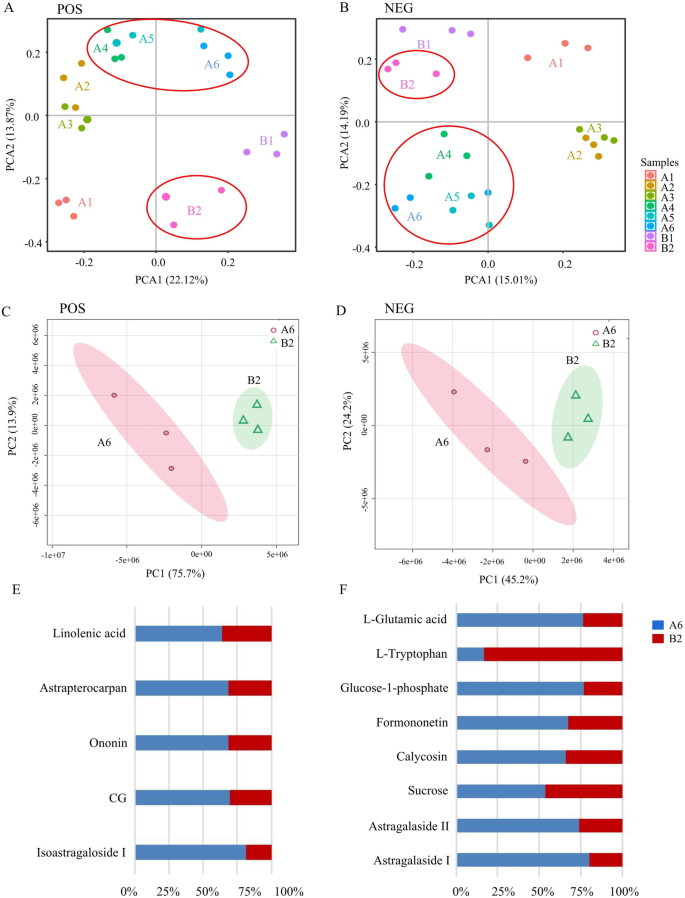
主成分分析(PCA)用于代谢组学数据分析。PCA是一种无监督的模式识别方法,它可以通过降低数据的原始复杂性来有效地确定数据中的重要信息[32]。在这项研究中,答:mongholicus以不同的生长方式进行分析。在代谢组学水平上,POS中A6和A4-A5是通过PC1轴来区分的,而B1-B2和A4-A6是通过PC2轴来区分的。对于A4和A6, A5和A6的聚集比A4更明显(图2)。5A)。然而,对A6和B2的PCA结果显示,A6和B2是通过POS中的PC1轴来区分的(图2)。5C)。在NEG中,通过PC2轴区分B1-B2和A4-A6(图2)。5B)。与之前POS的PCA结果一致,NEG中的PC1轴可以区分A6和B2(图2)。5D)。
综上所述,我们发现无论是在POS还是在NEG中,A6和B2都明显分为两组。结果还揭示了不同生长方式对土壤水分的影响答:mongholicus反映在代谢物上。因此,应进一步分析水坝,以探讨上述生长模式对代谢产物的影响答:mongholicus.
差异积累代谢物的鉴定
偏最小二乘判别分析(PLS-DA)模型通过置换检验进行验证(图5)4A / B)。在图中,R2和问2左值低于右值,Q的回归线2在负纵坐标轴相交。代谢产物在A6和B2之间有显著差异。因此,使用OPLS-DA模型得到A6和B2的散点图(图S)4C / D)。
利用数据库中的标准,通过比较m/z值、滞留时间和破碎模式,从A6和B2中共鉴定出13个坝(图2)。5E / F)。这些代谢物包括5种初级代谢物和8种次级代谢物。5种主要代谢物中,B2的l -色氨酸显著高于A6。其他主要代谢物,如l -谷氨酸、葡萄糖-1-磷酸、亚麻酸和蔗糖,在A6中显著高于B2。此外,黄芪甲苷II、黄芪甲苷I、异黄芪甲苷I和黄芪甲素在A6中的含量显著高于B2。与HPLC结果一致,异黄酮,包括芒柄花素、芒柄花素、毛蕊异黄酮和CG,在A6中积累更多(图6)。5E/F,表55).
从代谢组学数据分析蒙古黄芪异黄酮的分类
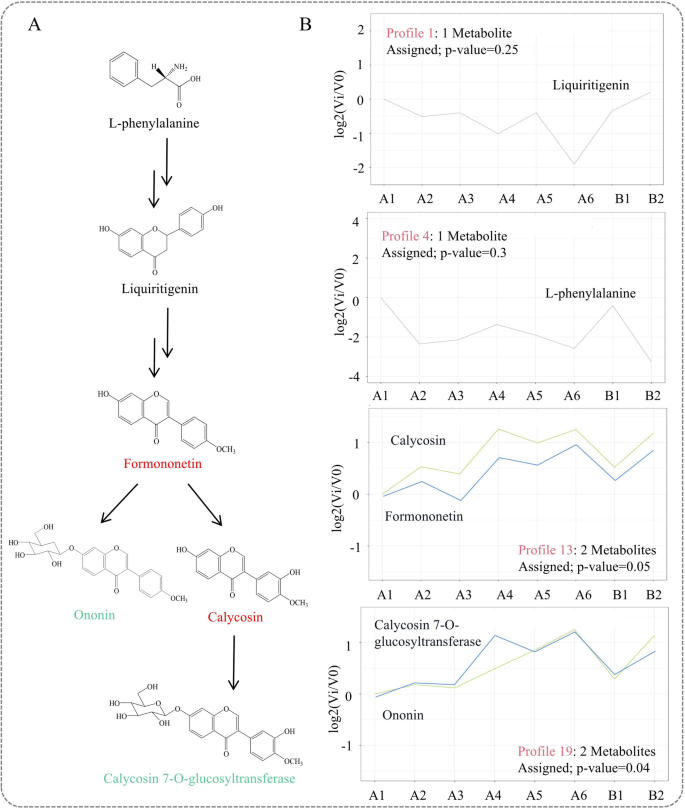
通过一系列聚类测试,通过STEM分析将不同的代谢物分类为不同的谱,揭示生物样品独特的变化模式。找到了最具代表性的代谢物簇及其趋势特征。根据代谢组学数据,共鉴定出异黄酮生物合成途径中的6种代谢物,包括l -苯丙氨酸、利尿素,以及从芒柄花素到CG下游途径中的4种异黄酮(图2)。6A、表S5).
采用UHPLC-ESI-Q-TOF-MS/MS对异黄酮生物合成途径代谢物进行STEM分析。结果由STEM在线分析http://www.omicshare.com/.一个异黄酮生物合成途径。相同的颜色表明代谢物谱是相同的。黑色表明代谢物具有不同的特征。B不同剖面代谢物的变化趋势
采用STEM分析异黄酮生物合成途径中6种代谢物的峰(表S)6).结果表明,6种代谢物对应4个谱。其中,基因型19显著富集两种代谢物(P< 0.05)。另外3个剖面13、1和4的富集程度不显著。
剖面13包含刺芒柄花素和毛蕊花素,A1-A6和B1-B2呈交替增减趋势。图19中含有CG和ononin,在A1-A6和B1-B2中逐渐增加,在A6中显著富集。l -苯丙氨酸和利尿原素分别对应于图谱4和图谱1。基因型4含有l -苯丙氨酸,其特征是A1-A6和B1-B2逐渐减少。图4显示,利尿素在B2中富集(图4)。6B)。
通过Iso-Seq和RNA-Seq进行非参考转录组学分析
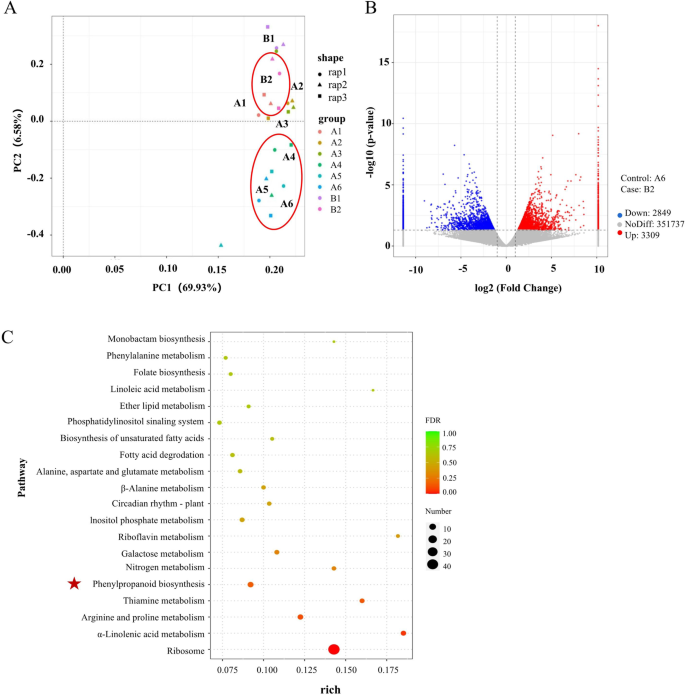
在转录组学水平上,当PC2沿X轴绘制时,将A4-A6和B2分为两组(图2)。7A).结果进一步揭示了答:mongholicus与代谢物谱的趋势基本一致(图2)。4一个)。
unigenes的功能注释
共获得833216个unigenes, N50为978 bp。通过基因本体(GO)和京都基因与基因组百科全书(KEGG)进行注释。氧化石墨烯分析将27,252个转录本分类为分子功能、细胞成分和生物过程。分子功能类基因在转移酶活性、激酶活性和蛋白激酶活性方面富集。参与细胞组分的基因主要富集于膜、膜部分和膜的整体组分。在生物过程方面,这些基因主要参与生物、代谢和细胞过程的调控(图5)5).KEGG结果显示,4276个转录本被映射到325个KEGG通路。共有89个基因参与了次生代谢物的生物合成(图5)6).
苯丙素途径及异黄酮相关基因的鉴定
采用DESeq分析各组间基因表达情况。在A6和B2之间共发现6158个差异表达基因(DEGs),其中上调基因3309个,下调基因2849个(图2)。7B、附加文件3.).在KEGG数据库中对A6至B2之间的所有deg进行注释。结果表明,deg主要参与核糖体、苯丙素途径、精氨酸和脯氨酸代谢、α-亚麻酸代谢和硫胺素代谢。核糖体、精氨酸和脯氨酸代谢途径以及α-亚麻酸途径也分别与翻译、氨基酸代谢和脂质代谢有关。硫胺素的代谢植根于辅因子和维生素的代谢。此外,苯丙素途径与次生代谢物的生物合成有关。值得注意的是,异黄酮生物合成途径是苯丙素途径的一个重要分支。7C) (33]。因此,A6和B2之间异黄酮含量的差异主要是由于异黄酮相关基因的表达差异。
本研究共发现11个参与异黄酮合成途径的候选基因,包括c759450 (朋友,GenBank: ON420729), c831948 (C4H,GenBank: MN241505), c795398 (4 cl, GenBank: ON420730), c780996 (CHS,GenBank: MN241506), c828977 (空空的,GenBank: ON420728), c801189 (气,GenBank: MN241507), c759107 (IFS,GenBank: ON420726), c773593 (IOMT,GenBank: MN241507), c792702 (I3'H,GenBank: ON420727), c778119 (UFGT,GenBank: ON375915)和c303354 (UCGT,GenBank编号:MN241498表S7 / S8).所有候选基因均已提交至NCBI数据库。
异黄酮相关基因的表达模式答:mongholicu年代
蒙古黄芪11个异黄酮相关基因的表达分析
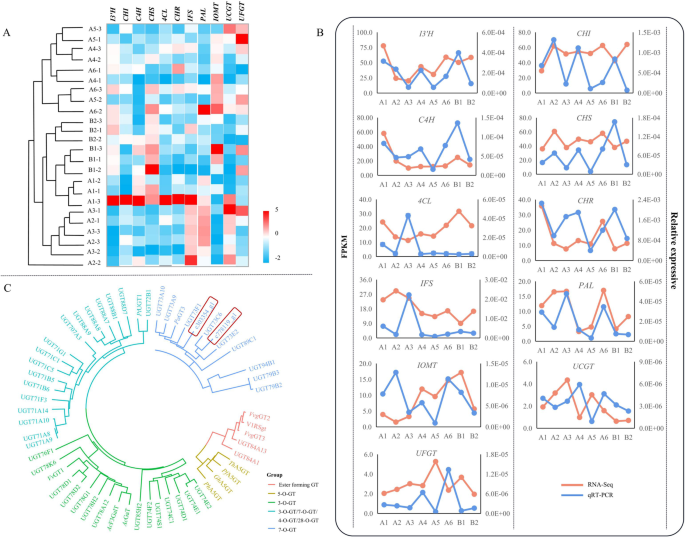
根据转录组学样本的聚类结果,将A4、A5和A6聚在一起。B2/B1/A1和A2/A3也聚集在一起。此外,我们发现A2-A6三个样方之间的差异较大,而A1、B1、B2三个样方之间的差异较小。
大豆异黄酮生物合成途径中关键酶基因的表达水平答:mongholicus根据FPKM值进行预测。的表达水平I3'H,气,C4H,CHS,4 cl,空空的在所有样本中都很高,而IFS,朋友,IOMT,UFGT,UCGT在所有样本中都很低。总体而言,11个异黄酮相关基因在A1中的总表达量在所有样品中最高,且所有基因在A6中的表达量均高于B2。的表达水平C4H,CHS,气A1组最高,其他组无明显变化。的表达水平I3'H,空空的,C4H在A6中表达量仅次于A1,且朋友在A6中最高。结果表明IOMTB1的表达量最高,CHS,气,IFSA2区最高(图2)。8A).除此之外,11个异黄酮相关基因的qRT-PCR的STEM分析结果放在了Additional文件中1(图七)。
利用RNA-Seq和qRT-PCR对11个异黄酮相关基因进行综合分析
选择qRT-PCR和RNA-Seq的结果进行综合分析(图2)。8B / S8).的Pearson相关分析结果朋友和I3'HqRT-PCR与RNA-Seq数据的相关系数(r)为0.738/0.599,进一步表明基于qRT-PCR的表达谱与基于RNA-Seq的表达谱一致。的表达式CHS和气在qRT-PCR和RNA-Seq分析中B1的表达差异较大。的qRT-PCR和RNA-Seq结果C4HA3则不同。除此之外,表达空空的和4 cl在A3和B1中,基于qRT-PCR的结果与基于RNA-Seq的结果不一致。为IFS和IOMT在A2和B1中,基于qRT-PCR的表达与基于RNA-Seq的表达不同。其他低表达的基因,如UFGT和UCGT结果显示,在所有样本中,qRT-PCR与RNA-Seq结果存在显著差异(图2)。8B / S8).qRT-PCR与RNA-Seq结果的差异主要集中在A2、A3和B1。考虑到用于qRT-PCR和RNA-Seq分析的样品是在不同的时间收集的,因此朋友和I3'H在答:mongholicus都相对稳定。
根据qRT-PCR结果,IFS,空空的,气,CHS,I3'H在所有样本中都很高,而4 cl,C4H,朋友,IOMT,UFGT,UCGT在所有样本中都很低。的表达水平IFS和4 cl在A3样品中含量最高,其他样品无显著差异。的表达水平C4H和CHS在B1中最高。的表达水平空空的,气,UCGT,4 cl,I3'H,IOMT在A1中高于B1(图5)9).与FPKM结果一致,A1中11个异黄酮相关基因的总体表达量高于B1, A6中所有基因的表达量也高于B2。并分别比较了11个异黄酮相关基因在A6和B2中的表达水平。结果表明,除异黄酮相关基因在A6中的表达量高于B2外,其他基因在A6中的表达量均高于B2IFS.其中,的表达水平气A6明显高于B2(图5)10).
AmUCGT和AmUFGT的系统发育分析
鉴于鉴定出两个低表达ugt答:mongholicus经系统发育分析,发现ugt位于异黄酮生物合成途径的下游。在此基础上构建了自举NJ系统发育树我UCGT (c303354),我UFGT (c778119)和其他54个功能已知的ugt(表S3)。这些UGT酶具有5种功能:酯生成GT、5-O-GT、3-O-GT、7-O-GT和3-O-GT/7-O-GT/4-O-GT/28-O-GT。c303354的答:mongholicus与UGT73E2、UGT73C6聚类,功能为7-O-GT。同样,c778119与UGT73F1聚类(图2)。8C).考虑到UGT73E2、UGT73F1、UGT73C6为黄酮醇-3O-glycoside-7 -O-葡萄糖基转移酶c303354和c778119预测为7-O-糖基转移酶,分别催化刺芒柄花素和毛蕊异黄酮。
异黄酮相关基因与代谢物的相关分析及生物合成机制
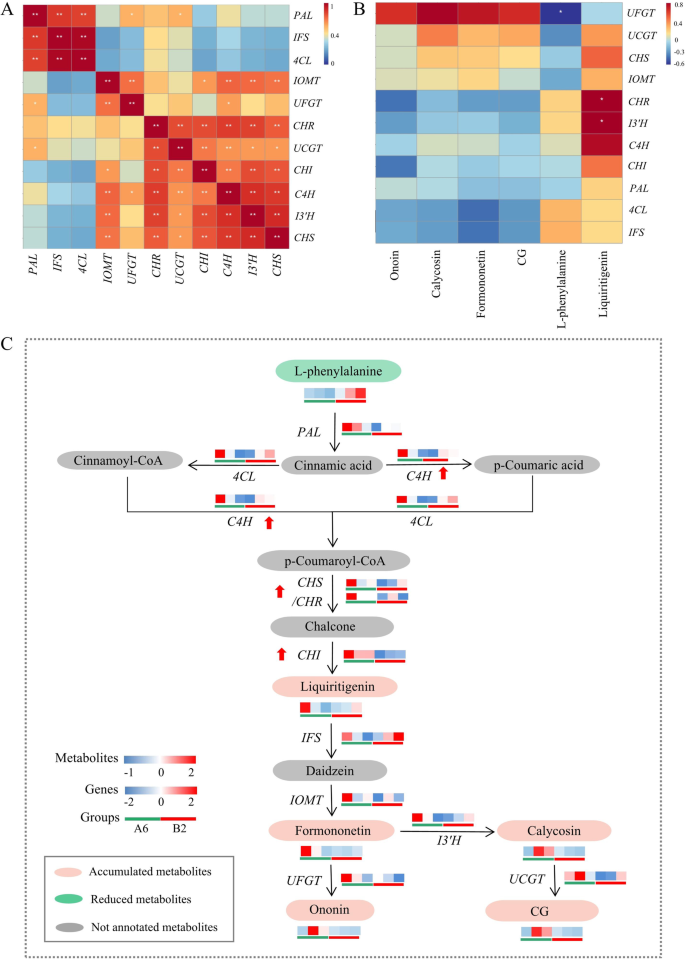
qRT-PCR对11个异黄酮相关基因表达量的Pearson相关性分析显示朋友和4 cl有显著的正相关IFS(P< 0.01)C4H有很强的相关性I3'H,IOMT,UCGT(P< 0.05)。此外,空空的和气有正相关UCGT(P< 0.01)(图9A)。此外,CHS和气都与IOMT UCGT,和I3'H(P< 0.05)(图9A,表S9)。此外,所有样本中6种代谢物与11个基因之间的Pearson相关性表明空空的和I3'H与利尿原素(P< 0.05)(图9B)。UFGT与l -苯丙氨酸(P< 0.05)(图9B,表S10)。因此,CHS,气,空空的,C4H在下游途径中对异黄酮的积累起重要作用。
异黄酮相关基因与代谢物的相关分析及生物合成机制。一个qRT-PCR分析11个异黄酮相关基因的Pearson相关性。*P< 0.05, * *P< 0.01。使用在线工具(http://www.lc-bio.com/).B采用qRT-PCR和UHPLC-ESI-Q-TOF-MS/MS对11个异黄酮相关基因和6个代谢物进行Pearson相关性分析。CA6和B2中异黄酮生物合成途径相关基因和代谢物的表达谱
转录组学和代谢组学分析表明,异黄酮生物合成途径,特别是苯丙素途径在A6和B2之间的差异中起重要作用。综上所述,A6中异黄酮的积累机制主要是由于异黄酮生物合成途径中四个关键酶的高表达。l -苯丙氨酸减少,产生利尿原,形成类黄酮骨架(C6-C3-C6)。第一,高表达C4H导致l -苯丙氨酸的减少。随后,CHI、CHS、CHR等限速酶的高表达进一步促进了利尿原在中游途径的积累。下游途径主要是对类黄酮主干进行修饰。最后,异黄酮,包括毛蕊异黄酮、芒柄花素、芒柄花素和CG,由于高表达I3'H,IOMT,UFGT,UCGT(无花果。9C)。
讨论
本研究收集了A1-A6和B1-B2样品,探讨了不同生长方式和生长年限对其化学成分的影响答:mongholicus.虽然A6和B2的直径比较接近,但A6的CG含量显著高于B2。组织解剖也表明A6韧皮部纤维发达,次生壁增厚,血管系统比B2更发达。转录组学和代谢组学联合分析表明,WAM和CAM的代谢组学特征与转录组学特征的变化一致。进一步分析表明,异黄酮如芒柄花素、芒柄花素、毛蕊花素和CG在A6中的积累量大于B2。结果还表明,11个异黄酮相关基因在A6中的表达量均高于B2,除IFS.最后,通过RNA-seq和qRT-PCR综合分析、Pearson相关分析、STEM分析等多种方法综合分析,A6中异黄酮的积累主要是由于四个关键基因的高表达,包括C4H,CHS,气,空空的.在这项研究中,我UFGT (c778119)和我预测UCGT (c303354)为7-O-糖基转移酶的系统发育分析;这些酶分别催化刺芒柄花素和毛蕊异黄酮。
鉴于其在药用植物中的广泛应用,代谢组学已逐渐应用于药用植物次生代谢途径的机理研究和中药的鉴定,包括人参[34],北柴胡[35],Saposhnikovia衣属鸦葱[36),而黄芩[37]。Gao等。[38用HPLC-UV-ELSD法鉴定出了2 ~ 6年龄WAM中的12种成分。PCA显示,A2-A3和A4-A6聚为两组,在第二组中,A4从含有A5和A6的组中分离出来。结果还表明,8种异黄酮和4种黄芪甲苷导致了含有2至6年WAM样品的组的差异。本研究利用UHPLC-ESI-Q-TOF-MS/MS分析了不同生长年限间WAM和CAM的差异。PCA在POS中的结果与前人的研究结果一致[38]。随着生长年限的增加,各组间差异呈逐渐增大的趋势,其中B2与A4-A6之间代谢物差异最为明显。
此外,通过代谢组学分析,发现A6和B2中的dam包括多糖、皂苷、氨基酸和异黄酮。我们还发现A6的异黄酮含量显著高于B2。WAM研究表明,影响黄酮类化合物含量的主要因素是海拔和纬度,经度也有一定的影响[39]。因此,这一发现可能是由于WAM的高海拔和纬度刺激了WAM产生应激反应和异黄酮的积累。然而,一项组织解剖学研究表明,韧皮部纤维的发达和次生壁的增厚有利于阻挡冷空气。根系发达的维管系统也更有利于答:mongholicus从干旱环境中吸收水分和矿物盐[40]。这一发现也进一步表明,A6发育良好的次生维管组织为其生长提供了充足的营养答:mongholicus.
“橙色是试当它诞生在淮南,它是柑橘trifoliata生在淮北”。这也说明,不同的生长环境对同源植物的性状外观和次生代谢物积累有不同的影响。造成这一现象的原因更为复杂,仍需进一步探索。在以后的实验中,我们会结合已有的实验结果,尽量使用相同的种子a . mongholicus让它们在两种生长模式下生长。我们还将进一步探讨海拔、温度、营养、水分等对CAM和WAM的影响。
转录组学和代谢组学的综合分析对于从这两个水平分析植物的内部变化具有重要意义。因此,这两种技术可以全面了解植物的分子功能和调控机制[41]。大多数代谢组学和转录组学结合的研究使用3个生物重复,通常将3-10个处于同一生长期的植物混合作为一个生物重复[42,43,44]。根据调查,种植面积答:mongholicus在中国山西浑源县,达到18666公顷22019年[45]。此前,我们课题组发现,生长的基部和尖端答:mongholicus皂苷和黄酮类化合物的分布位置答:mongholicus不同年份的差异[38]。由于实验样本的设计很重要,我们设计了三个相同距离和大小的样方答:mongholicus用相同的生长年限来选取具有代表性的样本。此外,每个样方采集3株植物,采用不同处理答:mongholicus在不同的生长阶段。
在这里,我们发现A4-A6在转录组学和代谢组学水平上聚集在一起。A4-A6和B2分为两组,差异有统计学意义,与既往结果一致[38]。同样,基于转录组学的样本聚类结果显示,A4-A6和B2聚为两组。然而,根据qRT-PCR结果,我们发现A6的三个样方之间的差异大于B2。尽管在qRT-PCR结果中A6的三个生物重复呈弱相关,但我们仍然发现异黄酮相关基因在A6中的表达水平高于B2,且气A6显著高于B2。
异黄酮生物合成途径是豆科植物苯丙素途径的一个分支,近年来引起了广泛的关注。研究发现异黄酮生物合成途径中的关键酶包括PAL、CHS、CHI和IFS,它们可以在转录前和转录后水平调控异黄酮的生物合成[46]。此外,在植物抗病方面,CHS是合成黄酮类和异黄酮的关键限速酶[46]。Zhang等。[47]指出CHR是大豆苷元合成过程中必需的酶。苯丙氨酸途径中的黄酮分支是黄酮合成的重要途径。C4H是苯丙氨酸途径第二步的关键酶,也被认为是该途径中的限速酶[48]。研究表明,CHS和CHI是类黄酮生物合成的限速酶[49,50,51]。植物毛状根的研究答:membranaceus检测了茉莉酸甲酯(MJ)和紫外线辐射,发现CHI和IFS是MJ诱导的异黄酮生物合成途径的关键酶。此外,PAL和C4H在uv - b诱导的异黄酮生物合成调控中发挥重要作用[52]。UHPLC-ESI-Q-TOF-MS/MS结果显示,A6中芒柄花素、芒柄花素、毛蕊花素、CG等异黄酮含量高于B2。此外,C4H、CHI、CHR和CHS在答:mongholicus根据生物信息学分析、Pearson相关分析和趋势分析。这四种酶的高表达进一步促进了异黄酮在A6中的积累。
植物异黄酮生物合成的最后一步是糖基化反应,ugt催化底物形成各种糖苷[53]。糖基化反应涉及糖基供体和糖基受体。先前的研究表明,ugt具有底物偏好。黄酮醇、黄烷酮、异黄酮和黄烷醇可被不同的ugt催化生成相应的苷类[54]。糖基供体包括udp -葡萄糖、udp -半乳糖、udp -鼠李糖和udp -阿拉伯糖[55]。在本研究中,c303354和c780119的功能最初被预测为具有7- 0的糖基传递函数,但这些功能没有得到验证。在未来,这两种酶的功能可以在大肠杆菌或酿酒酵母.随后,在转基因受体系统中也可以进行RNA干扰(RNAi)或过表达关键酶,如CHS、CHI、CHR、C4H、UCGT、UFGT等答:mongholicus验证其功能,加强相关研究基础。
结论
转录组学和代谢组学结果极大地阐明了WAM和CAM的代谢物谱和转录组谱变化趋势的相似性。异黄酮,包括芒柄花素、洋葱、毛蕊花素和CG,在A6中高度富集。我们的分析进一步表明,4个关键酶(C4H、CHS、CHI和CHR)的调控是A6异黄酮高积累的主要原因。
数据和材料的可用性
在此研究过程中生成和分析的数据包含在已发表的文章、附加文件和公开可用的存储库中。
参考文献
中国国家药典委员会。中华人民共和国药典。北京:化学工业出版社,2020;chapter1: 315 - 316。
范志强,李晓红,李玉波,李晓红,李晓红,李晓红,李晓红,李晓红,李晓红,李晓红,李晓红,李晓红,李晓红,李晓红,等。黄芪甲苷、毛蕊花素和毛蕊花素-7-的转录谱和分子特征O毛状根中-β- d -葡萄糖苷的生物合成黄芪对茉莉酸甲酯有反应。农业食品化学学报,2015;63(27):6231-40。
褚超,齐立文,李斌,高伟,李鹏。黄芪化学、分析、药理学和药代动力学的最新进展与趋势。化学学报,2010;14(16):1792-807。
徐伯强,陈勇,郭福祥,白德涛,周大东。移栽密度对玉米生长发育、产量和品质的影响黄芪var。Mongholicus.下巴。J.传统;医学杂志,2020;26(2):135-43。
胡明明,郭宝玲,周锐,黄文辉,曹晓军,侯明良。半栽培玉米品质分析黄芪var。mongholicus来自山西浑源。中药材,2012;43(9):1829-183。
冯XJ。蒙古沙苑传粉特性的研究。现代中国医学杂志,2011;13(4):3。
秦晓明,李志勇,孙海峰,张立中,周锐,冯启军,等。中国黄芪资源现状及分析。中华中医杂志,2013;13(19):3234-8。
曹秋文,张锐,李凯,李爱普,刘玉涛,秦晓明。质量评价与商品规格等级研究进展黄芪mongolicus.山西医科大学学报;2019;50(6):854-9。
郭文峰,李明辉,易立林,侯晓康,魏志强。黄芪的种植技术。蒙古变种(大)小:回顾一下。农业学报,2018;9(3):36-43。
孙华,谢东,郭鑫,张立忠,李志勇,吴斌,等。黄芪主要生物活性成分与浓香风味的相关性研究。农业食品化学学报,2010;58(9):5568-73。
李振宇,何鹏,孙海峰,秦晓明,杜光华。基于1H NMR的黄芪抗疲劳代谢组学研究。中华生物医学杂志,2014;6(6):3022-30。
闫涛,任科,白晓荣,张超,李明辉黄芪(费)。乞讨。var。mongholicus(请求)。萧。国防部,下巴。医学。2017;19(7):924 - 8。
熊云峰,万玉青,李坤,李振宇,秦晓明。山西衡山地区蒙古传统黄芪与移植黄芪的品质差异中药材,2017;48(8):1635-43。
辛斌,马世军,谢军,王秋文,侯建林。生长年限对黄酮类和皂苷含量积累的影响黄芪.中华医学杂志,2015;38(07):1366-9。
马田,杜达雷瓦。莽草酸途径与植物芳香族氨基酸的生物合成。植物学报,2012;36(1):73。
Croteau R, Kutchan TM, Lewis NG。植物生物化学与分子生物学,天然产物(次生代谢产物)。植物生理学报,2000;24(2):1250 - 319。
Seyed MN, Dunja Š, michaowt, Milella L, Russo D, Habtemariam S,等。植物类黄酮生物合成途径:代谢工程的多功能靶点。中国生物医学工程学报,2020;38(1):391 - 391。
潘华,王勇,张勇,周天成,方春明,南鹏,等。苯丙氨酸氨解酶是直接控制花蕊异黄酮和花蕊异黄酮-7-积累的开关O-β-Dglucoside在黄芪var。mongholicus植物。实验学报,2008;59(11):3027-37。
李军,李春春,苟剑杰,张玉英。新型异黄酮3-的分子克隆及功能表征O甲基转移酶的葛根.植物科学,2016;7:793。
Libault M, Joshi T, Benedito VA, Xu D, Udvardi MK, Stacey G.豆类转录因子基因:是什么让豆类如此特别?植物生理学报,2009,31(3):991 - 991。
Austin MB, Noel JP。III型聚酮合成酶的查尔酮合成酶超家族。中国生物医学工程学报,2003;20(1):79-110。
陈健,吴晓婷,徐玉青,钟毅,李永勇,陈建军,等。全球转录组分析描述了传统草药的代谢途径黄芪知母。var。Mongolicus(。)萧。BMC Genomics. 2015;16(增刊7):S15。
朴玉军,Thwe AA,李霞,金玉军,金建军,Arasu MV,等。毛状根、不定根和幼苗根的三萜和类黄酮生物合成和代谢分析黄芪.农业学报,2015;63(40):8862-9。
李建平,李建平。植物内毒素的提取。日本莲手册。多德雷赫特:施普林格;2005.p . 355 - 62。
Alseekh S, Perez de Souza L, Benina M, Fernie AR.植物类黄酮装饰的类型和物质同时定义结构和功能。植物化学。2020;174:112347。
李培强,阮志,费志祥,闫建军,唐光华。综合转录组学和代谢组学分析显示,黄酮类化合物的生物合成可能主导了抗性花椒防止茎溃烂。农业食品化学学报,2021;69(22):6360-78。
张锐,曹秋文,李凯,秦晓明。黄芪商业性状与化学性状及绝对生长年数的相关性分析。中草药,2020;51(02):451-60。
Burke PV, Bullen BL, Poff KL.用于数据快速分析的频率分布直方图。植物生理学报。1988;37(4):798 - 798。
王彦明,刘磊,马彦坤,郭磊,孙勇,刘强,等。化学鉴别黄芪mongholicus和黄芪使用UHPLC-ESI-Q-TOF-MS/MS方法进行代谢组学分析。分子.2019; 24(22): 4064。
潘海燕,方春明,周天成,王其智,陈建军。毛蕊异黄酮的积累及其7-O-β- d -葡萄糖苷及其相关基因的表达黄芪知母。var。mongholicus(。)低温应力诱导的萧。植物学报,2007;26(7):1111-20。
田村K, Peterson D, Peterson N, stechher G, Nei M, Kumar S. MEGA5:基于最大似然、进化距离和最大简约方法的分子进化遗传学分析。生物医学进展,2011;28(10):2731-9。
Du ZF。多元统计分析。北京:清华大学出版社;2016.p . 240 - 1。
Yadav V,王忠,魏超,Amo A, Ahmed B,杨鑫,等。苯丙烷途径工程:一种植物防御的新方法。病原体。2020;9(4):312。
李达元,金建军,Shrestha S,徐健,李彦宏,卢海军,等。质量评价人参根使用快速分辨率LC-QTOF/ ms为基础的代谢组学方法。分子。2013;18(12):14849 - 61。
郭小强,田建军,石碧,邢健,贾剑平,张立忠,等。逍遥散抗抑郁的1H-NMR代谢组学研究柴胡属scorzonerifolium或北柴胡.中药材,2012;43(11):2209-16。
李云云,王晓霞,赵磊,张宏,吕磊,周国光,等。高效液相色谱-电喷雾电离飞行时间质谱法分析鼠尾草代谢组学研究。色谱学报,2013;51(2):99-106。
庞云云,薛丽丽,郑永华,周永忠,秦晓明,杜光华,等。质量的比较研究黄芩采用UHPLC-MS/MS代谢组学技术对不同采收期的地瓜进行分析。医药学报,2017;52(12):1903-9。
高思义,李凯,熊云峰,秦晓明,崔广广,张翔,等。衡山仿野生栽培黄芪生长年限鉴定及黄酮类和皂苷积累规律研究。医药学报,2018;53(1):147-54。
胡明明,陈建军,郭宝玲,黄文辉,曹晓军,侯丽丽.影响野生植物品质的环境因素分析[j]黄芪varmongholicus在衡山。中药材,2012;43(5):161-6。
滕惠明,王丽丽,胡晓晨,王文华,胡振华。植物营养器官解剖与活性成分积累黄芪var。mongolicus.西北学报,2017;37(2):0279-85。
罗静。基于代谢物的植物全基因组关联研究。植物学报,2015;24:31-8。
徐鹏平,魏丽丽,黄顺生,杨宝成,王玉玲,袁海军,等。青科植物的抗旱性涉及苯丙素途径的重编程和以类黄酮生物合成为目标的udp -葡萄糖基转移酶对非生物胁迫耐受的调节。食品科学与技术学报,2011;39(2):591 - 591。
董晓康,高玉青,魏超,王文伟,龚丽,刘小强,等。水稻酚胺类物质时空分布及羟基肉桂酰亚精胺自然变异的遗传植物学报,2015;8:111-21。
李毅,陈毅,周磊,游思杰,邓华,陈毅,等。MicroTom代谢网络:重新布线番茄整个生长周期的代谢调节网络。植物学报,2020;13(8):1203-18。
刘HX。让衡山黄芪成为“中国之宝”。《大同日报》2020年3月20日
李丽,孙旭,马建林,赵颖。异黄酮合成关键酶CHS、CHI的研究进展。大豆学报,2007;26(5):762。
张志,刘志康,黄志,马军,姚东,曲军,等。大豆查尔酮还原酶基因的分离与功能鉴定GmCHR4.油料作物科学,2014;36(6):720-7。
罗晓军,刘晓春,杨学祥,袁杰。克隆及组织表达分析高压无壳大麦的C4H基因。植物遗传资源学报,2014,15(3):589-96。
张晓东,尹永春,周生,马玉英,胡涛,高志强,等。植物查尔酮异构酶基因的克隆与序列分析甘草glabra[j] .生物工程学报,2017;28(4):478-84。
钟伟,刘宇,刘秀敏,O'Keefe DP, Odell J, Fader G,等。豆科植物异黄酮合成关键酶异黄酮合成酶的鉴定与表达。生物工程学报。2000;18(6):518 - 518。
盖庆英,焦军,罗明,王伟,顾宝成,付玉军,等。异黄酮生物合成、相关基因表达和抗氧化能力显著增强黄芪茉莉酸甲酯诱导毛状根培养。生物化学学报,2016;51(5):642-9。
焦静,盖庆英,王伟,罗敏,顾宝成,付玉军,等。紫外辐射诱导了黄酮类化合物积累、生物合成基因表达和抗氧化活性的增强黄芪毛状根培养。农业食品学报,2015;63(37):8216-24。
王晓华,王晓华,王晓华,等。糖基转移酶在植物天然产物合成中的应用。植物科学进展,2000;5(9):380-6。
李建军,李建军,李建军。亲脂小分子的糖基转移酶。植物生态学报,2006;37(1):597 - 597。
黄酮类化合物o糖基化的研究进展。中国生物医学工程学报,2016;31(4):559 - 561。
资金
国家自然科学基金(批准号:31570346)资助。
作者信息
作者及单位
贡献
ZFS和QXM设计并监督了该项目。XZ, LYY, LHJ贡献了实验材料。XZ进行数据分析并撰写论文。ZFS、XZ、QXM对稿件进行了修改。所有作者都讨论了结果并对稿件进行了评论。作者们阅读并批准了最后的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用
发表同意书
不适用
相互竞争的利益
作者宣称他们没有竞争利益。
额外的信息
出版商的注意
伟德体育在线施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。
补充信息
附加文件1:表S1。
所有样本的信息。表S2。本研究使用的qRT-PCR引物。表S3。用于系统发育分析的ugt序列信息。表S4。直径范围答:mongholicus在不同的生长方式下。表S5。详细信息鉴定代谢物在答:mongholicus.表S6。异黄酮生物合成途径中代谢产物的峰面积。表S7。候选基因信息。表S8。候选基因的FPKM。表S9。qRT-PCR分析11个异黄酮相关基因的Pearson相关性。表S10。11个异黄酮相关基因与6个代谢物的Pearson相关分析。图S1。样品处理方法示意图。图S2。的直径散点图和频率分布直方图答:mongholicus.图S3。的直径散点图和频率分布直方图答:mongholicus.图S4。A6和B2代谢组学分析。图S5。生物过程、细胞成分和分子功能类别中所有注释的unigenes的GO术语分布。图S6。由单一基因富集的KEGG通路。图S7。异黄酮相关基因的表达答:mongholicusqRT-PCR分析。图S8。qRT-PCR分析A6与B2异黄酮相关基因的差异表达。图S9。异黄酮相关基因qRT-PCR的STEM分析
附加文件2。
候选基因序列。
附加文件3。
DESeq.A6_vs_B2。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
张飞,张翔,罗勇。et al。不同生长方式对大豆异黄酮积累的生物合成机制影响黄芪mongholicus产品。BMC Plant Biol22, 410(2022)。https://doi.org/10.1186/s12870-022-03769-5
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-022-03769-5
关键字
- 黄芪mongholicus
- 异黄酮积累
- 生物合成
- 转录组
- 代谢组学
- 不同的生长模式