摘要
背景
寒冷是严重影响植物生长发育和作物产量的主要非生物胁迫之一。低温胁迫下的转录变化已经在多种植物中得到了深入的研究。然而,调控不同抗寒性烟草品种间抗寒性差异的基因网络十分有限。
结果
在这里,我们对太烟(TT,冷敏感性)和烟(YT,抗寒性)进行了多时间点转录组分析,对比了不同的冷反应。与未经过冷处理的对照相比,我们发现这两个品种的deg相似,主要参与对非生物刺激、代谢过程和激酶活性的响应。通过对两个品种在各时间点的比较,与TT相比,YT具有更高的环境胁迫相关基因的表达水平。通过加权基因共表达网络分析(WGCNA),鉴定出两个主要模块:粉色模块相似,棕色模块不同。此外,我们获得了100个枢纽基因,其中包括11个可能参与冷胁迫的重要转录因子(TFs),棕色模块中的3个关键转录因子,粉红色模块中的8个关键转录因子。更重要的是,利用GENIE3分析了TFs与其他基因或TFs之间的遗传调控网络(grn),鉴定出主要参与两个品种差异冷响应的3个TFs (ABI3/VP1、ARR-B和WRKY),以及主要参与冷响应的3个关键TFs (GRAS、AP2-EREBP和C2H2)。
结论
总的来说,我们的研究为基于转录组的烟草冷反应基因网络研究提供了宝贵的资源。它有助于揭示关键的冷反应tf或其他基因是如何通过网络调节的。这也有助于鉴定潜在的关键冷响应基因,为今后烟草耐寒性增强品种的遗传操作提供依据。
背景
无柄植物在生命周期中不断受到干旱、盐、热、冷等各种非生物线索的影响。这些压力极大地限制了它们的正常生长和发育,以及最终的生产力[1].自然发生的冷胁迫通常会导致复杂的症状,包括生长迟缓、叶片黄化、枯萎和下垂、组织或植物的冷/霜/冻伤和最终死亡[2,3.,4].因此,冷胁迫被认为是影响植物生命周期的最具破坏性的威胁之一[5,6].植物必须调整多层瞬态变化,包括生理、生化、代谢和分子变化,以适应冷胁迫[j]。4,7,8,9,10,11,12].
基因表达变化是植物应对冷胁迫的适应性分子机制之一。特别是,快速上调冷响应基因,如C-REPEAT BINDING FACTOR (CBF)基因、COR (Cold Regulated)基因等关键调控基因,可以增强耐寒性[7,12,13,14,15,16,17,18].随着高通量测序的出现,转录组学研究已广泛应用于许多植物物种,包括模式植物[19]、农作物、园艺植物[20.,21,22,23]、蔬菜[24,25,26,27,28],树木[29,30.]和烟草[31,32].这些研究提供了在冷胁迫下转录变化如何发生的见解。
烟草(烟草),原属热带和亚热带植物。目前,它已成为全球范围内广泛种植的经济作物。此外,烟叶和BY-2细胞为功能基因组学和代谢研究提供了一个很好的系统[33,34].然而,烟草总体上很容易受到冷胁迫的影响[35,36,37,38].烟草对寒冷反应的机制已经在生理、生化、转录和代谢水平上进行了研究。冷驯化通过提高抗氧化酶活性、渗透调节电位和光化学效率来帮助烟草应对冷胁迫[j]。39],这些变化部分是由基因表达重编程和代谢物引起的[31].冷处理可以改变光合作用、蛋白质/RNA加工和氧化还原等过程中某些功能蛋白的积累水平[j]。40].NtbHLH123作为积极调节因子激活冷反应基因的表达,NtCBF(c -重复结合因子),减轻活性氧(ROS)的损伤,从而增强抗寒能力[41].此外,功能研究表明,叶绿体ω−3脂肪酸去饱和酶基因过表达的烟草植株[36],TaWRKY10[42],荠菜CE53和CBF基因(CblCE53和CbCBF) [43表现出更强的耐寒性,表明这些基因在烟草的寒冷反应中起着积极的作用。因此,阐明冷反应的潜在机制,特别是确定关键的冷反应基因,有助于培育耐冷烟草转基因品种。然而,烟草中与寒冷反应相关的基因网络仍未得到充分研究。
结果
低温处理下两个品种差异表达基因的鉴定
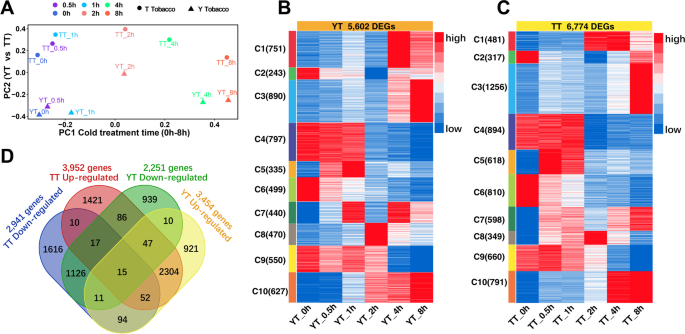
烟叶(YT)和太叶(TT)是两种重要的烟草品种,但对寒冷的反应却截然不同。YT具有抗寒性,而TT对冷胁迫敏感。为了研究两个品种在冷胁迫下的转录变化,我们在4°C冷处理前(0 h, CK)和后(0.5 h, 1 h, 2 h, 4 h和8 h)的6个时间点进行了rna测序,每个样品3个生物重复(附加文件)2:表1)。相关性分析表明,在YT (Additional文件)的同一时间点内,复制数据一般具有良好的相关性1:图S1A)或TT(附加文件)1:图S1B)。
为了检验冷处理后YT和TT与时间点相关的转录变化,我们进行了主成分分析(PCA),观察到TT和YT之间的PC2差异很大(图2)。1A).冷处理后YT和TT的时间点相关表达变化趋势相似,1 h前表达变化轻微,2 h后表达变化剧烈(图2)。1A)。然后,我们确定了与CK相比,在暴露于冷处理后的每个时间点,TY和TT中出现的差异表达基因(DEGs)2表2)。我们发现,在同一时间点,TT比YT有更多的dge,特别是对下调基因,这表明在冷胁迫下,TT相对于YT有更多的基因是动态的。为了评估冷诱导的YT或TT的转录变化,我们计算了总冷诱导的DEGs,其中一个至少在一个时间点差异表达,在YT (5622 DEGs)和TT (6799 DEGs)中。然后,我们通过去除一些极端的表达值来标准化deg的表达,并生成一个包含10个子簇的热图,以可视化YT (5602 deg)的时间点相关变化。1B)或TT(6774℃,图。1C)在YT和TT之间。在时间点上观察到YT和TT对冷刺激的相似和明显的变化。两两比较后,我们发现TT和YT中分别有1169和2418个基因下调和上调,337个基因(165个基因在TT中上调而在YT中下调,172个基因在TT中下调而在YT中上调)在TT和TY中表现出相反的表达变化,其余的上调或下调基因是TT或YT所特有的(图2)。1D)。
为了评估deg是否与任何重要的生物学相关性相关,我们使用上调和下调的基因进行了氧化石墨烯项富集分析。我们发现上调的基因比下调的基因有更多的氧化石墨烯项(附加文件)1:图S2)。此外,我们发现氧化石墨烯术语在TT或YT特异性上调基因中发生差异。氧化石墨烯在信号/分子转导活性、对刺激的反应、受体/结合活性和(细胞)蛋白质/初级代谢过程中的功能在TT而不是YT的上调基因中显著富集。相比之下,类囊体、光合作用、膜、细胞外区域以及前体代谢物和能量的产生等功能在YT中被上调的基因中被过度表达,而在TT中则没有(附加文件)1:图S2)。此外,在TT中上调而YT中下调的基因和TT中下调而YT中上调的基因中,GO术语的出现也存在差异(附加文件)1:图S2)。
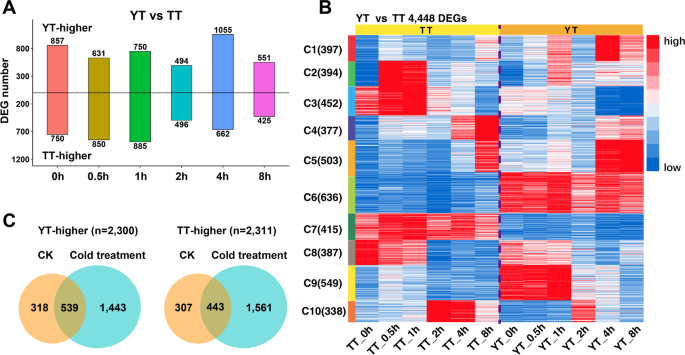
为了进一步评估冷诱导的YT和TT之间的转录变化,我们确定了YT和TT之间在每个时间点发生的DEGs(图2)。2A).我们注意到冷处理(CK)前有857个t -high基因和750个tt -high基因,反映了基因型相关基因的表达变化。如图所示。2 b将YT和TT之间的4448个deg分为10个亚群,以显示每个时间点基因型相关基因的表达变化。例如,C6和C7中的deg在YT和TT中几乎在每个时间点都有高表达。为了评估每个簇中的deg是否具有显著的功能富集,我们进行了氧化石墨烯项富集分析。我们观察到10个子集群中GO术语的变化(附加文件)1:图S3)。C10中的DEGs表现出与代谢过程、膜和类囊体相关的高度富集的氧化石墨烯功能;C6和C9中DEGs的氧化石墨烯功能在应激反应中被过度表达。综上所述,上述分析表明,在TT和YT之间的每个时间点,deg的表达谱和GO项功能都存在差异,从而导致TT和YT之间对冷处理的响应发生变化。
与对照相比,我们在冷处理下鉴定出1443个yt -high基因和1561个tt -high基因(图2)。2C)。根据氧化石墨烯项富集分析,我们在CK和冷处理中观察到与上调或下调基因相关的不同氧化石墨烯项(附加文件)1:图S4)。总体而言,CK中上调基因主要负责DNA/蛋白/核苷酸结合活性、激酶/水解酶/焦磷酸酶活性等基础生物学功能,而冷诱导下上调或下调基因则主要富集一些生物调控功能、胁迫响应、光合作用相关功能和繁殖功能。总的来说,转录组学分析表明,在冷处理过程中,TT和YT有一些特定的DEGs在不同的生物过程中发挥作用,这可能导致YT和TT之间的冷反应差异。
冷处理下差异表达tf和蛋白激酶的鉴定
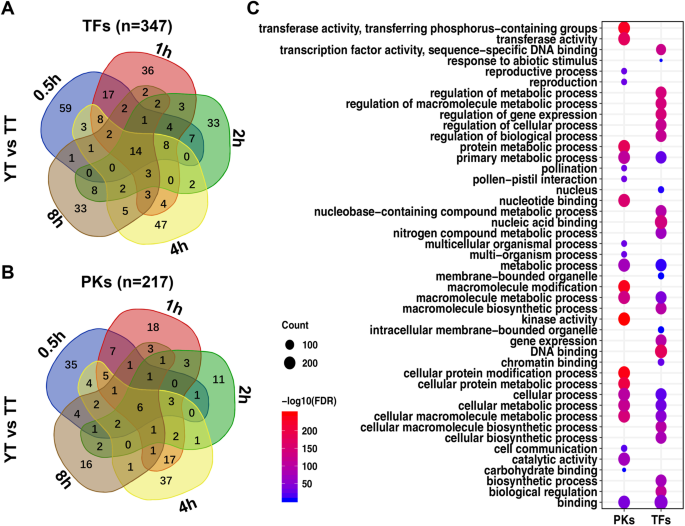
文献显示,转录因子[44,45]和多种蛋白激酶(PKs) [46,47,48]在植物对非生物/生物胁迫的反应中起着关键的调节作用。为了评估tf和PKs在低温处理下在TT/YT中或TT与YT之间的表达差异,我们将TT/YT中或TT与YT之间的所有deg分为tf、PKs和其他基因(附加文件)1:图5)。与TT相比,YT的下调tf和PKs数量相似,但上调tf和PKs数量较少。此外,我们观察到TT/YT中或TT和YT之间下调和上调的tf百分比的变化(附加文件)1图S6A)。例如,WRKY、MYB、NAC和AP2-EREBP TFs在TT和YT中表达上调的比例相对较高。在TT和YT下调和上调的TFs中,GRAS、C2H2和bHLH TFs所占比例相似。同样,我们还观察到TT/YT中或TT和YT之间下调和上调PKs百分比的变化(附加文件)1图S6B)。在TT和YT中,LRR激酶xi和xii较其他PKs下调较多,而LRR激酶VII和III较YT下调较多。
为了检测冷处理下tf和PKs的时间依赖性表达变化,我们使用TT和YT中差异表达的tf和PKs进行两两比较(附加文件)1:图S7)。对于609 tf /384 PKs在TT(附加文件1:图S7A, B)和YT中的526 tf /303 PKs(附加文件)1(图S7C, D),在冷处理后至少在一个时间点存在差异表达,TT组的89个tf /79个PKs和YT组的47个tf /19个PKs在所有时间点都存在差异表达(另一文件)2(表S3),其他tf和PKs在冷处理下的一个时间点差异表达。同样,我们使用347个tf进行了类似的分析(图2)。3.A)和217 PKs(图2)。3.B)在冷处理下,TT与YT至少有一个时间点差异表达。与TT相比,我们发现14个tf /6PKs在冷处理的所有时间点上都有差异表达(附加文件)2表S3)。
在进行氧化石墨烯项富集分析后,我们发现347个PKs具有显著富集的氧化石墨烯项,这些氧化石墨烯项具有转移酶活性、(细胞)蛋白质代谢过程、大分子/细胞蛋白质修饰、激酶活性等功能;正如预期的那样,具有217个TFs功能的氧化石墨烯术语主要在转录因子活性、核酸/DNA结合、基因表达和代谢过程的调控以及生物调控中被过度代表(图2)。3.C).基于上述分析,我们发现冷处理后两种样品中差异表达的TF主要包括AP2-EREBP、BHLH、WRKY、MYB TF家族,蛋白激酶主要包括亮氨酸富重复序列(Leucine Rich repeat)、植物外反应激酶(Plant External Response Like Kinase)和钙依赖蛋白激酶(Calcium Dependent protein Kinase)。除了一些在不同植物物种的冷反应中已经报道的tf或蛋白激酶[41,49,我们发现了一些新的基因,比如Nitab4.5_0002105g0060(乙炔)(附加文件2(表S3)可能与冷反应有关,这需要在烟草或其他植物中进行功能验证。
加权基因共表达网络分析(WGCNA)
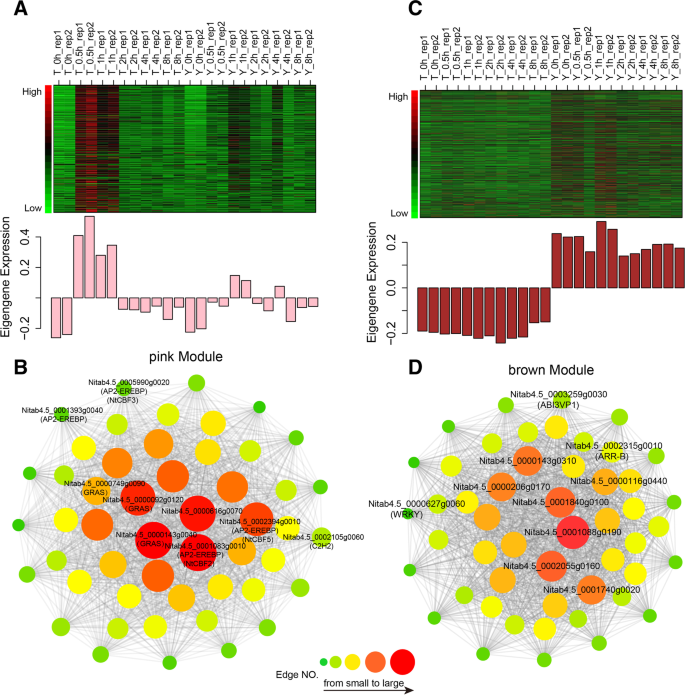
为了进一步揭示枢纽基因或TFs是否通过与TT和YT中其他基因或TFs的相互作用参与冷反应,我们进行了加权基因共表达网络分析(WGCNA) [50]使用9583个deg,这些deg在冷处理后至少在TT或YT中有一个时间点差异表达。特别是,WGCNA特别关注了两个相关性良好的生物复制(附加文件1:图S8)。根据WGCNA包函数,我们获得了17个用不同颜色显示的共表达模块(图2)。4A)。在提取每个模块的基因和tf数量后,我们观察到每个模块的基因或tf数量的变化,从灰60模块的38个基因和2个tf到绿松石模块的2258个基因和233个tf,平均数量为488个基因和44个tf(附加文件)1:图S9)。此外,我们构建了模块-时间点相关热图,以便清晰地可视化各个模块与每个时间点之间的相关性(图2)。4B)。我们还检测了每个模块中共表达基因在每个时间点的总体表达趋势(附加文件)1:图10)。我们发现,棕褐色模块基因在各时间点的总体表达量在YT组高于TT组;在YT和TT冷处理的第一个时间点(0.5 h),粉色模块基因有上调的趋势。
烟草低温反应关键基因的鉴定
我们将17个模块分别连接到TT和YT冷处理后的每个时间点。根据模时间点关联,我们发现在TT中,粉色模基因与时间点的相关系数在冷处理前(0 h)非常低,而在冷处理后0.5 h变得非常高。类似的趋势也发生在YT,但变化相对较弱(图2)。4B和5A)。同时,粉色模块包含471个基因,包括80个TF,是相对于其他模块的TF最多的模块(附加文件1:图S9)。为了评估粉色模块中基因在冷反应中的作用,我们进行了氧化石墨烯项富集分析,发现它们主要参与各种生物和代谢过程(附加文件)1:图S11A)。与基因表达调控、代谢过程调控、细胞过程调控、生物过程调控以及DNA结合相关的GO术语在冷处理后基因富集,这与植物对冷处理的调节变化的可能性是一致的。
为了进一步评估粉色模块中的基因是否通过与其他基因的相互作用参与冷反应。我们生成了一个共表达网络,包含边权> 0.1的基因和前50个边数,这些边来自粉红色模块中的deg。我们在粉色模块中获得了前50个枢纽基因,其中包含8个TFs和42个其他基因(图2)。5B、附加文件2:表S4)。网络中hub基因的具体描述在附加文件中列出2表S4。我们确实发现了一些与寒冷和压力相关的重要基因,比如NtCBF[41在应对冷应激中发挥重要的调节作用[18]、其他AP2-EREBP、GRAS和C2H2 TF家族。
TT和YT之间冷反应差异基因的鉴定
经过更仔细的研究,我们发现只有棕色模块与YT的所有时间点表现出高度关联,而不是TT(图2)。4B),提示该模块可能包含负责YT耐寒性的基因。与此一致的是,我们发现与TT相比,棕色模块中的基因在YT的所有时间点都主要上调(图2)。5C)。为了评估棕色模块中的共表达基因是否可能参与了TT和YT之间不同的冷反应,我们进行了氧化碳项富集分析,发现它们主要参与对应激或刺激的反应(附加文件)1:图S11B)。
同样,我们构建了一个共表达网络,其中包含边权> 0.1的基因和前50个边数,这些边来自棕色模块中的deg(图2)。5D).我们发现共表达网络包含一些枢纽基因,如RAP74UDP-Glycosyltransferase,WRKY21,VP1 ABI3 /(脱落酸不敏感3/胎生1,rav);PSP(3-磷酸丝氨酸磷酸酶)和ARR12(A型反应调节因子12)基因2表5)。其中一些基因已被发现参与植物的应激反应或信号转导[51,52,53,54,55,56].此外,AtRAP74通过与CTD磷酸酶样3 (CPL3)和CPL4相互作用参与渗透胁迫和ABA信号传导[57].
综上所述,上述分析表明,棕色模块基因的差异表达可能导致了TT和YT对冷处理的不同反应。
枢纽转录因子(TFs)在低温胁迫中的作用
基于WGCNA,我们发现了一些重要的枢纽基因,它们彼此在同一模块中共表达。我们推测它们之间是否存在一定的调控关系,在冷处理条件下对deg的调控中发挥重要作用。通过使用基于树的方法[58],我们利用粉色或棕色模块中的11个hub tf作为调控因子,构建了推断调控网络,研究tf与deg之间的调控关系。我们通过R包GENIE3(附加文件)获得了包含11个tf的遗传调控网络(grn)1图S12,附加文件2表S7)。我们发现11个tf可能与上述中心基因有交互作用关系,但也与其他模块中的基因有交互作用关系(附加文件)1:图S12),表明11个tf在TT或YT对冷胁迫的响应中发挥重要的调节作用。为了更清楚地可视化这些基因之间的调控关系,我们举例说明了仅包含WGCNA中鉴定的粉红色或棕色模块的枢纽基因/ tf的网络(图2)。6).我们清楚地观察到枢纽TFs和枢纽基因之间存在调节关系。例如,在棕色模块中,三个枢纽tf (ABI3/VP1, ARR-B和WRKY)与枢纽基因或彼此之间表现出调节关系(图2)。6).已有文献表明,WRKY TF家族参与了几种植物的冷胁迫[59],例如拟南芥[60]和茄子[61].此外,TFs和枢纽基因之间的调控关系也发生在粉色模块中,包括冷响应性TFsNtCBF2,NtCBF3和NtCBF5,在烟草中有很好的特征[41].部分TFs (肝,乙炔和AP2-EREBP)在网络中也检测到与应激/刺激反应相关的,并表现出与其他枢纽基因和deg的调节关系(图2)。6;额外的文件1:图12)。在拟南芥,肝该基因可诱导应激,并通过调节其他相关基因的表达来增强耐寒性[62].因此,根据GRN,我们确定了已知与烟草冷应激相关的基因,如NtCBF基因;更重要的是,我们还发现了与寒冷反应有关的其他基因。
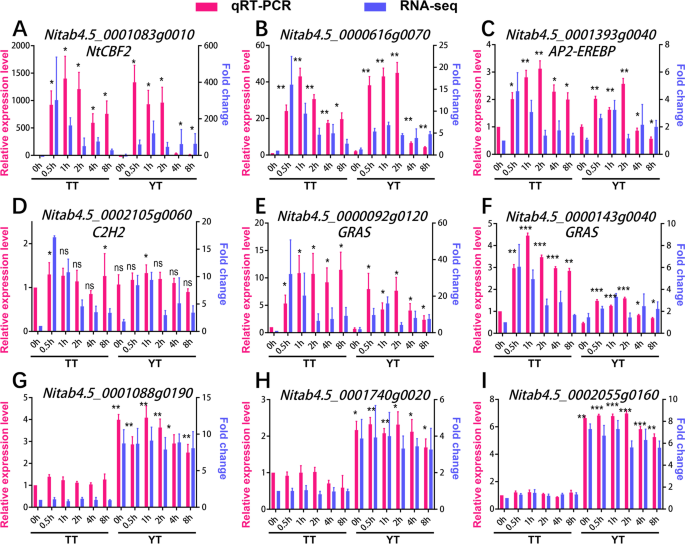
为了验证RNA-seq数据鉴定的deg和通过grn鉴定的枢纽基因的准确性,我们对随机选择的13个deg进行了qRT-PCR检测,其中粉红色模块中有6个枢纽基因/TFs(图2)。7A, B, C, D, E, F),棕色模块中有7个枢纽基因/ tf(图2)。7G, h, i;额外的文件1(图S14 A, B, C, D)。我们发现,与RNA-seq结果相比,9个基因(约69%),包括6个(100%)粉色模块基因,3个(约43%)棕色模块基因,在冷处理下表现出类似的表达变化趋势(图S14 A, B, C, D)。7).例如,Nitab4.5_0001083g0010 (NtCBF2)在检测的所有时间点(0.5 h, 1 h, 2 h, 4 h, 8 h)与对照(0 h)相比,表达上调(图2)。7一个),Nitab4.5_0001088g0190在各时间点YT相对于TT上调(图2)。7G),而其余4个基因与RNA-seq结果不同(附加文件1:图S14)。RNA-seq和qRT-PCR结果的不一致很可能是由于不同批次的生物样品在冷处理过程中存在差异。尽管我们遵循与RNA-seq相同的程序来培养材料和冷处理,但在基因表达水平上很难像以前那样获得100%的可重复性。我们也不能排除RNA-seq鉴定的部分deg可能是假阳性的可能性,这可能不是冷处理直接导致的。
网络中部分关键基因的qRT-PCR检测。双y轴图显示了通过RNA-seq(与TT 0 h相比的表达折叠变化,蓝色)和qRT-PCR(相对表达水平,红色)检测到的每个基因的平行比较。右坐标(y轴)蓝色表示RNA-seq的表达折叠变化,左坐标(y轴)红色表示qRT-PCR的相对表达水平。各时间点各基因的转录水平相对于内控(NtActin7).计算检测基因的相对表达量,表达为2——ΔΔCT[63]相对于相应的表达水平NtActin7,设为1.0。从三个生物重复中计算平均表达水平。误差条是三个生物重复的标准差。显著性检验采用Student’s t检验。" ns ":不重要," * ":p< 0.05,“**”:p< 0.01,“***”:p< 0.001
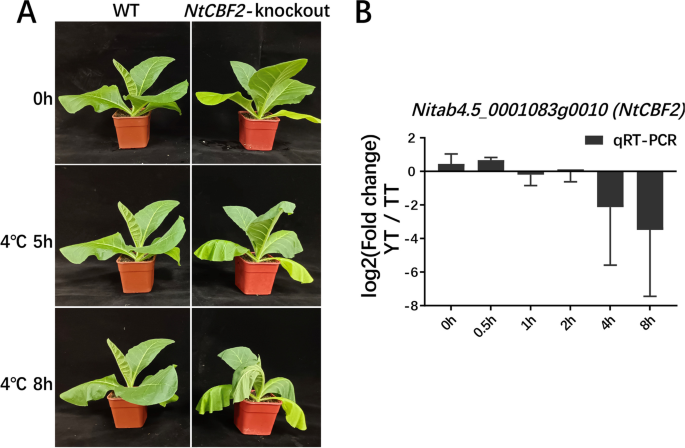
进一步确认的作用NtCBF2在增强耐寒性方面,我们生成了基于CRISPR-Cas9的NtCBF2K326基因敲除(KO)转基因株系8A、附加文件1:图S13)。经冷处理后,我们发现转基因系损失了NtCBF2基因功能在冷处理后5 h表现为两片下垂叶片,而延长冷处理的冷损伤更为严重,因为转基因系在冷处理后8 h表现为4片下垂叶片,与正常条件下生长的WT相比。这个结果证实了NtCBF2基因在烟草冷反应和耐受性中发挥作用,表明构建的以tf为中心的烟草冷反应调控网络的准确性。此外,我们比较了qRT-PCR结果与时间过程相关的差异表达模式NtCBF2在TT和YT之间。我们发现,在冷处理后0.5 h、4 h和8 h,其表达量在YT和TT之间的变化是CK (0 h)的两倍,而冷诱导的表达趋势是NtCBF2与4 h/8 h相比,0.5 h时YT和TT的值相反(图2)。8B).冷处理后;NtCBF2在0.5 h时表达量增加,而在4 h和8 h时表达量明显低于TT(图2)。8B).评估是否存在导致差异表达的序列变异NtCBF2在两个品种间的冷处理下,我们利用RT-PCR获得了CDS全序列,并利用PCR扩增了每个品种的启动子区域(ATG上游1.5 kb)进行测序。我们没有观察到cDNA和启动子区有任何序列多态性NtCBF2在YT和TT之间(附加文件)1:图15)。潜在的监管机制需要进一步研究。在讨论部分讨论了该基因在YT和TT之间冷诱导表达变化的可能原因。
讨论
为了应对影响植物正常生长发育的各种环境胁迫,无根植物必须在多个层面上进行调整,以适应这些胁迫,从而更好地生存。它们包括形态、生理、生化、代谢、遗传和表观遗传变化[64,65,66,67].在不同的植物物种中,对冷胁迫的全球转录变化进行了深入的研究[22,23,32,68,69,70].然而,与烟草冷处理相关的转录组网络研究相当有限。本研究对耐寒烟草品种TT和耐寒烟草品种YT进行了全面的多时间点转录组分析。我们观察到基因在每个时间点在每个品种或两个品种之间上调或下调(附加文件)2(表S2),包括冷反应基因或tf,如蛋白激酶和NtCBF基因(附加文件)2表6)。在两种具有不同冷敏感性的烟草品种中也进行了与冷处理相关的类似比较转录组学研究[71],由于当时无法获得烟草基因组序列,使用组装的所有独特基因鉴定了3557个冷诱导基因,使用马铃薯(茄属植物tuberosum)基因组作为参考。为了对两项研究进行平行比较,我们重新分析了1840个deg,就像我们使用烟草(烟草)基因组序列作为基因注释的参考。我们发现只有940度最适合烟草基因组。根据重叠比较,我们发现940个基因中有354个基因(约38%)也存在于9583个基因中,其中3个基因,4.5 _0000532g0070 Nitab。,4.5 _0001244g0020 Nitab。和4.5 _0002394g0010 Nitab。(NtCBF5),在我们的研究中存在于100个中心基因中。两项烟草低温相关研究的不一致很可能是由于使用了不同的参考基因组来鉴定deg和随后的基因注释。
此外,我们的研究还提供了TT和YT之间转录组变化的证据,这可能解释了TT和YT之间基于转录组的冷胁迫差异反应。它提供了TT和YT之间涉及冷反应的共同机制的证据。NtCBF冷响应基因在TT和YT中均上调。特别是,TT和YT具有相似的共表达基因网络(粉色模块,图5)。5B)。我们还观察了正常生长条件下(CK)基因型相关基因的表达变化。与冷处理前的TT相比,YT组上调基因857个,下调基因750个(图2)。2此外,YT在冷处理下的基因表达变化小于TT(另附文件)2:表S2),因此YT比TT可以花费更少的能量来重塑染色质结构以重编程基因转录。我们认为,在冷诱导前的这些deg可能有助于提高YT在应对冷胁迫的初始阶段耐受冷胁迫的能力。此外,我们发现TT特异性上调基因,包括TT中上调而YT中下调的基因,在各种生物和代谢过程以及应激反应中表现出更多的GO term富集。植物需要消耗更多的能量来完成这些过程,因此必须使用更少的能量来应对冷胁迫,因此导致对冷处理的敏感性。真核细胞需要消耗代谢燃料氧化产生的能量来完成各种依赖能量的生物过程[72].具有ATP供应的过氧化物酶体对植物幼苗发育至关重要拟南芥[73].相比之下,包括在YT中上调而在TT中下调的基因在内的YT特异性上调基因主要参与光合作用、膜功能和能量产生。因此,YT可以产生更多的能量,维持膜的稳定性,有利于植物抵御寒冷的伤害。据报道,经过冷驯化的植物的光合能力增加[74,75,76,77,78].膜蛋白和脂质的重塑以及膜流动性和通透性的维持是植物适应冷胁迫的主要适应策略之一[j]。79,80,81].
此外,我们观察到TT和YT之间的差异共表达网络。棕色模块中富含氧化石墨烯项的基因在应激反应中表达上调,而在YT而不是TT中表达上调(图2)。5C、附加文件1:图S11B)。更重要的是,我们确定了3个TF (ABI3/VP1, ARR-B和WRKY)主要参与两个品种之间的差异冷响应,3个关键TF (GRAS, AP2-EREBP和C2H2)主要参与冷响应(图2)。6).其中一些已被充分证明与其他植物物种的冷或应激反应有关。例如,C2H2锌指基因家族(ZAT12和ZAT10)已被报道参与应激反应[82,83].烟草GRAS蛋白与SCL13和PAT1蛋白同源拟南芥,分别参与光敏色素A (PhyA)信号转导和B (PhyB)相关的环境温度响应[84,85,86].乙烯响应元件结合因子(ERFs)参与了各种非生物胁迫,如寒冷、干旱和盐度[j]。87].COBL7基因已被报道在纤维素生物合成中起作用拟南芥而大米[88,89].AP2-EREBP家族参与胁迫反应已在几种植物中得到证实,如拟南芥[90],大米[91],玉米[92],棉花[93],Brachypodium Distachyon[94],Ammopiptanthus矮子[95].据报道,CERK1介导几丁质在盐胁迫中的作用拟南芥[96].据报道,AtWRKY21和arr12在干旱胁迫中起负调节作用拟南芥[52,97].盐胁迫可增加PSP的表达芸苔属植物juncea[51].丝氨酸/苏氨酸磷酸酶2A型(PP2A)在植物适应性生物和非生物胁迫反应的调控中起着至关重要的作用[98].拟南芥AB13/VP1基因过表达转基因植物(MtRAV3)从m . truncatula增加对冷处理的耐受性[99].过表达的水稻转基因植株GSA1编码一个udp -葡萄糖基转移酶可以增强对高温、NaCl和PEG胁迫的耐受性[56].我们的研究还表明,在寒冷胁迫下,蛋白酶激酶的表达存在差异,这表明蛋白激酶可能在烟草对寒冷处理的反应中发挥关键调节作用。据报道,在植物非生物胁迫过程中,蛋白激酶在级联信号转导中起着至关重要的作用[One hundred.,101].烟草丝裂原活化蛋白激酶激酶激酶(烟草PK1)表现出更强的抗冻性[102].烟草植株过表达马吕斯有明显钙依赖性蛋白激酶(MdCPK1a)基因ROS积累水平低,导致抗寒能力增强[103].蛋白激酶在烟草低温反应中的作用有待进一步研究。
此外,值得注意的是NtCBF2通过WGCNA利用TT和YT之间的deg筛选得到,但仅在K326背景下进行了功能验证,而没有对两个品种进行功能验证。更高的表达NtCBF2在冷处理初期,YT比TT更有利于提高抗寒性。qRT-PCR结果证明了这一点NtCBF2在冷处理前0 h和冷处理后0.5 h表达量较多,而在冷处理后4 h和8 h表达量明显少于TT(图2)。8B).因此,YT可能更早地激活冷反应,因此在冷处理开始时受到的冷损伤比TT小。除了…之外NtCBF2经冷处理后,YT比TT有更多高表达的冷反应基因(图2)。5).因此,两个品种之间的冷反应差异可能是由于一些关键冷反应基因的表达差异或其下游冷反应tf靶点功能的潜在差异造成的。
考虑到在cDNA和近端启动子区域未发生序列多态性NtCBF2在YT和TT之间(附加文件)1:图S15),差异转录NtCBF2YT和TT之间的差异可能是由以下几种可能性引起的:1)其上游调节因子如tf的不同表达;2)影响调控蛋白或蛋白复合物结合的远端顺式调控元件(CREs)发生序列变异;3)发生不同的表观遗传机制,如DNA甲基化、组蛋白修饰和染色质开放。需要提供进一步的证据。表观遗传学表征,如DNA甲基化和组蛋白修饰,可能有助于揭示导致冷反应基因差异表达的可能机制NtCBF2在YT和TT之间进行冷处理。
结论
通过综合多时间点转录组学和网络分析,我们确定了两个烟草品种差异耐寒性的关键基因和转录因子。因此,本研究为研究植物的冷适应机制提供了宝贵的转录组学资源。这有助于鉴定关键的冷响应基因,并对烟草品种进行基因改造,提高耐寒性。
材料与方法
植物生长和冷处理
两种种植烟草(烟草L.)具有不同冷响应的品种,太烟8号(TT,冷敏感性)和烟烟97 (YT,抗寒性)。选用湖南烟草研究所的胡日生和李阳阳为研究对象。75%乙醇室温灭菌10 min,无菌水洗5次。灭菌后的种子在1/2 MS培养基中在光照培养箱(16/8 h昼夜光照循环,26/24°C昼夜温度设置,相对湿度70%)中发芽和生长。烟草五叶期幼苗进行4℃低温处理。在不同的时间点(0、0.5 h、1.0 h、2.0 h、4.0 h和8.0 h)采集对照和冷处理植株的叶片。收集的样品立即冷冻在液氮中用于RNA制备。每个样本被生物学地复制三次以进行转录组学分析。
RNA-seq文库准备和数据分析
使用TRIzol试剂(ThermoFisher Scientific, Cat # 15596026)从烟叶中制备总RNA。DNA酶处理完全去除基因组DNA污染后,用聚(T)偶联磁珠富集总10 μg纯化RNA。按照制造商手册,使用Illumina TruSeq RNA样品准备试剂盒构建mRNA-seq文库。所有文库在Illumina Hiseq4500平台上测序。
使用FastQC (v0.11.5)和Trim_Galore (v0.6.4)对原始序列数据进行处理,去除低质量读数。过滤后的高质量reads被映射到烟草基因组[104] (ftp://ftp.solgenomics.net/genomes/Nicotiana_tabacum/edwards_et_al_2017/annotation/),使用带有默认参数的HISAT2 (v2.0.5)。使用SAMtools (v1.9)排除映射质量低于20的读数进行进一步分析。使用StringTie (v1.3.4d)和featuremts (v1.6.4)获得烟草基因组中所有注释基因的转录本每百万(TPM)和读取计数。利用Pearson相关系数与TPM值确定生物重复体之间的相关性。
主成分分析(PCA)是使用R包中的prcomp实用程序执行的。采用DESeq2分析差异基因表达水平。基因表达水平为1 / log2(褶皱变化)| > 1 and padj;< 0.05用于下游分析。基因本体(GO)富集分析通过在线网站AgriGO (http://systemsbiology.cau.edu.cn/agriGOv2/specises_analysis.php?&SpeciseID=15&拉丁语=Nicotiana_tabacum),这是专门为农业物种设计的。
存在分析
对于qRT-PCR检测,从样品中提取总RNA,处理方法与RNA-seq类似。提取的RNA用DNA酶处理去除基因组DNA污染,然后进行反转录合成第一条cDNA链。使用SYBR混合物进行qRT-PCR。NtActin7被用作内部控制。检测基因的相对表达水平由三个独立的生物重复计算,并表示为2——ΔΔCT[63].qRT-PCR检测的引物在附加文件中列出2表S9。
的识别NtCBF基因
用于鉴别冷反应NtCBF基因,我们遵循NtCBF先前文献中以脱水反应元件结合(DREB)蛋白命名的基因[41].为了提取相应的基因id,将DREB蛋白序列进一步比对烟草蛋白质基因组(ftp://ftp.solgenomics.net/genomes/Nicotiana_tabacum/edwards_et_al_2017/annotation/)使用Protein-Protein BLAST (v2.9.0+)。21个CBF基因的详细信息在附加文件中列出2表S6。
K326转基因系的产生
的Nitab4.5_0001083g0010.1(NtCBF2选择GRN中鉴定的)基因制备CRISPR-Cas9载体(附加文件2表S9)。该载体采用已公布的叶盘转化程序进行转基因植株的生成[105].通过测序筛选纯合子转基因植株,在生长室内培养,收集更多种子进行冷处理实验。
共表达网络分析
加权基因共表达网络分析(WGCNA)包[50在R中使用]进行共表达网络分析。两个品种中至少有一个时间点TPM值大于1的9583个deg用于WGCNA (https://horvath.genetics.ucla.edu/html/CoexpressionNetwork/Rpackages/WGCNA/Tutorials/).利用便捷的一步网络构建和模块检测功能生成共表达基因网络,并对各功能模块进行识别。本征值用于表示每个模块之间和每个品种内每个时间点的基因关联。所有共表达的deg被分为17个特定品种和时间点的模块。使用Cytoscape (v.3.7.2)对每个网络进行可视化。
遗传调控网络(GRNs)分析
我们遵循R包GENIE3 (v1.12.0)的用户手册,(https://bioconductor.riken.jp/packages/release/bioc/vignettes/GENIE3/inst/doc/GENIE3.html) [58],生成一个监管网络,在两个品种的每个时间点包含9583个deg和11个确定的枢纽tf作为监管机构。随后,我们设置阈值(权值> =0.2),得到11个tf和3308个deg之间存在强调控关系的调控网络图(附加文件)1:图S12)(见附加文件2:调节网络图详细信息见表S7)。使用Cytoscape (v.3.7.2)可视化grn。
研究中使用的植物材料说明
研究方案必须符合相关的机构、国家和国际准则和立法。
数据和材料的可用性
本研究中使用的原始RNA-seq数据保存在NCBI基因表达综合数据库(GEO)中(http://www.ncbi.nlm.nih.gov/geo/),登记号码为GSE173352。本研究资料由湖南省烟草研究所提供。该材料的代金券标本尚未存放在公共植物标本室。通信和索取材料请发至张文丽(wzhang25@njau.edu.cn)或胡日升(495298768@qq.com)。
缩写
- ABI3 / VP1:
-
脱落酸不敏感3/胎生1,rav
- 加勒比海盗:
-
A型响应调节器
- CBF:
-
c -重复结合因子
- 林后:
-
寒冷的监管
- 产线:
-
CTD phosphatase-like
- 度:
-
差异表达基因
- 含有DREB:
-
Dehydration-responsive元件结合
- 小块土地:
-
乙烯响应元件结合因子
- 走:
-
基因本体论
- 入库单:
-
基因调控网络
- 主成分分析:
-
主成分分析
- 战:
-
蛋白激酶
- PP2A:
-
丝氨酸/苏氨酸磷酸酶2A型
- PSP:
-
3-phosphoserine磷酸酶
- RT:
-
室温
- TPM:
-
每百万份转录本
- TFs:
-
转录因子
- TT:
-
大烟草
- WGCNA:
-
加权基因共表达网络分析
- 欧美
-
燕烟草
参考文献
陈建军,陈建军,陈建军。植物非生物胁迫对植物生长的影响。植物学报,2011;11(3):693。
植物的冷胁迫抗性机制。农学与可持续发展综述2010;30:15 - 527。
郭晓,刘东,钟凯。植物冷信号转导及其调控机制。植物学报,2018;36(2):745 - 756。
Sanghera GS, Wani SH, Hussain W, Singh NB。作物抗寒性的工程研究。Curr Genomics. 2011; 12:30-43。
朱军,董超,朱建军。植物冷驯化过程中冷响应基因调控、代谢和RNA加工的相互作用。植物学报,2007;10:299 - 296。
Theocharis A, Clement C, Barka EA.低温下植物的生理和分子变化。足底。2012;235:1091 - 105。
托马斯休曼氏金融。植物冷驯化:抗冻基因及其调控机制。植物生理学报。1999;50:571 - 599。
Hoermiller II, Naegele T, Augustin H, Stutz S, Weckwerth W, Heyer AG。拟南芥冷驯化过程中代谢的亚细胞重编程。植物生态学报,2017;40(1):1 - 6。
朱建军,孙嘉荣。植物冷胁迫驯化过程中的基因调控。方法:中华医学杂志。2010;639:39-55。
朱镕基JK。植物的非生物胁迫信号和响应。细胞。2016;167:313-24。
李建军,李建军。低温感知对高等植物基因表达和抗寒性的影响。植物学报,2012;19(5):737 - 751。
陈树华,陈树华。植物耐冷胁迫的生理和分子机制。植物(巴塞尔)。2020; 9:560。
刘建军,刘建军,刘建军。拟南芥CBF1编码一个含有AP2结构域的转录激活子,该转录激活子与C-repeat/DRE结合,后者是一种顺式作用的DNA调控元件,在低温和缺水条件下刺激转录。科学通报,1997;19(4):344 - 344。
Gilmour SJ, Zarka DG, Stockinger EJ, Salazar MP, Houghton JM, Thomashow MF。拟南芥CBF家族AP2转录激活因子的低温调控是冷诱导COR基因表达的早期步骤。植物学报。1998;16(4):433 - 442。
朱军,朱建军。冷胁迫对植物基因表达的调控。植物科学,2007;12:444-51。
Calixto CPG,郭伟,James AB, Tzioutziou NA, Entizne JC, Panter PE,等。快速动态选择性剪接对拟南芥冷响应转录组的影响。植物学报。2018;30:1424-44。
彭菲尔德。植物的温度感知和信号转导。植物科学学报,2008;39(1):615 - 628。
王大志,金勇,丁晓华,王文军,翟世生,白丽萍,等。植物冷胁迫下ICE-CBF-COR信号通路的基因调控和信号转导生物化学(Mosc)。2017; 82:1103-17。
Barah P, Jayavelu ND, Rasmussen S, Nielsen HB, Mundy J, Bones AM。10个拟南芥生态型的基因组尺度冷胁迫响应调控网络。生物医学工程学报,2013;14:722。
李强,杨建军,李建军,李建军,李建军,李建军。田间小麦物候发育和耐寒性的转录组学研究。植物生理学报,2018;17(6):379 - 379。
Svensson JT, Crosatti C, Campoli C, Bassi R, Stanca AM, Close TJ,等。大麦白秆和黄秆突变体冷驯化的转录组分析。植物生理学报。2006;41(1):57 - 60。
关森,徐强,马东,张伟,徐铮,赵敏,等。栽培稻和杂草稻对冷胁迫的转录组学分析。基因。2019;685:96 - 105。
李敏,隋宁,林玲,杨铮,张勇。玉米冷胁迫应答相关基因转录组学分析。植物学报,2019;46(6):830 - 844。
马亚莱SJ,鲁伊兹OA,埃斯卡雷FJ。冷胁迫介导的荷花转录组应答。植物科学,2016;7:374。
张勇,张勇,林勇,罗勇,王旭,陈强,等。转录组学分析揭示了草莓(Fragariaxananassa)应对冷胁迫的多种调控网络。中国生物医学工程学报,2019;19(2):444 - 444。
姜文辉,沈彦明,具宁,南吉耀,李俊,金宁,等。辣椒(Capsicum annuum)对热、冷、盐和渗透胁迫非生物响应的转录组分析[j] .植物生理学报,2020;7:17。
杨庆生,高军,何卫东,窦天天,丁丽娟,吴建辉,等。比较转录组学分析揭示了香蕉和大蕉对冷胁迫的关键基因表达差异。生物医学工程学报,2015;16:446。
陈,陈X,陈D,李J,张Y,王答:比较两个番茄的低温转录组基因型在不同冻结公差:茄属植物lycopersicum和茄属植物habrochaites。植物学报,2015;15(3):132。
李勇,王鑫,班强,朱鑫,姜超,魏超,等。比较转录组学分析揭示了茶树Camellia sinensis与冷适应相关的基因表达。生物医学工程学报,2019;20:624。
张欣,Teixeira da Silva JA,牛敏,李敏,何超,赵杰,等。通过生理和转录组学分析,揭示了檀香叶片对冷胁迫的响应机制。科学通报,2017;7:42 - 65。
孙丽丽,王彦斌,王瑞玲,王日辉,张鹏,鞠强,等。生理、转录组学和代谢组学分析显示氧化锌纳米颗粒调节番茄植株生长。环境Science-Nano。2020; 7:3587 - 604。
金杰,张辉,张杰,刘鹏,陈旭,李忠,等。整合转录组学和代谢组学分析表征烟草的冷胁迫反应。生物医学工程学报,2017;18:496。
gossens A, Hakkinen ST, Laakso I, Seppanen-Laakso T, Biondi S, De Sutter V,等。植物细胞次生代谢的功能基因组学研究。科学通报,2003;30(5):591 - 596。
李建军,李建军。烟草原生质体与叶片蛋白质相互作用的双分子荧光互补。[J] .生物医学工程学报,2014;9:551 - 527。
赵磊,刘峰,徐伟,狄超,周松,薛毅,等。OsSPX1表达的增加增强了烟草和拟南芥的冷/低温耐受性。植物学报,2009;7(2):555 - 561。
李勇,吴慧,李艳,李艳。转基因烟草对欧米伽-3脂肪酸脱饱和酶基因的克隆及其对抗寒性的影响。足底。2006;223:1090 - 100。
张晓明,李建平,李建平,等。转基因烟草[omega]-3脂肪酸脱饱和酶基因的克隆及其对烟草抗寒性的影响。植物生理学报。1994;105:601-5。
卓超,王婷,郭铮,陆生。苜蓿MfPIP2-7基因的过表达促进了NO3(−)缺乏条件下烟草植株的耐寒性和生长。植物医学学报,2016;16(1):138。
魏艳,陈红,王磊,赵强,王东,张涛。冷驯化对烟草叶片PSII抑制和氧化损伤的影响。植物信号学报。2022;17:2013638。
亚静,张超,杨辉,杨勇,黄超,田勇。烟草幼苗冷胁迫响应的蛋白质组学分析。中国生物医学工程学报,2011;10(1):991 - 994。
赵强,向鑫,刘东,杨安,王勇。烟草转录因子NtbHLH123通过调控NtCBF通路和活性氧稳态来调节对冷胁迫的耐受性。植物科学,2018;9:381。
王超,邓鹏,陈磊,王鑫,马辉,胡伟,等。小麦WRKY转录因子TaWRKY10赋予转基因烟草对多种非生物胁迫的耐受性。科学通报,2013;8:662 - 662。
林鹏,沈超,陈华,姚晓华,林健。胁迫诱导CbCBF和CbICE53基因共转提高烟草抗冻性。中国生物医学工程学报,2017;31(1):591 - 598。
汗萨,李明忠,王思敏,尹海军。重新审视植物转录因子在对抗非生物胁迫中的作用。中国生物医学工程学报,2018;19(1):634。
李建军,李建军,李建军,等。植物抗逆转录因子的研究进展。植物学报,2002;5(5):693 - 693。
Kitsios G, Doonan JH。细胞周期蛋白依赖性蛋白激酶与植物的胁迫反应。植物信号学报,2011;6(6):559 - 559。
李建军,李建军,李建军,李建军,等。干旱胁迫下植物丝裂原活化蛋白激酶信号通路的研究进展。科学通报,1996;19(3):1 - 9。
李春华,李春华,李春华,等。植物对环境胁迫的响应:丝裂原活化蛋白激酶。生物技术趋势。1997;15:15-9。
刘高杨L,吴K, P, X,李G,吴z GsLRPK,小说cold-activated富亮氨酸重复从甘氨酸大豆受体蛋白激酶,是一个积极监管机构冷应激宽容。植物科学,2014;15- 15:19 - 28。
王志强,王志强。一种加权相关网络分析方法。生物医学工程学报。2008;9:559。
陈春华,李春华,李春华,等。甘蓝型油菜盐胁迫响应型磷酸丝氨酸磷酸酶的结构与表达分析。[J] .生物信息学学报,2017;10:1190 - 1190。
赵克新,褚世生,张晓东,王磊,罗建军,杨志明。AtWRKY21负调控拟南芥对渗透胁迫的耐受性。环境科学学报,2020;39(9):1090 - 1090。
王晓明,王晓明,王晓明,等。丝氨酸-苏氨酸蛋白磷酸酶PP2A在植物氧化胁迫信号传导中的作用。中国生物医学工程学报(英文版);2019;20(3):344 - 344。
Javed T, Shabbir R, Ali A, Afzal I, Zaheer U, Gao SJ。植物逆境应答中的转录因子:甘蔗改良的挑战和潜力。植物(巴塞尔)。2020; 9:491。
谢志,Nolan TM,蒋宏,尹颖。拟南芥AP2/ERF转录因子调控网络对激素和非生物胁迫的响应。植物科学,2019;10:28 8。
董乃青,孙燕,郭涛,石春林,张彦明,阚燕,等。udp -葡萄糖基转移酶调节水稻籽粒大小和与代谢通量重定向相关的非生物胁迫耐受性。生态学报。2020;11:26 - 29。
Bang W, Kim S, Ueda A, Vikram M, Yun D, Bressan RA,等。拟南芥羧基末端结构域磷酸酶样异构体具有共同的催化和相互作用结构域,但在植物中具有不同的功能。植物生理学报。2006;42(2):586 - 594。
Huynh-Thu VA, Irrthum A, Wehenkel L, Geurts P.基于树的表达数据推断调控网络。科学通报,2010;5:12776。
金云云,吴金涛,阮天成,郑德华,李世基,库马尔,等。水稻冷响应WRKY基因OsWRKY71的功能分析植物学报,2016;10:13-23。
邹超,姜伟,于东。雄性配子体特异性WRKY34转录因子调控拟南芥成熟花粉的冷敏感性。中国生物医学工程学报,2010;31(1):391 - 391。
杨燕,刘杰,周霞,刘松,庄燕。茄子WRKY基因家族的鉴定及WRKY基因的冷胁迫响应特性。[j]; 2010; 31(1): 391 - 391。
袁勇,方丽,Karungo SK,张丽,高勇,李生,等。来自葡萄的GRAS转录因子VaPAT1的过表达赋予拟南芥非生物胁迫耐受性。植物学报,2016;35:655 - 656。
Livak KJ, Schmittgen TD。采用实时定量PCR和2(−Delta Delta C(T))法分析相关基因表达数据。方法。2001;25:402-8。
Lamalakshmi Devi E, Kumar S, Singh B, Sharma S, Beemrote A, Devi C, Chongtham S, Chongtham H, Yumlembam R, athhopam H等。植物在环境胁迫下的适应策略与防御机制见:药用植物与环境挑战。编辑:Ghorbanpour M, Varma A. Cham:施普林格国际出版社;2017:359 - 413。
常勇,朱超,姜军,张宏,朱建军,段根。植物非生物胁迫响应的表观遗传调控。植物学报,2010;32(2):563 - 568。
张建军,张建军,张建军,等。干旱、盐胁迫和温度胁迫诱导植物代谢重排及其调控网络。[J] .中国生物医学工程学报,2012;33(3):593 - 598。
Haak DC, Fukao T, green R, Hua Z, Ivanov R, Perrella G,等。植物非生物胁迫反应的多水平调控。植物科学,2017;8:1564。
Bashir K, Matsui A, Rasheed S, Seki M.干旱、盐、热和冷胁迫下植物转录组特征的研究进展。F1000Res。2019; 8: F1000。
Winfield MO, Lu C, Wilson ID, Coghill JA, Edwards KJ。植物对寒冷的反应:小麦的转录组分析。植物学报。2010;8(3):749 - 749。
李志斌,曾学祥,徐建伟,赵荣荣,魏永宁。低温梯度胁迫下棉的转录组学分析。科学通报,2019;6:197。
胡锐,朱鑫,向生,詹勇,朱明,尹华,等。比较转录组分析揭示了烟草基因型特异性冷响应机制。生物化学学报,2016;49(1):535 - 541。
Bonora M, Patergnani S, Rimessi A, De Marchi E, Suski JM, Bononi A,等。ATP的合成和储存。中国生物医学工程学报,2012;8:343 - 357。
Linka N, Theodoulou FL, Haslam RP, Linka M, Napier JA, Neuhaus HE,等。过氧化物酶体ATP输入对拟南芥幼苗发育至关重要。植物学报。2008;20(2):391 - 397。
Rapacz M, Wolanin B, Hura K, Tyrka M.冷驯化对四种基因型大麦(Hordeum vulgare)抗冻和强光处理的光合器官和COR14b表达的影响。生物医学工程学报。2008;31(1):689 - 698。
李建军,李建军,李建军,等。拟南芥的冷驯化导致光合能力的不完全恢复,与叶绿体基质的增加减少有关。足底。2001;214:295 - 303。
胡纳NP,奥奎斯特G,匆匆VM, Krol M, Falk S, Griffith M.耐冷植物光合作用、光抑制和低温驯化。光合作用学报。1993;37:19-39。
施蒂特M,匆匆V.四季植物:拟南芥冷驯化过程中光合碳代谢的变化。植物学报,2002;5(5):596 - 596。
Savitch L, leonardo E, Król M, Jansson S, Grodzinski B, Huner N,等。与生长和冷驯化相关的光合作用光利用的两种不同策略。植物学报。2002;25:761-71。
高桥,李波,Nakayama T, Kawamura Y, Uemura M.植物抗寒性的质膜蛋白质组学研究。植物科学,2013;4:90。
郑刚,田波,张峰,陶峰,李伟。植物对高低温变化的适应:膜脂质的重塑和不饱和水平的维持。植物生态学报,2011;34(4):531 - 531。
张宏,董军,赵旭,张勇,任军,邢磊,等。花生耐冷膜脂代谢及分子机制研究进展。植物学报,2019;10:838。
李建平,李建平,李建平,等。Zat10的功能获得和功能丧失突变增强了植物对非生物胁迫的耐受性。生物医学工程学报,2006;38(5):537 - 542。
李建军,李建军,李建军,等。锌指蛋白Zat12在拟南芥活性氧和非生物胁迫信号转导中的作用。植物生理学报。2005;39(3):847 - 856。
黄春华,黄春华,黄春华,等。GRAS蛋白在光敏色素a信号转导中的协同作用。植物生理学报,2013;31(1):391 - 391。
黄丽萍,黄丽萍,蔡新华,Bolle C. GRAS蛋白SCL13是光敏色素依赖的红光信号的正调控因子,但也可以调节光敏色素a的反应。生物医学工程学报。2006;26(6):1313 - 1330。
Jung JH, Domijan M, Klose C, Biswas S, Ezer D, Gao M,等。光敏色素在拟南芥中起热传感器的作用。科学。2016;354:886-9。
Fujimoto SY, Ohta M, Usui A, Shinshi H, ohme takagi M.拟南芥乙烯响应元件结合因子在GCC盒子介导基因表达中的转录激活或抑制作用。植物学报。2000;12:393-404。
Sorek N, Sorek H, Kijac A, szmenyei HJ, Bauer S, Hematy K,等。拟南芥COBRA蛋白在质膜处促进纤维素结晶。生物化学学报,2014;39(4):391 - 391。
李毅,钱强,周毅,闫敏,孙磊,张敏,等。脆性CULM1编码一种类似眼镜蛇的蛋白质,影响水稻的机械性能。植物学报。2003;15:2020-31。
宋春平,Agarwal M, Ohta M,郭勇,Halfter U,王鹏,等。拟南芥AP2/ erebp型转录抑制因子在脱落酸和干旱胁迫响应中的作用植物学报。2005;17(3):884 - 896。
Sharoni AM, Nuruzzaman M, Satoh K, Shimizu T, Kondoh H, Sasaya T,等。水稻AP2/EREBP转录因子家族的基因结构、分类和表达模式植物物理学报。2011;32(2):544 - 544。
玉米dre结合蛋白DBF1和DBF2通过aba依赖的干旱响应元件参与rab17调控。植物学报。2002;30(3):679 - 689。
刘超,张涛。AP2/EREBP超家族在棉花中的扩展与胁迫响应。生物医学工程学报,2017;18:118。
陈丽,韩军,邓霞,谭森,李丽,李丽,等。短茅AP2/EREBP超家族的扩展及胁迫响应科学通报2016;6:21623。
曹松,王燕,李霞,高峰,冯军,周勇。冷胁迫和渗透胁迫下毛参AP2/ERF转录因子家族特征及DREB亚家族的表达谱。植物(巴塞尔)。2020; 9:455。
esespinoza C, Liang Y, Stacey G.拟南芥几丁质受体CERK1与盐胁迫和几丁质触发的先天免疫有关。植物学报。2017;39(9):984 - 995。
Nguyen KH, Ha CV, Nishiyama R, Watanabe Y, Leyva-Gonzalez MA, Fujita Y,等。拟南芥B型细胞分裂素响应调控因子ARR1、ARR10和ARR12负向调控植物对干旱的响应。中国科学d辑,2016;33(3):391 - 391。
Pais SM, Tellez-Inon MT, Capiati DA。2A型丝氨酸/苏氨酸蛋白磷酸酶及其在应激信号传导中的作用植物信号学报,2009;4(4):1013 - 105。
王松,郭涛,王忠,康健,杨强,沈勇,等。拟南芥表达ABI3/VP1相关基因导致拟南芥抗逆性增强,分支增加。植物科学,2020;11(6):611。
李建军,李建军,李建军,等。非生物胁迫下植物丝裂原活化蛋白激酶信号转导的研究。植物信号学报,2011;6(6):1196 - 1203。
林丽,吴军,姜敏,王勇。环境胁迫下植物丝裂原活化蛋白激酶的级联反应。中国生物医学工程学报,2011;22(2):559 - 563。
Shou H, Bordallo P, Fan JB, Yeakley JM, Bibikova M, Sheen J,等。烟草丝裂原活化蛋白激酶激酶激酶的表达增强了转基因玉米的抗冻性。科学通报,2004;31(1):398 - 398。
董慧,吴超,罗超,魏敏,曲顺,王顺。苹果钙依赖蛋白激酶MdCPK1a基因过表达通过清除ROS积累提高烟草抗寒性。科学通报,2020;15:e0242139。
Edwards KD, Fernandez-Pozo N, Drake-Stowe K, Humphry M, Evans AD, Bombarely A,等。烟叶参考基因组的建立使与氮素利用效率相关的同源基因座的图谱克隆成为可能。生物医学工程学报,2017;18:448。
高军,王刚,马生,谢霞,吴霞,张霞,等。CRISPR/ cas9介导的烟草靶向诱变植物化学学报。2015;37(1):99 - 110。
致谢
我们感谢南京农业大学生物信息学中心为测序数据分析提供的设备。
资金
国家自然科学基金(32070561)资助;湖南省烟草公司科技重点项目(17-18Aa05, HN2021KJ04和HN2021KJ02)。
作者信息
作者及单位
贡献
WLZ和RSH构思了这项研究。WLZ和XJC指导了这项研究。ZYL分析了数据。ZCZ、YYL、ZRH、JSY进行实验。STT协助进行数据分析。Z.Y.L, z.c.z和yy.l WLZ撰写了手稿,所有作者都有贡献。所有作者都阅读并认可了稿件。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们没有竞争利益。
额外的信息
出版商的注意
伟德体育在线施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。
补充信息
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/。创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
罗忠,周忠,李,Y。et al。基于转录组的两个烟草品种抗寒性差异基因调控网络分析。BMC Plant Biol22, 369(2022)。https://doi.org/10.1186/s12870-022-03767-7
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-022-03767-7
关键字
- 转录组
- 差异基因表达
- Co-expression网络
- 冷处理
- 烟草