摘要
背景
对于翻译基因组学,需要一个路线图来了解物种之间的分子相似性或差异性,例如模式物种和作物物种。这些知识对于选择靶基因和改变下游响应相同刺激的途径是无价的。研究了六种激素(脱落酸- ABA和水杨酸- SA)处理下的转录组反应;引起氧化应激的处理(3-氨基-1,2,4-三唑- 3AT,甲基紫素- MV);抑呼吸作用(抗霉素A - AA)和诱导遗传损伤(紫外线辐射- uv)的研究结果与拟南芥(拟南芥)大麦(大麦)米饭(栽培稻)。
结果
在不同的物种之间发现了相同和相反的反应,不同处理和物种之间差异表达基因(DEGs)的数量差异很大。在一个物种中,至少70%的deg与至少一种其他处理重叠,表明重叠的反应网络。值得注意的是,15 - 34%的同源deg在物种间表现出相反的反应,这表明尽管同源性不同,但物种间的反应存在多样性。在三个物种中,对多种处理有共同反应的同源deg与实验数据相关,显示了这些基因在生物/非生物应激反应中的功能重要性。从响应基因和线粒体功能障碍元件的调控角度来看,线粒体功能障碍反应在所有三个物种中都是高度保守的。
结论
同源deg在物种之间显示出共同的反应,表明这些途径在物种之间的转录组反应是保守的。然而,许多基因,包括突出的盐胁迫反应基因,在多重胁迫下表现出相反的反应,这突出了这些基因在物种之间的反应和调控的根本差异。这项工作为物种间知识或功能的翻译提供了资源。
背景
在整个生命周期中,植物暴露在各种非最佳生长条件下,持续时间从数小时、数天到季节。为了生存,植物对这些条件的反应是将适应作为长期的跨代手段,将驯化作为中期反应和/或触发应激反应作为短期反应。感知和应对不同时间跨度变化的能力将最终决定一个物种能否生存。植物受到非生物和生物胁迫的挑战。对于生物胁迫,微生物病原体的感知通常是通过特定的受体-配体相互作用来实现的,因此识别病原体的能力往往是耐受性和易感性之间的区别[1,2,3.]。对于非生物挑战,从干旱、高温和洪水到营养或光照限制/过剩,感知和生存可能更加复杂。例如,对于淹水,非最佳条件是多因素的,其中除了氧气限制外,光线也大大减少,水环境可能使植物对生物感染更敏感[4]。在这些次优条件下改变的各种蛋白质可以触发信号通路,这是适应环境所必需的,并且大大增加了我们对非生物应激感知的理解[5]。由于植物暴露于多种非生物和生物刺激,以及环境的变化;从土壤到有益微生物的相互作用,在整个发育过程中需要整合这些不同的信号以优化生长[6]。
活性氧(ROS)已成为各种不利条件下的关键信号分子。活性氧在植物生长发育中起着关键作用,因此它们在逆境反应中的信号作用将植物生长与环境条件结合在一起[7,8]。产生ROS的类型和位置,定义了信号级联以及信号特异性如何实现,显然是一个重要的特征,部分原因在于大多数ROS物种,除了过氧化氢(H2O2),不能远离生产地点。因此,它们与蛋白质和代谢物的直接相互作用是ROS信号传递的一个特征[8,9]。使用“ROS wheel”或“Rosmeter”等工具对ROS信号特征进行分类,可以将转录组模式的变化与已知扰动进行比较,以确定应激感知和信号转导的位置[9,10]。在组织水平上,ROS在调节根伸长中的作用被详细地定义为调节这一过程的氧化还原敏感转录因子(TFs),并且根细胞中ROS丰度的扰动会改变生长[7,11,12]。在非最佳生长条件下,ROS也起着重要作用,胞外酶如过氧化物酶、多胺氧化酶和呼吸爆发氧化酶同源物负责产生ROS,后者被认为负责从各种非生物和生物来源产生ROS [8]。
在植物中,ROS信号可以发生在细胞内和细胞间以及系统中。过氧化物酶体、叶绿体和线粒体是细胞内来源,它们不断产生不同的ROS物种,启动信号通路[13]。而过氧化物酶体是H2O2,有效的解毒系统,如过氧化氢酶,意味着在稳态条件下产生的信号很少[14]。然而,水杨酸(SA)对过氧化氢酶的失活作用[15], Ca活化2 +(16]和相互作用的蛋白质,如NO过氧化氢酶活性或核还原蛋白1 [17,18],都能调节过氧化氢酶的活性。这表明由于不同途径的相互作用,ROS信号的复杂性,即SA对过氧化氢酶的失活导致生长素和茉莉酸(JA)信号的抑制[19]。叶绿体产生多种活性氧,包括独特的单线态氧(1O2)通过与类胡萝卜素和其他分子的相互作用而失去活性[20.]。与类胡萝卜素相互作用产生参与逆行信号传导的β-环柠檬醛[21]。叶绿体和线粒体都产生超氧化物(O)2。-),迅速转化为H2O2通过超氧化物歧化酶。在这两个细胞器中ROS通过H2O2通过各种传感器、介质和效应物触发转录反应。13]。在过去的十年中,叶绿体和线粒体已经成为通过逆行信号感知和响应的重要枢纽。依赖于四吡啶、氧化还原/ROS、质体基因表达、代谢物如3 ' -磷酸腺苷-5 ' -磷酸、2- c -甲基- d -赤藓糖醇-2,4-环焦磷酸和双定位蛋白的五种叶绿体信号通路都被证明在不同程度上参与信号传导[22,23,24]。线粒体信号通路是最佳生长发育所必需的,因为这些通路的破坏会导致生长和应激反应表型的严重改变[25,26]。与多种调节生长发育的植物激素(生长素,细胞分裂素)或在逆境反应中发挥作用(脱落酸,ABA;水杨酸,SA;茉莉酸;茉莉酸;乙烯),这导致一个复杂的相互作用的信号通路网络控制植物的生长和发育。
由于气候变化带来的热浪、干旱期、水资源短缺以及降水持续时间和频率的增加,预计未来几十年环境制约因素将会增加,从而导致洪水,并显著降低农业生产力,带来巨大的经济后果[27,28,29]。然而,过去作物育种计划的主要重点是作物产量的最大化,而不是努力提高抗逆性,特别是非生物抗逆性[30.]。快速变化的气候限制了对新环境条件的自然适应[31]。解决这些问题需要广泛的研究工作,因此了解植物适应不利环境条件的机制是植物研究中最重要的领域之一[32]。
为了提高作物物种的非生物胁迫耐受性,研究已经针对调节基因来改变潜在的信号网络[6]和许多已在作物品种中鉴定出具有非生物抗逆性的TFs ([33,342019, [35,362019年])。转录因子是调控回路中的中心开关,是改良作物品种的理想工具,具有增强的抗逆性,可能同时对抗多种胁迫[37]。功能基因组学工具、下一代测序(NGS)技术和高质量参考基因组的进展[38,39,40]已经并且将改进候选基因的鉴定,进一步使物种比较成为可能[41]。虽然细胞器信号传导已经在拟南芥中得到了广泛的研究,并且对作物的生长发育有很大的影响,但人们对作物物种中的细胞器信号传导知之甚少,也不知道这种途径是否能赋予对非生物胁迫的耐受性。鉴定了NAC013作为一种转录因子调节植物的精密度萝卜L.(萝卜),一种重要的农艺性状,品种之间的差异,指出了细胞器信号通路优化农艺增益的潜力[42]。一个与拟南芥根治细胞死亡1 (SRO1)相似的基因小麦促进生长和对非生物胁迫的耐受性[43,耐盐性番薯cairical . (44],以及多种非生物胁迫栽培稻(45]。在拟南芥中,自由基细胞死亡1已被证明通过与介导逆行信号传导的NAC转录因子相互作用来协调线粒体和叶绿体活动[46]。因此,有可能优化作物的细胞器信号,以增加对非生物胁迫的耐受性。
在这项工作中,dicot模型,拟南芥这两种农艺单子叶植物,栽培稻(大米)和大麦芽(大麦),以确定对产生ROS变化和改变激素水平的各种处理的共同或相反的反应,激素被证明与线粒体信号相互作用[47]。正群的构造[24]与综合基因表达谱相结合,用于确定特定生物学背景下的共性和物种特异性差异。
结果
拟南芥、水稻和大麦对胁迫的动态表达响应
通过使用激素(脱落酸- ABA和水杨酸- SA)分析了模式物种(拟南芥)和两种作物物种(水稻和大麦)对六种模拟应激反应的转录组反应;引起氧化应激的处理(3-氨基-1,2,4-三唑- 3AT,甲基紫素- MV);抑制呼吸(抗霉素A - AA)或诱导基因损伤(紫外线辐射- uv)(表1).为确保治疗方法的应用效果(见表1)1),本研究采用定量反转录聚合酶链反应(qRT-PCR)检测标记基因的表达。处理的起点是先前在拟南芥中广泛优化的浓度和时间[48,49,50], 3 h为线粒体应激标志物替代氧化酶(AOX)转录物丰度达到峰值的时间点。除大麦中ABA处理对标记基因的诱导作用外,所有品种和处理对标记基因的诱导作用在3 h时均达到16倍以上Beta-glucosidase 31大于8倍,ABA处理对AOX1a的诱导作用与水稻和拟南芥相似,这被认为是充分的。这与大麦对各种非生物胁迫具有天然耐受性这一事实是一致的,大麦被定义为最耐盐的谷物[51]和抗压力谷物[52]。用AA和MV处理大麦6小时,确实产生了相似数量级的标记基因变化(表2)2),因此这些处理选择6 h时间点。
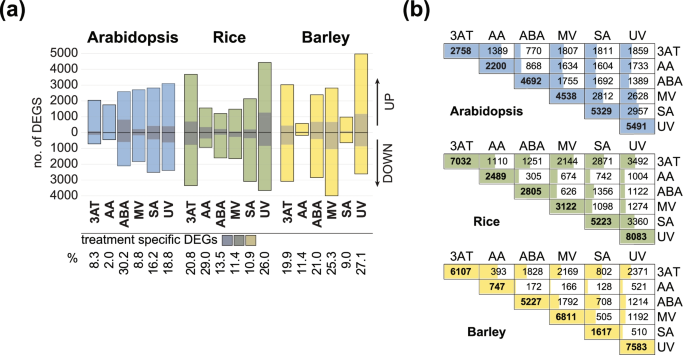
不同处理反应的RNA-seq分析(表2)1)显示,在拟南芥(Tair10)、水稻(IRGSP-1.0)和大麦(IBSCv2)基因组中分别注释了19,700、22,609和24,541个检测到的基因中,与模拟处理相比,总共有10,462、13,735和14,470个基因对至少一种处理有反应(图2)。1一个;表S2a-c)。对于所有三个物种,差异表达基因(DEGs;FDR < 0.05, |log2FC| > 1)对紫外光的响应[53]处理,并且观察到对抗霉素A (AA)处理有反应的数量最少(图2)。1a).三个物种中处理特异性deg的数量从2%到30%不等(图2)。1a).单子房中对过氧化氢酶抑制剂3-氨基-1,2,4-三唑(3AT)有反应的deg数量为2倍(水稻:7032 deg;大麦:6107℃),而拟南芥(2758℃;无花果。1a).单子代植物对3AT的反应也更为明显,水稻和大麦中分别有20.8%和19.9%的处理特异性deg,而拟南芥中这一比例为8.3%。值得注意的是,ABA处理后的deg数量在拟南芥(4692 deg)和大麦(5227 deg)之间更为相似,而在水稻(2805 deg)中几乎是其一半(图2)。1a).与其他处理相比,拟南芥对ABA的反应也最明显,30.2%的deg是处理特异性的,而只有2%的AA反应deg是处理特异性的。同样,SA处理后拟南芥(5329个)和水稻(5223个)之间的deg数量与大麦(1617个)相比更为相似,deg数量约为前者的三分之一(图2)。1a)对甲基紫菌素的反应[54],这导致叶绿体在光照下氧化应激和ROS的形成,三种植物之间存在差异,其中大麦(6811个)的deg最多,其次是拟南芥(4538个)和水稻(3122个)。对于每个物种,进行了处理之间重叠deg数量的双向比较,揭示了与水稻和大麦相比,拟南芥响应之间总体上更大的保守性(图2)。1b).例如,除ABA外,拟南芥中对AA和3AT处理有应答的所有deg中有一半以上与其他四种处理重叠(图2)。1b),而大麦和水稻对AA和3AT响应的deg差异更大,重叠deg的百分比更小(图2)。1b). 3AT和MV反应在水稻中重叠最大,而在大麦中3AT和UV反应重叠最大,表明物种特异性反应(图2)。1b)。
为了深入了解这些deg的功能,Pageman进行了过度代表性分析[55]对所有三个物种和显著过度代表的类别进行了测试(Fisher的测试,p< 0.05;表S3)在至少三种处理中发现了上调和下调基因(图5)1a, b)。鉴定了许多常见的类别,揭示了转录组水平上对治疗的保守功能反应(图2)。2a).正如预期的那样,编码氧化磷酸化、酪氨酸激酶样蛋白激酶、ABC转运蛋白和杂项氧化还原酶的基因,以及编码APETALA2/乙烯响应元件结合因子(AP2/ERF)、热休克因子(HSF)和含有tf的NAC和WRKY结构域的基因,在所有三个物种的上调基因集中都显著富集(图2)。2a).在所有三个物种的下调基因中,都观察到光合作用、RNA生物合成和RNA加工的富集(图2)。2b)。
然而,物种之间也存在显著差异。例如,在所有处理下,蛋白修饰在几乎所有亚类的上调拟南芥基因中都被过度表达,但在水稻和大麦中这种情况较少,尤其是磷酸化和酪氨酸激酶样蛋白激酶(图2)。2a).与水稻和大麦相比,下调的拟南芥基因中蛋白质生物合成功能的富集模式也有很大不同(图2)。2a).因此,处理对双子叶和单子叶的蛋白质修饰、稳态和合成的影响似乎有所不同。同样,与两种单子叶植物相比,拟南芥中下调基因的溶质转运过程似乎受到的影响较小(图2)。2b).上调基因中囊泡运输的富集在拟南芥和水稻中更为相似,而在大麦中则较少。总体而言,与拟南芥和大麦相比,上调水稻基因中富集的功能类别较少,而下调基因中富集的功能类别相似。相比之下,拟南芥和大麦中响应ABA的下调基因比水稻更相似,例如光合作用(图2)。2b)。
物种特异性差异也通过这种方式揭示出来,例如,在拟南芥中,编码氧化还原酶的基因在3个胁迫下被上调,在大麦中,5个胁迫下被上调,而在水稻中只有1个胁迫(图2)。2b).在下调的基因中,水稻和大麦在3AT、ABA和MV处理后,编码核糖体蛋白的基因显著富集,而这只在拟南芥对ABA的响应中观察到(图2)。2b)此外,拟南芥中TFs的PLATZ家族、水稻中的MYB家族和大麦中的C2H2-ZF家族在三个胁迫下分别富集了上调基因,而在其他两个物种中则没有表现出相同的富集模式(图5)1一个;表的年代3.).因此,物种和处理之间的数量和丰富的功能类别不同,表明这些差异与系统发育距离无关。
物种间同源基因的响应
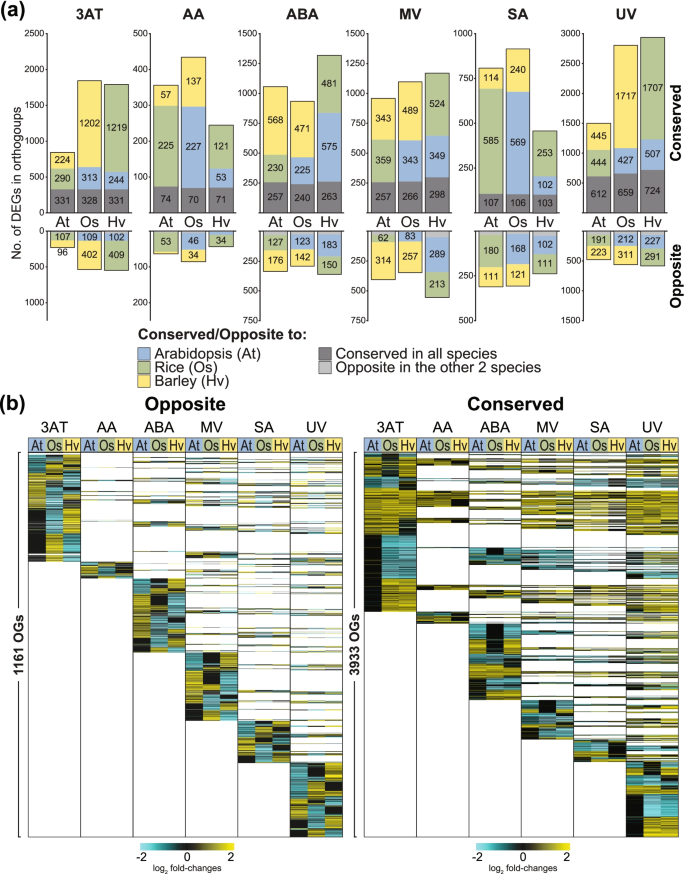
为了直接比较三个物种之间的转录组反应,使用Orthofinder鉴定了同源基因[56]定义一组同源基因,称为正系群[24],其中包含三个物种的同源物和相似物(表5)4a)。通过这种方法,鉴定出9371个正畸群,其中包含至少一个物种中对至少一种处理有反应的deg(表S)4b).有趣的是,其中49%的物种含有对至少一种处理有反应的deg,而其他两个物种的同源基因的表达保持不变。对这些进行更仔细的检查发现,每种处理只对一种物种有反应的含有deg的og数量不同(图5)2一个;表的年代4b)。例如,只有一个物种中含有对3AT、SA和UV有反应的deg的OGs数量最多,这表明尽管大麦和/或拟南芥中存在这些基因的同源基因,但水稻中对这些基因发生了差异转录组调控(图5)2一个;表的年代4b)。同样,大麦中含有对MV有反应的DEGs的og数量最多,这表明大麦对这些基因进行了特异性转录组调控(图5)2一个;表的年代4b).因此,虽然同源学表明在基因水平上具有保守性,但物种之间的转录组反应可能不同。
在物种之间含有相同反应方式(即上调/下调)的deg的正同源群被定义为共同的,而在至少两个物种之间含有相反反应的同源deg的正同源群被定义为相反的(图2)。3.一个;表的年代4b)在9371个OGs中,3933个OGs含有至少两个物种对至少一种处理表现出共同反应的基因,而1661个OGs含有表现出相反反应的基因(表5)4b).对于含有一个以上基因的正形群,如果在同一正形群中同一物种的特定处理下,该群体中含有一些基因上调,另一些基因下调,则这些基因将被排除在该处理的分析之外4b).通过这种方法,鉴定出821个多基因OGs,至少在一个物种中含有上调和下调的基因,其中80个在至少两个物种中含有上调和下调的基因(表5)4b)。
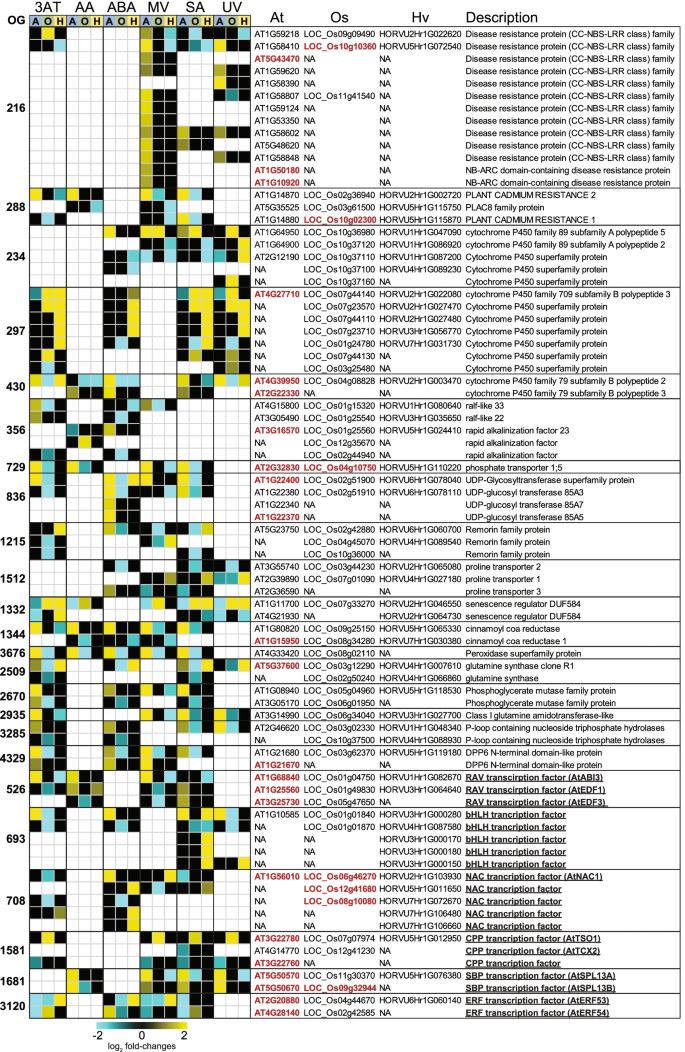
拟南芥、水稻和大麦在6种不同处理下同源基因的转录组反应(a)拟南芥(At)、水稻(Os)和大麦(Hv)中同源且对不同胁迫处理表现出保守或相反反应的deg数量。保守反应被定义为与至少一个其他物种同源的基因,这些基因在转录物丰度上也因治疗而上调或下调。相反反应被定义为至少在一个物种中同源的基因,在另一个或两个物种中表现出相反的反应。保守的和相反的反应都排除了任何基因在同一基因群中同时表现出向上和向下调节的基因。矫形组使用矫形器定义,方法部分概述。(b)所有正群的log2变换折叠变化热图[24],包含差异表达基因(DEGs),在所有三个物种中对六种处理的反应均表现出相反和保守的反应(上调/下调)。3AT = 3-氨基-1,2,4-三唑;AA =抗霉素A;ABA =脱落酸;甲基紫紫;SA =水杨酸;紫外线辐射
对OGs的进一步研究表明,拟南芥、水稻和大麦中分别有2758、7032和6107个deg对3AT有响应。1a), 845、1843和1794基因的同源物与至少一个其他物种表现出共同的反应(图2)。3.a).在拟南芥中,845个基因代表了所有对3AT有反应的基因的30%,其中331个基因在水稻和大麦中都表现出与其同源基因的保守反应,而290个和224个基因分别在水稻和大麦中表现出保守反应(图2)。3.a).相比之下,所有拟南芥deg对3AT有响应(图2)。1A), 8%(228个基因)对水稻和/或大麦表现相反的反应。25个基因在水稻和大麦中都对同源基因表现出相反的反应,而107个和96个基因分别在水稻和大麦中对同源基因表现出相反的反应(图2)。3.a).大麦和水稻对3AT的保守反应和相反反应的基因数量是拟南芥的两倍以上。其中大部分,即1202和1219基因,分别在水稻和大麦之间表现出保守响应,而402和409则相反(图2)。3.a).在1501、2803和2938度的温度下,对紫外线的响应也出现了类似的趋势,与至少一种其他物种表现出保守的响应(图1)。3.a),占所有deg的27 - 39%(图2)。1一个)。
总的来说,在一个或多个物种中表现出保守反应的基因至少是表现出相反反应的基因的两倍。3.a).在大麦中,与拟南芥基因相比,更多的基因对3AT、AA、MV、SA和UV的同源水稻基因表现出保守响应(图2)。3.a).同样,在水稻中,大麦中的同源基因对3AT、ABA、MV和UV的响应具有更大的保守性(图2)。3.a).因此,与拟南芥相比,水稻和大麦在至少4种胁迫下表现出更强的保守性。然而,拟南芥对AA(227个基因)和SA(569个基因)以及大麦对ABA(575个基因)的响应具有更大的保守性,这表明也存在与拟南芥更大相似性的例外(图5)。3.一个)。
对相反反应基因的检测显示,在对3AT和UV的反应中,所有基因中有7%至9% (228-581 deg)在至少一个其他物种中表现出相反的反应(图2)。3.a).水稻中反向反应基因分别占所有对ABA和MV反应的deg的10%和11%,在这两组中分别观察到293个和345个基因,而大麦中238个对sa反应的deg占所有deg的14%(图2)。3.a).因此,除AA外,228 ~ 581个deg至少在一个其他物种中与相反应答基因同源(图2)。3.a)占所有5种应激反应性deg的6%至14%。因此,当只考虑DE同源基因时,基于系统发育观察到更大的保守性(图2)。3.),而不是基因数量和丰富的功能类别(图2)。1&2).然而,拟南芥与水稻以及拟南芥与大麦之间的AA和SA含量的守恒更大(图2)。3.A)揭示了反应的多样化确实独立于系统发育而发生。
总的来说,对反向反应的deg的研究发现,在拟南芥、水稻和大麦中,分别含有2275、2365和2426个同源deg的1661个正位群对至少一种物种和至少一种处理产生反向反应(图2)。3.a).值得注意的是,这1661个正位群中有38%在一个以上的处理下也表现出相反的反应,其中拟南芥、水稻和大麦中含有1024、1083和1115个deg的628个正位群在一个以上的胁迫下表现出相反的反应(图2)。3.b).在正群中,对紫外线有相反反应的基因数量最多,其次是MV、3AT、ABA和SA,而对AA有相反反应的基因数量最少(图2)。3.b;无花果。2b).当检查特异性和重叠的反向反应og的数量时,1161个og中有407个表现出重叠反应,即在其他胁迫下也是相反的。例如,在对3AT有相反反应的正形体群的445个og中,有200个og在至少一种其他压力下也表现出相反的反应(图5)2b)。
类似的基因检测显示出保守的反应(图2)。3.a)发现3933个同源基因群分别含有5186、5560和5680个拟南芥、水稻和大麦同源基因,它们与至少一种其他物种和至少一种胁迫具有相同的保守响应(图2)。3.b).可视化显示,其中许多在一个以上的应力下表现出保守的反应,占48%,即3933个正交群中的1874个(图2)。3.b;无花果。2b).当检查每个应激下处理特异性和重叠的ogg数量时,发现除了UV外,大多数正形群在其他应激下表现出重叠反应(图5)2b).这与之前的研究结果一致,这些研究结果也揭示了不同植物物种间同源基因(定义为Expressologs)之间的动态表达响应[57],强调了在研究不同物种时同时考虑表达和形态学的价值。
跨物种共同应答基因的鉴定
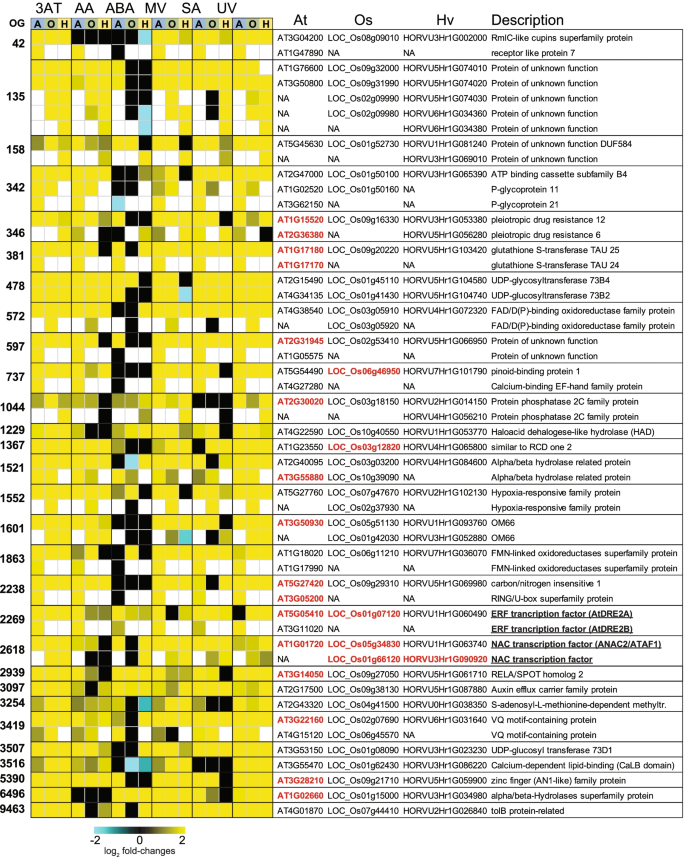
在3个物种的6个处理中,至少3个处理的deg的共同反应鉴定显示,105个ogg分别含有158、146和157个拟南芥、水稻和大麦基因(表S5a)。对这组拟南芥基因的GO注释显示,158个基因中有93个属于刺激响应类,过代表性分析显示,前两类基因为;对细菌来源分子的反应和对几丁质的反应(费雪试验,罗斯福)p< 0.05)6a)。前10个显著富集的类别中有6个涉及对氧气的反应、氧水平降低或缺氧(表S6a).同源deg在所有三个物种的6个处理中至少有4个表现出上调反应,在拟南芥、水稻和大麦中分别显示出一组29个ogg,分别含有43、40和39个基因(图2)。4;表的年代5b).这组基因确定了具有遗传和转录组保护的基因,表明这些基因的调控也可能是保守的。
拟南芥、水稻和大麦处理后同源基因表达的保守反应。log2变换后的褶皱变化显示为20个正群的热图[24],包含差异表达基因(DEGs),在6个处理中的4个(3AT = 3-氨基-1,2,4-三唑,AA =抗霉素A, ABA =脱落酸,MV =甲基紫素,SA =水杨酸,UV =紫外线辐射)中对三个物种(A =拟南芥,O =水稻和H =大麦)中的每一个都表现出保守的反应。在发育、防御和/或氧化还原稳态中具有已知功能的基因(补充表7a)(突变体/过表达体)用红色表示。下划线表示编码转录因子的基因
对拟南芥基因的进一步研究表明,与其他发育组织相比,有24个基因在叶片衰老过程中表达量最高或表达量最大[58,59](表五)7a)。还观察到,43个基因中有10个基因(23%)产生已知的细胞间移动mrna,这代表了显著的富集(卡方,p < 0.05),仅考虑2006个基因(约为1 / 3)。基因组中所有基因的6.7%)是细胞间可移动的[60]。基因功能检查显示,43个拟南芥基因中有19个已知具有功能作用,因此这些基因的突变/ RNAi/过表达等改变导致植物的应激反应/发育发生改变(表5)7a)。其中5个基因导致细胞中氧化还原相关的改变(表S7a).例如,编码谷胱甘肽s -转移酶(CLASS TAU) 24 (GSTU24, At1g17170)的基因突变导致GST总活性增加和氧化还原稳态改变[61]。一个基因编码跨膜蛋白(At2g31945),另一个基因编码甘油脂A1脂肪酶,标记为PLASTID脂肪酶2 (At1g02660)。4)也导致敲除这些基因的植物的氧化应激耐受性降低[62]。同样,锌指(an1样)家族蛋白应激相关蛋白[48] 12已被证明受氧化还原依赖性调节[63],其调节因子miR408的表达升高导致SAP12的诱导以及细胞抗氧化能力的增加[64](表五)7一个)。
此外,这三个物种中常见的7个基因表达的改变(图2)。4)导致生物应激反应的改变(表5)7a),包括两个ABCG基因(ABCG40和ABCG34)。这两种基因的突变导致基因受损疫霉brassicae和疫霉capsici以及对坏死性病原体的抵抗力[65,66]。同样,MAPK磷酸酶(At2g30020)的功能丧失[67],细胞色素BC1合成样线粒体外膜蛋白OM66 (At3g50930)的过表达[68]和ATL6 (At3g05200)和ATL31 (At5g27420)的过表达[69,70导致对…的抵抗力增加两而含有VQ基序的基因JAV1 (At3g22160)的沉默增强了茉莉酸调节的防御葡萄孢菌(71](表五)7a).两个编码生长素转运atp结合盒蛋白的基因(At2g47000和At3g62150)以及一个钙结合蛋白编码基因(At4g27280)被观察到导致相应突变植物生长素反应和根形成的改变[72,73,74]。因此,这组应激反应基因在拟南芥、水稻和大麦中是保守的,并参与氧化还原和防御维持,它们在表达上的保守意味着这些作用及其调控可能在这三个物种中也是保守的。事实上,钙结合蛋白OsCCD1 (LOC_Os06g46950)的功能丧失,是At4g27280 (OG0000737)的同源物。4),对渗透和盐胁迫的耐受性较差,而过表达显著增强了水稻的这种耐受性[75](表五)7一个)。
正群OG0002618代表了所有三个物种的保护例子,并包含对应激反应很重要的NAC TFs(图2)。4) [76]。ATAF1 (ANAC2;AT1G01720)在非生物和生物胁迫响应途径之间的串扰中发挥重要作用,并作为aba依赖的防御和植物抗逆性调节剂[77,78]。过表达ATAF1提高拟南芥抗旱性[j]79]和转基因水稻中该拟南芥基因的过表达赋予了对盐胁迫的耐受性[78]。在转基因水稻中,过表达与ATAF1最接近的同源基因赋予了水稻耐寒性和耐盐性(OsSNAC2;LOC_Os01g66120) [80]以及耐旱性(OsNAC52;LOC_Os05g34830) [81在依赖aba的物质中。在大麦中的同源物HvNAC6 (HORVU3Hr1G090920)介导aba依赖的防御反应,相应的敲低系更容易受到白粉病的影响。82](表五)7一个)。
线粒体功能障碍刺激是一种保守的细胞器反应
线粒体在应激反应中发挥重要作用,既提供能量,又作为应激传感器和信号中枢[83]。线粒体功能障碍刺激(MDS)是线粒体逆行信号通路的一部分,它向遗传、药理或环境条件引起的线粒体功能障碍发出信号,以改变线粒体应激标志物替代氧化酶AOX等核基因的表达[84]。ANAC013、ANAC017等NAC tf绑定a独联体-调节基序,称为线粒体功能障碍基序(MDM),存在于几个基因的启动子中,这些基因在线粒体功能受损的反应中表达改变[84]。基序搜索确定了这些结合位点存在于多种基因的启动子区域AOX水稻、大麦和小麦的基因,这表明植物家族中存在保守的MRR通路。er膜结合OsNAC054的相互作用进一步支持了这些途径在单子房中的保护作用,OsNAC054参与了aba诱导的水稻叶片衰老,并被证明与MDM特异性结合[85]。
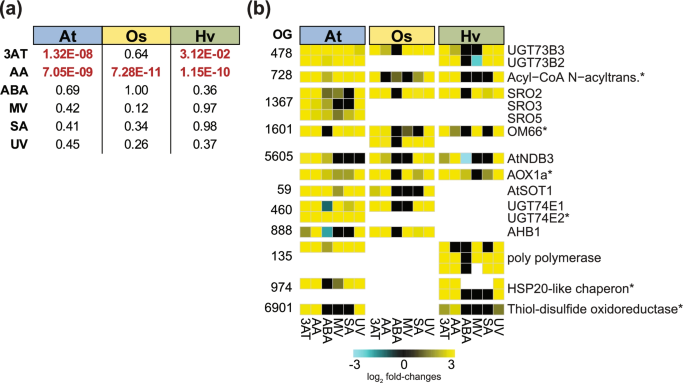
我们的同源分析显示,编码线粒体蛋白的基因在拟南芥、水稻和大麦中具有保守性(表5)4&年代5),并共同上调OM666个治疗组中有4个(图2)。4).为了研究单子系和双子系的这种保守性,我们在启动子区域(翻译起始位点上游2 kb)对本研究中表达的所有基因进行了严格的MDM (CTTGNNNNNCAMG)模式搜索,不允许任何排列,使用调控序列分析工具[54]。基序富集分析(气广场上测试,p< 0.05),进行治疗特异性亚群的比较(表S8a).对于AA响应的deg,该基序在所有三个物种中都显著富集,表明线粒体功能障碍和MRR响应的保守途径(图2)。5表58).相比之下,3at应答DEGs启动子中的MDM仅在拟南芥中保守(p值< 0.001;卡方检验)和大麦(p值< 0.05;卡方检验),但水稻没有(p值= 0.64)。ABA、MV、SA和UV在这三个物种中均未发现MDM富集,这表明MDM的基因诱导可能是线粒体氧化应激的特异性,与拟南芥的功能研究结果一致[84,86]。
拟南芥(At)、水稻(Os)和大麦(Hv)胁迫处理特异性基因集中线粒体功能障碍基序(MDM)的富集和潜在线粒体功能障碍刺激(MDS)基因的保护(a)包含所有差异表达基因(DEGs)的特定亚群上游启动子区的MDM富集分析;At、Os和Hv各应力处理的|log2 (fold change)| > 1, FDR < 0.05);3AT = 3-氨基-1,2,4-三唑,AA =抗霉素A, ABA =脱落酸,MV =甲基紫素,SA =水杨酸,UV =紫外线辐射。分析各物种和各胁迫下所有表达基因中是否存在严格的MDM (p值;卡方检验,显著性(p<0.05),用红色字体表示。(b) At、o和Hv中MDS候选基因DEGs基因表达水平的热图。所有基因都在2kb启动子区含有MDM,并且在AA和/或3AT胁迫下以及6种胁迫中的至少3种胁迫下表现出差异表达。每个正位群(OG)的数量被指示,已知的MDS基因用星号突出显示。基因名称/注释指拟南芥中的基因
为了鉴定新的MDS候选基因,ANAC017基因调控网络[25]分析是否存在MDM(表S8b)。ANAC017是拟南芥MRR的一个调节因子,也是一个直接的正调控因子AOX1a(86]。它直接与MDM和ANAC013的启动子相互作用,ANAC013是MDS基因本身[84]。根据MDM富集分析,筛选所有包含MDM的AtNAC017基因调控网络基因,这些基因在AA和3AT处理后差异表达,并且在至少一种其他处理(6个处理中的3个)中有应答。最终的82个候选基因列表与MDS基因分层聚集在一起(图5)3.).拟南芥候选基因列表包含7个udp -糖基转移酶(UGTs),其中包括已知的MDS基因UGT74E2(At1g05680),它在细胞器信号传导中起作用[87[图53.).非生物和生物胁迫下UGT基因的诱导表明,它们可能参与线粒体逆行信号传导下多种激素信号通路的调节[88]。生物应激反应细胞壁相关激酶的存在[89,90],将线粒体信号与细胞壁联系起来,如先前所示,ANAC017可以在纤维素合酶抑制剂存在的情况下以一种未知的方式恢复细胞壁生长[91]。候选名单中的其他ANACs有ANAC044 (At3g01600),其特征是介导应激诱导的细胞周期阻滞[92],介导蛋白酶体应激的ANAC053 (At3g10500) [93]和干旱时期活性氧的生成[94]和ANAC055 (At3g15500)在介导干旱反应中的作用[95]。此外,类似于RCD-ONE家族的三个成员(SRO2/3/5)也在列表中(图5)3.).结合这些例子,线粒体信号传导是多种细胞信号传导途径的重要枢纽,与线粒体在洪水反应中的新兴作用一致[25],与触摸信号相互作用[96],以及ANAC017在调节生长、衰老和细胞壁生长中的作用,ANAC017被认为是线粒体逆行信号的主要调节器[25]。
基于这一扩展的候选和已知MDS基因列表,使用推断的OGs分析了三个物种之间MDS的保护情况(表5)8c)。鉴定了几个OGs,其中包含MDM基因,这些基因在三个物种中也显示出相似的表达模式(图2)。5b).这些包括作为参考的AOX;SRO2, 3和5即替代脱氢酶NDB3,以及存在于所有三个物种中的几种糖基转移酶和酰基辅酶an -酰基转移酶。值得注意的是,与拟南芥相比,ABA似乎不是水稻和大麦中mdm依赖性反应的主要调节因子。5b).在水稻中,这些OGs均不响应ABA,而在大麦中仅响应ABANDB3受到ABA的负调控,只有AOX1a是稍微上调的。这可能反映了信号通路的差异,正如之前报道的生物和干旱胁迫[97]。MRR标记基因AtAOX1a以及AOX1a水稻和大麦中含有MDM,这在本分析中得到证实。在6个胁迫处理中,AOX1a至少在5个胁迫处理中上调,尽管在大麦中AOX1a不响应MV(或任何其他?AOX基因)。其他MDS基因如AtOM66和乙酰辅酶an -酰基转移酶(At2G32020)也是保守的,并且具有水稻和大麦同源物,也具有MDM和类似的表达响应(图2)。5b).本文确定的新的MDS候选者有AtSRO2/3/5以及大麦和大米中的同源物。这些是植物特异性SRO基因家族的成员,在逆境反应和发育中起重要作用。这个家族包括RADICAL-INDUCED CELL DEATH 1 (RCD1),这是一种核定位的转录调节因子,最近被证明可以抑制ANAC013和ANAC017的活性,并增加影响叶绿体中ROS稳态的MDS基因的表达[46]。这些MDS候选者对应的OG含有OsSRO1c,这是一种已知的多种非生物应激介质[45],并且在本研究中除ABA外的所有处理中均有反应(图2)。5b). OsSRO1c是OsSNAC1的直接靶基因,在干旱和氧化胁迫耐受中发挥作用[98]。在大麦中的同源物表现出与o相同的表达模式SRO1c这代表了一个有趣的目标,因为迄今为止还没有研究分析过地面读数大麦基因家族。其他几种含有新的MDS候选基因的OGs在物种间表现出保守的反应,包括NDB3,这与NDB2(99,One hundred.]可以与AOX1a在压力条件下形成一个保守和完整的呼吸链[48]。
相反响应的同源基因表明物种之间的转录组多样性
在含有反向应答基因的1661个OGs中,102个正群在至少3种胁迫下存在种间反向应答。其中,拟南芥、水稻和大麦中分别含有58、58和51个基因的24个OGs在至少四种胁迫下对两个物种产生相反的反应(图2)。6;表S9)。当对这两组基因中的拟南芥基因进行过度代表氧化石墨烯生物过程的检测时(Fisher的测试,p< 0.05),两组细胞内信号转导和对激素刺激的反应(表S6b).值得注意的是,58个拟南芥基因中的9个(基因组中占15%比6.7%)也产生了已知的细胞间移动mrna,代表了富集(卡方,p < 0.05) [60(图。6).检查反向反应基因集的功能(图2)。6)揭示了许多这些基因(用红色字体表示)在拟南芥和水稻的生物和非生物胁迫中的已知作用(图2)。6;表的年代7).
拟南芥、水稻和大麦处理后的反向应答同源基因。log2变换后的折叠变化(FDR < 0.05)显示为24个正群的热图[24在6个处理(3AT = 3-氨基-1,2,4-三唑,AA =抗霉素A, ABA =脱落酸,MV =甲基紫素,SA =水杨酸,UV =紫外线辐射)中,含有差异表达基因(DEGs)的三个物种(A =拟南芥,O =水稻和H =大麦)的每一个都表现出相反的反应(上调/下调)。在发育、防御和/或氧化还原稳态中具有已知功能的拟南芥基因(ST 7b)用红色表示。下划线表示编码转录因子的基因
在MV、SA和UV处理下,在拟南芥中诱导了一个包含58个抗病基因中的13个(4个处理中相反)编码抗病基因的大正位群,而在水稻和/或大麦中,它们的正位基因被下调(图2)。6).其中两个是含有NB-ARC结构域的抗病基因,注释为cel活化的抗性1 (CAR1;At1g50180)和LOCUS ORCHESTRATING victoreffects 1 (LOV1;At1g10920)(无花果。6),它们在拟南芥的防御中起着关键作用(表5)7b). CAR1是一个关键的宿主免疫受体,负责识别P.syringae效应器(101],而LOV1引发耐药性样反应,导致疾病易感性[102]。CAR1和LOV1的功能丧失导致对P.syringae和Cochliobolus victoriae,分别在拟南芥[101,102]。有趣的是,水稻蛋白LOW SEED SETTING RELATED (OsLSR;LOC_Os10g10360)在同一正位群(OG0000216)中导致构成性激活免疫系统[103]。同样,另一种抗病蛋白(At5g43470)的过表达导致对黄瓜花叶病毒的抗性增强[104],而两个细胞色素p450家族蛋白(At4g39950和At2g22330)和一个udp -糖基转移酶超家族蛋白(At1g22400)的功能丧失导致对链格孢属brassicicola和P.syringae,分别[105,106]。因此,改变这些基因的表达水平似乎在功能上改变了生物的应激反应。值得注意的是,上述所有基因在拟南芥中均上调,而它们的同源基因在水稻和/或大麦中均下调(图2)。6).
这组基因在非生物胁迫反应中也有功能(图2)。6).例如,水稻中OG0002509含有两种谷氨酰胺合成酶,这两种酶在ABA、MV、SA和UV的作用下下调,而相应组中的拟南芥和大麦同源物要么上调,要么不反应(图2)。6).同时过表达OsGS1;1和OsGS2已被证明可以增强渗透、盐度和MV诱导的光氧化应激耐受性[107]。同样,AtGLN1;1 (At5g37600)的缺失导致mv处理叶片叶绿体氧化还原稳态受损[108]。此外,ATGLN1;1和其他谷氨酰胺合成酶的组合缺失会影响拟南芥耐受非生物胁迫的能力[108]。与这些上调的拟南芥基因相反,编码细胞色素p450超家族蛋白CYP709B (OG0000297)的基因在拟南芥中下调或不响应,而其在大麦中的同源基因在3AT、SA和UV下被诱导(图2)。6).该基因在拟南芥中的功能缺失导致对ABA和盐胁迫的敏感性增加[109]。同样地,我们发现AtRAV2/ABI3 (At1g68840)在3AT、AA和MV下被诱导,而其水稻和大麦同源物被下调(图2)。6).AtRAV2的功能缺失也会改变盐胁迫反应rav2盐条件下种子萌发率提高的突变体[110]。有趣的是,AtRAV2的表达在盐胁迫下降低[110],而它的一个水稻同源物(OsRAV2;LOC_Os05g47650)在盐胁迫下诱发[111],也被认为在水稻盐胁迫反应中具有功能作用[112]。同样,拟南芥中udp -糖基转移酶85A5编码基因(At1g22370)在3AT、ABA和SA的作用下被显著诱导,而在ABA处理下,其水稻同源物被下调,大麦同源物仅被上调(图2)。6).已知该基因在拟南芥中在盐胁迫下被诱导,烟草中的异位表达导致转基因植物的耐盐性提高[113]。因此,该亚群中基因表达的改变似乎直接影响非生物胁迫反应,在盐胁迫耐受中已知作用的基因表达多样性可见。
最后,在拟南芥(AT1G15950和AT1G80820)和大麦中,观察到肉桂酰辅酶a还原酶(CCR) 1和CCR 2编码基因在拟南芥、水稻和大麦中的表达差异CCR1表情无变化;CCR2在除紫外线外的5种处理下,拟南芥中诱导了基因的表达,而其水稻和大麦同源基因的表达减少(图2)。6).CCRs在木质素生物合成中具有重要作用,当CCR1在拟南芥中被敲除时,观察到生长迟缓和发育迟缓,而在拟南芥中CCR1敲除Medicago truncatula显示出更严重的损害,导致大多数植物无法存活[114]。因此,尽管同源性不同,但这些基因在拟南芥、水稻和大麦之间的表达和功能可能不同,这表明同源性和表达之间的差异必须考虑到物种之间的翻译工作,无论是在对发育的影响方面还是在胁迫(如盐胁迫)下。
尽管同源性,转录因子表达的多样性
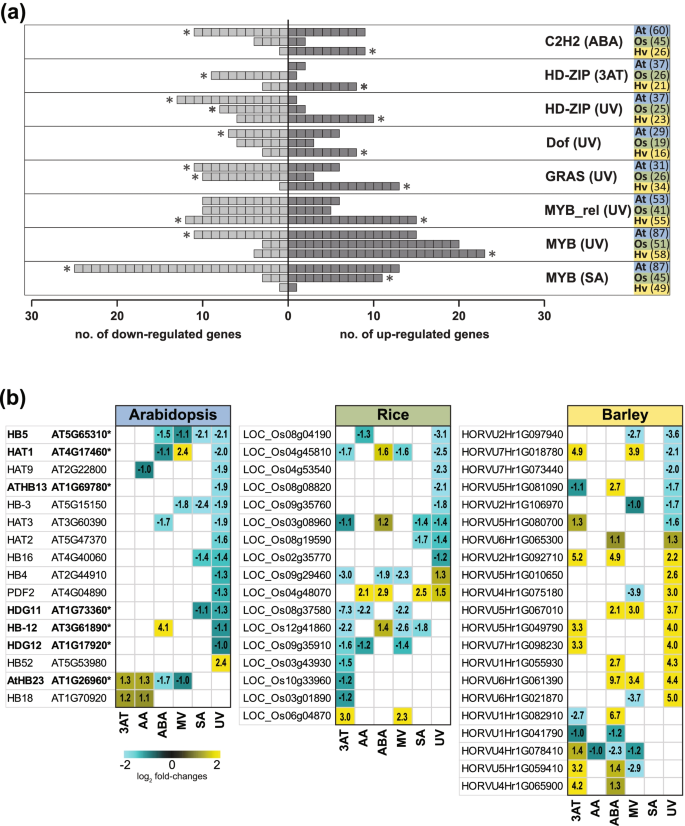
所有编码三个物种TFs的基因[115]对DEG集合内特定家族的富集进行了分析。ERF和NAC TFs富集(超几何分布);p-值< 0.05),在所有六种应力中至少有两个物种的DEG集(图S4,年代5一个;表的年代10).在3AT和UV条件下,三个物种中诱导的erf(拟南芥:32个,水稻:22个,大麦:26个)和NAC TFs(拟南芥:31个,水稻:27个,大麦:46个)的数量最多(图5)5a)同样,WRKY、bHLH、HSF、MYB和C2H2 tf显著富集(p< 0.05;无花果。5b;表的年代11)在至少两个物种中对六种处理中的五种作出反应。其中,WRKY因子在上调的基因集中富集,类似于erf和NACs(图5)5b)相比之下,在ABA、MV和SA的作用下,拟南芥和大麦中bHLH转录因子在下调基因中呈现保守富集,而在ABA和MV的作用下,仅在拟南芥中MYB编码基因在下调基因中呈现富集(图5)5b).考虑到这些物种特异性差异,我们进一步研究了TF家族,以确定物种之间富含相反响应的deg的家族。鉴定出5个TF家族(C2H2、HD-ZIP、Dof、GRAS和MYB),在相同的胁迫下,一个物种的基因组上调,另一个物种的基因组下调(反之亦然)(图2)。7一个;表的年代12).值得注意的是,所有五个家族在大麦中都富集了上调的基因集,而在拟南芥和/或水稻中,同一家族在下调的基因集(s)中被富集(图2)。7a).例如,在ABA的作用下,拟南芥下调的基因中富集了C2H2家族,而大麦上调的基因中富集了C2H2家族(图2)。7一个)。
由于tf可以补充同一家族中的其他tf,我们检测了富集相反反应集的五个家族中所有deg的表达(图2)。7a).这表明,尽管在相反反应亚群中富集,但TF家族中存在每个家族中上调和下调的成员,因此很难确定相反反应是否代表功能差异。然而,这项研究发现了大多数基因表现出相反转录组反应的家族(图2)。7a),并且对于其中的许多,他们的反应在一个以上的压力是保守的(图S)6).例如,在对SA和UV的响应中,水稻和大麦中大多数MYB因子上调,而拟南芥中大多数MYB因子下调,其中一些在每个物种的两种胁迫下都表现出相同的上调/下调反应(图5)6).同样,除了一个GRAS家族外,大麦中的所有GRAS家族tf在紫外线和3AT下均上调,而拟南芥中的大多数则下调,其中许多在MV下保持这种下调(图5)6).这支持了这些TFs在单一物种中保守的应激反应调节的观点。
对于同源结构域(hd - zip)家族,在响应3AT和UV时观察到物种之间相反的调节模式(图2)。7在大麦中富含上调基因,在拟南芥(仅紫外线)中富含下调基因,在水稻(3AT和紫外线)中富含下调基因的HD-ZIPs(图1)。7a).拟南芥中只有1个HD-ZIP因子上调,水稻中只有2个HD-ZIP因子上调,而大麦中大部分HD-ZIP因子受到紫外线的高度诱导(图2)。7b).在拟南芥中,在紫外线下编码hd - zip的14个DEGs中,13个被下调,6个被实验证明在发育和/或胁迫中具有重要的功能作用,功能丧失导致功能改变[116,117,118]。有趣的是,该家族在大麦中的表达显示,编码hd - zip的16个deg中有10个被上调,其中5个被上调了4倍以上(图2)。7b)。
讨论
一种模式物种(拟南芥)和两种作物物种(水稻和大麦)对六种模拟胁迫反应处理的转录组反应比较(表1)1)揭示了这些物种之间的遗传和转录组保护水平。检测对激素(ABA和SA)的反应;引起氧化应激(3AT, MV)的处理;抑制呼吸(AA)或引起基因损伤[53],揭示了受影响的非生物应激反应途径的异同(表2)1)揭示了单一治疗/物种研究无法实现的知识深度。标记基因的使用确保了处理的有效性,尽管在大麦中使用了较晚的时间点(6小时而不是3小时),以获得与水稻和拟南芥相似的反应。在进行跨物种比较时,需要对齐尽可能多的参数以验证比较是必要的。鉴于之前对拟南芥的处理和时间进行了广泛的优化,因此在可能的情况下保持了这一点,因为许多基于转录物变化的功能研究已经进行了,以验证它们在应激反应中的作用。同样,在组织方面,所有物种都处于早期发育阶段,两周大的拟南芥[119](生长期:1.06),稻米和大麦[120(均为生长阶段13)。虽然拟南芥1.06期与水稻和大麦第13期(相当于拟南芥1.03期)在发育上存在微小差异,但发育差异很小(见下文)。总的来说,比较的有效性是显而易见的;i) 80%的同源物在物种之间表现出相似的反应,ii)保守反应比非保守反应多四倍,iii)当观察到相反的反应时,这不能用小的生长阶段差异来解释,因为以相反模式反应的基因在第7天至第21天之间的相关性为r = 0.97(表S)9).
这种方法揭示了响应的共性和差异,将为翻译研究提供路线图,帮助将模型系统中获得的知识转移到作物物种。本研究揭示了对治疗的反应(表2)1)在数量、基因本体、同源性和表达上都存在差异。对不同物种中对处理有反应的转录本数量的分析确实表明了特异性或保守性方面的趋势(图2)。1).值得注意的是,与大麦和水稻相比,拟南芥对各种处理的响应重叠更大,这可能表明拟南芥的调控层级比其他物种更共享(图2)。1).
虽然这些差异现在可以通过实验来测试,但有趣的是,许多家族中tf表达的变化存在根本差异(图2)。7).最近对藻类、非种子植物和种子植物中TF的综述揭示了TF表达保守与保守功能之间的联系,并举例说明了TF表达保守与功能保守之间的联系,相反,功能不保守的TF具有不同或谱系特定的表达模式[121]。因此,在拟南芥研究中出现的涉及tf的信号网络的广泛相互作用可能在其他物种中更为有限或不同。例如,OsMYBS1的两个拟南芥同源基因在水稻糖和激素介导的信号传导中起作用,在调节拟南芥中葡萄糖和ABA信号传导中发挥相反的作用,这表明一些TFs在这些物种中具有不同的调节作用[122]。这些潜在的差异对转化为作物物种具有重要意义,因为在田间条件下,植物也暴露于多种非最佳条件下[123,124]。虽然对这些多种条件的反应可能在一个物种中高度整合,但它们可能会在其他物种中触发多个甚至是拮抗的平行途径。值得注意的是,在本研究中发现的相反反应组中,激素通路丰富。考虑到逆行、逆行和激素信号通路的相互作用[123,125,126],了解这些差异对于翻译研究至关重要。
在处理反应中观察到的一个差异是与蛋白质稳态相关的GOs,在拟南芥、水稻和大麦之间存在显著差异。拟南芥的生长速率与蛋白质周转呈负相关[127],而蛋白质合成在能量上是昂贵的[128]。因此,蛋白质周转和合成的速度是植物的主要能量汇,但也表明对刺激的反应。不同处理对拟南芥蛋白稳态和囊泡运输的影响(图2)。2A)可能指出植物之间这些过程的差异,同样也指出蛋白质生物合成的差异。因此,两者都可能表明在不利条件下三种物种之间蛋白质周转率的差异,并可能对生长发育产生影响。如果在不利条件下能量消耗限制生长的原理要从拟南芥应用到其他植物,这方面需要进一步研究[129]。值得注意的是,在本研究中,拟南芥加入哥伦比亚,在蛋白质周转率方面,在拟南芥加入哥伦比亚和哥伦比亚之间存在差异[127,这可能不一定是对压力的“典型”反应的反映。另一个可能的影响因素是三个物种的寿命差异,这影响了mRNA和蛋白质的周转。
本研究中使用的定义相反反应的方法是非常保守的,因为它仅限于正畸学,并且正畸群中的所有基因都需要显示相同的趋势。因此,本研究中概述的相反反应可能是对物种之间差异的低估。当分析整个TF家族的表达时,可以在一定程度上看到这一点(图2)。7).来自每个家庭的基因数量的巨大差异,在对治疗的反应中被大量上调或下调,表明基因的调节方式存在根本差异。因此,在另一个物种中表达来自一个物种的TF以转移对限制条件的耐受性等性状的常见做法可能不会产生所有期望的效果。例如,OsAP2和OsWRKY24被认为在水稻和拟南芥中具有相反的作用,已知它们是积极的调节因子,参与水稻的层倾角、晶粒大小和细胞伸长的增加,而它们在拟南芥中的过度表达导致植株大小和细胞大小的减小[130]。同样,与拟南芥相比,转基因水稻中AtFD和AtFDP过表达后的结果也不像预期的那样[131]。因此,尽管同源性不同,但不同物种之间的功能和表达可能存在明显差异,在密切相关的单子叶物种中观察到的tgf对处理的反应存在差异,例如GRAS和HD-ZIP tgf对紫外线的反应。TF家族对应激反应的差异可能表明,虽然上游调控网络可能不同,但保守靶基因的反应是相似的。这可能会限制在作物物种研究中广泛应用的跨物种启动子基序搜索的应用。
尽管启动子区域相似且基因之间具有显著的同源性,但也可能观察到相反的表达反应,如拟南芥和短叶菊中的趋光素基因[132]。同样,尽管在大麦和拟南芥中同源性和实验证实PAO/phyllobilin通路具有相同的功能,但这些蛋白的下游作用在物种之间是不同的[133]。这些差异的另一个例子可以在水稻光敏色素相互作用因子- like1 (OsPIL1)中看到,该因子负调控水稻叶片衰老ospil1突变体比WT早衰老,而拟南芥中OsPIL1的同源基因则相反atpif4和atpif5突变体(134]。钾剥夺对茉莉酸相关基因表达的影响以及对草食性昆虫的下游抗性也有相反的影响,尽管茉莉酸应答基因同源性不同,但大麦和拟南芥之间的影响也不同[135]。尽管拟南芥、水稻和大麦在同源性、基因功能和表型效应方面存在差异,但这些只是其中的一些例子,突出了对本研究和其他类似研究等资源的需求[57以确定物种之间的共同和独特的反应,特别是那些跨越多种处理的反应,为进一步的实验设计提供有价值的信息。
在本研究中观察到的物种反应存在显著差异的同时,也存在显著的相似性。所有三个物种对三种或三种以上刺激的保守反应表明,从感知到反应的基本反应途径在基因水平上是保守的(图2)。4).一个很好的例子是拟南芥线粒体功能失调反应[84]。在对AA的反应中,以及在较小程度上的3AT独联体DEGs启动子区域的-调控基序在所有三个物种中都富集(图2)。5a).此外,拟南芥中存在的MDS候选基因比先前定义的要多。因此,线粒体调控途径由潜伏ER结合的NAC TFs的激活控制,并被RCD样蛋白抑制,这是在单子房和双子房中观察到的一个共同主题。在拟南芥中,ANAC017 TF的作用现在已经扩展为参与洪水反应,衰老和衰老以及作为生长调节剂[136]。ANAC017缺陷植株的生长发育速度比野生型对照快,生物量积累可增加50%,而过表达ANAC017的植株则表现出生长迟缓[136]。然而,只有高水平的过度表达才会产生有害影响。因此,考虑到该TF通过将线粒体和叶绿体能量代谢与环境条件结合在一起在应激反应中发挥核心作用,以及该途径在物种间的保守性,我们的研究证明了目标基因的自然变异或修饰如何用于农艺目的。
结论
本研究中对6种处理的转录组反应的跨物种比较表明,胁迫之间存在重叠,拟南芥比大麦和水稻更明显。超过5000个基因都是同源的,并且在至少两个物种中对至少一种处理表现出保守的反应,这表明相关的反应途径在物种之间具有保守性,包括erf、NAC和WRKY tf等应激反应性tf。对显示共同反应的保守基因的进一步研究发现,有几个基因在应激反应途径中具有已知的功能,包括NAC [137]及ERFs及TFs [138]以及其他(红色字体;无花果。4).虽然同源基因存在的大量重叠表现出保守的反应是意料之中的,但值得注意的是,物种之间15-34%的同源deg表现出相反的转录组反应。对这些在生物和非生物应激反应途径中具有已知作用的已鉴定基因进行检查,其中一些基因具有已知功能,因此表达改变导致拟南芥表型改变(红色字体;无花果。6).因此,尽管这些基因在水稻和大麦中也是同源的,但这里确定的候选名单可能只代表了具有不同调控的基因的一个子集,特别是考虑到在至少四种独立处理后观察到相反的反应。在20个至少在4个处理中反应相反的TF中,有6个正位群含有相反反应的TF,这表明TF基因表达存在多样性,进一步支持物种间差异调控的可能性。虽然这项研究比较了拟南芥、大麦和水稻对各种刺激的反应,但一次只使用一种刺激,新兴的研究强调了组合应激的重要性[139]。在对处理的重叠反应和相反反应中观察到的差异意味着当施加联合压力时,物种之间可能出现更多差异。
方法
植物材料和生长条件
水稻种子(Oryza sativa L. ssp。对粳稻(品种Millin)进行表面灭菌,在培养皿中黑暗萌发。1周后,将预发芽的水稻幼苗移栽到土壤中,在29°C/26°C、350 μE m-2 s-1、相对湿度为65%的生长室内日夜循环12 h/12 h生长。大麦种子(大麦芽l . ssp。vulgare,栽培品种Commander)直接播种到土壤中,在21°C的温室中生长。拟南芥(生态型Columbia-0)种子表面消毒,在4℃下分层48 h。在22°C(日)/19°C(夜)、120 μE m-2 s-1条件下,生长室日夜循环16 h/8 h。
植物来源如下:1)拟南芥(Col-0)从NASC (NASC ID: N1092)获得,并在James Whelan教授的实验室中连续生长。这一结论得到了种子库登记员詹姆斯·惠兰教授的证实,并通过对作为种子库种植的植物的目视检查得到了证实。2)栽培稻(Nipponbare)由浙江大学生命科学学院shhuixia教授从遗传资源水稻(GSOR)库存中心(GSOR ID: 301164)获得,每年培养用于种子生产,并由James Whelan教授验证。大麦芽L (Commander) -在阿德莱德大学韦特校区种植后,由马修·塔克教授获得并验证了谷物。Commander是在阿德莱德大学培育的,可以从SeedNet (https://associatedgrain.com.au/wp-content/uploads/2014/11/Commander-Barley_Factsheet_2014.pdf).指挥官是一种麦芽型大麦,非常适合澳大利亚的所有种植区域。
应激处理,组织收集,RNA分离和qRT-PCR
2周龄拟南芥(生长期:1.06;Boyes等人,2001),水稻和大麦(都是生长阶段13;Zadok等,1974)幼苗喷施2 mM水杨酸(SA), 1 mM甲基紫剂[54], 10 mM 3-氨基-1,2,4-三唑(3-AT), 100 μM脱落酸(ABA)或50 μM抗霉素A,添加0.01% Tween20作为润湿剂,直到液体从叶片上滴下。30 min后重复喷洒。模拟对照植物以同样的方式处理,水和0.01%的Tween20。采集水稻和大麦叶片样本(最顶端叶片中部1cm)以及拟南芥整个莲座组织,在液氮中冷冻提取总RNA。对于紫外线处理,所有植物在灭菌罩中暴露于UVC照射(主要波长254)15分钟,使用欧司朗HNS 30 W G13光源,将样品置于距离光源10厘米的RT下。所有处理后的样本收集在每个处理的最早时间点进行,其中表S中标记基因的基因表达反应1通过qRT-PCR观察到或先前在水稻或拟南芥中显示出显著性,而对于大麦,各自基因的测试时间分别为3小时,6小时和12小时(表51).除大麦AA和ABA在喷施后6 h外,所有品种和处理均在喷施后3 h。用50 μM AA处理水稻幼苗,将2 cm叶段漂浮在10 mM磷酸钾缓冲液(pH 6.8)中(0.01% Tween20) 3 h。以水和0.01% Tween20进行模拟处理。采集叶片样品,在液氮中冷冻,提取rna。对于总RNA的分离,3个生物重复中的每一个都汇集了3-4个单株的组织。
根据制造商的方案,使用SpectrumTM植物总RNA试剂盒(Sigma-Aldrich)分离总RNA。洗脱前用柱上dna酶I (Sigma-Aldrich)酶切总RNA。采用SPECTROstar®(BMG LABTECH, Freiburg, Germany)分光光度计和琼脂糖凝胶电泳分析RNA的数量和质量。qRT-PCR分析用cDNA Synthesis Kit (Bio-Rad)逆转录1 μg总RNA,按照生产商的说明书,详见补充材料。
RNA-seq
根据制造商说明(Illumina)使用TruSeq单链mRNA文库准备试剂盒制备RNA-seq文库,并在HiSeq1500系统(Illumina)上测序为60 bp reads,平均质量分数(Q30)高于95%,平均每个样本1800万reads。质量控制采用fastqc软件(https://www.bioinformatics.babraham.ac.uk/projects/fastqc/).转录本丰度(每百万转录本数)和估计计数在基因水平上进行了量化,方法是使用kallisto程序对从代表性转录本模型(tair10 -拟南芥,irgsp -1.0-水稻,ibscv2 -大麦)构建的k-mer指数进行伪比对。140]。只有在每种基因型的四分之一样本中至少有5个计数的基因才被纳入进一步的分析。使用带有Wald测试的程序侦探来测试差异基因表达[141]。当错误发现率FDR < 0.05,且log2 (fold change) =/> 1时,称为差异表达基因。
生物信息学分析
拟南芥、水稻和大麦的同源物和对应的同源群通过OrthoFinder v. 2.3.3进行推断[56]使用默认参数和MMseqs2 [142]进行序列相似性搜索。蛋白质序列从EnsemblPlants v44 (https://plants.ensembl.org/index.html)用于大麦(IBSCv2), TAIR用于拟南芥(TAIR10), IRGSP-1.0用于水稻。
使用phatmap R包进行分层聚类和生成热图[143]。
TF富集分析、Pageman分析、GO-term分析和motif分析的详细内容见补充方法。
数据和材料的可用性
本研究的所有NGS数据已根据加入协议提交给GEO:
大麦:https://dataview.ncbi.nlm.nih.gov/object/PRJNA655522?reviewer=8106fo6qrhll624dnds1plt36k
赖斯:https://dataview.ncbi.nlm.nih.gov/object/PRJNA655523?reviewer=eek2167n23ucnakjhn4gh9vj9o
拟南芥:数据已经公开- PRJNA486068 [136]。
缩写
- 3:
-
3-amino-1 2 4-triazole
- AA:
-
抗霉素A
- 阿坝:
-
脱落酸
- AOX:
-
替代氧化酶
- 度:
-
差异表达基因
- 小块土地:
-
乙烯响应系数
- 罗斯福:
-
错误发现率
- 走:
-
基因本体论
- HSF:
-
热冲击系数
- 是:
-
茉莉酸
- 南京:
-
NAM, ATAF, CUC转录因子
- 门店:
-
新一代测序
- MDM:
-
线粒体功能障碍基序
- MDS:
-
线粒体功能障碍刺激
- MRR:
-
线粒体逆行调节
- OG:
-
Orthogroup
- ROS:
-
活性氧
- 山:
-
水杨酸
- TF:
-
转录因子
- MV:
-
甲基紫罗碱
- 紫外线:
-
紫外线辐射
参考文献
蒋玉华,郭克。效应触发免疫:NLR免疫感知和下游防御反应。拟南芥图书2015;2015.
李伟,邓勇,宁勇,何铮,王国良。利用作物的广谱抗病性:从分子解剖到育种。植物学报,2010;31(1):579 - 583。
王志强,王志强,王志强,López Sánchez A,王志强,王志强,等。在一个充满敌意的世界中生存:植物抵抗病虫害的策略。植物学报,2019;57(5):555 - 529。
李建军,李建军,李建军,等。水驱应力信号在水驱过程中的应用。植物学报,2016,29(1):39-43。
李建军,李建军,李建军,等。植物对环境压力的感知与反应。植物生理学报,2014;32(4):344 - 344。
李建平,李建平。植物信号转导在逆境胁迫下的应用。[J] .生物医学工程学报,2010;31(5):649 - 651。
韩晓平,张建平,张建平。RGF1通过ROS信号控制根分生组织大小。大自然。2020;577(7788):85 - 8。
张建军,张建军,张建军,等。植物活性氧信号转导的研究进展。植物学报,2018;39(6):559 - 559。
李建军,李建军,李建军,等。ROS转轮:改善ROS转录足迹。植物生理学报,2016;17(3):1720-33。
刘建军,刘建军,刘建军,等。ROSMETER:一种生物信息学工具,用于鉴定与活性氧类型和来源相关的转录组印迹,为应激反应提供了新的见解。植物生理学报,2013,32(2):1071 - 1083。
Fernandez-Marcos M, Desvoyes B, Manzano C, Liberman LM, Benfey PN, Del Pozo JC,等。MYB36对拟南芥侧根原基边界的控制。植物学报,2017;21(1):105-12。
刘建军,刘建军,刘建军。ROS的转录调控控制着根从增殖到分化的转变。细胞。2010;143(4):606 - 16。
王晓明,王晓明,王晓明,等。植物氧化还原基因的克隆与表达。中国生物医学工程学报,2018;31(2):391 - 391。
Foyer CH, Noctor G.应激触发的氧化还原信号:前景研究植物学报,2016;39(5):951-64。
Rao MV, Paliyath G, Ormrod DP, Murr DP, Watkins CB。水杨酸对H2O2生成、氧化应激和H2O2代谢酶的影响。水杨酸介导的氧化损伤需要H2O2。植物生理学报。1997;15(1):394 - 394。
邹建军,李晓东,Ratnasekera D,王超,刘文霞,宋丽玲,等。拟南芥钙依赖蛋白KINASE8和CATALASE3参与干旱胁迫下气孔保护细胞脱落酸介导的信号传导和H2O2稳态。植物学报,2015;27(5):1445-60。
李江,刘J,王G, Cha司法院,李G,陈年代,et al。在拟南芥中,NO过氧化氢酶活性1的伴侣功能是维持过氧化氢酶活性和多重胁迫反应所必需的。植物学报,2015,27(3):908-25。
李建军,李建军,李建军,等。核氧还蛋白通过保护抗氧化酶来防止氧化应激。科学通报,2017;35(3):444 - 444。
袁惠明,刘万文,吕玉涛。在植物防御中,CATALASE2协调sa介导的生长素积累和JA生物合成的抑制。细胞宿主微生物。2017;21(2):143-55。
Ramel F, Birtic S, Ginies C, soubigou - tacconnat L, Triantaphylides C, Havaux M.类胡萝卜素氧化产物介导植物单线态氧的基因应答。中国科学:自然科学版,2012;39(4):535 - 540。
D'Alessandro S, Ksas B, Havaux M.解码β -环心醛介导的逆行信号解毒反应在植物耐光氧化胁迫中的作用。植物学报,2018;30(10):2495-511。
李建军,李建军,李建军,等。植物逆转录信号在逆境胁迫中的作用。实验学报,2018;69(11):2783-95。
Leister D.将谜团拼凑在一起:活性氧和氧化还原中心在叶绿体逆行信号传导中的核心作用。抗氧化还原信号。2019;30(9):1206 - 1209。
陈建新,Phua SY, Crisp P, McQuinn R, Pogson BJ。学习叶绿体的语言:逆行信号及其他。植物学报,2016;37(4):557 - 557。
孟霞,李丽,De Clercq I, Narsai R,徐勇,Hartmann A,等。ANAC017通过逆行信号重编程协调细胞器功能和应激反应。植物生理学报,2019;18(1):634-53。
Ng S, De Clercq I, Van Aken O, Law SR, Ivanova A, Willems P,等。在生长、发育和应激过程中编码线粒体蛋白的核基因的顺行和逆行调控。植物学报,2014;7(7):1075-93。
赵超,刘波,朴松,王霞,Lobell DB,黄勇,等。四项独立估计显示,气温升高降低了全球主要作物的产量。科学通报,2017;35(3):326 - 331。
Zandalinas SI, Mittler R, Balfagon D, Arbona V, Gomez-Cadenas A.植物对干旱和高温组合的适应。植物物理学报,2018;32(1):2-12。
王伟,王文华,王文华,等。植物对干旱、盐和极端温度胁迫的抗性基因工程研究。足底。2003;218(1):1 - 14。
Gilliham M, Able JA, Roy SJ。将有关非生物逆境耐受性的知识转化为育种计划。植物学报,2017;39(5):898-917。
梅瑟勒M,朗D,梅耶KF。利用新一代技术分析抗应力。农学。2018;8(8):130。
长谷川总理。非生物胁迫、胁迫组合与作物改良潜力。植物学报,2017;39(5):837 - 838。
李培平,于福峰,何光华,陈敏,周玉波,柴世臣,等。大豆Hsf家族的全基因组分析及GmHsf-34参与干旱和热胁迫的功能鉴定。生物医学工程学报,2014;15:1009。
引用本文:Sarkar T, Thankappan R, Mishra GP, Nawade BD. DREB对转基因作物非生物胁迫抗性的研究进展。植物物理学报,2019;25(6):1323-34。
沈静,吕波,罗磊,何静,毛超,席冬,等。nac型转录因子OsNAC2调控aba依赖基因和水稻的非生物胁迫耐受性。科学通报,2017;7:40641。
Visioni A, Al-Abdallat A, Elenien JA, Verma RPS, Gyawali S, Baum M.大麦抗非生物胁迫的基因组学和分子育种[j]。大麦芽l .)。非生物抗逆性作物基因组学辅助育种,第二卷:Springer;2019.49 - 68页。
王丽,叶霞,刘宏,刘霞,魏超,黄勇,等。水稻nb - lrr样基因OsLSR的过表达和抑制都会导致免疫反应的自身激活和硫胺素的积累。科学通报2016;6:24079。
Kawahara Y, de la Bastide M, Hamilton JP, Kanamori H, McCombie WR, Ouyang S,等。利用下一代序列和光学图谱数据对粳稻参考基因组进行改良。水稻学报,2013;6(1):4。
李建军,李建军,李建军,等。利用全注释参考基因组改变小麦研究和育种的限制。科学。2018;361(6403)。
Mascher M, Gundlach H, Himmelbach A, Beier S, Twardziok SO, Wicker T,等。染色体构象捕获大麦基因组的有序序列。大自然。2017;544(7651):427 - 33所示。
王晓明,王晓明,王晓明,等。下一代育种。植物科学,2016;42(2):3 - 13。
黄乃文,朴思,朴C,徐海,金士德,蔡娥,等。NAC013诱导的氧化应激反应和细胞程序性死亡调控萝卜主根的精密度。工厂J. 2021。
刘松,刘松,王敏,魏涛,孟超,王敏,等。一种类似RCD-ONE基因的小麦通过调节氧化还原稳态和维持基因组完整性来促进幼苗生长和抗非生物胁迫。植物学报,2014,26(1):164-80。
袁波,陈敏,李松。拟南芥甘甜基因IcSRO1的分离与鉴定及其对盐耐旱性的影响。中国生物医学工程学报,2010;21(3)。
尤杰,宗伟,杜华,胡华,熊磊。水稻SRO家族的一个特殊成员OsSRO1c通过与多种转录因子的相互作用介导对多种非生物胁迫的应答。植物化学学报,2014;34(6):693-705。
Shapiguzov A, Vainonen JP, Hunter K, tosavainen H, Tiwari A, Jarvi S,等。拟南芥RCD1通过与ANAC转录因子的相互作用协调叶绿体和线粒体功能。Elife。2019;8。
王晓明,王晓明,王晓明,等。植物生长发育过程中线粒体信号与激素的相互作用。植物细胞环境学报,2016;39(5):1127-39。
Clifton R, Lister R, Parker KL, Sappl PG, Elhafez D, Millar AH,等。胁迫诱导的拟南芥其他呼吸链组分的共表达。植物化学学报,2009;32(2):393 - 398。
吴绍平,王勇,徐磊,等。细胞周期蛋白依赖性激酶E1 (CDKE1)在植物生长和胁迫反应之间提供细胞开关。生物化学学报,2013;28(5):349 - 359。
Berkowitz O,徐勇,刘立龙,王勇,朱勇,Hurgobin B,等。激光显微解剖拟南芥叶片表皮、叶肉和脉管系统的RNA-seq分析确定了组织对多种胁迫处理的特异性转录反应。植物学报,2011;31(3):938 - 955。
Munns R, James RA, Lauchli A.提高小麦和其他谷物耐盐性的方法。[J] .生物医学工程学报,2006;57(5):1025 - 1043。
牛顿AC, Flavell AJ, George TS, Leat P, Mullholland B, Ramsay L,等。养活世界的作物大麦:韧性强的作物?粮食安全背景下的优势和劣势。粮食安全。2011; 3(2): 141 - 78。
Sugliani M, Abdelkefi H, Ke H, Bouveret E, Robaglia C, caffri S,等。一种古老的细菌信号通路调节叶绿体功能,影响拟南芥的生长发育。植物学报,2016;28(3):661-79。
Medina-Rivera A, Defrance M, Sand O, Herrmann C, Castro-Mondragon JA, Delerce J,等。RSAT 2015:调控序列分析工具。核酸学报,2015;43(1):W50-6。
刘建军,刘建军,刘建军,等。PageMan:一个交互式本体工具,用于生成、显示和注释概述图,用于分析实验。生物医学工程学报,2006;7:535。
OrthoFinder:解决全基因组比较中的基本偏差显著提高了正位群推断的准确性。基因组生物学。2015;16:157。
帕特尔RV, Nahal HK, Breit R, Provart NJ。BAR表达谱鉴定:植物物种中同源基因的表达谱相似性排序。植物学报,2012;31(6):1038 - 1041。
图菲利K,布雷迪SM,奥斯汀R, Ly E, Provart NJ。植物学阵列资源:e- northern、表达角和启动子分析。植物学报,2005;43(1):563 - 563。
陈勇,陈勇,刘建军,刘建军,等。生物信息学在生物信息学研究中的应用。科学通报,2011;6(1):15237。
Thieme CJ, rojass - triana M, Stecyk E, Schudoma C,张伟,杨玲,等。内源性拟南芥信使rna转运到远处组织。植物学报,2015;1(4):15025。
霍瓦思,王晓明,王晓明,等。控制或盐胁迫条件下拟南芥谷胱甘肽转移酶基因突变的补偿中国生物医学工程学报,2010;21(7)。
卢华S, Hegie A, Suzuki N, Shulaev E, Luo X, Cenariu D,等。通过高通量表型筛选将未知功能基因与非生物应激反应联系起来。植物物理学报,2013;48(3):322-33。
王晓军,王晓军,王晓军,王晓军。拟南芥应激诱导锌指蛋白SAP12的氧化还原依赖性调控。植物学报,2009;2(2):357-67。
马建军,李建军,李建军,等。miR408基因在拟南芥非生物胁迫应答中的表达。植物学报,2015;31(1):379 - 379。
王莹,Cordewener JH, America AH, Shan W, Bouwmeester K, Govers F.拟南芥凝集素受体激酶(lck - ix)。1和LecRK-IX。2are functional analogs in regulating Phytophthora resistance and plant cell death. Mol Plant-Microbe Interact. 2015;28(9):1032–48.
郝德华,崔浩,许秀,Bassin B, Kim J, Martinoia E,等。拟南芥ABCG34通过介导camalexin的分泌参与对坏死性病原体的防御。中国科学:自然科学版,2017;39(6):1182 - 1182。
刘建军,刘建军,刘建军,等。蛋白磷酸酶AP2C1负调控丁香假单胞菌的基础抗性和防御反应。实验学报,2017;68(5):1169-83。
张b, Van Aken O, Thatcher L, De Clercq I, Duncan O, Law SR,等。拟南芥线粒体外膜AAA atp酶AtOM66影响细胞死亡和病原体抗性。植物学报,2014,31(4):779 - 779。
Maekawa S, Inada N, Yasuda S, Fukao Y,藤原M, Sato T,等。碳/氮调节剂拟南芥毒理学家EN LEVADURA31通过与SYNTAXIN OF PLANTS121相互作用,控制白粉真菌渗透后乳突的形成。植物生理学报,2014,31(2):879-87。
前川S,佐藤T,浅田Y,安田S,吉田M,千叶Y,等。拟南芥泛素连接酶ATL31和ATL6控制防御反应和碳/氮反应。植物化学学报,2012;39(3):557 - 557。
胡鹏,周伟,程志,范敏,王丽,谢东。JAV1调控茉莉素调控的植物防御。生物质化学工程,2013;50(4):504-15。
Terasaka K, Blakeslee JJ, Titapiwatanakun B, Peer WA, Bandyopadhyay A, Makam SN等。PGP4是一种ATP结合盒p糖蛋白,可催化拟南芥根部生长素的运输。植物学报,2005;17(11):2922-39。
Kamimoto Y, Terasaka K, Hamamoto M, Takanashi K, Fukuda S, shiitan N,等。拟南芥ABCB21是由细胞质生长素浓度调控的兼性生长素输入/输出基因。植物生理学报,2012;53(12):2090-100。
哈扎克O, Mamon E, Lavy M, Sternberg H, Behera S, Schmitz-Thom I,等。一种新的Ca2+ -结合蛋白,可以在根生长过程中快速转导生长素反应。生物学报,2019;17(7):e3000085。
景鹏,邹军,孔磊,胡松,王斌,杨军,等。OsCCD1是一种新型的小钙结合蛋白,具有一个EF-hand基序,积极调节水稻的渗透和耐盐性。植物科学,2016;37(4):1044 - 1044。
陈建军,陈建军,陈建军,等。NAC蛋白在植物抗胁迫中的作用。植物科学进展,2012;17(6):369-81。
马志强,王志强,王志强,等。ATAF1转录因子在植物抗生物和非生物胁迫中的作用。细胞生物学杂志,2009;19(12):1322-3。
刘艳,孙军,吴勇。拟南芥ATAF1基因增强转基因水稻对盐胁迫和ABA的耐受性。植物学报,2016;29(5):955 - 662。
吴勇,邓志,赖军,张勇,杨超,尹斌,等。拟南芥ATAF1在非生物和生物胁迫响应中的双重功能。细胞生物学杂志,2009;19(11):1279-90。
胡慧,尤佳,方勇,朱鑫,齐铮,熊磊。水稻耐冷耐盐转录因子SNAC2基因的克隆与表达。植物化学学报,2008;37(1):379 - 379。
高峰,熊安,彭锐,金霞,徐军,朱斌,等。OsNAC52是一种水稻NAC转录因子,可能对ABA起应答作用,并使转基因植株具有耐旱性。植物细胞与组织器官学报。2010;100(3):255-62。
陈彦杰,Perera V, Christiansen MW, Holme IB, Gregersen PL, Grant MR,等。大麦HvNAC6转录因子影响ABA积累,促进大麦对白粉病的基础抗性。植物化学学报,2013;31(6):577 - 590。
王莹,王晓明,王晓明,徐勇。拟南芥胁迫响应线粒体蛋白的研究进展。中国生物医学工程学报,2018;22(2):444 - 444。
De Clercq I, Vermeirssen V, Van Aken O, Vandepoele K, Murcha MW, Law SR等。膜结合NAC转录因子ANAC013在拟南芥氧化应激反应的线粒体逆行调控中起作用。植物学报,2013;25(9):3472-90。
Sakuraba Y, Kim D, Han SH, Kim SH,朴伟,Yanagisawa S,等。ONAC054在脱落酸诱导的水稻叶片衰老过程中具有多层调控作用。植物学报,2020;32(3):630-49。
Ng S, Ivanova A, Duncan O, Law SR, Van Aken O, De Clercq I,等。膜结合的NAC转录因子ANAC017介导拟南芥线粒体逆行信号传导。植物学报,2013,25(9):3450-71。
陈建军,陈建军,李建军,等。线粒体扰动对生长素信号传导产生负面影响。植物学报,2014;7(7):1138-50。
Rehman HM, Nawaz MA, Shah ZH, Ludwig-Muller J, Chung G, Ahmad MQ,等。三种芸苔属植物和拟南芥中1家族UDP糖基转移酶的比较基因组学和转录组学分析表明胁迫响应性调控。科学通报,2018;8(1):1875。
bottp, Mun BG, Imran QM, Hussain A, Lee SU, Loake G,等。AtWAKL10在一氧化氮应答中的差异表达表明在生物和非生物应激应答中可能起作用。PeerJ。2019; 7: e7383。
Meier S, Ruzvidzo O, Morse M, Donaldson L, Kwezi L, Gehring C.拟南芥壁相关激酶样10基因编码一个功能性胍基环化酶,并与病原体防御相关基因共表达。科学通报,2010;5(1):8904。
胡忠,Vanderhaeghen R, cooling T,王勇,De Clercq I, Leroux O,等。线粒体缺陷赋予对纤维素缺乏的耐受性。植物学报,2016;28(9):2276-90。
高桥N, Ogita N, Takahashi T, Taniguchi S, Tanaka M, Seki M,等。调控拟南芥应激诱导细胞周期阻滞的调控模块。Elife。2019;8。
Gladman NP, Marshall RS, Lee KH, Vierstra RD.拟南芥NAC转录因子对蛋白酶体胁迫调控的研究。植物学报,2016;28(6):1279-96。
李松,徐鹏军,李海军,朴志明。NAC转录因子NTL4在拟南芥干旱诱导的叶片衰老过程中促进活性氧的产生。植物学报,2012;37(5):831 - 831。
傅莹,马慧,陈生,顾涛,龚杰。干旱条件下组蛋白甲基化酶CAU1和转录因子ANAC055调控脯氨酸积累的新途径。实验学报,2018;69(3):579-88。
许毅,Berkowitz O, Narsai R, De Clercq I, Hooi M, Bulone V,等。线粒体功能调节拟南芥的触摸信号。植物学报,2019;37(4):623 - 645。
刘建军,刘建军,刘建军,等。EDS1/PAD4信号通路在几种植物谱系中的趋同缺失揭示了植物免疫和干旱反应的共同进化成分。《植物细胞》2020。
游健,宗伟,李旭,宁军,胡华,李旭,等。snac1靶向基因OsSRO1c通过调控水稻过氧化氢调控气孔关闭和氧化胁迫耐受。实验学报,2013;64(2):569-83。
Sweetman C, Waterman CD, Rainbird BM, Smith PMC, Jenkins CD, Day DA等。AtNDB2是线粒体中主要的外部NADH脱氢酶,对环境胁迫的耐受性很重要。植物生理学报,2019;31(2):774-88。
李建军,李建军,李建军,等。拟南芥线粒体复合体。植物学报,2017;39(6):1079-92。
拉夫拉姆B, Dillon MM, Martel A, Almeida RND, Desveaux D, Guttman DS。宿主-病原体相互作用的泛基因组效应触发免疫景观。科学。2020;367(6479):763 - 8。
罗朗J, Kidarsa T, Bradford CS, Gilbert B, Curtis M, Tzeng SC等。骗过守卫:利用植物防御疾病易感性。科学。2012;338(6107):659 - 62。
王红,王红,邵红,唐霞。利用转录因子转基因技术提高植物非生物逆境抗性的研究进展。植物学报,2016;7:67。
李春华,李春华,李春华,等。拟南芥抗黄瓜花叶病毒基因的克隆与表达。科学通报,2014;9(6):e99041。
Nafisi M, Goregaoker S, Botanga CJ, gllawischnig E, Olsen CE, Halkier BA等。拟南芥细胞色素P450单加氧酶71A13在camalexin合成中催化吲哚-3-乙酰氧肟的转化。植物学报。2007;19(6):2039-52。
Carviel JL, al - daoud F, Neumann M, Mohammad A, Provart NJ, Moeder W,等。正、反向遗传学鉴定拟南芥年龄相关抗性反应相关基因。植物学报,2009;10(5):621-34。
James D, Borphukan B, Fartyal D, Ram B, Singh J, Manna M,等。OsGS1;1和OsGS2基因在转基因水稻(Oryza sativa L.)中同时过表达:对非生物胁迫耐受性的影响植物科学,2018;9:786。
季勇,李强,刘刚,Selvaraj G,郑铮,邹军,等。胞质谷氨酰胺合成酶在拟南芥发育和胁迫反应中的作用。植物生理学报,2019;60(3):657-71。
毛国华,王晓明,王晓明,等。拟南芥细胞色素P450单加氧酶基因CYP709B3的克隆及其对盐胁迫的影响。植物生理学报,2013;13(1):691。
傅明,姜洪,孙胜,金世克,南KH。拟南芥RAV转录因子的一个子集独立于ABA调节干旱和盐胁迫反应。植物生理学报,2014;55(11):1892-904。
段彦斌,李军,秦瑞荣,徐汝荣,李宏,杨玉成,等。通过非原位和原位启动子分析鉴定水稻OsRAV2盐诱导的调控元件。植物化学学报,2016;39(1):449 - 462。
刘霞,吴东,单涛,徐生,秦锐,李华,等。三螺旋转录因子osggamma -2参与水稻对盐胁迫的适应。植物化学学报,2010;33(4):545 - 560。
孙玉刚,王波,金山,屈新,李彦军,侯伯康。拟南芥糖基转移酶UGT85A5异位表达增强烟草耐盐性。科学通报,2013;8(3):59924。
周荣,Jackson L, Shadle G, Nakashima J, Temple S,陈芳,等。不同的肉桂酰辅酶a还原酶参与平行路线的木质素在凤仙花。中国科学:自然科学版,2010;37(4):17803-8。
金J,田F,杨,孟YQ,香港L,罗J,等。PlantTFDB 4.0:迈向植物转录因子和调控相互作用的中心枢纽。核酸学报,2017;45(D1): D1040-D5。
Ebrahimian-Motlagh S, Ribone PA, Thirumalaikumar VP, Allu AD, Chan RL, Mueller-Roeber B,等。JUNGBRUNNEN1在HD-zip I转录因子AtHB13下游具有耐旱性。植物科学,2017;8:2118。
鲁德巴克拉里F,格鲁特EP。同源结构域亮氨酸拉链(HD-ZIP)家族蛋白在胚胎发生中的调控功能。植物化学学报,2017;13(1):95-104。
Perotti MF, Ribone PA, Cabello JV, Ariel FD, Chan RL。AtHB23参与控制根分枝的基因调控网络,揭示了次生和三级根之间的差异。植物学报,2019,31(6):1224 - 1236。
Boyes DC, Zayed AM, Ascenzi R, McCaskill AJ, Hoffman NE, Davis KR等。基于生长阶段的拟南芥表型分析:植物高通量功能基因组学模型。植物学报。2001;13(7):1499-510。
赵建军,张涛,孔泽克,等。谷物生长阶段的十进制编码。植物科学。1974;14(6):415-21。
Romani F, Moreno JE。植物转录因子功能宏观进化的分子机制。中国生物医学工程学报,2011;33(4):444 - 444。
陈玉英,赵玉春,曾涛涛,黄国强,罗永平,卢春霞。两个myb相关转录因子在拟南芥糖信号转导中的作用。植物化学学报,2017;39(3):391 - 391。
张建军,张建军,张建军,等。高温胁迫对植物生长的影响。物理植物。2020。
刘建军,李建军,李建军,等。非生物胁迫与生物胁迫组合研究。植物学报,2014;203(1):32-43。
李建军,李建军,李建军,等。植物叶绿体发育过程中光信号的相互作用。生物质化学工程学报,2014;39(3):397-406。
Medina-Puche L, Tan H, Dogra V, Wu M, Rosas-Diaz T, Wang L,等。一种连接质膜和叶绿体并被病原体吸收的防御途径。细胞。2020。
石原H, Moraes TA, Pyl ET, Schulze WX, Obata T, Scheffel A,等。拟南芥植株生长速率与蛋白质周转呈负相关。植物学报,2017;31(3):416 - 429。
Nelson CJ, Li L, Millar AH。植物蛋白质周转的定量分析。蛋白质组学,2014;14(4 - 5):579 - 92。
刘建军,刘建军,刘建军,等。氧化应激对拟南芥80S细胞质核糖体功能、丰度和周转的影响工厂J. 2020。
张松,李海燕。OsAP2和OsWRKY24在拟南芥中过表达导致植株大小减小。植物生物技术(东京)。35 2018;(3): 273 - 9。
张松,李汉英,郭明林。拟南芥FD和FD PARALOGUE基因在水稻中的异位表达导致颖花缩小和矮化。科学通报2017;7:44 - 44。
刘建军,刘建军,刘建军,等。植物叶绿体对蓝光的响应。Plant Cell rep 2020。
Das A, Christ B, Hortensteiner S.叶绿素分解过程中叶绿素氧化酶/叶绿磷脂途径的研究。足底。2018;248(4):875 - 92。
樱叶,金永英,白国荣。水稻光敏色素相互作用因子样1 (OsPIL1)在叶片衰老中的作用植物信号学报,2017;12(9):e1362522。
Davis JL, Armengaud P, Larson TR, Graham IA, White PJ, Newton AC,等。对比营养病关系:大麦叶片钾梯度对两种对茉莉酸不同敏感的真菌病原体有相反的影响。植物学报,2018;41(10):2357-72。
孟小霞,李莉,Narsai R, De Clercq I, Whelan J, Berkowitz O.线粒体信号转导对拟南芥抗洪适应性的影响。植物学报,2010;31(1):379 - 379。
赵军,mishoun TD, Bartels D. ATAF1转录因子是拟南芥醛脱氢酶7B4 (ALDH7B4)基因表达的关键调控因子。足底。2018;248(4):1017 - 27所示。
周敏,Paul AL, Ferl RJ。拟南芥T-DNA插入系SALK_084889的鉴定数据。数据简报。2017;13:253-8。
乔杜里FK, Rivero RM, Blumwald E, Mittler R.活性氧,非生物胁迫和胁迫组合。植物学报,2017;39(5):856-67。
Bray NL, Pimentel H, Melsted P, Pachter L.近最优概率rna序列定量。生物工程学报,2016;34(5):525-7。
ppimentel H, Bray NL, Puente S, Melsted P, Pachter L.考虑定量不确定度的RNA-seq差异分析。地理学报,2017;14(7):687。
MMseqs2使敏感蛋白序列搜索能够用于海量数据集的分析。生物工程学报,2017;35(11):1026-8。
科尔德·R,科尔德·先生。R Package20152015;1(7) 790。
致谢
我们要感谢Asha haaslem和拉筹伯大学基因组学平台对下一代测序的支持。
资金
A.H.获得了拉筹伯大学研究生研究奖学金和拉筹伯大学全额研究奖学金的支持。R.N.由澳大利亚研究理事会DECRA奖学金(DE160101536)支持。这项研究得到了澳大利亚研究委员会发现基金(DP210103258)的支持
作者信息
作者及单位
贡献
J.W.和O.B.构思了这个项目,A.H.进行了所有的应激处理和RNA分离,O.B.进行了NGS, A.H.和R.N.对数据进行了生物信息学分析和可视化,A.H.、J.W.和R.N.起草了手稿,所有作者对手稿进行了审查和批准。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
我们声明没有相互竞争的利益。
额外的信息
出版商的注意
伟德体育在线施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。
补充信息
附加文件1:补充图1a。
跨物种应激反应中上调基因的功能分类。补充图1b。跨物种应激反应中下调基因的功能分类。补充图2。拟南芥、水稻和大麦正群的差异表达基因。补充图3。拟南芥MDS候选基因的热图。补充图4。拟南芥、水稻和大麦对不同胁迫处理的转录因子编码基因表达补充图5。转录因子家族在跨物种逆境响应中的富集。补充图6。转录因子家族富集于反向响应的基因集(上调/下调)。
附加文件2:补充表1。
标记基因的基因表达验证应激处理。补充表2不同胁迫处理下所有差异表达基因的Log2 FC。补充表3所有物种差异表达基因的功能分类。补充表4。拟南芥、水稻和大麦的正类群推断及deg在这些植物中的表达响应。补充表5。跨物种的保守应激反应。补充表6。基因本体(GO)分析拟南芥基因在逆境下的差异表达。补充表7。拟南芥基因表达模式及其功能作用。补充表8MDM富集分析及MDS候选基因鉴定。补充表9。胁迫处理下拟南芥、水稻和大麦的反向应答基因。补充表10拟南芥、水稻和大麦转录因子列表。补充表11拟南芥、水稻和大麦对胁迫响应的转录因子家族富集分析。补充表12。转录因子家族在不同胁迫处理中的相反应答。补充表13。本研究使用的所有qRT-PCR引物列表。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/。创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
哈特曼,A,伯克维茨,O,惠兰,J。et al。跨物种转录组学分析揭示了拟南芥、水稻和大麦在氧化应激和激素处理后的共同和相反的反应。BMC Plant Biol22, 62(2022)。https://doi.org/10.1186/s12870-021-03406-7
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-021-03406-7
关键字
- 拟南芥
- 栽培稻
- 大麦芽
- 拟南芥
- 大米
- 大麦
- 压力
- 氧化
- 激素
- 转录组
- Orthology