摘要
背景
日本药品不良事件报告数据库(JADER)中未见调查儿科患者药品不良反应(ADR)报告特征及利用该数据库对这些患者进行药品安全监测的报道。
方法
我们的目的是评估JADER中儿科患者的ADR报告。我们使用了自2004年4月1日至2017年12月31日在JADER中包含的自发ADR报告,该报告于2018年4月下载。在共504,407份ADR报告中,自发报告数38.64万份(76.6%),其中未知年龄报告数37,534份(7.4%)。在提取了小于10岁和10 - 19岁儿童的27,800份ADR报告后,我们将与疫苗相关的ADR报告(n= 6355)及无怀疑药物报告(n= 86)。总共有21359个(4.2%)报告最终被纳入该分析。
结果
超过一半的不良反应报告是针对10岁以下儿童的。约30%的ADR报告中存在多种可疑药物,且不因年龄而异。< 10岁和10 - 19岁患者adr致死率分别为4.7和3.9%。最常报告的药物、反应和药物反应对是奥司他韦,异常行为,奥司他韦和异常行为,分别。
结论
我们使用JADER明确了日本儿童ADR报告的特点。ADR报告数据库,特别是针对儿科患者的ADR报告数据库,在日本和其他国家是很有价值的药物警戒工具。因此,正确理解JADER中ADR报告的特点是很重要的。此外,应持续和仔细监测儿科患者潜在的不良反应信号。
背景
药物不良反应自发报告系统对上市后药物安全监测至关重要[1].这种系统已被广泛用于许多药物安全性研究。由于国家汇编的数据,特别是儿科患者数据可能有限,全球儿科研究卓越网络(GRiP)网络旨在促进儿童药物的开发和安全使用,并对检查药物安全性很有价值[2].GRiP项目描述了在美国食品和药物管理局运营的自发报告数据库中报告的单个案例安全报告(icsr)的特征[1].尽管一般来说,自发ADR报告数据库存在一些局限性,如缺乏用户基数,但了解数据集的结构和范围以及此类数据库各自的优势和局限性对于正确使用和解释至关重要。了解数据库的特性是评估和开发药物警戒或药物安全新方法的第一步和重要步骤[1].对不良反应报告数据库的几项回顾性研究澄清了其特点和可用于其他国家(包括美国)儿童药物安全监测数据库的可用性。[3.)、瑞典(4],联合王国[5)、法国(6)、马来西亚(7)、西班牙(8]和尼日利亚[9].
日本监管当局在1961年制定法律后开始收集ADR报告。自法律颁布以来,从个别病例和来自行业的研究报告、来自医疗机构的直接自愿报告、来自治疗结果研究的研究结果和上市后临床试验积累了有关严重不良反应的信息。日本药品不良反应报告数据库(JADER)已编制了2004年以后的ADR报告,其中包括icsr的一些项目,如患者人口统计信息、药物信息、不良事件和原发疾病。自2012年起,任何人都可以从药品和医疗器械局(PMDA)的网站上免费下载该信息(https://www.info.pmda.go.jp/fukusayoudb/CsvDownload.jsp).该药物警戒数据库提供了adr的概貌,并建议使用定量信号检测方法的相对合理性。然而,目前尚无研究调查JADER作为儿科患者药物安全监测资源的特性和用途。因此,在本研究中,我们研究了JADER中儿童患者的ADR报告,旨在阐明JADER中儿童患者ADR报告的特点。
方法
我们使用了自2004年4月1日至2017年12月31日在JADER中包含的自发ADR报告,该报告于2018年4月下载。ADR报告在由PMDA在JADER中注册前,会对ADR报告是否严重进行检查和评估,JADER原则上由PMDA选择的严重ADR报告组成。一个ADR报告通常包括多个ADR,其中可能包括不严重的事件,如发热和皮疹。PMDA建议公司和医疗保健专业人员通过一个称为药品和医疗器械安全信息报告系统的系统报告ADR,即使药物使用和ADR之间的因果关系尚不清楚。在患者方面,患者和消费者可以直接向PMDA报告ADR的“ADR直接报告系统”从2012年开始试行,并于2019年3月26日开始全面运行。但是,JADER还没有包括来自该系统的报告。JADER由四个表组成:(1)患者人口统计信息(2)药物信息(3)不良事件和(4)原发病。我们从公司和医疗机构中提取了自发的报告。在《人用药品注册技术要求国际协调会议指南E2B》中,自发报告定义为来自非请求来源的ADR报告,包括来自医疗机构或公司的直接报告,来自摘要、文献、互联网等的ADR报告。由于疫苗不良反应的报告系统不同,疫苗报告被排除在外。 The adverse reaction and primary disease fields in the JADER are described by using the Medical Dictionary for Regulatory Activities/Japanese version (MedDRA®/J) and were coded as preferred terms (PTs). We used MedDRA®/J Version 21.0 in the present study. The information included patient details (age and sex), type of report sender, reporters, suspected drugs, outcomes from ADR reports, and ADRs coded according to PTs. Age, sex, type of report sender (company or healthcare facility), reporters (doctor, pharmacist, healthcare professional, consumer, or lawyer), number of suspected drugs per ADR report, outcomes from ADR reports (cured, recovering, did not recover, recovering with sequelae, death, or unexplained) were collected. As for suspected drugs, we collected both International Nonproprietary Name (INN) and brand name and used INN to treat drugs with the same ingredients as the same drugs for analysis. Since the JADER only included age information as a categorical variable, we extracted ADR reports for children aged < 10 and 10–19 years. The 10 most frequently reported drugs, reactions, and drug-reaction pairs were determined according to age (< 10 years and 10–19 years). Time trends for the number of reports and the frequently reported drug, reaction, and drug-reaction pair were also determined. Adverse events were considered serious when they resulted in death, were life threatening, required hospitalization or prolongation of existing hospitalization, resulted in persistent or significant disability or incapacity, were congenital abnormalities or birth defects or were any other medically significant events.
结果
JADER中报告的特征
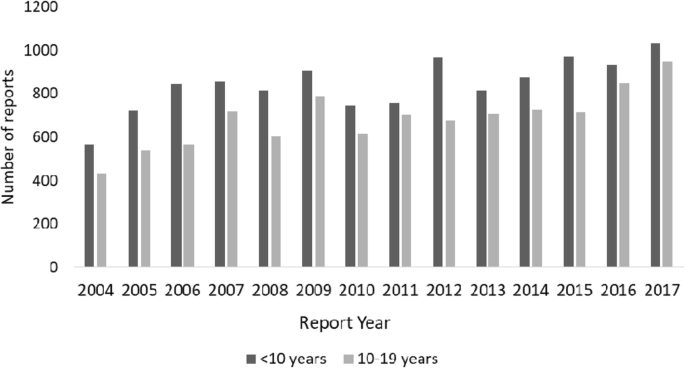
从2004年4月到2017年12月,共有504,407份ADR报告在2018年4月从JADER下载。其中自发报告数38.64万例(76.6%),未知年龄报告数37534例(7.4%)。在提取了小于10岁和10 - 19岁儿童的27,800份ADR报告后,我们将与疫苗相关的ADR报告(n= 6355)及无怀疑药物报告(n= 86)。总共有21359个(4.2%)报告最终被纳入该分析。超过一半的不良反应报告与10岁以下儿童有关(表1).ADR通报中,< 10岁患者性别分布为男53.5%,女40.5%;10 - 19岁患者性别分布为男51.3%,女46.5%。无论年龄大小,JADER中的大多数报告都是由公司发送的,70%是由医生发送的。数字1ADR报告数量呈稳步上升趋势。约30%的ADR报告中存在多种可疑药物,且不因年龄而异1).对于< 10岁的患者,总共有11786例ADR报告,其中552例(4.7%)为致命ADR报告,结果为死亡。10-19岁患者共发生9573例ADR报告,其中369例(3.9%)为致死性ADR报告,以死亡为结局。当ADR报告中存在多种可疑药物时,致死性ADR报告的比例较高1).
与ADR报告相关的结果
对于年龄小于10岁的患者,在11786份报告中,共报告了18309份adr。患者治愈、恢复、后遗症恢复的比例为43.1% (n= 7898)、23.4% (n= 4288)及1.8% (n分别为= 338);5.4% (n= 993例)的患者没有康复。致命结果的百分比为4.4% (n= 803)。对于10-19岁的患者,在9573份报告中,共报告了15419份adr。患者治愈、恢复、后遗症恢复的比例为44.1% (n= 6805), 22.6% (n= 3492), 1.1% (n分别为= 162);4.4% (n= 684)的患者没有康复。致命结果的百分比为3.3% (n= 512)。
经常报道的药物
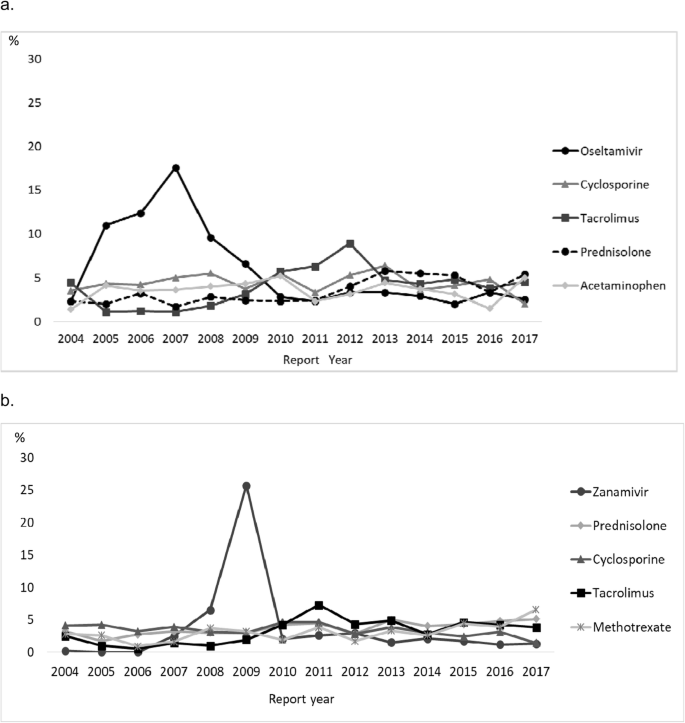
< 10岁和10 - 19岁患者ADR报告中最常见的药物分别为奥司他韦(2.8%)和扎那米韦(2.7%)。有许多与他克莫司、环孢素和泼尼松龙等免疫抑制剂相关的不良反应报告,这些不良反应没有因年龄而异。(表2).2004 - 2008年奥司他韦不良反应报告较多,尤其是2007年10岁以下患者的不良反应报告较多。2009年,10-19岁患者使用扎那米韦的不良反应报告较多。2).< 10岁和10 - 19岁患者致死性ADR报告分别为552和369种,报告药物1128和764种,报告最多的药物分别为依托泊苷(3.6%)和他克莫司(5.1%)。
经常报道的反应
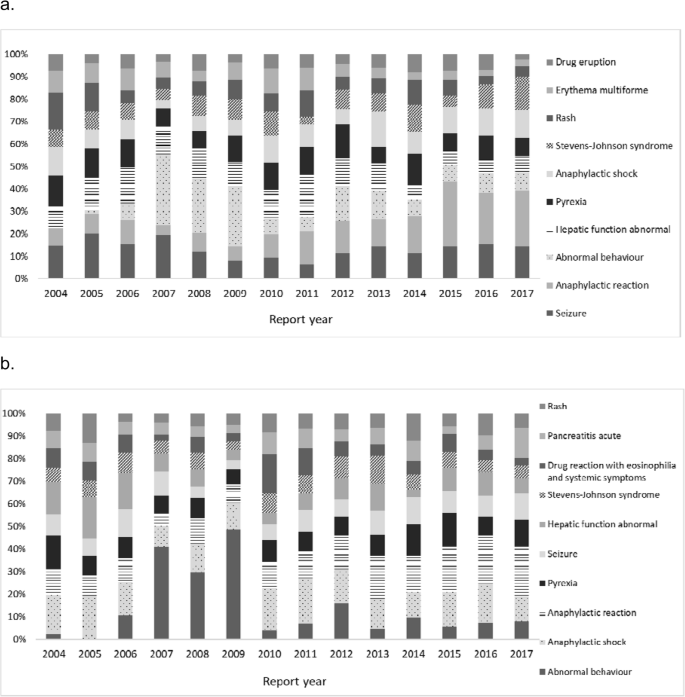
对于< 10岁和10 - 19岁的患者,最常报告的反应分别是癫痫发作(2.2%)和异常行为(2.8%)3.).从2007年到2009年,频繁报告的反应的时间趋势是异常行为,而且没有年龄差异(图1)。3.).在< 10岁和10 - 19岁的致死性ADR报告中,552和369种报告的1095和768种药物中,最常见的反应分别为“死亡”(3.0%)和败血症(3.4%)。
频繁报道的药物反应对
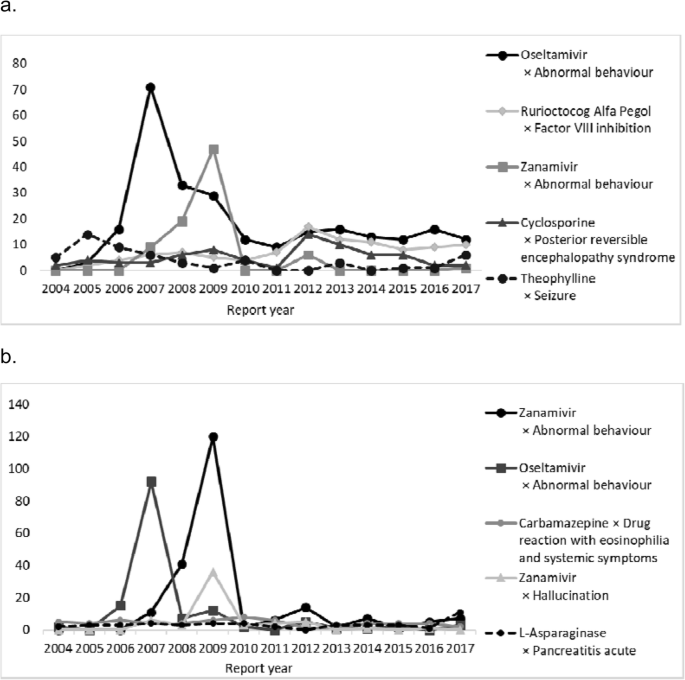
在< 10岁和10 - 19岁的患者中,最常见的药物反应对分别是“奥司他韦和行为异常”(0.8%)和“扎那米韦和行为异常”(0.8%)4).频繁报告的药物反应对的时间趋势是2007年的“奥司他韦和异常行为”和2009年的“扎那米韦和异常行为”,没有年龄差异(图。4).在< 10岁和10 - 19岁患者的552和369例致死性ADR报告中,2363和1852对报告的药物反应对中,最常见的药物反应对分别是“依泊苷和急性呼吸窘迫综合征”(0.3%)和“硼替佐米和中性粒细胞减少症”(0.4%)。
讨论
在本研究中,来自非公司,特别是药剂师的ADR报告数量较低。虽然大多数日本医院药师充分了解ADR自发上报制度,但在上报ADR时也存在一定的障碍,如上报什么样的ADR [10].此外,与医疗保健机构不同的是,公司被严格要求在报告截止日期内报告所有adr。因此,与医疗保健机构相比,来自该公司的ADR报告数量可能相对较高。
在日本,在研究期间,3.3% - 4.4%的儿科ADR报告与致命病例有关,高于其他国家的相应比例(英国0.37%,马来西亚0.24%,西班牙0.49%)[7,8,11].致死病例比例较高的一个原因是,JADER是一个自发的ADR数据库,原则上包括PMDA选择的严重ADR报告,其他国家的数据库包括非严重ADR。因此,致命病例的百分比可能反映了不同国家在药物使用和对报告的态度方面的差异[12].
致命的ADR报告是指结果被描述为死亡的病例,由于其重要性和难以理解,往往被更积极地报告。我们的研究发现,当ADR报告中含有多种可疑药物时,致命ADR报告的比例更高。虽然多重用药可能反映一种需要使用多种药物的严重疾病,但先前对报告的不良反应严重性的评估发现,与单一药物使用相比,多重药物接触可能更经常导致严重的不良反应报告[13].另一项研究发现,同时使用4种以上药物与ADR发生呈正相关[14].多药房制增加了药物相互作用的机会和发生不良反应的可能性[15,16].由于我们的发现是建立在对自发报告的检查基础上的,所以我们只是观察了报告倾向。然而,考虑到之前的发现和我们自己的发现,我们可能会特别关注被开出两种或两种以上药物的儿童的不良反应,以最大限度地降低严重不良反应的风险。
本研究显示,有许多与免疫抑制剂相关的不良反应报告。因为JADER是一个包含严重ADR报告的数据库,它可能包含大量关于可能导致严重ADR的药物的信息。至于表中报告频率最高的药物2在美国,关于奥司他韦的不良反应报告数量可能会因《亲爱的医疗保健专业信件》而增加。清单中的所有药品、关于药品包装说明书预防措施修订的安全信息已在厚生劳动省出版的《药品和医疗器械安全信息》或日本药品制造商协会联合会出版的《药品安全更新》中提供。这一信息可能增加了ADR报告的数量。因此,药物清单在表中2似乎与吸毒无关。
在以往的报告中,ADR报告的特征因儿童患者年龄的不同而有很大差异[7].严重不良事件的潜在风险随着年龄的变化而变化,根据儿童是否能抱怨副作用,不同儿童患者年龄的不良反应的变异性也不同。换句话说,年龄小的孩子比年龄大的孩子更常报告客观反应,而年龄大的孩子比年龄小的孩子更常报告主观反应。因此,年龄信息在讨论adr时至关重要,特别是在儿科患者中。但本研究无法获得与年龄相关的连续变量信息,将其作为分类变量,如“< 10岁”和“10 - 19岁”,是与JADER相关的最弱属性。本研究主要报道客观反应。因此,儿科ADR报告需要考虑更详细的年龄分类。在最初的ADR报告中,年龄信息应该作为连续变量报告;但是,出于隐私考虑,JADER只将年龄信息作为分类变量。为了增加JADER的可用性和价值,年龄信息作为一个连续变量应该公开,特别是在儿科ADR报告中。
2007年报告了许多与奥司他韦有关的异常行为,2009年报告了许多与扎那米韦有关的异常行为。与奥司他韦相关的异常行为引起了关注,2007年11月27日,日本监管机构发布了关于与奥司他韦相关的异常行为的《亲爱的医疗保健专业信件》。此外,2008-2009年出现对奥司他韦具有耐药性的病毒后,与奥司他韦类似的扎那米韦的使用有所增加。在早期上市后阶段警戒(EPPV)中,一种独特的上市后监测系统于2001年10月在日本启动,医疗代表在上市的前6个月定期访问医疗机构收集不良反应,因此有人认为EPPV期间与报告的不良反应数量之间存在正相关关系[17,18].然而,EPPV对2007年与奥司他韦相关的异常行为的ADR报告数量的增加没有积极影响,因为2002年在日本对奥司他韦进行了EPPV。“奥司他韦与异常行为”和“扎那米韦与异常行为”的不良反应报告被认为在这些信件发表后就变得频繁,尽管奥司他韦与异常行为之间的因果关系尚未明确。然而,由于“抗流感病毒药物和异常行为”的报告比例并不高(10岁以下为1.1%,10 - 19岁儿童为1.4%),这些对可能不会影响其他信号的检测。在西班牙,在监管机构发布了关于使用抗抑郁药物和治疗注意缺陷障碍和多动与儿童患者心脑血管疾病风险相关的警告后,使用抗抑郁药物和治疗注意缺陷障碍和多动后心脑血管疾病的不良反应报告数量增加[8].与对乙酰氨基酚相关的中毒性表皮坏死松解症(TEN)和Stevens-Johnson综合征(SJS)的报道数量也非常高。这一结果可能有以下原因:对乙酰氨基酚常用于儿童,对乙酰氨基酚的开始治疗发生在发热或耳、鼻、喉疼痛的反应中,这些症状通常可能是SJS/TEN的前驱症状,以及支原体感染或病毒感染(如流感)等传染性疾病的前驱症状[19,20.,21].
与成人相比,基于儿童自发报告的药品不良反应监测是一项重要的安全监测活动,因为评估儿童药物安全性的基础很少。然而,实际的因果关系需要继续单独验证,即使已经观察到许多自发的报告和监管部门发出警告。应该认识到,日本的一个自发报告数据库JADER也包括这种因果关系不明确的报告。
目前的研究有几个局限性。首先,JADER是一个被动的系统,具有多种局限性,如报告时间关联、未确诊的诊断、缺乏用户的基数和无偏见的比较摸索[22].由于这些限制,通常不可能从JADER报告中建立药物和不良反应之间的因果关系。其次,由于JADER只将年龄信息作为分类变量,如< 10岁和10 - 19岁儿童,因此无法根据WHO年龄分组分类(如5-17岁儿童)来分析情况。野村等人已经比较了FAERS和JADER之间的日本ADR报告[23].尽管FAERS包括了全球制药公司收到的非美国数据,并且可以选择具有详细年龄信息的日本报告,但他们澄清了FAERS和JADER具有不同的属性。因此,在我们的研究中,我们使用JADER明确了日本儿童ADR报告的特点。第三,在JADER中,没有披露自发ADR报告来源的详细信息。因此,仍然存在重复报告的可能性,即一个病例可能被报告多次。不能完全排除这种可能性,因为对于同一情况没有标识符。从分析中识别和消除重复对数据的正确解释是有利和重要的。在未来的研究中,我们将基于本研究中阐明的JADER的特性来评估JADER的信号检测能力。
结论
我们使用JADER明确了日本儿童ADR报告的特点。ADR报告数据库,特别是针对儿科患者的ADR报告数据库,在日本和其他国家是很有价值的药物警戒工具。因此,正确认识JADER中ADR报告的特点是很重要的,同时还需要改进年龄、报告重复等局限性。此外,应持续和仔细监测儿科患者潜在的不良反应信号。
数据和材料的可用性
本研究中使用和/或分析的数据集可根据合理要求从通讯作者处获得。
缩写
- 美国存托凭证:
-
药物不良反应
- 玉:
-
日本不良药物事件报告数据库
- 控制:
-
全球儿科研究卓越网络
- ICSRs:
-
个案安全报告
- PMDA:
-
医药和医疗器械局
- EPPV:
-
早期后营销阶段的警惕
- 十:
-
中毒性表皮坏死松解症
- sj:
-
史蒂文斯—约翰逊综合征
参考文献
de Bie S, Ferrajolo C, Straus SM, Verhamme KM, Bonhoeffer J, Wong IC, Sturkenboom MC;控制网络。FDA-AERS儿童药物安全监测:GRiP项目不良事件描述。科学通报,2015;10(6)e0130399。
心脏的。全球儿科研究。[引自2019年11月22日]。可以从:https://cordis.europa.eu/project/rcn/97619/factsheet/en.
Brewer T, Colditz GA。上市后监测和药物不良反应:目前的观点和未来的需要。《美国医学协会杂志》上。1999; 281:824829。
Kimland E, Rane A, Ufer M, Panagiotidis G. 1987 - 2001年瑞典儿科药物不良反应报告。药物流行病学杂志2005;14(7):493-9。
DB Hawcutt, Russell NJ, Maqsood H, Kouranloo K, Gomberg S, Waitt C, Sharp A, Riordan A, Turner MA。英国2001-2010年新生儿和婴儿自发药物不良反应报告:内容和效用分析。中华临床药学杂志。2016;82(6):1601-12。
Kaguelidou F, beaui - salinas F, Jonville-Bera AP, Jacqz-Aigrain E.新生儿药物不良反应:法国药物警戒数据库报告的分析。中华临床药学杂志。2016;82(4):1058-68。
Rosli R, Ming LC, Abd Aziz N, Manan MM.与儿科患者相关的自发药物不良反应报告的回顾性分析。《公共科学图书馆•综合》。2016;11 (6):e0155385。
Aldea A, García Sánchez-Colomer M, Fernández Quintana E, Fernández Quintana E, García SM。2004年至2009年向西班牙药物警戒系统报告的儿科药物不良反应。中华临床医学杂志,2012;68(9):1329-38。
Obebi Cliff-Eribo K, Sammons H, Star K, Ralph Edwards I, Osakwe A, Choonara I.尼日利亚儿童的药物不良反应:对2005年至2012年提交给尼日利亚药物警戒中心的报告的回顾性回顾。儿科和儿童健康。2016;36(4):300-4。
Kobayashi T, Noda A, Obara T, Tsuchiya M,赤坂K, Yoshida M, Matsuura M, Sato M, Murai Y, Yamaguchi H, Tsuchiya F, Kihira K, Mano N.日本医院药师对药物警戒和不良反应报告的知识、态度和实践。Hosp制药。(印刷中)。
英国致命的可疑药物不良反应的监测。《儿童科学》2002;87(6):462-6。
Cliff-Eribo KO, Sammons H, Choonara I.药物警戒数据库中有关药物不良反应的儿科研究的系统综述。2016;15(10): 1321-8。
李红,郭新军,叶晓峰,姜红,杜伟明,徐建峰,张新军,何杰。上海儿童人群自发报告的药物不良反应。《公共科学图书馆•综合》。2014;9 (2):e89829。
Zopf Y, Rabe C, Neubert A, Hahn EG。入院后药物不良反应相关的危险因素:对两所德国大学医院907例患者的前瞻性分析药物Saf 2008; 31(9): 789 - 798。
Rashed AN, Wong IC, Cranswick N, Tomlin S, Rascher W, Neubert A.住院儿童药物不良反应相关的危险因素:国际多中心研究。临床临床杂志,2012;68(5):801-10。
德国非收容机构儿童和青少年的药物不良反应。中华临床药学杂志。2010;70(3):409-17。
Yamada T, Watanabe Y, Kusama M, Sugiyama Y, Ono S.日本药物不良反应自发报告的相关因素。药物流行病学杂志2013;22(5):468-76。
Matsuda S, Aoki K, Kawamata T, Kimotsuki T, Kobayashi T, Kuriki H, Nakayama T, Okugawa S, Sugimura Y, Tomita M, Takahashi Y.日本药物不良反应自发报告的偏倚。《公共科学图书馆•综合》。2015;10 (5):e0126413。
勒本-维涅斯B,盖伊C,让-帕斯特MJ,格拉斯-尚佩尔V.泽纳特M;法国药物警戒区域中心网络和法国药物不良皮肤反应调查人员。中国临床药学杂志。2018;84(2):331-8。
Abe J, Umetsu R, Mataki K, Kato Y, Ueda N, Nakayama Y, Hane Y, Matsui T, Hatahira H, Sasaoka S, Motooka Y, Hara H, Kato Z, Kinosada Y, Inagaki N, Nakamura M.利用日本药物不良事件报告数据库分析史蒂文斯-约翰逊综合征和中毒性表皮坏死松解症。医药卫生科学,2016;2:14。
Ban GY, Ahn SJ, Yoo hhs, Park hhs, Ye YM。与病毒性感染期间使用对乙酰氨基酚相关的Stevens-Johnson综合征和中毒性表皮坏死松解症。免疫Netw。2016;16(4):256 - 60。
周伟,Pool V, Iskander JK, English-Bullard R, Ball R, Wise RP, Haber P, Pless RP, Mootrey G, Ellenberg SS, Braun MM, Chen RT.免疫后安全性监测:疫苗不良事件报告系统(VAERS)-美国,1991-2001。mwr监测综述2003;52(1):1 - 24。
野村K,高桥K,日村Y,川口G,松下Y, Marui H, Anzai T, Hashiguchi M, Mochizuki M.数据库概况变化对药物安全性评价的影响:日本病例的自发不良事件报告分析。2015; 9:3031-41。
确认
作者要感谢Rie Suenaga的技术帮助。
资金
该研究的设计得到了日本厚生劳动省(H24-iyakuwakate-011)的拨款支持。数据的解释、分析和撰写手稿得到了来自日本医学研究与发展机构、AMED (17mk0101095h0001, 18mk0101095h0002)和日本科学促进协会(JSPS) (19 K07213)的药品、医疗设备、再生和细胞治疗产品、基因治疗产品和化妆品监管协调与评估研究的资助。
作者信息
作者和联系
贡献
所有作者都对这项科学工作做出了贡献,并批准了手稿的最终版本。AN和TS设计了本研究,进行了数据分析,并撰写了手稿。TO深入参与了研究的设计并监督了数据分析。MM, MT, GO, YM和NM协助数据分析和监督手稿的起草。所有作者都对数据的完整性和数据分析的准确性负责。
相应的作者
道德声明
伦理批准和同意参与
该研究获得了东北大学医学院机构审查委员会(2017-1-506)的伦理批准。访问我们在研究中使用的数据不需要行政许可或许可证,因为这些数据可以从PMDA网站上免费下载。由于本研究的回顾性性质,不需要同意参与。
同意出版
不适用。
相互竞争的利益
Makoto Miyazaki是Merck Sharp & Dohme公司的员工,该公司是美国新泽西州Kenilworth的Merck & Co.公司的子公司。Makoto Miyazaki是日本东北大学的一名研究生,他独立于美国新泽西州凯尼尔沃思市默克公司的子公司默克夏普公司对目前的研究做出了贡献。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
野田佳彦,酒井法子,大坂,大坂。et al。日本药品不良事件报告数据库中儿童药品不良反应报告的特点。BMC杂志Toxicol2136(2020)。https://doi.org/10.1186/s40360-020-00412-7
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s40360-020-00412-7
关键字
- 药物不良反应
- 儿科患者
- 孩子们
- 的玉
- 自发报告
- 药品安全
- 药物警戒
- 信号检测