摘要
背景
一些报告表明,消化系统的微生物组会影响疫苗的效力,而冠状病毒疾病(COVID-19)的严重程度与口腔和/或肠道微生物组的多样性下降有关。本研究检测了严重急性呼吸综合征冠状病毒2 (SARS-CoV-2) mRNA疫苗对口腔微生物组的影响。
方法
招募了40名健康的日本口腔保健人员,在接种疫苗前、第一次接种疫苗后和第二次接种疫苗后收集未刺激的唾液。从唾液样本中提取基因组DNA,利用下一代测序分析16S rRNA基因的PCR扩增物。微生物多样性和组成分析使用定量洞察微生物生态学2。此外,使用PICRUSt2评估微生物功能的改变。
结果
接种sars - cov - 2mrna后,口腔细菌多样性显著增加,属比例显著降低拟杆菌.
结论
SARS-CoV-2 mRNA疫苗可以改变口腔微生物群;因此,接种疫苗可能对口腔健康有益。
背景
口腔是严重急性呼吸综合征冠状病毒2型(SARS-CoV-2)感染的最重要途径之一,2019冠状病毒病(COVID-19)患者的唾液中高浓度存在该病毒[1].一些报告表明,COVID-19患者表现出口腔微生物群失调[2,3.,4].此外,口腔微生物群α多样性的降低与COVID-19的严重程度相关,口腔生态失调与炎症细胞因子水平升高和IgA反应降低有关[5].然而,这些横断面研究并没有解释口腔微生物群失调是否是COVID-19的原因或结果。
疫苗接种是抗击COVID-19的一项重要战略,在世界范围内的应用正在增加。虽然接种疫苗的人的口腔和肠道微生物群有可能发生改变,但这些微生物群尚未进行分析[6].微生物群的改变可能为了解接种者的健康状况提供一些有益的信息。然而,也有人推测,口腔微生物群的变化除了可能改变对COVID-19的易感性外,还可能直接影响口腔健康状况[2,3.,4].因此,应尽可能排除可能影响口腔微生物组组成的潜在环境因素,对口腔微生物组进行调查。在这项研究中,我们收集了牙科专业人员的唾液,确认了他们的口腔健康状况和全身健康状况,并观察到COVID-19疫苗接种后他们口腔微生物群的变化。
方法
数据收集
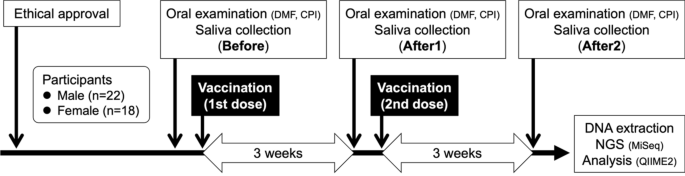
北海道健康科学大学预防医学科学研究所伦理委员会批准了这项研究的伦理(批准号:no. 2)。2021 - 001)。实验中使用的方法是按照《赫尔辛基宣言》进行的。我们招募了40名北海道健康科学大学的教职员工,他们计划接受comirnty®(Pfizer, NY, USA;BioNTech SE,美因茨,德国)。所有受试者均同意参与本研究,并提供书面知情同意书。正在接受牙科治疗或有全身疾病或吸烟习惯的人被排除在研究之外。所有人都没有感染COVID-19。在参与者中,有22名男性(平均±SD年;38.4±12.3)例,女性18例(32.2±7.7)。 The number of participants in each age group was as follows: 20–29 years (n = 15); 30–39 years (n = 16); and over 40 years (n = 9). The decayed, missing, and filled teeth (DMFT) index was used to assess tooth condition according to the WHO-recommended criteria. According to the DMFT index, carious teeth received the letter D, missing teeth received the letter M, and filled or processed teeth that had not rotted received the letter F. DMFT was examined for 28 teeth, excluding the third molars. Periodontal examinations were performed using the WHO criteria [7].使用社区牙周指数(CPI)记录参与者的牙周状况。分别对索引牙(11、16、17、26、27、31、36、37、46、47)进行检查。CPI评分为0分,牙周组织健康;1、探头有出血现象;2、存在微积分;3、口袋4-5毫米;4、口袋≥6mm。
样品收集
分别于接种前(接种前)、第一次接种后3周(接种后1)、第二次接种后3周(接种后2)在锥形管中采集唾液样本。这些样本是在参与者醒来后从他们家中采集的。在样本采集前,参与者被要求避免漱口、饮食和刷牙(图2)。1)。
DNA提取和测序
根据制造商的说明,使用DNeasy血液和组织试剂盒(Qiagen, Hilden, Germany)从唾液样本中提取基因组DNA。扩增体PCR检测细菌16S核糖体RNA (rRNA)基因的V3-V4区[8,9].V3-V4区测序文库根据16S宏基因组测序文库制备说明书(Illumina, San Diego, CA, USA)生成。简而言之,扩增子PCR使用KAPA HiFi HS ReadyMix (Nippon Genetics, Tokyo, Japan)和V3-V4区域引物(正向,5 ' - tcgtcggcagcgtcagatgtgtataagagagacaggctcggagatgtgtataagagacaggactachvgggtatctaatcc -3 '),指数PCR使用KAPA HiFi HS ReadyMix和Nextera XT指数试剂盒(Illumina)。将文库稀释,与PhiX (Illumina)混合,然后使用Illumina MiSeq系统和MiSeq试剂盒v3进行测序(600循环,Illumina)。测序深度测定为14000 reads from alpha rare。
测序数据分析
使用Quantitative Insights into Microbial Ecology 2 (QIIME2 v2020.2)软件包对分配到16S rDNA数据库(Greengenes v13.8)的16S rRNA基因序列进行宏基因组测序数据分析[8,9].扩增子序列数据分析采用DADA2管道。利用观察到的OTUs、Faith的系统发育多样性(PD)和Shannon指数估算Alpha多样性。p < 0.05为差异有统计学意义。Beta多样性基于UniFrac距离进行评估,该距离表示组间共享的系统发育树分支长度的百分比。使用三维主坐标分析(PCoA)生成UniFrac散点图,以直观地比较各组的微生物组成。使用未加权和加权UniFrac距离度量法分析前、后1、后2组细菌群落的差异。采用Permutational multivariate analysis of variance (PERMANOVA),结合未加权和加权UniFrac距离矩阵,确定不同组间微生物群落有显著性差异。p < 0.05为差异有统计学意义。所有结果均以未经校正的p值表示。 Significant differences in microbial taxon abundance among the Before, After1, and After2 groups were analyzed using the analysis of composition of microbiomes (ANCOM) in QIIME2. The final significance was expressed as the empirical distribution of W. Feature volatility analysis was performed to determine the linear mixed-effects (LME) model results for bacterial taxonomy. Several bacterial taxa were selected for subsequent analysis, depending on their importance, which were analyzed using the LME model to detect important bacterial taxonomies [10].利用重构未观察状态(PICRUSt2)软件进行群落系统发育研究,仅基于标记基因序列预测功能丰度。采用metagenomic profiles (STAMP)软件包统计分析PICRUSt2结果。两组比较采用Welch's t检验,置信区间计算采用Welch's倒置信区间法。采用Benjamini-Hochberg错误发现率法计算调整后的p值(p < 0.05)。
结果
口试(DMFT指数和CPI)
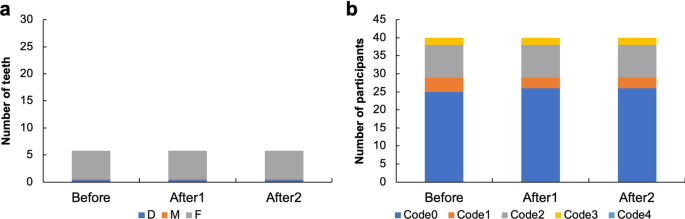
平均DMFT值为D(平均±SD牙;M(0.2±0.5),F(5.2±4.0)。接种疫苗前后,所有参与者的平均DMFT指数均未发生变化。2)。为了了解牙周病的实际情况,采用CPI。疫苗接种前后的CPI比较显示,CPI变化不大,编码4的参与者数量没有变化(图2)。2)。
物种丰富度和多样性(alpha多样性)
所有120个样本都使用MiSeq进行测序,从Before、After1和After2组扩增出的序列总数为7,073,846条,每个样本最少14,347条,最多175,709条,平均每个样本52150条。本研究生成和分析的序列数据存入日本DNA数据库(DDBJ),登录号为PRJDB12809。数据总结如下:PSUD ID;PSUB 016463;和PRJDB12809。
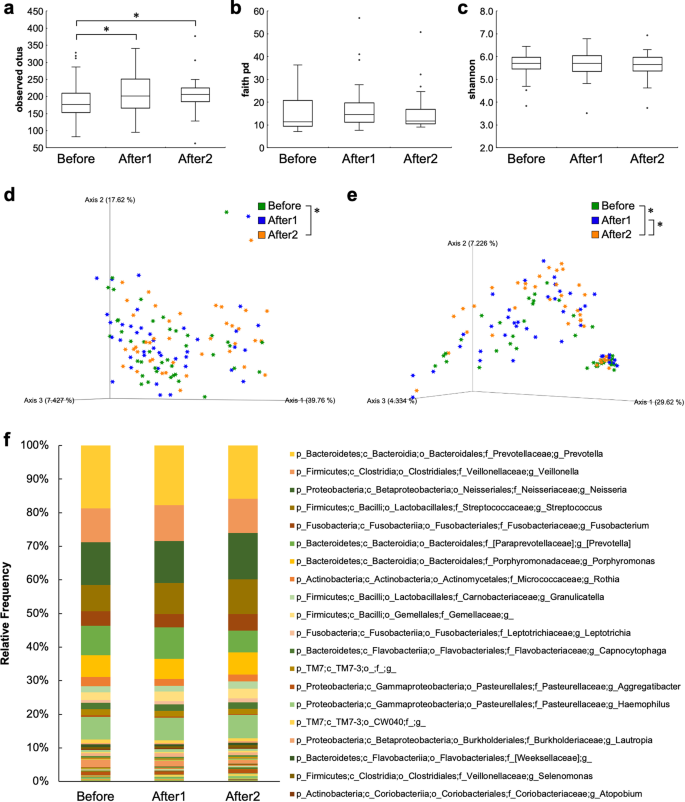
为了评估每个参与者在本地尺度内不同地点或栖息地的物种平均多样性,我们分析了alpha多样性。观察到的OTUs在After1组和After2组明显高于Before组(p = 0.040和p = 0.007;无花果。3.a).在Before、After1和After2组之间,信仰的PD和Shannon指数没有显著差异(图2)。3.b, c)。
加权UniFrac和非加权UniFrac的PCoA (beta多样性)
为了评估Before、After1、After2组间的多样性差异,进行UniFrac距离PCoA。PCoA图显示各组间聚类。基于PERMANOVA的加权UniFrac距离度量在术前和术后2组之间有显著差异(p = 0.020;无花果。3.d).基于PERMANOVA的未加权UniFrac距离度量在Before和After2组之间以及After1和After2组之间存在显著差异(p = 0.032;无花果。3.e)。
口腔唾液细菌分类学
QIIME2在Before、After1和After2组中共检测到142种不同的细菌属。所有样品中数量最多的属为普氏菌,然后是奈瑟氏菌属,韦永氏球菌属,链球菌(无花果。3.f).在属水平上,ANCOM检验揭示拟杆菌在Before、After1和After2组中均为差异丰度属(W = 138);属在后1组和后2组中所占比例低于前组(表2)1)。特征波动率和LME分析进行了高度重要的细菌属确定的波动率图。4个细菌属在加药前、加药后1、加药后2组间差异显著(p < 0.05)。接种疫苗增加了该属的丰度Lachnoanaerobaculum,Moryella,Parvimonas,消化链球菌属(表2)。
微生物功能的改变
与Before组相比,After2组共有60条MetaCyc通路发生了显著改变。接种COVID-19疫苗后,28条MetaCyc通路,包括糖原合成- pwy和pxy -6470,增加,而32条通路,包括PANTO-PWY和pxy -5659减少(图)。4)。此外,与Before样本相比,分析确定了After2样本中路径数量最多。
讨论
在这项研究中,我们使用下一代测序(NGS)对COVID-19疫苗接种前后的唾液微生物组进行了全面分析。此外,我们还研究了DMFT指数和CPI。我们发现,在处理前、处理后1和处理后2组之间,植物群的α多样性(观察到的OTUs)和β多样性存在显著差异。与我们的研究一致,其他几项研究通过使用NGS进行综合分析,证明了口腔和肠道微生物群落多样性的改变[11,12].例如,在患有牙周病和龋齿的患者中,发现口腔微生物群的多样性增加[13],而在有吸烟习惯和口腔癌的患者中,基因多样性则有所下降[14,15].在病理和非有益条件下,包括宿主衰老、饮食变化和心理压力,肠道菌群多样性已被发现减少[12].肥胖、高能量饮食和衰老与肠道微生物多样性下降最为相关[16,17].此外,肥胖患者的口腔和肠道菌群多样性明显减少[18].口腔菌群多样性主要受牙周病和龋齿状况等局部因素的影响。在这项研究中,在检查牙周和龋齿状况后,从妥善管理自己口腔状况的牙科专业人员那里收集唾液样本。分析显示,龋齿细菌的比例没有显著增加,如链球菌和牙周细菌,如Porphyromonas临床指标,包括DMFT指数和CPI,在实验期间无明显差异。这些结果表明,COVID-19疫苗接种不会影响口腔致病菌、龋齿或牙周病的发生或发展。
在我们的研究中,影响口腔微生物群多样性的局部因素是最小的。因此,我们研究中口腔菌群多样性的增加可能不会受到局部因素的太大影响。之前的一项研究表明,现代人群的口腔微生物群多样性明显低于历史人群,这表明低多样性可能会导致后工业化生活方式下的慢性口腔疾病[19].因此,可以推断,接种疫苗后口腔微生物群多样性的增加有利于口腔健康。
ANCOM显示该属植物的丰度拟杆菌接种后显著低于接种前。拟杆菌属口腔及肠道的正常菌群[20.].虽然属的成员拟杆菌对于特定的口腔疾病并不具有致病性,它们可以引起机会性感染。多项研究表明,其含量与COVID-19的严重程度之间存在关系。SARS-CoV-2利用血管紧张素转换酶2 (ACE2)受体进入宿主,ACE2受体在口腔和鼻腔黏膜、肺、心脏和胃肠道等多种身体器官中高度表达。21,22].在小鼠中,ACE2在肠道中的表达被抑制拟杆菌spp。23].COVID-19患者的粪便微生物群发生了改变,而粪便拟杆菌sp .含量与COVID-19严重程度呈负相关[24].这些研究表明如果口服拟杆菌同时抑制ACE2的表达,降低拟杆菌在COVID-19疫苗接种后,口腔微生物组中的sp .可能是ACE2表达增加的危险因素。相比之下,属的丰富拟杆菌也与缺乏内毒素耐受性和自身免疫活性增加有关[25],表明该属的丰度下降拟杆菌可能会改善炎症反应。因此,需要进一步的研究来阐明该属丰度的影响拟杆菌口腔微生物组对COVID-19易感性的影响。
我们进行了特征波动性和LME分析,以确定相对丰度是否受到COVID-19疫苗接种的影响。尽管我们发现了四个属,包括乳酸菌,莫氏菌,细小单胞菌和消化性链球菌,这些属的估计值较小(0.000)。这些属属于厚壁菌门,可能参与口腔病变的糖代谢,尽管参与可能不密切。
我们确定了60条通路丰度的变化,包括在2组之前和2组之后几种碳水化合物代谢相关通路的富集。最近的一项研究显示,在对从COVID-19疫苗(包括CoronaVac和BNT162b2疫苗)疫苗收集的粪便样本进行宏基因组分析时,与碳水化合物代谢相关的途径高度丰度[26].这些通路大多与蛋白的丰度呈正相关双歧杆菌adolescentis.碳水化合物代谢相关途径的丰富可能是疫苗的一个特征性现象。这种富集可能与疫苗接种者唾液中几种细菌属的丰度有关。需要进一步的调查来澄清这一猜测。
了解SARS-CoV-2疫苗如何影响微生物组组成,可能会提供关于对SARS-CoV-2感染产生免疫反应后口腔环境变化的重要信息。这一信息可能使我们能够建立新的口腔健康管理策略,以对抗COVID-19。然而,本研究分析的是接种疫苗前单个时间点的样本,不同时间点口腔微生物组的确切组成可能有所不同。因此,进一步研究疫苗接种前不同时间点采集的样本,可以提供更可靠的非由COVID-19引起的时间波动信息,揭示COVID-19疫苗接种对口腔和肠道微生物组组成的影响,并阐明潜在机制。
结论
本研究显示,使用NGS接种COVID-19疫苗后,口腔微生物组发生了变化。结果表明,口腔细菌多样性显著增加,属比例显著降低拟杆菌接种COVID-19疫苗后。
数据和材料的可用性
本研究中分析的数据集可根据合理要求从通讯作者处获得。
缩写
- 安共体:
-
微生物群落组成分析
- 消费者价格指数:
-
社区牙周指数
- DMFT:
-
蛀牙、缺牙、补牙
- 门店:
-
新一代测序
- OTU:
-
操作分类单位
- PCoA:
-
主坐标分析
- PERMANOVA:
-
置换多元方差分析
- QIIME2:
-
微生物生态学的定量洞察
- PICRUSt2:
-
通过重建未观察状态的群落系统发育研究
- 邮票:
-
宏基因组谱的统计分析
参考文献
黄宁,Pérez P,加藤T, Mikami Y, Okuda K, Gilmore RC,等。SARS-CoV-2感染口腔和唾液。中华医学杂志,2021;27(5):892-903。
鲍玲,张超,董娟,赵玲,李艳,孙娟。口腔微生物组与SARS-CoV-2:警惕肺部合并感染。前沿微生物。2020;11:1840。https://doi.org/10.3389/fmicb.2020.01840.
Patel J, Sampson V.口腔细菌在COVID-19中的作用。《柳叶刀》微生物杂志2020;1(3):e105。https://doi.org/10.1016/s2666 - 5247 (20) 30057 - 4.
向智,古宏,陈强,周霞,刘勇,Simon-Soro A. SARS-CoV-2口腔感染对宿主菌群的潜在影响。口腔微生物学杂志,2020;13(1):1853451。https://doi.org/10.1080/20002297.2020.1853451.
Soffritti I, D 'Accolti M, Fabbri C, Passaro A, Manfredini R, Zuliani G,等。COVID-19患者口腔微生物组失调与症状严重程度和局部免疫/炎症反应相关:一项横断面研究前沿微生物。2021;12:687513。https://doi.org/10.3389/fmicb.2021.687513.
胡秀明,王永平,王永平,等。肠道环境对疫苗免疫应答的影响。疫苗。2020;38(44):6959 - 65。https://doi.org/10.1016/j.vaccine.2020.08.079.
世界卫生组织。口腔健康调查:基本方法。第四版,日内瓦:世界卫生组织;1997.
胡尔丘伦,上原,李文杰,李文杰,等。蜂花粉饮食改变了小鼠口腔内的菌群和抗菌肽。食物。2021;10(6):1282。https://doi.org/10.3390/foods10061282.
上原奥,平木D,仓光Y,松冈H,高井R,藤田M,等。斯里兰卡嚼槟榔果者口腔菌群的改变。中华微生物学杂志,2011;29(6):369 - 369。https://doi.org/10.1016/j.jmii.2020.06.009.
Tabone M, Bressa C, García-Merino JA, Moreno-Pérez D, Van EC, Castelli FA,等。急性中等强度运动对越野耐力运动员血清和粪便代谢组及肠道菌群的影响。科学通报2021;11(1):3558。https://doi.org/10.1038/s41598-021-82947-1.
王晓燕,李晓燕,李晓燕,王晓燕。口腔微生物群在口腔健康和疾病中的作用。Periodontol 2000。2021年,87(1):107 - 31所示。https://doi.org/10.1111/prd.12393.
贾伟,Rajani C.肠道微生物代谢对非酒精性脂肪性肝病发生发展的影响。Adv Exp医学生物学2018;1061:95-110。https://doi.org/10.1007/978-981-10-8684-7_8.
Relvas M, Regueira-Iglesias A, Balsa-Castro C, Salazar F, Pacheco JJ, Cabral C,等。口腔和牙周健康状况与唾液微生物群之间的关系:细菌多样性,共现网络和预测模型。科学通报2021;11(1):929。
于国强,李志强,李志强,等。吸烟对口腔和鼻腔微生物群的影响。微生物。2017;5(1):3。https://doi.org/10.1186/s40168-016-0226-6.
高桥Y, Park J, Hosomi K,山田T,小林A,山口Y,等。利用16S rRNA测序分析日本口腔癌患者口腔菌群。口腔医学杂志,2019;61(2):120-8。https://doi.org/10.1016/j.job.2019.03.003.
李丽娟,王娟,张春华,王俊杰,等。年龄和衰老过程显著地改变了小肠微生物群。Cell Rep. 2021;36(13): 109765。https://doi.org/10.1016/j.celrep.2021.109765.
劳特曼AW,德拉塞尔CB。微生物群在饮食驱动的食物摄入改变中的作用:饱腹感、能量平衡和奖励。营养。2021;13(9):3067。https://doi.org/10.3390/nu13093067.
内田F, Oh S, Shida T,铃木H,山形K, Mizokami Y,等。运动对非酒精性脂肪肝患者口腔菌群和唾液的影响《国际环境与公共卫生杂志》,2021;18(7):3470。https://doi.org/10.3390/ijerph18073470.
Adler CJ, Dobney K, Weyrich LS, Kaidonis J, Walker AW, Haak W,等。对古代钙化牙菌斑的测序显示,口腔微生物群随着新石器时代和工业革命的饮食变化而变化。中国科学,2013;45(4):450-5。https://doi.org/10.1038/ng.2536.
霍尔B,斯诺M, Herrman E,雷N,曼苏哈尼K,帕特尔KA,等。口腔和肠道微生物群之间的相互联系:逆转微生物生态失调和系统健康与疾病之间的平衡。微生物。2021;9(3):496。https://doi.org/10.3390/microorganisms9030496.
尚杰,叶刚,石凯,万勇,罗超,爱原华,等。SARS-CoV-2受体识别的结构基础大自然。2020;581(7807):221 - 4。https://doi.org/10.1038/s41586-020-2179-y.
徐红,钟琳,邓洁,彭洁,丹红,曾旭,等。新型冠状病毒ACE2受体在口腔黏膜上皮细胞高表达。中华口腔医学杂志2020;12(1):8。https://doi.org/10.1038/s41368-020-0074-x.
Geva-Zatorsky N, Sefik E, Kua L, Pasman L, Tan TG, ortizz - lopez A,等。挖掘人体肠道微生物群中的免疫调节有机体。细胞。2017;168 (5):928 - 943. - e11。https://doi.org/10.1016/j.cell.2017.01.022.
左涛,张峰,吕广昌,杨玉凯,李爱林,詹华,等。COVID-19患者住院期间肠道菌群的变化胃肠病学。2020;159 (3):944 - 955. - e8。https://doi.org/10.1053/j.gastro.2020.05.048.
Vatanen T, Kostic AD, d 'Hennezel E, Siljander H, Franzosa EA, Yassour M,等。微生物组LPS免疫原性的变化有助于人类自身免疫。细胞。2016;165(4):842 - 53年。https://doi.org/10.1016/j.cell.2016.04.007.
吴素生,彭勇,张林,莫志强,赵松,李安,等。肠道菌群组成与SARS-CoV-2疫苗免疫原性和不良事件相关肠道》2022。https://doi.org/10.1136/gutjnl-2021-326563.
确认
我们要感谢Editage (www.editage.com)进行英文编辑。
资金
这项研究得到了8020促进基金会(采用编号:21-6-14)2021财年的8020研究补助金和Futokukai基金会2021财年的研究补助金的支持。
作者信息
作者及隶属关系
贡献
OU, YA和TN设计了这项研究。OU, TM, DH, FH, YK, ST, DP, SS, KY收集并分析数据。OU、HMa和HMi解释数据。OU、YA、TN、MA、YF、HMi起草并修改了手稿。所有作者都同意提交这篇手稿。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
北海道健康科学大学预防医学科学研究所伦理委员会批准了这项研究的伦理(批准号:no. 2)。2021 - 001)。所有受试者均同意参与本研究,并提供书面知情同意书。
发表同意书
不适用。
相互竞争的利益
作者声明没有利益竞争。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
上原,O,阿比子,Y,长泽,T。et al。COVID-19疫苗接种后口腔环境健康的个体口腔微生物组的变化。BMC口腔健康22, 50(2022)。https://doi.org/10.1186/s12903-022-02093-6
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12903-022-02093-6
关键字
- 新型冠状病毒肺炎
- 疫苗
- 16 s rRNA
- 口腔微生物
- 健康口腔环境