摘要
广泛应用于癌症治疗的阿霉素(DOX)可诱发心肌病。DOX诱导心脏毒性的主要机制之一是通过NLR家族pyrin结构域3 (NLRP3)炎症小体和gasdermin D (GSDMD)发生焦亡。增加NAPDH氧化酶(NOX)和氧化应激触发焦亡。外源性8-羟基脱氧鸟苷(8-OHdG)通过灭活NOX减少活性氧(ROS)的产生。在这里,我们研究了8-OHdG治疗是否可以减轻dox诱导的H9c2心肌细胞焦亡。暴露于DOX增加了过氧化谷胱甘肽氧化还原状态和NOX1/2/4、toll样受体(TLR)2/4和活化B细胞的核因子κ轻链增强子(NF-κB)的表达,而额外的8-OHdG处理减弱了这些作用。此外,DOX诱导NLRP3炎症小体成分的高表达,包括NLRP3、含有c-末端caspase募集结构域(ASC)的凋亡相关斑点样蛋白和caspase-1前。此外,它还增加了caspase-1活性(焦亡标志物)和白细胞介素(IL)-1β的表达。经8-OHdG处理后,这些影响均减弱。此外,DOX可增加心脏毒性标志物心房钠肽(ANP)和脑钠肽(BNP)的表达,而8-OHdG可逆转DOX诱导的ANP和BNP的表达。 In conclusion, exogenous 8-OHdG attenuated DOX-induced pyroptosis by decreasing the expression of NOX1/2/3, TLR2/4, and NF-κB. Thus, 8-OHdG may attenuate DOX-induced cardiotoxicity through the inhibition of pyroptosis.
介绍
阿霉素(DOX)被广泛用于治疗多种癌症,如乳腺癌、软组织肉瘤、淋巴瘤和白血病。尽管有效,但DOX可诱发严重并发症,如累积性心脏毒性[1,2]。已知dox引起的心脏毒性主要是累积效应,因此建议累积剂量不应超过500 mg/m2(3.]。然而,最近的研究表明,即使单次给药DOX也可能发生DOX诱导的心脏毒性[4,5]。dox诱导的心脏毒性可导致不可逆心肌损伤或充血性心力衰竭[6]。dox致心脏毒性的病理生理机制尚未完全揭示;然而,氧化应激、细胞凋亡、炎症和自噬调节受损可能参与其发展[7,8,9,10]。此外,NLR家族pyrin结构域包含3 (NLRP3)炎性体形成,导致气皮蛋白D (GSDMD)依赖性焦亡,最近被确定为DOX诱导心脏毒性的主要机制之一[11]。
损伤相关分子模式(DAMPs)从死亡细胞中释放出来,并被nod样受体如NLRP3识别[12]。NLRP3炎性小体包括传感器分子NLRP3、炎性小体接头凋亡相关斑点样蛋白(含c-末端caspase募集结构域(ASC))和caspase-1原[13,14]。NLRP3炎性小体的激活通过前caspase-1的裂解导致caspase-1的激活[13,14]。反过来,caspase-1的激活通过前IL-1β和前IL-18的裂解导致IL-1β和IL-18的成熟[15,16,17]。此外,活化的caspase-1裂解GSDMD,产生的n端裂解产物(GSDMD- nt)与质膜结合形成孔[15,16]。通过这些毛孔,IL-1β和IL-18被释放到细胞外空间,从而加剧炎症[17,18,19]。此外,细胞膜上气孔的形成和炎症因子的释放导致细胞肿胀、膜破裂和焦亡[15,20.,21,22]。焦亡参与各种疾病的发展,如糖尿病性心肌病、心肌梗死和糖尿病性肾内皮细胞损伤[23,24,25]。此外,通过钠-葡萄糖共转运蛋白-2 (SGLT-2)抑制剂、枯草素蛋白转化酶/Kexin型9 (PCSK9)抑制剂或丁酸钠抑制焦亡被认为有可能作为与焦亡相关疾病的治疗药物[23,24,25]。
肿瘤坏死因子(TNF)-α在dox诱导的心脏毒性中表达升高[j]26,27],这也会导致焦亡[28]。toll样受体(TLRs)在心肌细胞中高表达,并与dox诱导的心脏毒性有关[28]。在dox诱导的心脏毒性中,TLR-4和TLR-2的激活导致活化B细胞的核因子kappa轻链增强子(NF-κB)的上调,从而导致各种促炎细胞因子的表达增加,包括TNF-α和IL-6 [29,30.]。TLR/NF-κB信号通路增加NLRP3与ASC的结合[31]。此外,氧化应激增加与dox诱导的心脏毒性有关[32]。氧化应激是细胞系统中活性氧(ROS)产生增加和内源性抗氧化剂(如过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和谷胱甘肽(GSH))产生减少的结果[32,33]。在dox诱导的心脏毒性过程中,NADPH氧化酶(NOX)1和NOX4也通过增加ROS的产生参与NLRP3炎性体的激活[34]。在脑损伤中,NOX2也参与NLRP3炎性体的激活[35]。此外,TLR4促进nox4介导的ROS生成[36], TLR2刺激NOX1和NOX2产生ROS [28,37]。TLR2表达增加也通过TLR2/Myd88/ NF-κB通路导致焦亡[qh]38]。
内源性8-OHdG经常被用作ROS诱导的DNA氧化损伤的指标,因为它是DNA的氧化核苷[39]。矛盾的是,外源性8-OHdG已知通过抑制ras相关的C3肉毒毒素底物1 (Rac1)和NOX复合物来减少ROS的产生[39]。此外,外源性8-OHdG通过抑制NOX复合物减少脂肪组织中促炎细胞因子的产生,包括IL-1β、TNF-α和IL-6 [40]。此外,外源性8-OHdG下调胃肠道NF-κB通路[39]。
在这里,我们研究了外源性8-OHdG是否可以减轻dox诱导的H9c2心肌细胞焦亡。我们假设外源性8-OHdG处理会导致NOX和NF-κB表达下调,并通过降低Rac1来减少TNF-α的产生,最终导致dox诱导的焦亡的衰减。
材料与方法
细胞系和试剂
H9c2细胞来自ATCC (Manassas, VA, USA),在Dulbecco 's modified Eagle 's培养基(DMEM) (Welgene,大邱,韩国)中培养,加入10%胎牛血清(FBS, Welgene)和1%青霉素-链霉素(Welgene)。8-羟基脱氧鸟苷(8-OHdG),由郑明熙教授提供。DOX来自Seleckchem (houston, TX, USA)。
细胞活力测定
1 × 104将细胞置于96孔培养板中,用DOX或8-OHdG处理,在37℃下孵育24、48或72 h。然后,细胞在含有0.5 mg/mL 3-(4,5-二甲基噻唑-2-基)-2,5-二苯基溴化四唑(MTT) (#M2128, Sigma-Aldrich, St. Louis, MO, USA)的培养基中37℃孵育1小时。在反应结束时加入二甲亚砜(DMSO)来溶解活细胞中的甲醛晶体。用酶标仪(Emax, Molecular Devices, San Jose, CA, USA)在560nm处测量吸光度。
乳酸脱氢酶测定
2 × 104将细胞接种于96孔板,在含1%胎牛血清的培养基中,用DOX和8-OHdG处理24-48 h, 37℃。将无细胞培养上清与乳酸脱氢酶(LDH)反应混合物(#MK401, Takara Bio Inc., Otsu, Shiga, Japan)混合,在室温下孵育30 m。在490 nm处测定吸光度。
Rac1活化试验
使用Rac1激活测定试剂盒(Cell Biolabs, San Diego, CA, USA)根据制造商的方案测定Rac1活性。简单地说,为了免疫沉淀,200个μg蛋白在含有p21活化蛋白激酶(PAK) p21结合域(PBD)琼脂糖珠的缓冲液中4℃孵育过夜。用1X实验缓冲液洗涤后,上清液用12% SDS-PAGE凝胶分离。采用一抗Rac1 (1:1000) (Cell Biolabs)和β-actin (1:3000) (Santa Cruz Biotechnology)。使用Amersham Imager 600 (GE healthcare, Chicago, IL, USA)拍摄图像。
实时定量PCR
从H9c2细胞中分离总RNA (3 × 10)5细胞/ 60mm皿),使用RNAiso plus (9108, Takara Bio)和Qiagen RNeasy Mini Kit (74104, Qiagen, Hilden,德国)。RNA定量使用NanoDrop-2000 (Thermo Fisher Scientific, Waltham, MA, USA)。然后,使用PrimeScript第一链cDNA合成试剂盒(#6110A, Takara Bio)进行cDNA合成。采用SYBR Green I Universal PCR Master Mix (Takara Bio)和引物(Bioneer,大田,韩国),在CFX96实时PCR系统(Bio- rad, Hercules, CA, USA)上进行实时PCR,反应条件为:95°C 10 min, 95°C 15 s, 60°C 1 min,循环40次。GAPDH作为内参基因。相对基因表达用比较的方法给出了相对于内控基因的相关基因的表达数据CT方法也称为2−△△CT方法。引物(Bioneer,大田,韩国)大鼠TNF-α序列。AB553578.1), NLRP3 (GeneBank检索号:XM_039085397.1),心房利钠肽(ANP) (GeneBank登录号:M27498.1),脑利钠肽(BNP) (GeneBank登录号:xm_032885781.1), GATA结合蛋白4 (GATA4) (GeneBank登录号:XM_032917655.1), GATA结合蛋白6 (GATA6) (GeneBank登录号:NM_019185.2), TLR-2 (GeneBank登录号:NM_198769.2), TLR-4 (GeneBank登录号:NM_019178.2),以及GAPDH (GeneBank Accession no.; NM_017008) are listed in Table1.
Western blot分析
细胞(3 × 105细胞/60 mm培养皿)在RIPA缓冲液中裂解(20 mm Tris-HCl (pH 7.5), 150 mm NaCl, 1 mm EGTA, 2.5 mm磷酸氢钠,1 mm β-甘油磷酸,1 mm正钒酸钠,1 μg/ml胰肽,1%脱氧胆酸钠,1% NP-40) (#9806, Cell signaling technology, Danvers, MA, USA)。10-20 μg蛋白用8-12%的SDS-PAGE凝胶分离,转移到PVDF膜上。用5%脱脂乳封堵后,用一抗在4℃下孵育过夜。ASC一抗(1:1000)(GeneBank登录号:NM_172322.1) (sc-271054, Santa Cruz, Dallas, TX, USA), caspase-1 (1:1000) (GeneBank登录号:NM_012762.3) (NBP1-45433, Novus biicals, Denver, CO, USA), caspase 3 (1:1000) (#9661S, Cell signaling technology), IL-1β (1:1000) (GeneBank Accession no. 10);XM_032902343.1) (NB600-633, Novus biicals), NOX1 (1:1000) (GeneBank登录号:NM_053683.2) (NBP1-31546, Novus biicals), NOX2 (1:1000) (GeneBank登录号:NM_023965.1) (NBP2-41291, Novus biicals), NOX4 (1:1000) (GeneBank登录号:NM_053524.1) (NB110-58851, Novus biicals), NF-κB p65 (1:2000) (GeneBank登陆号: AJ002424.2) (#8242, Cell signaling technology), Phospho-NF-κB p65 (1:1000) (#3033, Cell signaling technology), GSDMD-NT (1:1000) (ER1901-37, HUAbio, Boston, MA), and β-actin (1:3000) (SC-47778, Santa Cruz) were used. Images were taken with an Amersham Imager 600 (GE healthcare, Chicago, IL, USA). Band intensities were normalized to β-actin using ImageJ software (NIH, Bethesda, MD, USA).
Pyroptosis化验
3 × 105将细胞置于60 mm培养皿中,并用DOX和8-OHdG处理24小时。按照制造商的说明,使用焦亡/ Caspase-1检测试剂盒(MBS258046, Mybiosource, San Diego, CA, USA)检测Caspase-1的活化情况。首先,细胞在含有荧光染料标记的半胱天蛋白酶抑制剂(FLICA)的培养基中37℃黑暗孵育4小时。然后,将细胞洗净,转移到黑色微滴板上测量荧光强度(激发波长,480 nm;发射波长,515 nm)与微孔板读取器(Molecular Devices)。然后,用固定缓冲液固定细胞2分钟,用Dulbecco 's磷酸缓冲盐水(DPBS)洗涤,置于玻片上,玻片上涂有50 μL抗褪色挂载培养基(H-1000-10, Vector Laboratories Inc., Burlingame, CA, USA),用25 mm玻片覆盖。使用LSM 700蔡司共聚焦显微镜(Carl Zeiss, Oberkochen, Germany)拍摄图像,并使用ZEN软件(Carl Zeiss)进行分析。实验进行了三次。
谷胱甘肽测定
将细胞置于100 mm培养皿中,并用DOX和8-OHdG处理24小时。按照制造商的说明使用谷胱甘肽检测试剂盒(Abcam, Cambridge, UK)。简单地说,细胞悬液从裂解106使用裂解缓冲液的细胞在含硫醇或GSSG探针的培养基中室温孵育10-60 m。然后,我们使用荧光酶标仪(Thermo Scientific, Waltham, MA, USA)在Ex/Em = 490/520 nm处测量谷胱甘肽和总谷胱甘肽(GSH + GSSG)的浓度。GSH/GSSG比值由GSH和GSSG浓度计算。
统计分析
所有实验均重复三次以上,除非另有说明,否则给出平均值。数据以平均值±标准差表示。采用Prism®软件(GraphPad, San Diego, CA, USA)采用单因素方差分析和事后Dunnett检验确定结果的统计学显著性。显著性定义为*P< 0.05, **P< 0.01, ***P所有实验均< 0.001。
结果
DOX以剂量依赖性的方式降低H9c2细胞活力
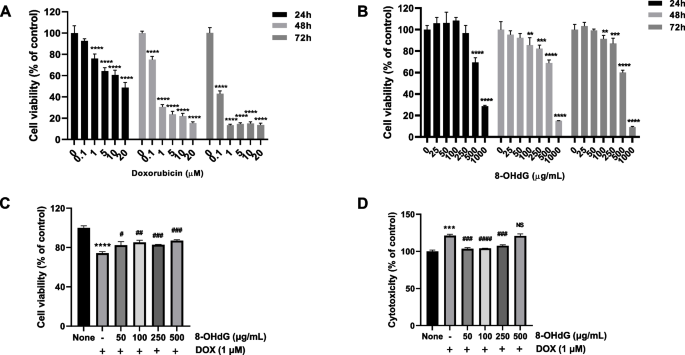
首先,我们进行了初步实验,确定DOX的适宜毒性浓度和8-OHdG的有效浓度。用0.1、1、5、10和20 μM DOX或25、50、100、250、500和1000 μg/mL 8-OHdG处理细胞24、48和72 h,然后用MTT法评价细胞活力。
结果表明,随着DOX浓度的增加,细胞活力逐渐降低(图3)。1A) IC50研究期间DOX值分别为20.6 μM (24 h)、0.4778 μM (48 h)和0.02895 μM (72 h)。培养24 h后,8-OHdG处理的H2c9细胞在0 ~ 250 μg/mL范围内的活力与对照组无显著差异;当浓度≥500 μg/mL时,细胞活力明显降低(图2)。1B)。培养48和72 h后,当8-OHdG浓度在0 ~ 50 μg/mL范围内时,8-OHdG处理的H2c9细胞的活力与对照组没有显著差异(图2)。1B) IC508-OHdG的浓度分别为699.4 μg/mL (24 h)、595.5 μg/mL (48 h)和544.4 μg/mL (72 h)。为了评估8-OHdG对焦亡的影响,我们采用1 μM DOX(与先前报道相同)[41]。此外,我们通过不同浓度(50、100、250和500 μg/mL)的8-OHdG处理1 μM dox处理的细胞,检测细胞增殖和细胞毒性。50、100和250 μg/mL的8-OHdG增强了dox处理的H9c2细胞的增殖,反过来减轻了这些细胞的细胞毒性(图2)。1因此,我们用1 μM的DOX和100和250 μg/mL的8-OHdG处理这些H9c2细胞进行后续研究。
外源性8-OHdG降低dox处理的H9c2细胞中心脏毒性相关标志物的表达
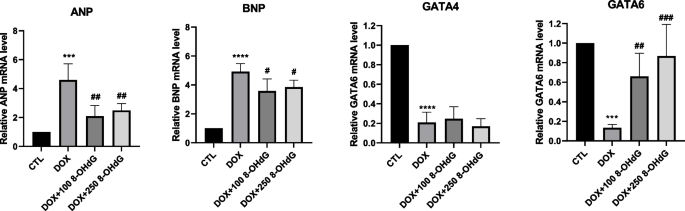
8-OHdG处理可降低dox处理的H9c2细胞的细胞毒性(图2)。1)。因此,我们测试了外源性8-OHdG是否影响dox处理的H9c2细胞中心肌肥厚标志物、ANP和BNP的表达。与对照细胞相比,DOX使ANP和BNP mRNA水平分别升高258-479%和337-428%,而在DOX处理的细胞中,8-OHdG的添加使它们的表达水平分别降低18.4-78.1%和16.4-49.1%(图4)。2)。因此,8-OHdG可减轻dox诱导的H9c2细胞心脏毒性。
GATA4和GATA6是参与细胞存活的转录因子。我们评估了DOX和8-OHdG对心肌细胞中GATA4和6表达的影响。如图所示。2与对照细胞相比,DOX暴露使GATA4和6的mRNA水平分别降低了68-90%和83.4-91%。然而,在dox处理的H9c2细胞中,8-OHdG只恢复了GATA6的表达,而没有恢复GATA4的表达。这些发现表明,8-OHdG可能减轻dox诱导的H9c2细胞的心脏毒性,并且GATA6可能参与其中。
外源性8-OHdG降低dox处理的H9c2细胞NOX1/2/4表达和NF-κB磷酸化,增加GSH/GSSG比值
考虑到8-OHdG通过Rac1参与氧化应激,我们检测了DOX和8-OHdG对H9c2细胞NOX1/2/4表达和Rac1活性的调节作用。
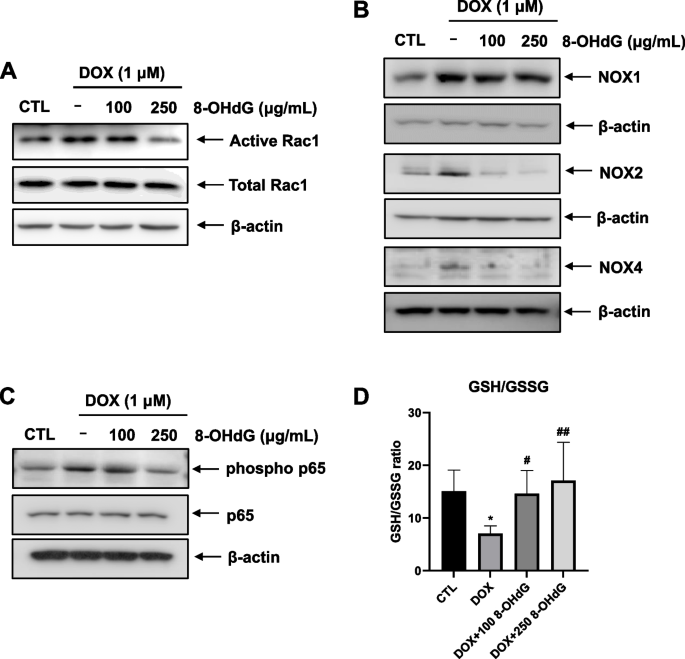
我们使用免疫沉淀法进行了Rac1激活实验,发现250 μg/mL 8-OHdG降低了暴露于dox的大鼠H9c2细胞中Rac1的活性(图2)。3.A)。此外,当细胞同时接受DOX和8-OHdG处理时,与DOX处理的细胞相比,NOX1、2和4的蛋白水平降低(图2)。3.B).然而,在dox处理的细胞中,8-OHdG对NOX2和NOX4的抑制作用大于对NOX1的抑制作用。此外,与dox处理的H9c2细胞相比,外源性8-OHdG抑制p65的磷酸化水平(图2)。3.这些发现表明,8-OHdG可能通过p65和Rac1的失活来减轻dox诱导的NOX1/2/4上调。
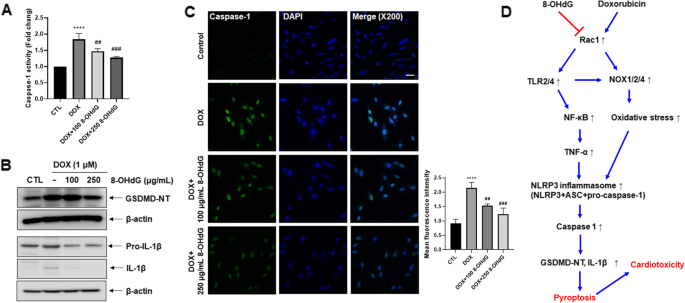
外源性8-OHdG降低dox处理的H9c2细胞NOX1/2/4表达和NF-κB磷酸化,增加还原性谷胱甘肽/氧化性谷胱甘肽比值。一个Rac1激活试验。用DOX (1 μM)和8-OHdG(100或250 μg/mL)处理H9c2细胞1 h后,用p21活化蛋白激酶(PAK) p21结合域(PBD)琼脂糖珠沉淀细胞裂解液,并用Rac1特异性单克隆抗体进行免疫印迹。B- - - - - -D1 μM DOX和100 μg/mL或250 μg/mL 8-OHdG作用H9c2细胞24 h。B- - - - - -CWestern blot分析DOX-和8- ohdg处理的H9c2细胞中NOX1/2/4、p65和磷酸化p65蛋白水平。D采用谷胱甘肽测定试剂盒测定谷胱甘肽/谷胱甘肽比值。细胞毒性t淋巴细胞,控制;阿霉素、阿霉素;8-OHdG 8-hydroxydeoxyguanosine;NOX, NADPH氧化酶;GSH/GSSG,还原型谷胱甘肽/氧化谷胱甘肽比值。*P与对照组相比< 0.05;#P< 0.05和# #P与dox处理组比较< 0.01
氧化应激是细胞系统中ROS生成增加和内源性抗氧化剂(如CAT、SOD和GSH)含量减少的结果[32,33]。因此,我们研究了8-OHdG处理是否会影响dox处理的H9c2细胞的GSH/GSSG比率。在dox处理的H92C细胞中,外源性8-OHdG使GSH/GSSG的比值恢复了13.8-389%。3.综上所述,8-OHdG可降低dox处理的H9c2细胞NOX1/2/4的表达,提高GSH/GSSG比值,提示8-OHdG可减轻dox诱导的心肌细胞氧化应激。
外源性8-OHdG在dox处理的H9c2细胞中降低NLRP3炎性体成分和caspase-1的表达
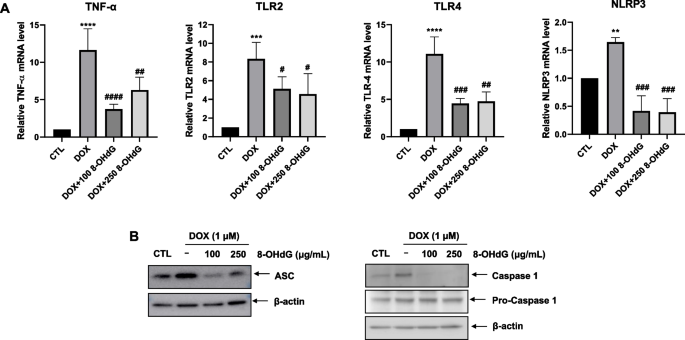
dox诱导的心脏毒性增加TNF-α,导致焦亡[26,27,28]。因此,我们研究了8-OHdG处理是否会影响dox处理的H9c2细胞中TNF-α、TLR2和TLR4的mRNA水平。与对照组相比,暴露于DOX使TNF-α、TLR2和TLR4的表达分别增加了690-1369%、565-937%和825-1264%,而与DOX处理组相比,额外使用8-OHdG使它们的表达水平分别降低了42.2-78.3%、12.8-74%和39.8-75.7%。4一个)。
外源性8-OHdG在dox处理的H9c2细胞中降低NLRP3、ASC和caspase-1的表达。a - b1 μM DOX和100 μg/mL或250 μg/mL 8-OHdG作用H9c2细胞24 h。一个实时荧光定量PCR检测DOX-和8- ohdg处理的H9c2细胞中TNF-α、TLR2、TLR4和NLRP3的表达。BWestern blot分析DOX-和8- ohdg处理的H9c2细胞中ASC和caspase-1蛋白水平。细胞毒性t淋巴细胞,控制;阿霉素、阿霉素;8-OHdG 8-hydroxydeoxyguanosine;肿瘤坏死因子;toll样受体;NLRP, NLR家族含pyrin结构域;ASC,凋亡相关斑点样蛋白,含有CARD c端caspase募集结构域。**P< 0.01和****P与对照组相比< 0.0001;#P< 0.05,# #P< 0.01,# # #P< 0.001,# # # #P与dox治疗组相比< 0.0001
为了评估8-OHdG是否能像Rac1 siRNA一样降低NOX1/2/4和TLR2/4,我们将阴性对照siRNA和两种大鼠Rac1转染H9c2,然后用DOX和/或8-OHdG处理24 h。在DOX暴露的H9c2细胞中,8-OHdG对NOX1/2/4和TLR2/4的抑制作用与两种Rac1 siRNA相似(supl。无花果。1)。
接下来,为了阐明8-OHdG是否减轻dox诱导的炎性小体激活,我们在dox处理的H9c2细胞中检测了8-OHdG对炎性小体成分、NLRP3、ASC和caspase-1表达的影响。
DOX诱导的NLRP3表达(55-70%)在8-OHdG的额外处理中降低了54.8-91.2%。4A)。此外,与对照组相比,DOX增加了ASC和caspase-1的蛋白水平,而与DOX处理的细胞相比,8-OHdG处理降低了ASC和活性caspase-1的水平。4B).总的来说,这些发现表明8-OHdG可能有效抑制dox诱导的心肌细胞炎性体活化。
外源性8-OHdG降低dox处理的H9c2细胞中IL-1β的表达、GSDMD-NT的产生和焦亡
鉴于活化的caspase-1切割GSDMD,导致GSDMD- nt的释放[15,16,17],我们研究了8-OHdG对dox处理细胞中caspase-1活化和GSDMD切割的影响。与对照组相比,DOX增加了63-94.8%的caspase-1活性,与DOX处理的细胞相比,8-OHdG额外处理使caspase-1活性降低了7-36.9%(图2)。5A)。此外,8-OHdG抑制dox诱导的GSDMD-NT生成和pro-IL-1β/IL-1β表达(图2)。5B).为了证实8-OHdG对dox诱导的caspase-1激活的抑制作用,我们使用共聚焦显微镜观察了dox处理的H9c2细胞中caspase-1阳性活性细胞。如图所示。5C,与对照细胞相比,DOX使caspase-1活性增加了83.3-190%,而与DOX处理的H9c2细胞相比,8-OHdG使caspase-1活性降低了19.2-52.8%。
外源性8-OHdG降低dox处理的H9c2细胞IL-1β表达、GSDMD-NT水平和焦亡。一个- - - - - -C1 μM DOX和100 μg/mL或250 μg/mL 8-OHdG作用H9c2细胞24 h。一个通过焦亡/ Caspase-1检测试剂盒检测细胞中Caspase-1活性。DOX和8-OHdG处理后细胞中活性caspase-1的水平。1 μM DOX和100或250 μg/mL 8-OHdG处理后,细胞用FAM-YVAD-FMK染色,用荧光酶标仪检测caspase-1活性。BWestern blot分析DOX-和8- ohdg处理的H9c2细胞中GSDMD、前IL-1β、IL-1β和β-肌动蛋白水平。C8-OHdG抑制dox诱导的H9c2细胞caspase-1活性。标尺,20 μm。固定后,共聚焦显微镜下观察经FAM-YVAD-FMK染色的细胞(左)。条形图显示活性caspase-1阳性细胞的定量。8-OHdG处理降低了dox处理细胞的caspase-1活性(右)。D8-OHdG在dox暴露心肌细胞中的作用机制示意图。外源性8-OHdG降低dox处理细胞中NOX1/2/4、TLR2/4和NF-κB的表达,最终导致NLRP3炎性体、IL-1β和GSDMD-NT水平降低。此外,焦热相关因子水平的降低导致心肌炎相关标志物如ANP和BNP的表达降低。细胞毒性t淋巴细胞,控制;阿霉素、阿霉素;8-OHdG 8-hydroxydeoxyguanosine;GSDMD-NT,气敏D n端裂解产物;IL,白介素;toll样受体;NOX, NADPH氧化酶; NF-κB, nuclear factor kappa-light-chain-enhancer of activated B cells; TNF, tumor necrosis factor; NLRP, NLR family pyrin domain containing.****P与对照组相比< 0.0001;# #P< 0.01和# # #P与dox治疗组相比< 0.001
总之,我们的研究结果表明,dox诱导的caspase-1激活可切割GSDMD,从而引发H9c2细胞的焦亡,而8-OHdG可减轻dox诱导的心肌细胞焦亡。
讨论
心脏毒性是化疗后最严重的并发症,可导致左心室射血分数(LVEF)降低10% ~ 50%以上[42]。dox引起的心脏毒性是剂量依赖性的,发生在3%至18%的患者中[43]。此外,DOX治疗导致充血性心力衰竭,这是最严重的心脏毒性形式,约5%的患者[44]。
dox诱发的充血性心力衰竭预后很差[45]。为防止dox引起的心脏毒性,建议定期监测LVEF,当LVEF低于40%时也建议停止化疗[46]。目前,用于治疗dox引起的心脏毒性的预防性或治疗性药物很少[47,48]。几种标准的心力衰竭药物包括肾素-血管紧张素系统阻滞剂或受体阻滞剂已被使用;然而,它们在治疗或预防dox诱导的心脏毒性方面不是很有效[47,48]。因此,对于dox诱导的心脏毒性,需要开发其他针对性的心脏保护疗法或预防性治疗[49]。
NLRP3炎性小体已被证明参与dox诱导的心脏毒性。DOX治疗增加小鼠心肌NLRP3炎性体和IL-1β分泌[50]。在体外和体内模型中,dox诱导的心脏毒性也与焦亡增加有关[51]。此外,抑制NLRP3炎症反应可降低dox诱导的心脏毒性[52]。因此,减少NLRP3炎性体或焦亡可能是预防或治疗dox诱导的心脏毒性的有希望的治疗方法[53]。
已知ROS或NOX活性增加可增加NLRP3炎性体[34,35]。外源性8-OHdG通过下调Rac1导致ROS和NOX活性的降低[39]。因此,我们评估了外源性8-OHdG是否通过抑制Rac1降低dox处理的心肌细胞NLRP3炎症小体相关炎症和焦亡。H9c2细胞是来源于胚胎大鼠心脏组织的亚克隆细胞系,与分化的成年心肌细胞有相似之处[j]。54,55],但H9c2细胞不具有收缩能力[55]。然而,H9c2在抗癌药物开发的临床前研究中应用最为广泛,如心脏毒性和安全性的评估[56]。特别是,DOX处理的H9c2模型可以模拟DOX诱导的心脏损伤的相关机制,如氧化应激、细胞凋亡、肌浆网应激和细胞死亡[33,57,58]。因此,我们认为H9c2是评价dox诱导的焦亡的合适细胞系。
在我们的研究中,8-OHdG降低了dox处理的H9c2细胞中Rac1的活性(图2)。2A).前期研究表明,DOX诱导Rac1给药NOX活化[59]。DOX显著增加H9c2细胞NOX1/2/4的表达,8-OHdG则显著降低NOX1/2/4的表达。此外,我们通过测量GSH/GSSG比率来评估氧化应激,发现DOX处理增加了氧化应激,而8-OHdG则降低了氧化应激。
既往研究表明,在dox诱导的心脏毒性中,TLR2、TLR4、TNF-α和NF-κB的表达升高,这些信号的上调导致NLRP3炎性体的增加和焦亡[29,30.,31,32]。我们发现DOX处理增加了TLR2、TLR4和NF-κB (p65)的表达,而8-OHdG处理则降低了它们的表达。我们证实了8-OHdG在抑制NOX1/2/4和TLR2/4表达方面具有与Rac1 siRNA相似的作用。无花果。1)。由此可见,8-OHdG降低NOX1/2/4和TLR2/4表达的作用似乎是通过降低Rac1活性介导的。
NLRP3炎性体的产生经历了启动和激活两个阶段。在启动阶段,在DAMPs或促炎细胞因子TNF-α和IL-1β的刺激下,NLRP3和前IL-1β和前il -18的转录增加[11,12,13,14,15,16,17]。各种信号如ROS诱导NLRP3炎性体的激活。NLRP3低聚物与ASC(适配器)和前caspase-1(效应物)形成炎性体复合物,导致caspase-1的激活[11,12,13,14,15,16,17]。激活的caspase-1可导致前IL-1β、前IL-18和GSDMD分别裂解为IL-1β、IL-18和GSDMD- nt [11,12,13,14,15,16,17]。GSDMD-NT形成膜孔,导致细胞热亡和IL-1β和IL-18外溢,从而加重炎症[11,12,13,14,15,16,17]。
在我们的研究中,DOX治疗增加了NLRP3炎症小体成分(NLRP3、ASC和前caspase-1)和caspase-1的表达,而8-OHdG治疗则降低了它的表达。DOX处理导致H9c2细胞中IL-1β和IL-1β的表达增加。DOX治疗组GSDMD-NT水平升高,8-OHdG治疗组GSDMD-NT水平降低。此外,通过caspase-1活性测定,DOX处理增加了焦亡细胞的数量,8-OHdG处理减少了焦亡细胞的数量。
已知ANP和BNP都是心衰的有用预测因子和预后标记物[60,61,62]。心房扩张时从心房分泌ANP [63,64,65]。BNP在心室合成取决于舒张末压和容积,因此是比ANP更敏感的心力衰竭标志物[63,64,65]。此外,在dox引起心脏毒性的第6 - 12周,BNP的产生开始增加[65]。多项研究表明,BNP可作为dox诱导的心脏毒性的标志物[61,62]。BNP和LVEF是DOX化疗后心力衰竭住院的有效预测因子[66]。然而,BNP比LVEF更准确地预测dox诱导的心脏毒性后的总体死亡[66]。另一方面,GATA4是GATA蛋白家族的一员,对心肌细胞的适应性反应至关重要[67,68,69]。DOX治疗导致GATA4耗竭,GATA4水平降低与DOX诱导的心脏毒性有关。GATA4水平降低50%会导致小鼠对DOX的过度反应,并导致比野生型小鼠更高的心肌细胞损失[70]。GATA6水平也因DOX而降低。此外,在dox处理的H9c2细胞中,GATA4/6的表达降低[71]。
在我们的研究中,ANP和BNP的表达在DOX处理下升高,在8-OHdG处理下降低。然而,DOX处理降低了GATA4/6的表达,8-OHdG处理仅增加了GATA6的表达。因此,在dox处理的H9c2细胞中,8-OHdG似乎降低了心毒性因子的表达,并伴有TLR2/4、NF-κB和NOX 1/2/4的表达降低和焦亡。dox处理的H9c2细胞也表现出IL-6的表达增加,IL-6和IL-1β或TNF-α引起细胞损伤[72]。因为外源性8-OHdG也会导致IL-1β、TNF-α和IL-6的降低[39], 8-OHdG可能通过直接降低IL-6、IL-1β和TNF-α,以及减少焦亡,从而降低心毒性物质的表达。
免疫检查点抑制剂(ICIs)显示抗pd -1 (nivolumab和pembrolizumab),抗pd - l1 (atezolizumab, avelumab和durvalumab)和抗ctla -4抗体(ipilimumab和tremelimumab)的作用[73,74,75]也会导致心肌炎的副作用[76]。这些ICIs导致小细胞NLRP3和MyD88增加[77]。因此,8-OHdG可能通过抑制NRLP3来减轻ICIs诱导的心肌炎。我们将在未来的研究中评估8-OHdG是否可以减少ICIs诱导的心肌炎。Ferroptosis是一种非凋亡性细胞死亡,它是由脂质过氧化通过铁依赖的脂氧合酶激活而引起的[78,79]。此外,铁下垂是dox诱导心脏毒性的病理生理机制之一[79]。DOX通过上调NOX4信号通路诱导铁介导的铁下垂增加[80]。因此,我们将在未来的研究中评估8-OHdG是否可以通过减少铁下垂来降低dox诱导的心脏毒性。
结论
总的来说,外源性8-OHdG通过降低dox处理细胞中的Rac1活性,降低NOX1/2/4、TLR2/4和NF-κB的表达,最终导致NLRP3炎性体、IL-1β和GSDMD-NT水平降低。此外,焦热相关因子水平的降低导致心肌炎相关标志物如ANP和BNP的表达降低(图2)。5因此,外源性8-OHdG可能通过抑制焦亡来减轻dox诱导的心脏毒性。
数据和材料的可用性
本研究过程中产生或分析的所有数据均包含在本文及其补充信息文件中。
参考文献
我是MS,我是SM。抗癌治疗的心脏毒性。中华医学杂志,2015;12(9):547-58。
蒽环类药物介导的心脏毒性研究进展。中华医学杂志,2018;9:1262。
彭丽娟,李建平,李建平,等。多柔比星心肌毒性小鼠线粒体连接蛋白43表达的研究。中华医学杂志,2018;19(3):757。
张建军,张建军,张建军,等。抗肿瘤药物的心脏毒性研究。化学与毒物,2008;21(5):978-89。
马卓康,马卓康,马卓康,马卓康,苏伦提诺,Ciccarelli M, Iaccarino G, Pinto A, Popolo A.多柔比星诱导心脏毒性小鼠模型的研究。中华毒物学杂志,2016;29(3):44 - 52。
袁玉平,马志刚,张翔,徐世臣,曾晓峰,杨震,邓伟,唐启智。CTRP3通过激活Sirt1来防止阿霉素诱导的心功能障碍、炎症和细胞死亡。中华生物医学杂志,2018;39(4):481 - 481。
Boyd A, Stoodley P, Richards D, Hui R, Harnett P, Vo K, Marwick T, Thomas L.蒽环类药物诱导左心室收缩和舒张功能早期改变:单中心研究。科学通报,2017;12(4):e0175544。
王松,王勇,张志,刘强,顾军。成纤维细胞生长因子21通过SIRT1/LKB1/AMPK通路对阿霉素毒性的心脏保护作用。细胞死亡杂志,2017;8(8):e3018。
林慧,张军,倪婷,林娜,孟玲,高峰,罗慧,刘霞,迟军,郭辉。黄酒多酚化合物通过激活Nrf2信号通路阻止阿霉素诱导的心脏毒性。中华细胞医学杂志,2019;23(9):6034-47。
杨燕,李宁,陈涛,张超,李军,刘磊,齐勇,郑旭,张超,卜平。Sirt3通过抑制GTSP1/JNK/自噬途径促进舒尼替尼诱导的心脏毒性的体内外敏感性。中华毒物杂志,2019;93(11):3249-60。
朱军,张军,向东,张忠,张磊,吴敏,朱生,张荣,韩伟。重组人白细胞介素-1受体拮抗剂对小鼠急性阿霉素心脏毒性的保护作用。中国药理学杂志,2010;32(2):357 - 357。
Lamkanfi M, Dixit VM。回想起来:炎性体15岁了。大自然。2017;548(7669):534 - 5。
郭宏,Callaway JB, Ting JP。炎性小体:作用机制、在疾病中的作用和治疗。中华医学杂志,2015;21(7):677-87。
何勇,贺华,Nunez G. NLRP3炎性小体激活的机制及调控。生物化学进展,2016;41(12):1012-21。
何文涛,万华,胡林,陈鹏,王鑫,黄铮,杨振华,钟春青,韩杰。Gasdermin D是焦亡的执行者,是白细胞介素-1 β分泌所必需的。生物医学进展,2015;25(12):1285-98。
李建军,李建军,李建军,等。半胱天冬酶的研究进展[j]。生物化学学报,2002;10(2):417 - 426。
王晓明,王晓明。炎性小体依赖性细胞因子在肿瘤发生中的作用。生物医学进展,2019;20(6):e47575。
阮静。气皮蛋白家族驱动热腐细胞死亡的结构分析。中国生物医学工程学报,2019;32(2):591 - 591。
王军,姚军,刘勇,黄磊。靶向气皮蛋白D治疗缺血性脑卒中的策略。中国生物医学工程学报(英文版);2009;33(1):481 - 481。
胡他WT,陈X L,李J,方Y,王X,徐X, Z,黄K,汉族J . Pyroptosis是由非选择性gasdermin-D孔隙及其形态不同于MLKL channel-mediated necroptosis。生物医学工程学报,2016;26(9):1007-20。
石静,赵燕,王凯,石晓,王燕,黄海,庄燕,蔡涛,王峰,邵峰。炎性半胱天冬酶裂解GSDMD决定热亡细胞死亡。大自然。2015;526(7575):660 - 5。
单超,苗生,刘超,张斌,赵伟,王辉,杨伟,查俊,赵荣,肖鹏,等。致病性大肠杆菌高致病性岛(HPI)诱导云南沙巴猪巨噬细胞热噬相关因子的研究生物医学工程学报,2011;17(1):114。
贾勇,李东,于健,姜伟,廖晓,赵强。糖尿病心肌病治疗焦亡的研究进展。前沿心血管医学,2022;9:985020。
王鑫,李鑫,刘森,Brickell AN,张健,吴铮,周生,丁铮。PCSK9通过mtDNA损伤调控慢性心肌缺血的焦亡。中国生物医学工程杂志。2010;31(6):366。
顾军,黄伟,张伟,赵涛,高超,甘伟,饶明,陈强,郭明,徐勇,等。丁酸钠通过抑制焦亡减轻高糖诱导的肾小球内皮细胞损伤。国际免疫学杂志,2019;75:105832。
Al- taee H, Azimullah S, Meeran MFN, Alaraj Almheiri MK, Al Jasmi RA, Tariq S, Ab Khan M, adeate E, Ojha S. -石竹烯,一种膳食大麻素减轻氧化应激、炎症、细胞凋亡和防止心肌结构改变的大鼠抗阿霉素急性心脏毒性的体外和体内研究。中华药理学杂志,2019;38(5):744 - 744。
Quagliariello V, Coppola C, Mita DG, Piscopo G, Iaffaioli RV, Botti G, Maurea N.低剂量双酚A具有促炎和促氧化作用,刺激脂质过氧化,增加阿霉素对心肌细胞的心脏毒性。环境毒理学杂志,2019;69:1-8。
王莹,张辉,陈强,焦飞,石晨,裴敏,吕健,张辉,王玲,龚铮。tnf - α /HMGB1炎症信号通路在肝功能衰竭和急性肾损伤中对焦亡的调控。中国生物医学工程学报,2014;33(6):829 - 829。
张建军,张建军,王勇,等。toll样受体刺激心肌细胞收缩性和nf - κ b依赖性炎症反应的研究。中华心血管病杂志,2006;32(3):391 - 391。
吴志强,张志强。模式识别受体与炎症的关系。细胞。2010;140(6):805 - 20。
李建军,李建军,李建军,等。炎性小体的研究进展。自然。2012;481(7381):278 - 86。
华莱士KB。阿霉素诱导的心脏线粒体病。中华毒物学杂志,2003;33(3):105 - 105。
杨建军,刘建军,刘建军,刘建军,刘建军。阿斯帕冬苷对阿霉素诱导的心肌细胞氧化应激的影响。体外毒物。2019;55:134-9。
曾超,段峰,胡军,罗波,黄波,娄鑫,孙鑫,李辉,张鑫,尹生,等。NLRP3炎症小体介导的焦亡参与非缺血性扩张型心肌病的发病机制。中国生物医学工程学报,2020;34(4):1093 - 1093。
马文伟,王杰,Dhandapani KM, Brann DW。NADPH氧化酶2调控外伤性脑损伤后NLRP3炎性体的激活。中国生物医学工程学报,2017;37(2):557 - 557。
王勇,陈华,陈强,焦方忠,张文博,龚志军。CAY10683通过LPS/TLR4/MyD88通路对急性肝衰竭肠黏膜屏障的保护机制中西医结合学报。2018;18(2):591 - 591。
林海,金东,李世杰。toll样受体2介导周围神经损伤诱导的NADPH氧化酶2在脊髓小胶质细胞中的表达。生物化学学报,2013;28(11):772 - 779。
罗鑫,鲍鑫,翁鑫,白鑫,冯勇,黄娟,刘松,贾红,余波。槲皮素通过TLR2/Myd88/NF-kappaB和ROS/AMPK通路对巨噬细胞热亡的保护作用。生命科学学报。2022;29:120064。
吴春英,金英华,崔金东,李海军,Hahm KB, Chung MH. 8-羟基脱氧鸟苷:氧化应激的生物标志物,对氧化应激相关胃肠道疾病的治疗作用。中华胃肠病杂志,2012;18(4):302-8。
Pepping JK, Freeman LR, Gupta S, Keller JN, Bruce-Keller AJ。NOX2缺乏可减弱高脂饮食引起的脂肪病和脑损伤标志物。[J] .中国生物医学工程学报,2013;31(4):394 - 394。
Harishkumar R, Selvaraj CI。莲花素,一种来自莲花的生物碱,在胚胎来源的H9c2细胞中减弱阿霉素引起的毒性。体外细胞发育生物学杂志,2020;56(5):367-77。
Cardinale D, Colombo A, Bacchiani G, Tedeschi I, Meroni CA, Veglia F, Civelli M, Lamantia G, Colombo N, Curigliano G,等。蒽环类药物心脏毒性的早期发现及心衰治疗的改善。循环。2015;131(22):1981 - 8。
Von Hoff DD, Layard MW, Basa P, Davis HL Jr, Von Hoff AL, Rozencweig M, Muggia FM。阿霉素诱发充血性心力衰竭的危险因素。中华临床医学杂志。1979;21(5):791 - 797。
余雅,琼斯LW。乳腺癌治疗相关的心血管毒性及运动对策的影响。Cardio-Oncology。2016; 2:1。
Felker GM, Thompson RE, Hare JM, Hruban RH, Clemetson DE, Howard DL, Baughman KL, Kasper EK。最初不明原因心肌病患者的潜在病因和长期生存。中华医学杂志,2000;32(5):1077 - 1084。
Finet我。癌症患者和癌症幸存者心力衰竭的管理。心衰临床,2017;13(2):253-88。
McGowan JV, Chung R, Maulik A, Piotrowska I, Walker JM, yellm。蒽环类药物化疗与心脏毒性。心血管药物学报,2017;31(1):63-75。
张建军,张建军,张建军,等。乳腺癌治疗诱导的心脏毒性的研究进展。心血管医学杂志,2020;30(1):22-8。
蒂姆·凯恩,泰勒·DJ。AMPK活化在阿霉素诱导的心脏毒性中的心脏保护作用。心血管内科杂志,2020;34(2):255-69。
苏德嘉,伍立杰,王杰,王志强,王志强,王志强。阿霉素和柔红霉素通过激活NLRP3炎性体诱导白介素-1 β的加工和释放。中华肿瘤杂志,2011;11(12):1008-16。
郑鑫,钟涛,马勇,万鑫,秦安,姚波,邹华,宋勇,尹东。Bnip3通过caspase-3/GSDME介导阿霉素诱导的心肌细胞焦亡。生命科学学报,2020;42(2):117186。
孟玲,林海,张健,林宁,孙志,高峰,罗慧,倪婷,罗伟,迟杰,等。阿霉素通过tincr介导的NLR家族pyrin结构域3的转录后稳定诱导心肌细胞焦亡。中华生物医学杂志,2019;36(1):1 - 6。
孙志,陆伟,林宁,林慧,张健,倪婷,孟玲,张超,郭辉。二氢杨梅素通过激活SIRT1抑制NLRP3炎性体减轻阿霉素诱导的心脏毒性。中国生物医学工程学报(英文版);2009;35(5):563 - 568。
王建平,王建平。大鼠心脏肌细胞系克隆特性的研究。中国生物医学工程学报,2006;22(2):368 - 368。
刘建军,刘建军,刘建军,等。阿霉素诱导的心肌细胞源性H9C2细胞毒性和dexrazoxane细胞保护作用的新见解:体外(1)H-NMR代谢组学的贡献中华医学杂志,2020;11:79。
谭鑫,王德宝,卢鑫,魏辉,朱锐,朱世生,姜辉,杨志军。阿霉素诱导H9c2心肌细胞凋亡:真核翻译起始因子5A过表达的作用中国生物医学工程学报,2010;33(10):1666-72。
Moreira AC, Branco AF, Sampaio SF, Cunha-Oliveira T, Martins TR, Holy J, Oliveira PJ, Sardao VA.线粒体凋亡诱导因子参与阿霉素诱导的H9c2心肌细胞毒性。生物化学学报,2014;42(12):2468-78。
楼莹,王铮,徐艳,周鹏,曹军,李艳,陈艳,孙军,傅磊。白藜芦醇通过抑制内质网应激和激活Sirt1通路来预防阿霉素诱导的H9c2细胞心脏毒性。中华医学杂志,2015;36(3):873-80。
马军,王勇,郑东,魏敏,徐宏,彭涛。Rac1信号通过活性氧依赖和非依赖途径介导阿霉素诱导的心脏毒性。中华心血管病杂志,2013;37(1):77-87。
杜思杰,张建军,张建军。利钠肽对心力衰竭诊断准确性的系统综述。中华医学杂志,2004;16(6):368 - 368。
Feola M, Garrone O, Occelli M, Francini A, Biggi A, Visconti G, albriile F, Bobbio M, Merlano M.蒽环类药物化疗对乳腺癌左室射血分数、肌钙蛋白I和脑钠肽的影响。中华心血管病杂志,2011;32(2):391 - 391。
张晓明,张晓明,张晓明,张晓明,张晓明,等。纵向b型利钠肽测定和放射性核素脑室造影的研究进展。生物学报,2005;19(3):567-76。
argn M, Uzum K, Sonmez MF, Ozyurt A, Derya K, Cilenk KT, Unalmis S, Pamukcu O, Baykan A, Narin F,等。二甲双胍对大鼠阿霉素心脏毒性的保护作用。中华心血管病杂志,2016;16(4):234-41。
Kesik V, Yuksel R, Yigit N, Saldir M, Karabacak E, Erdem G, Babacan O, Gulgun M, Korkmazer N, Bayrak Z.臭氧改善阿霉素诱导皮肤坏死的动物模型。中华创伤杂志,2016;15(3):248-54。
Koh E, Nakamura T, Takahashi H.肌钙蛋白-T和脑利钠肽在阿霉素诱导的大鼠心肌病中的预测作用。中国生物医学工程学报,2004;68(2):163 - 167。
Skovgaard D, Hasbak P, Kjaer A. BNP预测化疗相关心脏毒性和死亡:与门控平衡放射性核素脑室造影的比较。科学通报,2014;9(5):96736。
Charron F, Tsimiklis G, Arcand M, Robitaille L, Liang Q, Molkentin JD, Meloche S, Nemer M.组织特异性gtp酶RhoA的转录效应因子。基因工程学报,2001;15(20):2702-19。
王晓明,王晓明,王晓明,等。压力过载对血管内皮素-1结合活性的影响。循环。2001;103(5):730 - 5。
Morimoto T, Hasegawa K, Wada H, Kakita T, Kaburagi S, Yanazume T, Sasayama S. Calcineurin-GATA4通路参与心肌细胞β -肾上腺素能激动剂反应性内皮素-1的转录。中国生物医学工程学报,2001;27(3):391 - 391。
李建军,李建军,李建军,等。GATA-4基因在心肌细胞凋亡中的作用。美国国家科学促进会。2004; 101(18): 6975 - 80。
甘草根提取物通过减轻氧化应激和稳定H9c2心肌细胞的心脏健康来减轻阿霉素诱导的心脏毒性。[J] .中国生物医学工程学报,2010;28(1):444 - 444。
姜颖,张强。梓醇通过激活ppar - γ改善阿霉素诱导的H9C2细胞炎症和氧化应激。中国生物医学工程学报,2016;20(2):391 - 391。
免疫疗法:炒作与希望。中华医学杂志,2018;19(7):845。
张建军,张建军,张建军,张建军,等。PD-1/PD-L1信号通路在肿瘤免疫治疗中的作用。中国生物医学工程学报,2019;34(5):563 - 567。
张建平,张建平,张建平,等。抗pd -1和抗ctla -4在肿瘤治疗中的作用机制、疗效和局限性。中华医学杂志,2018;8:86。
引用本文:周云伟,朱玉娟,王明明,谢燕,陈云燕,张婷,夏峰,丁志勇,刘建勇。免疫检查点抑制剂相关心脏毒性:机制、诊断和治疗的新进展。前沿医药,2019;10:1350。
Quagliariello V, De Laurentiis M, Cocco S, Rea G, Bonelli A, Caronna A, Lombari MC, Conforti G, Berretta M, Botti G,等。NLRP3作为依匹单抗在雌激素反应性和三阴性乳腺癌细胞存在高血糖时诱导的心脏毒性的推定标记物中国生物医学工程学报,2011;31(2):444 - 444。
Darr JA,张军,Makwana NM,翁鑫。连续水热合成无机纳米颗粒:应用及未来发展方向。化学工程学报,2017,37(7):1225 - 1238。
石磊,刘莹,李敏,罗铮。铁下垂在肿瘤免疫景观中的新作用:从危险信号到抗肿瘤免疫。[j] .中国科学d辑。2022;28(3):366 - 366。
科学通报,2020;6(18):888 - 888。
致谢
不适用。
资金
本研究由韩国国家研究基金会(NRF)拨款(2020R1A2C200652811)(资助给khs)和韩国环境产业技术研究所(KEITI)通过韩国环境部(MOE)(2021003310006)(资助给khs)资助的环境疾病预防和管理计划核心技术开发项目资助。
作者信息
作者及单位
贡献
概念化,k.h.y., j.w.l.和K.H.S.;方法,S.H S.-H.K M.-H.C。,J.W.L, K.H.S.;验证,K.H.Y, J.W.L和k.h.s;调查,S.H S.-H.K J.W.L。,和K.H.S.;数据管理,S.H。,S.-H.K J.W.L, K.H.S.;写作-原稿准备,s.h., s.h.k.和K.H.S.;写作-评论和编辑,m.h.c., j.w.l.和K.H.S.;可视化,j.w.l.和K.H.S.;监督,J.W.L.和K.H.S.;项目管理,J.W.L.和K.H.S.; funding acquisition, K.H.S. All authors have read and agreed to the published version of the manuscript.
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者声明无利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。
补充信息
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
Hwang, S., Kim, SH., Yoo, K.H.et al。外源性8-羟基脱氧鸟苷通过减少H9c2心肌细胞的焦亡来减弱阿霉素诱导的心脏毒性。BMC Mol与细胞生物学23, 55(2022)。https://doi.org/10.1186/s12860-022-00454-1
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12860-022-00454-1
关键字
- 外生8-hydroxydeoxyguanosine
- 阿霉素
- 毒性
- Pyroptosis