摘要
宫颈癌是世界范围内威胁妇女身心健康的重要恶性肿瘤。作为一种新型钙活化氯离子通道蛋白,钙活化氯离子通道(CLCA2)在肿瘤发生和发展中起重要作用。但其在宫颈癌中的作用和确切调控机制尚不清楚。在研究中,我们发现CLCA2在宫颈癌细胞中显著降低,且CLCA2抑制宫颈癌细胞的增殖、迁移和侵袭,促进宫颈癌细胞的凋亡CLCA2抑制上皮间质转化(EMT)p38 / JNK / ERK途径。体内实验结果与体外实验结果一致。总之,过度表达CLCA2在体内和体外均可抑制宫颈癌的进展。这可能为……提供理论依据CLCA2作为宫颈癌临床诊断和预后的新指标或作为药物治疗的潜在靶点。
介绍
宫颈癌是中国女性最常见的恶性肿瘤,也是世界各国女性死亡的主要原因之一。近年来,通过早期筛查和疫苗预防,宫颈癌的发病率得到了控制,但治愈率有所下降[1]。耐药、侵袭转移、术后复发是晚期宫颈癌患者常见的死亡原因[2]。也是影响患者治疗和临床预后的重要因素。虽然晚期宫颈癌患者不能完全治愈,但有许多治疗方法可以提高患者的寿命和生活质量。随着分子生物学技术的发展和医学领域的应用,开展宫颈癌发病机制的分子生物学研究,为临床防治提供实验和理论依据变得越来越重要[3.,4,5]。钙活化氯离子通道(CLCA)是其中一个氯离子通道[6]。可广泛表达于各种组织和细胞中,参与感觉传导、经上皮离子和体液分泌、心肌细胞和神经细胞的兴奋、平滑肌细胞的收缩等多种生理过程[7]。CLCA家族是一种新型的钙活化氯离子通道家族,主要包括CLCA1, CLCA2和CLCA4。该基因位于1号染色体的短臂位点(1p22-31)。的上游片段CLCA2基因为5 ' - agacaatccctacacccttcaa -3 ',下游片段为5 ' - tgtcggtagaacaccttgtacc -3 ',其转录片段大小为233bp。在已知的家庭成员中,CLCA2和CLCA4有相似的结构。它们是典型的I型跨膜蛋白,大小约125 kDa,含有约900个氨基酸。在氨基端有对称的半胱氨酸基序CX12CX4 CX4CX12C。CLCA跨膜蛋白可快速裂解成90和35 kDa的亚基,并通过亚基- β4的半保守序列与整合素相互作用,促进肿瘤早期血行转移和生长。近年来,CLCA2已被发现与多种肿瘤密切相关[8]。CLCA2已被证实与乳腺癌的侵袭转移密切相关。它通常被认为在乳腺癌中被下调,可以诱导乳腺癌细胞向正常细胞分化。敲出CLCA2基因会诱发EMT,增加癌细胞的侵袭性。然而,到目前为止,CLCA2在宫颈癌中的调控作用尚未明确。我们的团队先前通过免疫组化研究发现,CLCA2在人正常宫颈组织、低级别鳞状上皮内病变(LSIL)、高级别鳞状上皮内病变(HSIL)和宫颈鳞状细胞癌组织中的表达存在显著差异(P< 0.05),推测CLCA2可能参与了宫颈癌的发生发展。
在本研究中,我们首先检测到了CLCA2在宫颈癌细胞系siha,hela和C33A中稳定过表达后CLCA2通过慢病毒载体检测细胞增殖、凋亡、迁移和侵袭的变化,检测EMT相关标志物和相关信号通路的变化。然后进行裸鼠成瘤实验,在体外验证结果。本研究初步探讨CLCA2以期为进一步的临床应用提供一定的依据。
材料与方法
细胞培养
C33A(CL-0045)、SiHa (CL-0210)和HeLa (CL-0101)细胞均来自Procell。H8细胞来源于清启(上海)生物技术开发有限公司。将它们从液氮中取出,并迅速放入37°C水浴中。溶解后,将细胞转移到含有5ml培养基的离心管中。离心收集细胞,室温下1000rpm离心5min,丢弃上清;将细胞悬浮在含10%胎牛血清的完全培养基中,接种于培养皿中,轻轻吹匀,在37℃、5% CO2饱和湿度下培养。
中存在
实时荧光定量PCR是一种在DNA扩增反应中,利用荧光化学物质测定每次聚合酶链反应(PCR)循环后产物总量的方法。一种对内参或外参检测样品中特定DNA序列进行定量分析的方法。根据制造商的说明,使用TRIzol试剂(Invitrogen, Carlsbad, CA, USA)从细胞中提取总RNA。为了检测mRNA,使用RevertAid第一链cDNA合成试剂盒(Thermo Fisher Scientific Inc., Waltham, MA, USA)合成第一链cDNA。所有cDNA样本单独配置用于实时定量PCR反应系统。系统配置如下:SYBR Green 10 uL,上游引物1 uL,下游引物1 uL, dNTP 1 uL, Taq聚合酶2 uL,待测样品cDNA 5 uL, ddH2O 30 uL,总体积50 uL,轻弹管底混合,6000 rpm短暂离心。将制备好的PCR反应液置于real - time PCR仪上进行PCR扩增反应。反应条件为:93℃预变性2分钟,93℃预变性1分钟,55℃预变性1分钟,72℃预变性1分钟,最后72℃预变性7分钟,共40次循环。使用2-ΔΔCt自动计算相对基因表达量。引物序列见表1。
Westernblot
用细胞裂解液裂解贴壁细胞、悬浮细胞或组织样品。然后测定每个蛋白质样品的蛋白质浓度。收集的蛋白样品中加入适量的浓缩SDS-PAGE蛋白上样缓冲液。一般建议使用上凝胶时使用低压恒压电泳,溴酚蓝进入下凝胶时使用高压恒压电泳。一旦目标蛋白被正确地分解,电泳就会停止。使用Bio-Rad的标准湿转移装置,转移电流设定为300-400 mA,转移时间为30-60分钟。使用Bio-Rad的标准湿式转移装置,转移电流可设置为300-400 mA,转移时间为30-60分钟。加入Western阻断液,在4°C下阻断过夜。磷酸化蛋白用1% BSA封闭。然后与小鼠抗人药在4℃下孵育过夜钙粘蛋白(武汉三营1:5000),N-cadherin(武汉三营1:5000),扭(1:1000, Abcam, Cambridge, MA, USA)和兔子反人类GAPDH(1:1000, Cell Signaling Technology, Danvers, MA, USA),蜗牛(1:1000,美国麻萨诸塞州沃本比奥斯)p-p38(1:1000, Affinity Biosciences, OH, USA),p-JNK(1:1000, Cell Signaling Technology, Danvers, MA, USA),p-ERK(1:1000, Affinity Biosciences, OH, USA),p38(1:1000, Cell Signaling Technology, Danvers, MA, USA),物(1:1000, Cell Signaling Technology, Danvers, MA, USA),的兵(1:1000, Cell Signaling Technology, Danvers, MA, USA)。TBST洗涤后,用马萝卜过氧化物酶(HRP)偶联的山羊抗兔或抗小鼠IgG(1:2000,武汉波士德)孵育。使用ECL试剂(Pierce, Rockford, IL, USA)和化学发光成像系统(Bio-Rad, Richmond, CA, USA)对印迹进行可视化。
慢病毒感染实验
人载体pLVX-mCMV-ZsGreen-IRES-Puro来源于武汉维诺瑟生物科技有限公司。人类CLCA2以质粒CLCA2为模板,进行PCR扩增。在引物两端分别引入EcoRI和BamHI位点。质粒pLVX-mCMV-ZsGreen-IRES-Puro大片段与人的联系CLCA2片段,结扎反应在22℃下进行3小时。需要10 ul结扎产品和100 ul JM109主管细菌,把它们混合在冰浴30分钟,热休克42°C的60年代,立即把它们放在冰2分钟,加入400 ul磅中预热至室温,文化在恒定的温度在37°C瓶1 h,离心机在4000转3分钟,丢弃400 ul文化上层清液,把剩余的100 ul和吸管,并均匀地涂在磅板包含100μg / ml氨苄青霉素抗性,细胞在37℃培养箱中倒置培养过夜。选择3个单菌落,接种于含5 ml、100 μg/ml耐氨苄西林LB培养基中。用EcoRI + BamHI酶切质粒,选择正确的克隆进行测序。改变细胞培养基,加入病毒感染细胞。混合后,细胞继续培养。8-12小时后观察细胞,用新鲜培养基替换。感染3-4天后观察荧光表达,中途更换培养基维持细胞活性。通过观察细胞感染效果,确定目标细胞的感染条件和参数。
菌落形成试验
SiHa、HeLa和C33A用DMEM制备单细胞悬液,浓度为2 × 105将细胞均匀接种于6孔板;在37℃和5% CO的条件下2饱和湿度下,细胞培养48 h;根据慢病毒滴度,加入慢病毒作用细胞72小时。慢病毒处理后,用0.25%胰蛋白酶消化细胞,吹成单细胞。细胞悬浮在培养基中待机;将细胞悬液稀释后,接种于密度为300个细胞的6孔板;轻轻旋转,使细胞均匀分散;将培养皿置于37℃5% CO2培养箱中,培养2-3周;克隆出现后,丢弃上清,PBS洗涤2次,70%乙醇固定15min;弃去固定液,加入适量结晶紫染色液10- 30min;用PBS清洁并计数。
Transwell化验
正常细胞,NC(阴性对照)和-exCLCA2慢病毒处理后的细胞加入3ml PBS清洗细胞,0.25%胰蛋白酶消化收集,1000 rpm离心5min,取上清,PBS清洗残余血清2次;将细胞重悬于无血清DMEM培养基中,用细胞计数板计数。在无血清DMEM培养基中,将细胞浓度稀释至2.5 × 105个/mL。在Transwell室中加入200uL细胞悬液,在5% CO2培养箱中37℃培养;取出Transwell,用PBS仔细清洗室,用70%冰乙醇溶液固定细胞1 h;细胞用0.5%结晶紫染料染色,室温下放置20分钟,PBS清洗,用干净棉球擦拭上腔一侧不运动的细胞,显微镜下观察拍照。
流式细胞术
处理后的细胞用PBS洗涤2次,1000 rpm离心5 min,按照AnnexinV-APC/7-AAD细胞凋亡检测试剂盒(科基生物,南京,CN)的操作说明进行流式细胞术检测。加入500 μL结合缓冲液,重悬细胞;加入5 μL AnnexinV-APC,拌匀,加入5 μL 7-AAD,拌匀;室温光保护反应5-15 min(同时设置阴性对照,即正常细胞不添加annexin - apc和7-AAD)。最后采用流式细胞术检测。
免疫荧光
在培养板中,用PBS浸泡玻片3次,每次3分钟;4%多聚甲醛固定15 min, PBS每次浸泡3 min;0.5% Triton X-100 (PBS配制)室温下可透性20分钟(E-cad和n-cad可透性5分钟);载玻片在PBS中浸泡3次,每次3分钟。PBS用吸水纸吸干。将正常山羊血清滴入载玻片,室温密封30分钟;每张载玻片滴入足够稀释的一抗,放入湿盒,在4°C下孵育过夜。加荧光二抗:用PBST浸泡3次,每次3分钟。用吸湿纸吸去载玻片上多余的液体后,滴下稀释后的荧光二抗,在37℃湿箱中孵育1小时。用PBST浸泡切片3次,每次3分钟; DAPI was dripped and incubated in dark for 5 minutes. The specimens were stained with nucleus and PBST for 5 minutes. The redundant DAPI was washed off 4 times; Water absorbent paper was used to suck up the liquid on the climbing sheet, and the sealing liquid containing anti fluorescence quenching agent was used to seal the sheet, and then the images were observed and collected under the fluorescence microscope.
动物研究
SPF雌性裸鼠购自常州洞穴实验动物有限公司,体重18-21 g。动物分为正常组、对照组和过表达组,每组3只裸鼠,注射C33A细胞体积为5 × 10个[6]。用左手轻轻拧右腋下皮肤,右手握住1毫升注射器平行于皮肤,将针头插入皮下1毫升,从左向右摇动针头,没有阻力,看到针头在皮下移动,说明针头在皮下。此时将100ul肿瘤细胞注射到皮下,拔针后轻轻按压针眼位置几秒钟,防止细胞流出。28天后,腹腔注射戊巴比妥钠62.5 mg/kg麻醉后,脱位处死动物,统一送甘肃省危重症中心集中救治,一半肿瘤组织固定,一半冷冻,留待随访研究。
TUNEL法检测细胞凋亡
石蜡包埋组织切片放入染色缸中,二甲苯洗涤2次,每次5分钟。每次三分钟,无水乙醇,洗涤两次。分别用95%和75%乙醇洗涤3分钟。用PBS洗涤5分钟。加入蛋白酶K溶液,在37℃反应15min,去除组织蛋白。PBS每次5分钟,洗涤3次。含3% H的PBS2O2加入染色缸,在室温下放置10分钟。用PBS洗涤3次,每次5分钟。用滤纸仔细除去组织切片周围多余的液体后,快速加入2滴TdT酶缓冲液,室温放置1-5分钟。用滤纸仔细吸去切片周围多余的液体后,加入54 uL TdT酶反应液涂在切片上。将切片放入染色罐中,加入已预热至37℃的洗涤和停止反应缓冲液,在37℃下保持30 min,每隔10 min轻轻提起并放下玻片,使液体轻微搅拌。切片用PBS洗涤3次,每次5分钟。将两滴链霉亲和素HRP工作液直接加入切片中,置于湿盒中,在暗处反应30分钟。用PBS洗涤3次,每次5分钟。将新制备的0.05% DAB溶液加入组织切片中,室温孵育30s-5min。用蒸馏水洗4次,前3次每次洗1分钟,最后一次洗5分钟。 After 10 minutes of re staining with hematoxylin at room temperature, the slide was lifted up and put down in distilled water for 20 times, and then left standing for 30s. They were soaked with 70, 85, 95% absolute alcohol for 5 minutes. Xylene was dehydrated 2 min each time for 3 times. Then the film was sealed, dried and photographed under the microscope.
统计分析
所有实验至少重复3次,每个实验独立进行至少3次。使用GraphPad Prism 5.0进行图像展示。数据以均数±SE表示,采用SPSS 21.0软件(Chicago, IL, USA)进行分析。统计学差异采用卡方检验或双尾t检验。差异被认为是显著的P< 0.05(*)或高度显著P< 0.001(**)。
结果
表达减少CLCA2子宫颈癌细胞
我们首先检测了CLCA2在正常宫颈细胞系H8和宫颈癌细胞系SiHa、HeLa和C33A中表达。结果表明,mRNA(图2)的表达1A)和蛋白表达(图2)。1B)的CLCA2在宫颈癌细胞中,尤其是在C33A细胞系中。
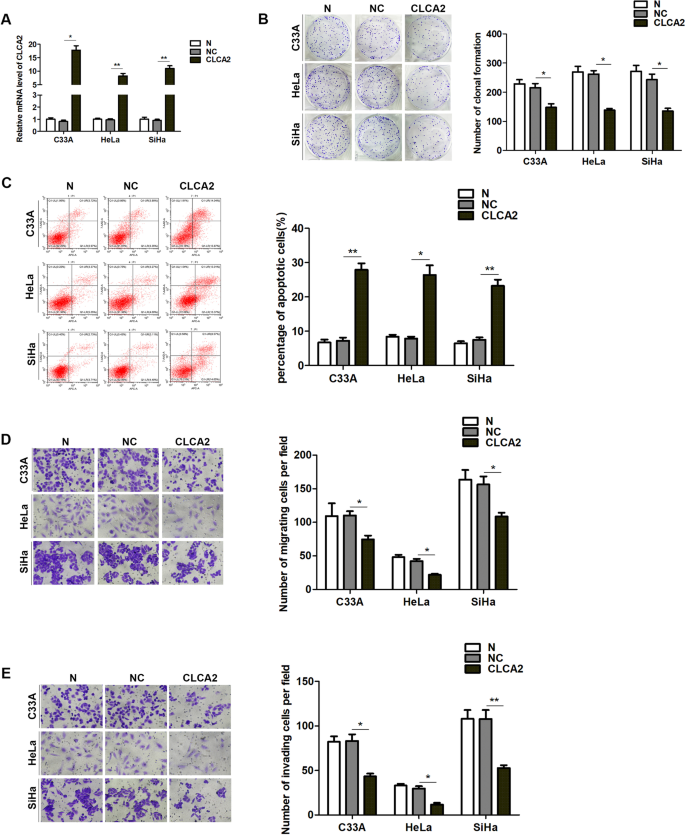
过度的CLCA2抑制宫颈癌细胞增殖、迁移、侵袭,促进宫颈癌细胞凋亡
在过表达CLCA2在宫颈癌细胞中(图。2A),检测细胞增殖、迁移、侵袭和凋亡。结果表明CLCA2抑制了克隆的形成(图2)。2B),迁移(图2)。2D)和侵袭(图2)。2E),并促进细胞凋亡(图2)。2C) SiHa, HeLa和C33A细胞系。
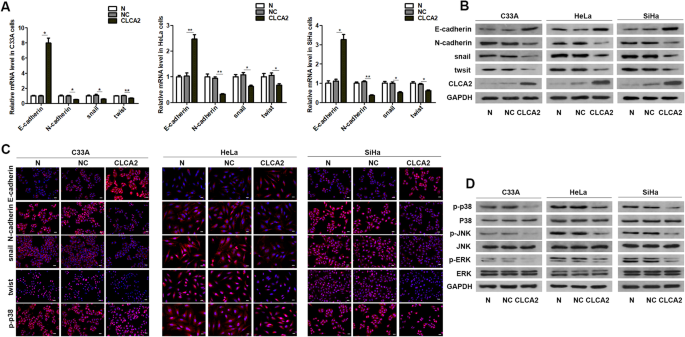
CLCA2抑制子宫颈癌细胞的EMT
然后,我们检测过表达后EMT相关标志物的变化CLCA2在子宫颈癌细胞中。我们发现过度表达CLCA2上调mRNA和蛋白的表达钙粘蛋白下调的表达N-cadherin(无花果。3.A、B)。蜗牛和扭是EMT中重要的转录因子。结果表明CLCA2的表达明显降低蜗牛和扭(无花果。3.A, B).免疫荧光结果显示CLCA2可能会增加钙粘蛋白并减少N-cadherin,蜗牛,扭,p-p38(无花果。3.C)CLCA2抑制子宫颈癌细胞的EMT
过度的CLCA2抑制p38 / JNK / ERK通路
之前的研究表明CLCA2可以调节p38 / JNK / ERK信号通路[9]。我们检验了……的效果CLCA2在p38 / JNK / ERK途径,结果显示CLCA2抑制了p-p38, p-JNK, p-ERK的表达水平p38、物和的兵不变(图2)3.D).这些结果显示过度表达CLCA2抑制p38 / JNK / ERK途径。
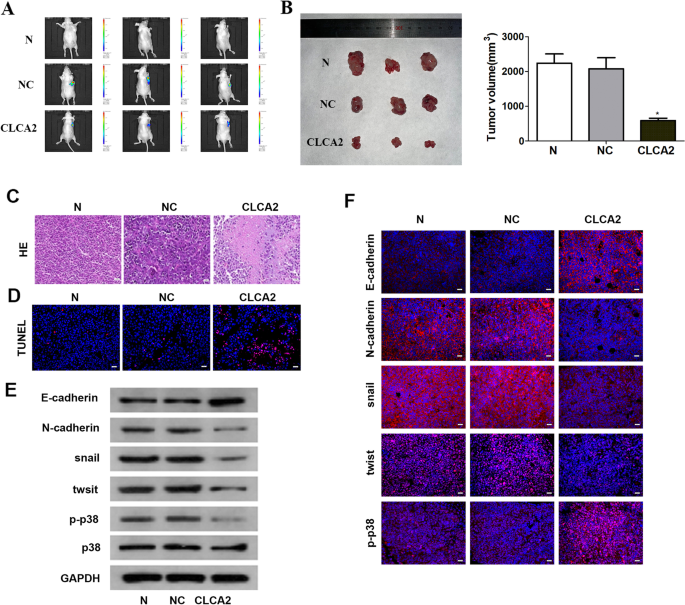
CLCA2在体内抑制宫颈癌生长和EMT
进一步验证的效果CLCA2在子宫颈癌细胞体内生长的基础上,建立了C33A细胞致瘤模型。与之前的观察结果一致,CLCA2过表达导致肿瘤体积明显减小(图2)。4A, B)。在凋亡方面,肿瘤中TUNEL阳性细胞较多CLCA2过表达处理比NC处理(图2)。4C, D).进一步调查是否CLCA2能在体内将C33A细胞的间充质性状转化为上皮表型,对皮下肿瘤进行固定,免疫荧光分析证实e -钙粘蛋白,n -钙粘蛋白,蜗牛,扭曲和p-p38,皮下肿瘤CLCA2表达小鼠表现出明显高水平的钙粘蛋白,和低水平的n -钙粘蛋白,蜗牛,扭曲。和CLCA2是否也能抑制核易位p-p38(无花果。4F)。westernblot结果与免疫荧光结果一致(图2)。4E).这些体内研究结果与细胞模型中观察到的体外变化相吻合,表明CLCA2抑制子宫颈癌生长和EMT。
讨论
宫颈癌是世界范围内威胁妇女身心健康的重要恶性肿瘤,死亡率高[10]。因此,探索宫颈癌细胞侵袭转移的机制,对治疗宫颈癌、改善宫颈癌患者预后具有十分重要的意义。
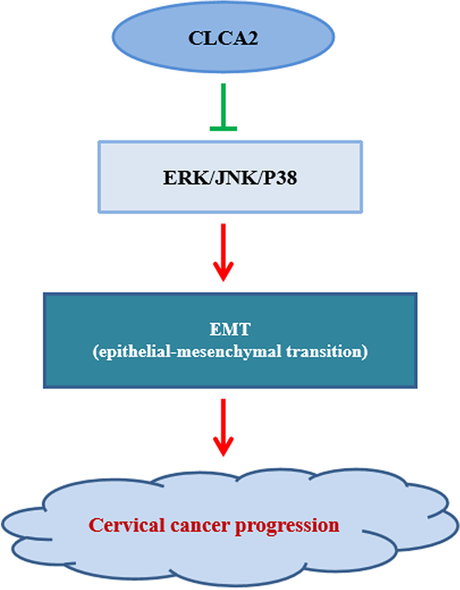
目前对离子通道在肿瘤发生发展中的作用知之甚少,特别是钙活化的氯离子通道蛋白在肿瘤生长调节、细胞凋亡、细胞侵袭或转移中的作用。CLCA2是钙活化氯离子通道家族的一员[11]。据报道,NDRG1基因可能通过其下游作用在宫颈癌和卵巢癌的侵袭转移中发挥重要作用CLCA2基因(12]。然而,监管的作用CLCA2宫颈癌还没有被研究过。在我们的研究中,我们发现了CLCA2在宫颈癌细胞中明显减少,且过表达CLCA2抑制宫颈癌细胞的增殖、迁移和侵袭,促进宫颈癌细胞凋亡(图2)。5).
目前普遍认为上皮间充质转化(epithelial mesenchymal transition, EMT)发生在上皮细胞源性恶性肿瘤中。一般认为EMT的中心环节是上皮型E-cadherin表达的减少和间质型N-cadherin表达的增加[13,14,15]。CLCA2阻断了许多癌症的EMT [16,17,18,19]。在这项研究中,我们发现CLCA2的表达上调钙粘蛋白下调的表达N-cadherin,表明过表达CLCA2基因可以阻断宫颈癌细胞上皮间充质转化(EMT)。
的激活的兵信号通路可以促进细胞增殖,同时激活物信号通路与细胞凋亡密切相关,并参与许多疾病的病理生理变化[20.,21,22]。它已经证实CLCA2能通过什么方式调节细胞功能p38 / JNK / ERK通路(9],我们的研究结果也表明了这一点CLCA2在宫颈癌细胞中也能调控该通路,但具体机制尚需进一步阐明。
作为一种新型的钙活化氯离子通道蛋白,CLCA2在肿瘤发生和发展中起重要作用。大多数研究表明,存在异常的表达水平和相关的信号通路CLCA2在恶性肿瘤中,与肿瘤侵袭转移密切相关[7,23,24],CLCA2在子宫颈癌中被下调[25,26],但其在宫颈癌中的作用和确切调控机制尚不清楚。我们的结果证实了CLCA2在宫颈癌细胞中显著降低。过度的CLCA2在体内和体外均可抑制宫颈癌的进展。这可能为……提供理论依据CLCA2作为宫颈癌临床诊断和预后的新指标或作为药物治疗的潜在靶点。
数据和材料的可用性
本研究过程中产生或分析的所有数据都包含在这篇发表的文章中。
缩写
- CLCA2:
-
钙活化氯离子通道2
- EMT:
-
Epithelial-mesenchymal过渡
- 物:
-
c-Jun n末端激酶
- 兵:
-
细胞外调节蛋白激酶
参考文献
王晓明,王晓明,王晓明,等。宫颈癌的临床研究进展[J]。中华临床医学杂志,2012;32(2):379 - 379。
Wenzel HHB, Smolders RGV, Beltman JJ,等。早期宫颈癌经腹、腹腔镜根治性子宫切除术后患者的生存率分析及文献综述[J]。[J]中国癌症杂志,2020;33(3):14 - 21。
甄森,卢杰,刘永华,等。PD1阻断与crispr - cas9介导的HPV敲除合理联合对宫颈癌的协同抗肿瘤作用[J]。癌症基因杂志,2020;27(3):168-78。
田玉辉,李宏伟,李玉玲,等。e7 -树突状细胞免疫治疗联合人钠/碘同调体放射碘基因治疗在小鼠宫颈癌模型中的应用[J]。放射医学,2011;26(6):671-9。
肖军,周军,梁磊,等。局部晚期宫颈癌新辅助化疗联合基因治疗的敏感性[J]。J BUON。2019; 24(3): 967 - 74。
Cuppoletti J, Malinowska DH。Ca2+−激活的cl-通道:关注“人肺、气管和乳腺hCLCA2的分子克隆和跨膜结构”[J]。中国生物医学工程学报(英文版);1999;31(6):559 - 559。
夏尔玛A, Elble RC。E-cadherin在肿瘤组织中的应用[J]。共同参与。2020;8(6):169。
Haworth AS, Brackenbury WJ。多分子离子通道辅助亚基在肿瘤中的应用[J]。细胞钙。2019;80:125-40。
Seltmann K, Meyer M, Sulcova J,等。高渗胁迫对植物生长的影响[J]。科学通报,2018;10(4):888 - 888。
小W Jr, Bacon MA, Bajaj A等。宫颈癌的流行病学分析[J]。癌症。2017;123(13):2404 - 12所示。
王晓明,王晓明,王晓明,等。p53家族的靶基因CLCA2负调控肿瘤细胞的迁移和侵袭[J]。中华肿瘤杂志,2012;13(14):1512-21。
赵刚,陈杰,邓勇,等。ndrg1基因在卵巢癌中的表达及表达[J]。生物化学学报,2011;32(1):559 - 559。
张建军,张建军,张建军,等。EMT与肿瘤转移的关系[J]。生物医学进展,2019;29(3):212-26。
georgakopoulou - soares I, Chartoumpekis DV, Kyriazopoulou V,等。EMT因子与肿瘤代谢途径的关系[J]。中华医学杂志,2020;10:499。
张建军,张建军,张建军,等。肿瘤转移的临床研究进展[J]。中国生物医学工程学报,2020;13(11):100845。
余宇,王丽娟,王丽娟。CLCA4基因表达对乳腺癌细胞间质转化的影响[J]。科学通报,2013;8(12):83943。
Ramena G,尹勇,余勇,等。CLCA2相互作用因子EVA1在乳腺上皮细胞分化中的作用[J]。科学通报,2016;11(3):e0147489。
强云云,李传志,孙睿,等。CLCA2通过抑制FAK/ERK信号通路抑制鼻咽癌细胞的生长和转移,并具有良好的预后作用[J]。中华肿瘤杂志,2018;37(1):34。
张建军,张建军,张建军,等。CTBP1、hdac、ZEB1、EP300和miR-196b-5p对代谢综合征前列腺癌细胞粘附和EMT的影响[J]。国际肿瘤学杂志,2018;43(4):897-906。
曹鑫,方鑫,马利文生,等。TRB3与ERK、JNK相互作用对肺腺癌细胞增殖、凋亡和迁移的影响[J]。中国生物医学工程学报,2010;31(1):538 - 538。
程霞,陈敏,刘忠。MicroRNA-294对肝癌细胞增殖、迁移和侵袭的调控作用[J]。中华医学杂志,2020;359(6):365-71。
徐勇,顾勇,季伟,等。细胞外信号调节激酶(ERK)/c-Jun n -末端激酶(JNK)信号通路的激活与膝关节骨性关节炎患者软骨下骨成骨因子的关系[J]。中华检验医学杂志,2013;9(8):663。
Hämäläinen L, Bart G, Takabe P,等。钙激活的氯离子通道相关蛋白rCLCA2在大鼠表皮表达,促进细胞凋亡和UVB的下调[J]。中国生物医学工程学报;2013;31(5):559 - 561。
Purrington KS, Knight J 3rd, Dyson G,等。CLCA2表达与非裔美国女性三阴性乳腺癌生存率的关系[J]。科学通报,2020;15(4):e0231712。
杨欣,曹建林,杨芳芬,等。宫颈鳞状细胞癌CLCA2表达降低与免疫浸润相关的生物信息学分析[J]。台湾妇产科杂志,2021;60(3):480-6。
张鹏,林燕,刘燕。CLCA2对宫颈癌增殖、迁移和侵袭的抑制作用[J]。中华医学杂志,2011;22(1):776。
致谢
不适用。
数据可用性声明
支持本文结论的数据集包含在本文中。
声明
我们确认该研究是按照我们手稿中的ARRIVE指南进行报告的。我们确认所有实验方案均经兰州大学第二医院伦理委员会(D2019-072)批准。我们确认所有的方法都是按照相关的指导方针和规定进行的。
资金
国家自然科学基金(No.81960515)和甘肃省自然科学基金(No. 20JR5RA332)资助。
作者信息
作者及单位
贡献
WF, LYF和XWH构思和设计实验;ZJ, XWH, MXY和ZHB进行实验,XWH和ZYZ撰写论文。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
我们确认所有实验方案均经兰州大学第二医院伦理委员会批准。我们确认所有的方法都是按照相关的指导方针和规定进行的。
发表同意书
不适用。
相互竞争的利益
作者声明他们没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/。创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
辛伟,张杰,张华。et al。CLCA2过表达通过使ERK/JNK/p38-MAPK信号通路失活,抑制宫颈癌细胞上皮向间质转化。BMC Mol与细胞生物学23, 44(2022)。https://doi.org/10.1186/s12860-022-00440-7
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12860-022-00440-7
关键字
- CLCA2
- p38
- 进展
- 子宫颈癌