- 研究gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
由THP-1细胞衍生的各种巨噬细胞亚型调节的培养基对胰腺癌细胞隧道纳米管形成的影响gydF4y2Ba
分子与细胞生物学gydF4y2Ba体积gydF4y2Ba23gydF4y2Ba、物品编号:gydF4y2Ba26gydF4y2Ba(gydF4y2Ba2022gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
隧道纳米管(TNTs)是一种用于细胞间通信的特殊膜结构。重要的货物(如线粒体)可以通过tnt从健康细胞运送到拯救受损细胞。tnt可用于在细胞间系统地递送治疗剂。然而,对梯恩梯地层的控制强化研究还不够。本研究的目的是了解巨噬细胞如何影响癌细胞中TNT的形成。gydF4y2Ba
结果gydF4y2Ba
在这里,我们比较了由THP-1细胞衍生的M0、M1和M2巨噬细胞调节的培养基在人胰腺癌细胞(PANC-1)中诱导tnt的能力。M0和M1巨噬细胞条件培养基促进TNT的形成。使用聚焦离子束切割TNT,我们用扫描电子显微镜观察到致密细胞骨架内部的隧道状结构。TNT的形成与PANC-1细胞的运动性、侵袭性和上皮-间质转化增强有关。线粒体和溶酶体也被发现在tnt中运输。gydF4y2Ba
结论gydF4y2Ba
这些结果提示,TNT的形成可能是M0和M1巨噬细胞引起的胰腺癌细胞免疫应激反应之一。这一发现对于巨噬细胞靶向癌症治疗的发展是有价值的。gydF4y2Ba
背景gydF4y2Ba
隧道纳米管(TNTs)是一种特殊的膜结构,用于短距离和长距离(高达数百微米)的细胞间通信。由TNT连接的两个细胞可以交换各种物质,包括病毒[gydF4y2Ba1gydF4y2Ba],蛋白质[gydF4y2Ba2gydF4y2Ba], microRNAs [gydF4y2Ba3.gydF4y2Ba],线粒体[gydF4y2Ba4gydF4y2Ba)等。TNT的形成也被认为是一种应激反应。例如,紫外线处理的PC12细胞与未处理的细胞形成tnt,并且观察到线粒体从健康细胞传递到紫外线处理的细胞中[gydF4y2Ba4gydF4y2Ba]。此外,胰腺癌细胞经阿霉素处理后,促进了TNTs的形成,药物可通过TNTs在癌细胞之间转移[gydF4y2Ba5gydF4y2Ba]。在各种压力下的细胞似乎可以产生tnt,在附近的细胞中传递有益或有害的成分。我们很容易怀疑tnt也可能参与肿瘤中癌细胞之间复杂的相互作用。gydF4y2Ba
巨噬细胞是肿瘤微环境的重要组成部分。肿瘤微环境中的巨噬细胞可根据其辅助性T型1和辅助性T型2 (TH1-TH2)的极化分化为不同的亚型[gydF4y2Ba6gydF4y2Ba]。M1(促炎)巨噬细胞可增强药物敏感性或降低肿瘤活性[gydF4y2Ba7gydF4y2Ba]。相反,在某些癌症中,M2(抗炎)巨噬细胞倾向于促进肿瘤发生或恶性肿瘤[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba]。因此,需要探索这些不同类型的巨噬细胞如何影响癌细胞中TNT的形成。gydF4y2Ba
在本研究中,我们研究了巨噬细胞M0、M1和M2亚型的条件培养基(CMs)对PANC-1人胰腺癌细胞中TNT形成的影响。M0和M1 cm使PANC-1细胞产生更多的tnt,提高细胞迁移速度。相比之下,M2 CM对PANC-1细胞中TNT的形成效果较差。我们使用共聚焦显微镜和聚焦离子束扫描电子显微镜(FIB-SEM)观察TNT内部致密的细胞骨架网络。我们还检查了TNT的形成与PANC-1细胞上皮间质转化(EMT)之间的相关性。此外,我们还观察到了巨噬细胞CM中两个癌细胞之间线粒体的双向运输。gydF4y2Ba
结果gydF4y2Ba
M0和M1巨噬细胞CMs诱导PANC-1细胞形成TNTsgydF4y2Ba
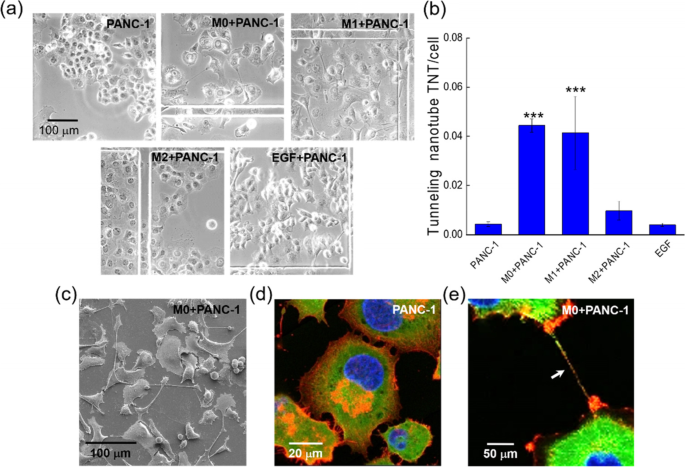
在这些实验中,PANC-1细胞最初在DMEM中培养24 h,然后我们用巨噬细胞CMs代替DMEM再培养48 h。在M0和M1 CM中,PANC-1细胞比在DMEM和M2 CM中培养的细胞产生更多的tnt,如图所示。gydF4y2Ba1gydF4y2Baa. DMEM中培养的PANC-1细胞形成致密的菌落,而M0 CM和M1 CM中培养的PANC-1细胞分离良好,并形成TNT。与DMEM组相比,M2 CM组的PANC-1细胞的大小似乎有所扩大,但大多数细胞与邻近细胞保持接触。在无花果。gydF4y2Ba1gydF4y2Bab我们可以看到,M0 CM和M1 CM的TNT形成概率要高得多。数字gydF4y2Ba1gydF4y2Bac为M0 CM中培养的PANC-1细胞产生的tnt的典型SEM图像。数据gydF4y2Ba1gydF4y2Bad和e显示了PANC-1细胞膜附近的细胞骨架(橙色为f -肌动蛋白,绿色为微管)的重新分布。未经M0 CM处理,图中膜突出。gydF4y2Ba1gydF4y2Bad主要含有f -肌动蛋白。相比之下,在M0 CM中,TNT充满了f -肌动蛋白和微管,如图箭头所示。gydF4y2Ba1gydF4y2Bae.因此,在没有巨噬细胞CMs刺激的情况下,TNTs中的细胞骨架可能与PANC-1细胞膜突起中的细胞骨架不同。gydF4y2Ba
巨噬细胞条件培养基诱导PANC-1细胞形成tnt。gydF4y2Ba一个gydF4y2BaDMEM、巨噬细胞CMs和200 ng/ml EGF中PANC-1细胞的典型形态。gydF4y2BabgydF4y2Ba巨噬细胞CMs和200 ng/ml EGF作用下PANC-1细胞中平均tnt /细胞数。***,gydF4y2BaPgydF4y2Ba与DMEM中的PACN-1细胞相比< 0.005(事后Tukey’s检验)。gydF4y2BacgydF4y2BaM0 CM中培养的PANC-1细胞的典型SEM图像。gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba细胞骨架共聚焦荧光图像(绿色,微管;橙色,f -肌动蛋白)分别在DMEM和M0 CM的PANC-1细胞中。蓝色表示dapi染色的细胞核gydF4y2Ba
据报道,表皮生长因子(EGF)可能在大鼠乳腺癌细胞(MTLn3)中TNT的形成中起重要作用[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba]。然而,在我们的实验中,在DMEM中加入200 ng/mL EGF诱导的tnt要比M0和M1 cm少得多(图2)。gydF4y2Ba1gydF4y2Ba我们还发现巨噬细胞CMs中EGF浓度非常低(补充信息中的图S2(a))。因此,我们推测巨噬细胞CMs诱导的PANC-1细胞中TNT的形成可能与EGF无关。gydF4y2Ba
用FIB-SEM观察tnt内部的超微结构gydF4y2Ba
tnt不是空的膜管,而是在不同类型的细胞中充满了不同的细胞骨架[gydF4y2Ba12gydF4y2Ba]。我们观察到PANC-1细胞间的tnt同时含有肌动蛋白丝和微管,如图所示的荧光图像。gydF4y2Ba1gydF4y2Bae. TNT看起来像一个从细胞膜伸出的开口管,TNT内的两个细胞骨架与细胞体内的细胞骨架是连续的。然而,细胞骨架是如何在如此狭窄的空间内排列的,以及它们如何能够运送货物,这些都不能通过光学显微镜来解决。因此,我们固定了PANC-1细胞,并通过FIB解剖了tnt,然后用扫描电镜观察了内部结构,如图所示。gydF4y2Ba2gydF4y2Baa.图中纵向切割TNT的SEM图像。gydF4y2Ba2gydF4y2Bab显示TNT充满了密集排列的细胞骨架。我们还使用FIB-SEM沿着一个TNT产生了一系列的横截面图像(图2)。gydF4y2Ba2gydF4y2Bac g)。我们在横截面上观察到一些被细胞骨架包围的隧道状结构。由于FIB-SEM图像中的内通道直径在100 nm左右甚至更小,因此细胞器(如直径500-1000 nm的线粒体)的运输不能由细胞质的被动流动驱动。货物可能通过TNT以挤压的方式运输,类似于参考文献[1]中报道的那样。gydF4y2Ba13gydF4y2Ba]。gydF4y2Ba
TNT的形成与细胞运动增强和EMT相关gydF4y2Ba
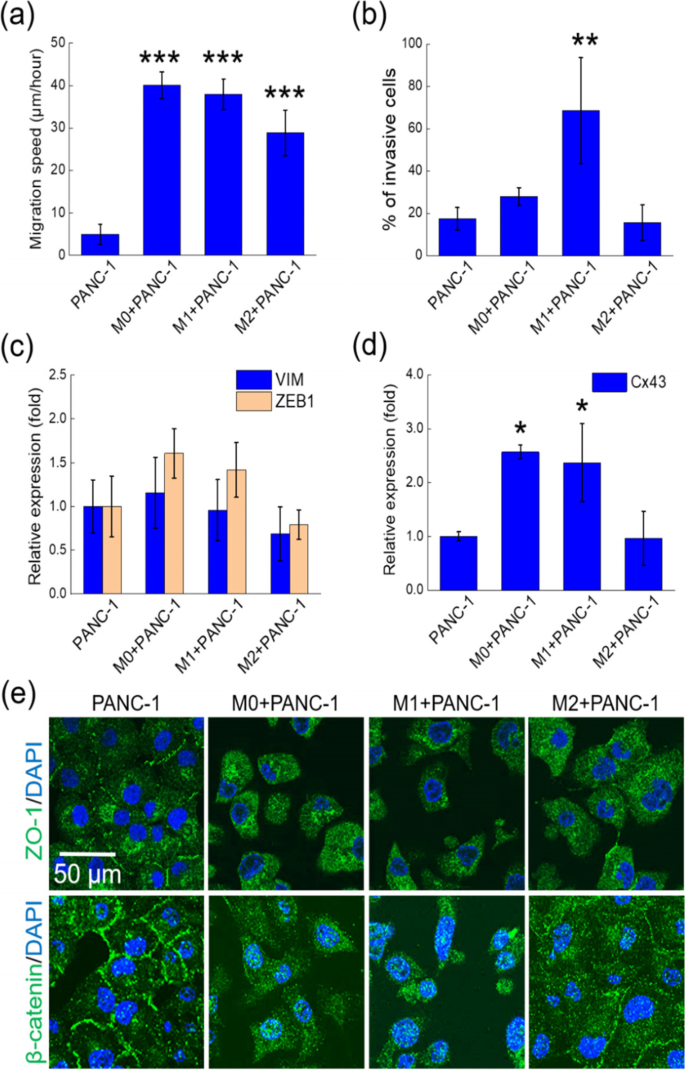
除了形成tnt外,我们还发现M0、M1和M2 cm显著提高了PANC-1细胞的迁移速度(图2)。gydF4y2Ba3.gydF4y2Baa),而只有M1 CM增强了细胞侵袭性(图2)。gydF4y2Ba3.gydF4y2Bab).因此,我们推测TNT的增强形成可能是由于最初接触的两个细胞的解离,称为“细胞移位”TNT形成过程[gydF4y2Ba14gydF4y2Ba],如图所示。gydF4y2BaS3gydF4y2Ba。很容易将细胞迁移速度的增加与EMT联系起来,这通常会导致更高的细胞运动性和侵袭性[gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba]。我们使用qPCR检测了两种emt相关蛋白vimentin和Zeb-1的mRNA水平[gydF4y2Ba17gydF4y2Ba]。M0和M1 cm均使Zeb-1 mRNA水平升高,但差异无统计学意义(图2)。gydF4y2Ba3.gydF4y2Bac)。此外,M0和M1 CM上调了连接蛋白43的mRNA水平,而M2 CM没有上调(图2)。gydF4y2Ba3.gydF4y2Bad).因为连接蛋白43参与了p-38介导的细胞迁移[gydF4y2Ba18gydF4y2Ba],这一结果提示p-38信号通路可能是图中M0和M1 cm引起的迁移加速机制的一部分。gydF4y2Ba3.gydF4y2Baa. M2 CM没有引起vimentin、Zeb-1和connexin 43的变化。gydF4y2Ba
巨噬细胞CMs诱导的TNT形成与细胞运动性增强和EMT相关。gydF4y2Ba一个gydF4y2BaPANC-1细胞在DMEM和巨噬细胞CMs中的迁移速度。在每个实验中,我们测量了45个细胞的速度。gydF4y2BabgydF4y2BaDMEM和巨噬细胞CMs中PANC-1细胞24 h的侵袭。gydF4y2BacgydF4y2BaDMEM和巨噬细胞CMs培养的PANC-1细胞中vimentin (VIM)和Zeb-1 (ZEB1) mRNA水平的变化。对于Zeb-1gydF4y2BaPgydF4y2BaDMEM与M0 CM中PANC-1细胞间-值为0.17;DMEM与M1 CM中PANC-1细胞间的比值为0.34。gydF4y2BadgydF4y2BaDMEM和巨噬细胞CMs培养的PANC-1细胞中连接蛋白43 (Cx43) mRNA水平的变化。所有数据均来自三个独立实验。***,gydF4y2BaPgydF4y2Ba< 0.005;**gydF4y2BaPgydF4y2Ba< 0.01;*,gydF4y2BaPgydF4y2Ba< 0.05(事后Tukey’s检验),与DMEM中PANC-1细胞比较。gydF4y2BaegydF4y2BaDMEM和巨噬细胞CMs中PANC-1细胞ZO-1和β-catenin的共聚焦荧光图像gydF4y2Ba
我们还监测了两种细胞粘附蛋白ZO-1和β-catenin的空间分布[gydF4y2Ba15gydF4y2Ba,gydF4y2Ba19gydF4y2Ba],用共聚焦荧光显微镜观察PANC-1细胞。图2中的图像。gydF4y2Ba3.gydF4y2Bae显示,当细胞处于M0和M1 cm时,ZO-1和β-连环蛋白从细胞膜进入细胞质。这一过程与EMT以及图中细胞解离行为一致。gydF4y2Ba1gydF4y2Baa.图中ZO-1和β-catenin的易位与M0和M1 cm诱导的TNT形成相关。gydF4y2Ba1gydF4y2Baa.另一方面,M2 CM没有诱导β-连环蛋白从细胞膜转位到细胞质。这种现象可能与M2 CM中TNT含量较低有关。gydF4y2Ba
线粒体和溶酶体通过tnt在PANC-1细胞之间传递gydF4y2Ba
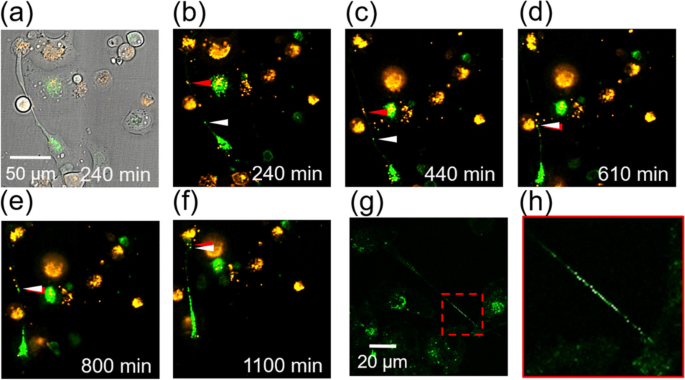
已发现多种细胞成分(货物)可通过tnt传递[gydF4y2Ba20.gydF4y2Ba]。因为线粒体通过tnt的转移被认为是对凋亡细胞的一种拯救[gydF4y2Ba4gydF4y2Ba],我们想了解线粒体运输是否发生在巨噬细胞cm诱导的tnt中。这里我们使用M0 CM作为代表性治疗。将两组PANC-1细胞进行传代培养,分别用MitoTracker™绿色FM和MitoTracker™橙色CMTMRos进行标记。在无花果。gydF4y2Ba4gydF4y2Baa,我们将荧光和明场图像重叠,以显示两个线粒体和连接两个PANC-1细胞的TNT在M0 CM中的相对位置。图4中的延时图像。gydF4y2Ba4gydF4y2Bab-f显示两个线粒体在TNT中头对头移动,碰撞,然后一起移动到上层细胞。(请参阅英文版的视频1)gydF4y2Ba补充信息gydF4y2Ba)。线粒体的这种主动运输被认为与运动蛋白有关[gydF4y2Ba21gydF4y2Ba]。在小鼠组织中形成的tnt中也观察到含有羧基修饰量子点的囊泡的类似双向运输[gydF4y2Ba22gydF4y2Ba]。我们还证实了酪蛋白与线粒体在TNT中的共定位(图S4)gydF4y2Ba补充信息gydF4y2Ba)。线粒体被认为在动力蛋白(如运动蛋白和动力蛋白)的驱动下沿着微管移动。尽管运动蛋白和动力蛋白在微管上的运动方向相反[gydF4y2Ba23gydF4y2Ba],在连接两个细胞的TNT细胞中,线粒体也可能受到来自这两个细胞的微管上的两个驱动蛋白分子的驱动。因此,即使只有一种驱动马达蛋白,在连接两个细胞的TNT中也可以实现双向运输。gydF4y2Ba
线粒体和溶酶体可以在M0 CM中通过TNT连接的PANC-1细胞之间运输。gydF4y2Ba一个gydF4y2Ba重叠的亮场和荧光图像显示两个PANC-1细胞由TNT连接。gydF4y2BabgydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba线粒体在TNT内运输的延时共聚焦荧光图像gydF4y2Ba一个gydF4y2Ba)。将两个PANC-1细胞进行传代培养,分别用MitoTracker™绿色FM和MitoTracker™橙色CMTMR进行标记。来自每个细胞的两个线粒体向相反的方向前进,碰撞,然后一起进入上层细胞。gydF4y2BaggydF4y2BaPANC-1细胞中溶酶体的荧光图像。溶酶体用LysoTracker®Green标记。gydF4y2BahgydF4y2Ba图中红色虚线框所围区域的放大图gydF4y2BaggydF4y2Ba)gydF4y2Ba
除了线粒体外,在连接两个癌细胞的TNT中也发现了溶酶体,如图所示。gydF4y2Ba4gydF4y2Bag和h. Wong等人指出溶酶体可以通过膜接触调节线粒体功能[gydF4y2Ba24gydF4y2Ba]。我们推测线粒体和溶酶体通过tnt的共同运输也可能是PANC-1细胞对巨噬细胞CMs的反应之一。gydF4y2Ba
讨论gydF4y2Ba
巨噬细胞通过分泌多种细胞因子在不同类型的癌症中发挥复杂的作用[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba]。它们还可能参与癌细胞与其他类型细胞(如成纤维细胞)之间的相互作用[gydF4y2Ba27gydF4y2Ba]。一般认为M1巨噬细胞在肿瘤微环境中具有促炎活性。另一方面,肿瘤微环境中的M2巨噬细胞可支持肿瘤进展和恶性[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba]。然而,M1巨噬细胞分泌的许多炎性细胞因子,如IL-1、IL-6、IL-12、TNF-α也是EMT的重要介质[gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba,这可以改善癌细胞的运动性和侵袭性。Kuwada等人报道,M1和M2巨噬细胞均可诱导胰腺癌细胞发生EMT [gydF4y2Ba30.gydF4y2Ba]。显然,癌细胞EMT与M1/M2巨噬细胞之间的关系有待进一步研究阐明。gydF4y2Ba
癌细胞和巨噬细胞之间的旁分泌环一直被认为是肿瘤微环境中必不可少的相互作用,它可以调节两种细胞的表型和功能[gydF4y2Ba25gydF4y2Ba]。另一方面,巨噬细胞(M2a)与癌细胞的直接接触可导致癌细胞聚集体的分散[gydF4y2Ba31gydF4y2Ba]。在本工作中,为了避免癌细胞与巨噬细胞之间的旁分泌环和直接接触,我们研究了巨噬细胞CMs对人胰腺癌细胞系PANC-1的影响。我们发现M0和M1 CM诱导了TNTs的形成,提高了癌细胞的迁移速度,而只有M1 CM增强了PANC-1细胞的侵袭性。这些影响与emt相关蛋白Zeb-1的表达升高以及ZO-1和β-catenin在PANC-1细胞中从膜转移到细胞质有关。M0和M1 cm也增加了与p-38介导的细胞迁移相关的Connexin 43。Patheja和Sahu报道了来自U937单核细胞的M0巨噬细胞的CM也诱导了人乳腺癌细胞MCF-7之间TNTs的形成[gydF4y2Ba32gydF4y2Ba]。有趣的是,tnt可以连接MCF-7细胞和称为微质体的细胞质片段,并将线粒体和囊泡从亲本细胞运输到微质体。gydF4y2Ba
相比之下,虽然M2 CM增加了PANC-1细胞的迁移速度,但它没有引起TNTs、Zeb-1和连接蛋白43的可识别变化。因此,我们怀疑THP-1细胞衍生的M2巨噬细胞可能不像肿瘤微环境中极化的巨噬细胞,也不像与癌细胞共培养的巨噬细胞[gydF4y2Ba33gydF4y2Ba]。Shiratori等人比较了THP-1细胞衍生的巨噬细胞和人外周血单核细胞(PBMCs)的行为。他们认为THP-1细胞衍生的巨噬细胞更适合于吞噬作用和M1极化而不是M2极化的研究[gydF4y2Ba34gydF4y2Ba]。我们的观察似乎与这个建议是一致的。gydF4y2Ba
我们使用FIB-SEM来揭示细胞骨架和隧道状结构嵌入在TNT拥挤的空间中。Sartori-Rupp等人利用低温透射电子显微镜报道了单个隧道纳米管(iTNTs)捆绑在神经元细胞之间的TNT中[gydF4y2Ba13gydF4y2Ba]。这些itnt可能作为囊泡和线粒体的运输通道。我们怀疑线粒体或溶酶体可能受到肌动蛋白-肌球蛋白相互作用产生的收缩力和共定位的运动蛋白(如运动蛋白)的推力的挤压而通过TNT。gydF4y2Ba
巨噬细胞由于其内化能力和接近肿瘤和缺氧的倾向,被认为是纳米药物的新型细胞载体。gydF4y2Ba35gydF4y2Ba]。携带纳米颗粒的M1巨噬细胞被证明能够通过内皮屏障迁移到肿瘤周围的组织中[gydF4y2Ba36gydF4y2Ba]。发现巨噬细胞和乳腺癌细胞之间形成了tnt [gydF4y2Ba11gydF4y2Ba]或卵巢癌细胞[gydF4y2Ba37gydF4y2Ba]。巨噬细胞与肿瘤细胞之间的tnt可增强巨噬细胞携带抗癌药物阿霉素的递送效果[j]。gydF4y2Ba37gydF4y2Ba]。因此,操纵癌细胞以可控的方式产生tnt可能为癌症治疗铺平新的道路。gydF4y2Ba
结论gydF4y2Ba
总之,我们已经证明M0和M1 CMs诱导PANC-1胰腺癌细胞中TNTs的形成。TNTs的形成与PANC-1细胞的高细胞运动性和EMT相关。我们还观察到线粒体在tnt中的双向运输。这一发现可能为巨噬细胞靶向癌症治疗的发展铺平道路。然而,本文主要研究了tnt的内部结构和运输功能。为了验证巨噬细胞是否真的能促进肿瘤微环境中TNT的形成,未来的实验工作将需要使用从外周血中分离的单核细胞衍生的巨噬细胞和更多的胰腺癌细胞系。gydF4y2Ba
方法gydF4y2Ba
细胞培养gydF4y2Ba
人胰腺癌细胞系PANC-1 (ATCC CRL-1469)来自台湾新竹生物资源收集与研究中心。我们将PANC-1细胞培养在Dulbecco 's Modified Eagle Medium (DMEM;Gibco®,Thermo Fisher Scientific, Waltham, MA, USA),添加10%胎牛血清(FBS)和1%抗生素笔-链球菌-ampho。人单核细胞系THP-1 (ATCC TIB-202)也从生物资源收集与研究中心获得。我们将THP-1细胞培养在添加10%牛血清和1%抗生素笔链-ampho的RPMI中。gydF4y2Ba
巨噬细胞培养基的制备gydF4y2Ba
为了收集巨噬细胞CMs,我们收获了6 × 10个gydF4y2Ba6gydF4y2BaTHP-1细胞加入含有0.32 μM phorbol 12-肉豆蔻酸13-乙酸酯(PMA)的10 mL DMEM中;Sigma-Aldrich,圣路易斯,密苏里州,美国)。经PMA处理24 h后,大部分单核细胞附着在培养皿底部,认为已分化为M0巨噬细胞[gydF4y2Ba7gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba]。M0巨噬细胞与10 pg/mL LPS + 20 ng/mL IFN-γ孵育24 h或20 ng/mL IL-4 + 20 ng/mL IL-13孵育72 h后,M0巨噬细胞分别极化为M1和M2巨噬细胞[gydF4y2Ba40gydF4y2Ba]。巨噬细胞中M1和M2相关标志物的表达水平如图S1所示gydF4y2Ba补充信息gydF4y2Ba。我们用新鲜的DMEM替换上述各巨噬细胞的培养基,再培养24 h。然后收集培养基作为实验中的巨噬细胞CMs。gydF4y2Ba
TNT量化gydF4y2Ba
我们以1 × 10的剂量接种PANC-1细胞gydF4y2Ba5gydF4y2Bacells/mL in a μ-Dish (35 mm, high Grid-500);ibidi GmbH, Gräfelfing,德国)在正常培养条件下(5% COgydF4y2Ba2gydF4y2Ba37°C)过夜。然后在巨噬细胞- cm中再培养48小时。用磷酸缓冲盐水(PBS, pH = 7.4)洗涤细胞3次,然后在室温下用3.7%福尔马林固定15 min。取下固定液,PBS洗涤细胞3次,然后用1 μg/mL DAPI (Thermo Fisher Scientific)染色细胞核。孵育10分钟后,用PBS彻底清洗固定细胞,然后在倒置显微镜(ECLIPSE Ti, Nikon, Tokyo, Japan)上安装20倍相衬物镜成像。我们根据两个标准对tnt进行计数:(1)管连接两个细胞,(2)管的长度大于50 μm。gydF4y2Ba
FIB-SEM成像gydF4y2Ba
PANC-1细胞在清洁和消毒的盖片(22 mm × 22 mm)上培养。巨噬细胞CMs处理后,PBS冲洗细胞,3.7%甲醛固定15 min, 1% OsO后固定gydF4y2Ba4gydF4y2Ba在PBS中浸泡2小时三次PBS冲洗后,从10% (v/v) H开始逐渐用乙醇替代培养基gydF4y2Ba2gydF4y2Ba0)到99.9%。最后的样品用临界点干燥机(EM CPD300, Leica Microsystems, Wetzlar, Germany)干燥。在FIB-SEM操作之前,样品表面溅射10nm金以提高电导率。FIB-SEM操作使用FEI Helios NanoLab 660 (Thermo Fisher Scientific)进行。首先通过离子束诱导沉积在靶区沉积500 nm的铂保护层,然后在30 kV加速电压下用40 pA的镓离子束进行粗铣,再用7.7 pA的镓离子束进行细铣。所有的扫描电镜图像都是在FIB操作后立即拍摄的,在1-5 kV的加速电压下,用25-50 pA的光束电流和二次电子的“透镜内”探测器获得。gydF4y2Ba
细胞迁移速度分析gydF4y2Ba
我们将PANC-1细胞以5 × 10的剂量接种gydF4y2Ba4gydF4y2Ba细胞/mL在35mm培养皿中正常培养条件下过夜。然后将培养基改为巨噬细胞- cms。我们使用10倍相衬物镜每10分钟捕捉细胞的延时图像,持续48小时。在每个实验中,使用ImageJ计算45个细胞的迁移速度。gydF4y2Ba
细胞侵袭试验gydF4y2Ba
~ 3 × 10的样品gydF4y2Ba5gydF4y2BaPANC-1细胞在正常培养条件下重新悬浮于6孔板中过夜。将培养基改为巨噬细胞CMs,再培养48小时。然后细胞在无血清培养基中饥饿24小时,然后进行侵袭试验。约5 × 10gydF4y2Ba4gydF4y2Ba将细胞接种到Transwell室(ab235697, Basement Membrane, 8 μm, Abcam)的孔中,底室中含有正常培养基。细胞培养24小时,然后根据试剂盒说明用荧光染料(Ex. 530 nm/ Em. 590 nm)标记60分钟。利用平板阅读器(Synergy 2, BioTek Instruments, Winooski, VT, USA)测量入侵细胞的荧光强度,以评估细胞入侵百分比。gydF4y2Ba
定量聚合酶链反应gydF4y2Ba
总RNA使用RNeasy迷你试剂盒(217,604,Qiagen, Hilden, Germany)纯化,并使用High-Capacity RNA-to-cDNA™试剂盒(4,387,406,Applied Biosystems™,Thermo Fisher Scientific)反转录为cDNA。采用PowerTrack™SYBR Green Master Mix (A46110, Applied Biosystems™)和LightCycler 480 (Roche, Basel, Switzerland)进行qPCR。结果以肌动蛋白为内控进行归一化,并采用2gydF4y2Ba−ΔΔCtgydF4y2Ba方法。本研究所用引物由Genomics (New Taipei City, Taiwan)合成,列于表中gydF4y2Ba1gydF4y2Ba。gydF4y2Ba
共聚焦荧光成像gydF4y2Ba
为了成像连接蛋白,PANC-1细胞用PBS洗涤三次,然后用无水甲醇固定10分钟。细胞用0.1% Triton X-100渗透10分钟,在室温下用1% BSA在1倍PBS中阻断1小时。将细胞与ZO-1 (MA3-39100-A488, 1:100, Thermo Fischer Scientific)和β-catenin (ab32572, 1:250, Abcam)抗体在4℃下孵育过夜,然后与山羊抗兔(A11008, 1:100, Invitrogen, Alexa Fluor®488)二抗在室温下孵育1小时。核DNA用DAPI (62,248, 1:1000, Thermo Fisher Scientific)标记。使用共聚焦显微镜(SP5, Leica Microsystems)获取图像。gydF4y2Ba
统计分析gydF4y2Ba
所有数据均以均数±标准差表示。两组间的比较采用双尾Student’s进行gydF4y2BatgydF4y2Ba以及。两组以上资料间比较采用单因素方差分析(ANOVA)。然后用事后Tukey检验检查特定两组之间的差异。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
本研究过程中产生或分析的所有数据都包含在这篇发表的文章及其附加文件中。gydF4y2Ba
缩写gydF4y2Ba
- VIM:gydF4y2Ba
-
波形蛋白gydF4y2Ba
- ZEB1:gydF4y2Ba
-
锌指E-Box捆绑盒gydF4y2Ba
- M-Sec:gydF4y2Ba
-
tnf α-诱导蛋白gydF4y2Ba
- Cx43:gydF4y2Ba
-
联接蛋白43gydF4y2Ba
- ZO-1:gydF4y2Ba
-
Zonula occluden-1gydF4y2Ba
- CTNNB1:gydF4y2Ba
-
连环蛋白β 1gydF4y2Ba
- IL1B:gydF4y2Ba
-
白细胞介素1gydF4y2Ba
- TLR2:gydF4y2Ba
-
Toll样受体2gydF4y2Ba
- CCL22:gydF4y2Ba
-
C-C趋化因子22gydF4y2Ba
- ACTB:gydF4y2Ba
-
肌动蛋白βgydF4y2Ba
- tnt:gydF4y2Ba
-
隧道纳米管gydF4y2Ba
- CMs:gydF4y2Ba
-
的媒体gydF4y2Ba
- FIB-SEM:gydF4y2Ba
-
聚焦离子束扫描电子显微镜gydF4y2Ba
- EMT:gydF4y2Ba
-
Epithelial-mesenchymal过渡gydF4y2Ba
- 表皮生长因子:gydF4y2Ba
-
表皮生长因子gydF4y2Ba
参考文献gydF4y2Ba
细胞素和隧道纳米管在细胞间通讯和病毒发病中的作用。细胞生物学进展,2008;18(9):414-20。gydF4y2Ba
王志刚,刘士林,田志强,张志林,唐华伟,庞德伟。膜纳米管介导的肌球蛋白驱动的小麦胚芽凝集素在人肺癌细胞间的细胞间运输。纳米学报,2012;6(11):10033-41。gydF4y2Ba
李建军,李建军,李建军,等。肿瘤细胞间相互作用的研究进展。生物医学工程学报,2014;32(5):559 - 559。gydF4y2Ba
王鑫,Gerdes H-H。通过隧道纳米管转移线粒体可挽救凋亡的PC12细胞。细胞死亡差异[j] . 2015;22(7):1181。gydF4y2Ba
李建军,李建军,李建军,李建军,等。化疗诱导的隧道纳米管介导胰腺癌细胞间药物外排。科学通报,2018;8:944。gydF4y2Ba
王晓明,王晓明。巨噬细胞可塑性与淋巴细胞亚群相互作用的研究进展。中国生物医学工程学报,2010;11(3):889 - 896。gydF4y2Ba
袁安,肖云杰,陈海燕,陈华伟,何春春,陈云燕,等。M1和M2巨噬细胞亚型对肺癌进展的相反作用。科学通报,2015;5:1473。gydF4y2Ba
伊诺Y,山崎伊藤R, Shimada K,岩崎M, Kosuge T, Kanai Y,等。免疫细胞浸润作为胰腺癌免疫微环境的指标。中国生物医学工程学报,2013;38(1):391 - 391。gydF4y2Ba
张丽娟,张丽娟,张丽娟,等。M2巨噬细胞诱导卵巢癌细胞增殖的细胞间反馈机制。Oncotarget。2016;7(52):86608 - 20。gydF4y2Ba
张建军,张建军,张建军,张建军。巨噬细胞诱导肿瘤细胞隧道纳米管对乳腺癌细胞的三维侵袭作用。巨蟹座医学杂志2019;2:1 - 12。gydF4y2Ba
李建军,李建军,李建军,李建军,李建军。纳米管在肿瘤细胞侵袭过程中的应用。中国生物医学工程学报,2019;32(2):533 - 536。gydF4y2Ba
王晓华,王晓华,王晓华,等。隧道纳米管的形态和结构多样性研究。通用集成学报,2014;7(1):27934。gydF4y2Ba
Sartori-Rupp A, Cervantes DC, Pepe A, Gousset K, Delage E, Corroyer-Dulmont S,等。相关冷冻电镜显示神经细胞中tnt的结构。学报。2019;10:34 . 42。gydF4y2Ba
李建军,李建军,李建军,等。纳米管在骨髓细胞间的相互作用。中华免疫学杂志,2018;9(1):43。gydF4y2Ba
Kalluri R, Weinberg RA。上皮-间质转化的基础。中华临床医学杂志,2009;19(6):391 - 391。gydF4y2Ba
张建平,张建平。EMT与细胞迁移的研究进展。发展。2016;143(23):4291 - 300。gydF4y2Ba
Krebs AM, JuliaMitschke LML, Schmalhofer O, Boerries M, Busch H, Boettcher M,等。emt激活因子Zeb1是胰腺癌细胞可塑性和促进转移的关键因子。中国生物医学工程学报,2017;19(5):518 - 29。gydF4y2Ba
张建军,张建军,张建军,等。细胞迁移的研究进展。中国生物医学工程学报,2010;39(4):444 - 444。gydF4y2Ba
李建军,李建军,李建军,等。β-catenin和ZO-1在肿瘤侵袭相关的上皮-间质转化过程中的表达。细胞与组织器官。2007;18(3):61-5。gydF4y2Ba
格德斯H-H,卡瓦略RN。隧道纳米管介导的细胞间转移。中国生物医学工程学报,2008;20(4):457 - 457。gydF4y2Ba
吴敏,Kalyanasundaram A,朱静。真核细胞线粒体运动的结构和生物力学基础。中国生物医学工程学报,2013;8(4):444 - 444。gydF4y2Ba
Rehberg M, Nekolla K, Sellner S, Praetner M, Mildner K, Zeuschner D,等。在体内,纳米材料的细胞间运输是由膜纳米管介导的。小。2016;12(14):1882 - 90。gydF4y2Ba
Hirokawa N.动力学蛋白和动力蛋白超家族蛋白与细胞器运输机制。科学。1998;279(5350):519 - 26所示。gydF4y2Ba
王玉春,王志强,王志强,等。线粒体-溶酶体接触对RAB7 - GTP水解的影响。大自然。2018;554(7692):382。gydF4y2Ba
钱宝珍,波拉德JW。巨噬细胞多样性促进肿瘤进展和转移。细胞。2010;141(1):39-51。gydF4y2Ba
王晓明,王晓明。巨噬细胞在肿瘤治疗中的应用。前沿学报,2018;8:49。gydF4y2Ba
徐廷辉,高云龙,林文龙,肖建林,郭培林,吴昌伟,等。微流控芯片中巨噬细胞与肌成纤维细胞共培养对癌细胞迁移速度的影响。中国生物医学工程学报,2012;4(4):1777 - 1782。gydF4y2Ba
Bates RC, Mercurio AM。肿瘤坏死因子-α刺激人结肠类器官上皮向间质转化。中华生物医学杂志,2003;14(5):1790-800。gydF4y2Ba
张建军,张建军,张建军,等。原发性肿瘤上皮-间质转化和炎症的研究进展。中国生物医学工程学报,2017;47(1):357 - 357。gydF4y2Ba
Kuwada K, Kagawa S, Yoshida R, Sakamoto S, Ito A, Watanabe M,等。肿瘤相关巨噬细胞诱导的上皮细胞到间质细胞的转化赋予了腹膜播散性胰腺癌的化疗耐药。中华临床医学杂志,2018;37(3):391 - 391。gydF4y2Ba
白军,Adriani G,党天明,涂天宇,潘宏祥,王绍成,等。M2a巨噬细胞通过ICAM-1和β2整合素相互作用的接触依赖性癌聚集分散。Oncotarget。2015;6(28):25295 - 307。gydF4y2Ba
巨噬细胞条件培养基通过增强隧道纳米管形成和隧道纳米管介导的活细胞质片段释放诱导MCF-7细胞网络形成。中国生物医学工程学报,2017;35(5):591 - 591。gydF4y2Ba
孟峰,李超,李伟,高铮,郭凯,宋松。胰腺癌细胞与肿瘤相关巨噬细胞相互作用促进胰腺癌细胞侵袭及巨噬细胞的分化和迁移。[j] .生命科学学报,2014,36(12):835-46。gydF4y2Ba
白志刚,李建军,李建军,等。THP-1和人外周血单核细胞来源的巨噬细胞在体外极化能力不同。中国生物医学工程学报,2017;33(2):591 - 591。gydF4y2Ba
司杰,邵生,沈勇,王凯。巨噬细胞作为肿瘤早期靶向和辅助化疗的活性纳米载体。小。2016;12(37):5108 - 19所示。gydF4y2Ba
庞磊,朱勇,秦军,赵伟,王军。原代M1巨噬细胞作为多功能载体联合PLGA纳米颗粒递送抗肿瘤药物的研究。药物输送。2018;25:1922-31。gydF4y2Ba
郭亮,张勇,杨志,彭宏,魏锐,王超,等。隧道纳米管高速公路用于超快速和准确的M1巨噬细胞递送抗癌药物到转移性卵巢癌。化学学报。2019;13:1078-96。gydF4y2Ba
褚建伟,陈建生,顺春涛,林世杰,廖玉华,褚春云,等。环氧化酶-2诱导肿瘤相关巨噬细胞侵袭和血管生成。中华皮肤科杂志,2009;29(4):1016 - 1025。gydF4y2Ba
Daigneault M, Preston JA, Marriott HM, Whyte MKB, Dockrell DH。pma刺激的THP-1细胞和单核细胞源性巨噬细胞中巨噬细胞分化标志物的鉴定。科学通报,2010;5(1):1 - 6。gydF4y2Ba
Genin M, Clement F, Fattaccioli A, Raes M, Michiels C. THP-1细胞衍生的M1和M2巨噬细胞差异调节癌细胞对依托胞苷的反应。中华医学会癌症杂志,2015;15:577。gydF4y2Ba
致谢gydF4y2Ba
我们感谢中央研究院神经科学核心设施与创新仪器计划(AS-CFII-108-106)获取图中的图像。gydF4y2Ba1gydF4y2BaD和e。gydF4y2Ba
资金gydF4y2Ba
本研究由中央研究院专题研究计划(AS-105-TP-A06)和台湾科学技术部(批准号MOST 106-2112-M-001-028-MY3)资助。gydF4y2Ba
作者信息gydF4y2Ba
作者及单位gydF4y2Ba
贡献gydF4y2Ba
CHL和CNS构思、设计实验,并监督该项目。CWL进行了大部分共聚焦显微镜和FIB-SEM成像实验。CCK进行了大部分的细胞侵袭,ELISA和qPCR。CCK和HJP制备了样品并对tnt进行了定量。CJL进行流式细胞术分析。CWL对数据进行了分析。CWL和CHL撰写了手稿。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明不存在财务和非财务利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
伟德体育在线施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:视频S1。gydF4y2Ba连接两个PANC-1细胞的TNT中线粒体的双向运输。时间间隔为10分钟。gydF4y2Ba
附加文件2:图S1。gydF4y2Ba
M1巨噬细胞标志物(a) IL-1β和(b) TLR-2,以及(c) M2巨噬细胞标志物CCL22的mRNA水平,根据材料和方法章节中描述的方案在分化后的巨噬细胞中测量。这些数据来自三个独立的实验。***,gydF4y2BaPgydF4y2Ba< 0.005;*,gydF4y2BaPgydF4y2Ba与THP-1细胞比较< 0.05(事后Tukey’s检验)。gydF4y2Ba图S2。gydF4y2Ba(a) THP-1细胞和巨噬细胞的条件培养基(CMs)和(b)巨噬细胞CMs中培养48小时的PANC-1细胞的条件培养基(CM)中EGF的ELISA结果。这些数据来自三个独立的实验。(c)光密度(OD)与EGF浓度的校准曲线。从这条校准曲线,我们了解到面板(a)和(b)中的EGF浓度均低于ELISA的检测限。ELISA试剂盒为dy236, DuoSet ELISA (R&D Systems, Minneapolis, MN, USA)。用平板阅读器(Synergy 2, BioTek Instruments)测量分析物的吸光度。gydF4y2Ba图S3。gydF4y2Ba在M0 CM中,两个最初接触的PANC-1细胞之间形成的tnt(在0分钟时的图像中用箭头表示)。这一过程符合“细胞移位”TNT的形成机制。gydF4y2Ba图S4。gydF4y2Ba酪蛋白(红色)与线粒体(绿色)在TNT内的共定位。大多数明亮的线粒体与运动蛋白信号共定位。在稳定克隆的PANC-1细胞系中,线粒体与绿色荧光蛋白融合。先用兔抗体(ab5629, abcam)标记,再用DyLight 650偶联二抗(ab96886, abcam)进行探针检测。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba。创作共用公共领域免责声明(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文中提供的数据,除非在数据的信用额度中另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
李,连续波。,Kuo, CC., Liang, CJ.et al。gydF4y2Ba由THP-1细胞衍生的各种巨噬细胞亚型调节的培养基对胰腺癌细胞隧道纳米管形成的影响gydF4y2BaBMC Mol与细胞生物学gydF4y2Ba23gydF4y2Ba, 26(2022)。https://doi.org/10.1186/s12860-022-00428-3gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12860-022-00428-3gydF4y2Ba
关键字gydF4y2Ba
- 隧道纳米管(TNT)gydF4y2Ba
- 胰腺癌细胞gydF4y2Ba
- 巨噬细胞条件培养基gydF4y2Ba
- Epithelial-mesenchymal过渡gydF4y2Ba
- 线粒体运输gydF4y2Ba