摘要
背景
STAT3 (Signal transmitter and activator of transcription 3)是一种致癌转录因子,在未转化细胞中促进细胞增殖和免疫调节,维持转化细胞的干性,促进侵袭和转移。STAT3蛋白的大量点突变已被证实在各种肿瘤实体中驱动恶性肿瘤。定位于STAT3 dna结合区域的错义突变D427H先前在NK/T细胞淋巴瘤患者中有报道。为了评估这个错义突变的生物活性,我们将STAT3-D427H突变与野生型(WT)蛋白以及已知的超活性突变F174A进行了比较。
结果
尽管此前报道的STAT3-D427H突变是一种激活突变,但与WT蛋白相比,STAT3-D427H突变既没有表现出细胞因子诱导的酪氨酸磷酸化升高,也没有改变核积累。然而,D427H突变体与stat特异性DNA结合位点的结合增强了,但序列特异性和与DNA的分离率降低了,这在电泳迁移率漂移试验中得到了证实。这一观察结果与STAT1蛋白中同源E421K突变的表型一致,该突变也表现出与DNA的结合增强,但缺乏相应的转录活性增加。
结论
根据我们的数据,STAT3蛋白中的D427H错义突变不太可能具有WT分子以外的致癌潜力。
背景
信号转导和转录激活因子(STATs)是一组细胞因子驱动的转录因子,可启动和调节细胞内的众多增殖和免疫过程[1].高度保守的STAT信号通路被无数的细胞因子和生长因子用来影响细胞功能。在响应细胞因子刺激时,STATs被细胞因子受体相关的Janus激酶(JAKs)激活,该激酶磷酸化STAT转激活域的关键酪氨酸残基。这促进了二聚和随后的核易位,启动细胞因子响应基因的转录。所有的STATs都有一个共同的结构组织,由6个结构域组成:1)氨基末端结构域,2)螺旋线圈结构域,3)dna结合结构域,4)连接结构域,5)src同源结构2 (SH2)结构域,以及(6)c末端transactivation结构域[2,3.].在人类STAT家族中,STAT3最初被确定为急性期反应因子(APRF),在肝脏炎症中被白细胞介素-6 (IL-6)快速激活。深入的研究表明,APRF在对干扰素-γ (IFNγ)的反应中被额外激活,并与其他发现的STAT家族成员具有同源性[4].IL-6细胞因子家族通过由膜糖蛋白130kda (gp130,也称为IL-6Rβ)组成的异二聚体受体发挥作用。gp130受体与细胞内的JAKs结合,使STAT3的转激活区域的酪氨酸残基705磷酸化[5,6,7].STAT3单体可以以两种可能的方向二聚:要么通过磷酸酪氨酸和SH2结构域的相互作用形成平行二聚体,要么通过线圈结构域和dna结合结构域的分子间相互作用形成反平行二聚体[8,9,10,11].
通过IL-6和其他细胞因子的激活,STAT3参与了许多免疫过程,包括诱导肝脏急性期蛋白,刺激淋巴细胞中的细胞增殖和分化,维持胚胎干细胞的多能性,抑制凋亡[1,12].STAT3蛋白的致癌突变已被确认,其中其超磷酸化、过早核保留、增强的dna结合亲和力以及随后靶基因的上调已知可驱动肿瘤发生的几个特征,包括转移、免疫逃避和耐药性。由于STAT3在细胞增殖和分化中的调节作用,它的突变与几种癌症的不良预后有关。在t细胞大颗粒淋巴细胞白血病(T-LGL)患者中已经发现了STAT3的SH2结构域的几个激活突变,如D661V和D661Y [13].据报道,V637M突变会导致高ige综合征,而Y640F突变则与几种恶性肿瘤的发生有关[14].STAT3的dna结合结构域和卷曲结构域也被报道含有引起自身免疫和淋巴增生的突变[15].
在成熟t细胞淋巴瘤及其亚型(外周t细胞淋巴瘤(PTCL)和NK/ t细胞淋巴瘤(NKTL)患者中,STAT3是最常突变的基因之一[16].此前在成熟t细胞淋巴瘤患者中发现了四种新的STAT3突变(D427H, E616G, E616K和E696K),并根据FATHMM(通过隐马尔可夫模型进行的功能分析)评估报告了其损伤和功能获得(GOF)。与野生型(WT)分子相比,这些突变体被描述为构成性过磷酸化,并增加了STAT3靶基因的转录[16].由于STAT3中的D427H替换与STAT1中的E421K突变同源,我们选择研究与疾病相关的D427H突变的高活性背后的分子机制。STAT1的E421K突变体显示伽马激活位点(GAS)结合增强,与DNA的脱出率低,基因激活显著降低[17].因此,我们对STAT3中D427H突变可能增加的致癌潜力很感兴趣,并取代了Asp427在与组氨酸(D427H)的dna结合域通过位点定向突变。然后将该突变体的表型与WT蛋白和之前的特征进行比较,激活STAT3卷曲圈结构域的GOF突变F174A,该突变被用作阳性对照[18].
材料和方法
质粒,诱变和细胞培养
本研究使用两个表达质粒进行研究,分别是编码带有绿色荧光蛋白(GFP)的小鼠全长STAT3 cDNA的羧基末端融合蛋白的pSTAT3-GFP和带有SNAP标签的pSTAT3-SNAP [10,18].这两个载体是来自德国亚琛工业大学Universitätsklinikum Gerhard教授Müller-Newen的友好礼物。使用Stratagene公司的QuikChange II试剂盒进行定点突变,在表达质粒中引入点突变。为此,我们使用了以下带有突变密码子下划线的引物(仅显示正向引物):
D427HF;5´- GGAGGCCGTGCCAATTGT猫GCCTCCTTGATCGTGACTG´3,
F174AF;5´- CTCCAGGACGACTTTGAT海湾合作委员会AACTACAAAACCCTCAAG´3,
所有点突变均通过标准双脱氧端DNA测序(Microsynth Seqlab, Göttingen)确认,并将生成的载体用于转染实验。除了HeLa-S3细胞外,为了控制共表达STAT1对STAT3信号转导的干扰,我们还将STAT1阴性的U3A细胞转染相应的质粒[19].这些细胞株是来自英国诺丁汉大学Uwe vinkmieier教授的礼物。细胞在5%的湿润CO中培养2在37°C Dulbecco 's modified Eagle 's medium (DMEM)中(用于U3A细胞;PAA实验室)或罗斯威尔公园纪念研究所1640培养基(RPMI)(用于HeLa细胞;添加10%胎牛血清(FCS;Biochrom), 100 IU/ml青霉素,100 IU/ml链霉素,0.04 μg/ml嘌呤霉素(仅对U3A细胞;Sigma-Aldrich)。细胞转染MegaTran2.0 (Origene),第二天用25 ng/ml重组人IL-6 (Gibco)或50 ng/ml重组人IFNγ (Biomol)按指示时间刺激细胞。对于EMSA提取物,用指示的细胞因子刺激stat3变体表达细胞30分钟。
蛋白质提取与检测
表达带有GFP-或SNAP标记的重组STAT3的细胞生长在6孔培养皿中,在50 μ l的细胞质提取缓冲液(20 mM HEPES, pH 7.4, 10 mM KCl, 10% (v/v)甘油,1 mM EDTA, 0.1 mM Na)中冰溶5 min3.签证官4, 3 mM 1,4-二硫苏糖醇[DTT], 0.1% IGEPAL-CA-360, 0.4 mM Pefabloc [Sigma-Aldrich], Complete Mini蛋白酶抑制剂[Roche])。裂解物在4℃和16000克的温度下离心15秒。将上清再次旋转5分钟,作为细胞质提取物收集。从第一步离心保留的球粒被重新悬浮在50 μ l的核提取缓冲液中(20 mM Hepes, pH 7.4, 420 mM KCl, 20% (v/v)甘油,1 mM EDTA, 3 mM DTT, 0.1 mM Na)3.签证官4、0.4 mM Pefabloc和Complete Mini蛋白酶抑制剂),并在冰上孵育30分钟。随后,这些样品在4°C、16000 g条件下离心15分钟,作为核提取物收集。每个样品混合等量的核提取物和相应的细胞质提取物。然后在十二烷基硫酸钠(SDS)样品缓冲液中煮沸3分钟,用10% SDS -聚丙烯酰胺凝胶电泳(PAGE)进行解析,然后转移到聚偏二氟乙烯(PVDF)膜上。然后用含有0.05% Tween-20的tris缓冲盐水中的25%牛血清白蛋白阻塞膜。然后将这些印迹与单克隆phospho- tyr705特异性STAT3抗体D3A7或单克隆泛STAT3抗体D1B2J孵育,这两种抗体都来自《细胞信号》(Cell Signaling),经过三个洗涤步骤后暴露于偶联的二级抗兔IRDye 800CW抗体(LI-COR)。利用LI-COR Odyssey成像系统检测膜上的结合免疫反应性。pSTAT3波段强度归一化为每个变量和刺激条件下STAT3总量的对应量。
荧光显微镜
利用直接荧光显微镜监测IL-6-和ifn γ-诱导的U3A和HeLa细胞中STAT3变异体核积累的动力学[18].如所示,表达GFP或snap标记STAT3的细胞在8孔室玻片中被细胞因子刺激。用New England Biolabs的SNAP-Cell TMR-Star底物对细胞进行30分钟的SNAP-tag STAT3染色。之后,细胞用预热的培养基洗涤三次,在细胞因子刺激前在培养基中休息30分钟。在刺激结束时,细胞在室温下用4%的多聚甲醛磷酸盐缓冲盐水(PBS)固定15分钟,然后用5 μg/ml的Hoechst染料33258 (Sigma-Aldrich)染色10分钟。对于抗体染色,在细胞因子刺激后,表达GFP或snap3标记的细胞,用甲醇在-20°C固定15分钟,然后用1% Triton X-100/PBS在室温下(RT)渗透20分钟。为了使非特异性结合位点饱和,细胞用25% FCS在PBS中处理45分钟,同时摇晃。然后用一抗(单克隆兔phospho- tyr705特异性STAT3抗体,细胞信号,D3A7;在25% FCS/PBS中1:1000)。然后用PBS冲洗细胞三次。用于一级磷酸- stat3抗体的检测,来自山羊的cy3偶联抗兔IgG二抗(Jackson免疫研究实验室,美国; 1:1000 in 25% FCS/PBS) was added and incubated for 45 min at RT while being shaken, followed by nuclear staining. Slides were mounted in a fluorescence mounting medium, which was obtained from Southern Biotech. Intracellular fluorescence staining patterns were visualized using a Nikon Eclipse Ti fluorescence microscope, which was equipped with appropriate filters. Images taken with a Nikon DS-Qi2 camera were further processed with the NIS elements software (Nikon). Nuclear and total cellular fluorescence intensities were determined using ImageJ (NIH) and normalized to the background intensity of the respective images. Mean nuclear-to-total cellular fluorescence intensity ratios including their standard deviations were calculated from 20 randomly selected transfected cells, for each variant.
电泳迁移率迁移试验
通过电泳迁移率转移试验(EMSA)检测STAT3蛋白与含有单一硅诱导元件(SIE)/GAS元件的特异性或突变双寡核苷酸的结合。表达重组STAT3的IL-6或ifn γ刺激细胞的细胞提取物(4µl)与EMSA反应缓冲液(8µl)孵育,缓冲液含有非特异性的合成竞争对手聚脱氧肌苷-脱氧胞苷酸和1ng [33P]标记的双寡核苷酸探针,它是由末端填充反应使用Klenow片段(新英格兰Biolabs)产生的。一个双链寡核苷酸M67带有一个单一的、典型的SIE/GAS位点,用于测试STAT3变体的结合(SIE/GAS位点有标记,反义寡核苷酸未显示):5´-TTTTCGACATTTCCCGTAAATCTG——´3。为了检测STAT3突变体的序列特异性DNA结合的变化,我们使用了附加的具有两个完整GAS位点串联定位(2xGAS)或一个完整GAS位点(GAS-non -GAS)或无GAS位点(2xnon-GAS)的寡核苷酸:
2的xga;5 ' -TTTTCGTTTCCCCGAAATTGACGGATTTCCCCGAAAC - 3,
GAS-nonGAS;5 ' -TTTTCGTTTCCCCGAAATTGACGGATTTACCCCAAC - 3,
2 xnongas;5 ' -TTTTCGTTTACCCCAAATTGACGGATTTACCCCAAC - 3所示。
在竞争实验中,细胞提取物与[33P]标记的双工M67寡核苷酸在EMSA缓冲液中RT处理15分钟。随后,加入750倍摩尔的未标记M67 DNA,在冰上放置10分钟。反应加载在4.8%丙烯酰胺:双丙烯酰胺(29:1)凝胶上,4℃,400 V分离。使用激光磷酸化成像系统Typhoon FLA 9500 (GE Healthcare Life Sciences)在真空干燥凝胶上可视化序列特异性DNA结合。放射自显像上STAT3变异对应的带强度,要么测量为绝对值,要么除以快速迁移的非特异性带强度,将其视为加载控制,并在图中用星号标记。
报告基因检测和实时PCR
在转染的U3A细胞中研究STAT3介导的启动子激活,使用的载体编码荧光素酶报告子,在转录起始位点上游的启动子区含有ifn γ诱导的Ly6E GAS元件的三个拷贝[20.,21],如我们先前的论文所述[18].在48孔板上生长的U3A细胞在每个孔中共转染三种载体:荧光素酶报告基因3xLy6E (70 ng), β-半乳糖苷酶质粒(200 ng),以及编码GFP或snap标记的WT或突变STAT3的表达质粒(250 ng)。转染24小时后,细胞要么不处理,要么用IL-6或ifn - γ处理6小时,然后用含有25 mM甘氨酸、1% Triton X-100、15 mM MgSO的裂解缓冲液制备细胞提取物44 mM EGTA, 0.4 mM Pefabloc, 3 mM DTT, pH 7.8,完全蛋白酶抑制剂。报告基因的表达通过Promega公司的荧光素酶检测系统进行评估,该系统使用了Centro KS LB960发光仪(Berthold Technologies)。荧光素酶的表达首先归一化为β-半乳糖苷酶的活性,在420 nm波长下测定相应样品的光谱。对每种STAT3变体和刺激模式分别进行5次独立转染测试,实验重复进行。
为了测试内源性靶基因诱导,表达STAT3-GFP的U3A细胞在添加1% FCS的Dulbecco改良Eagle培养基中培养18小时,然后用IL-6或IFNγ刺激3小时。使用peqGold总RNA试剂盒(VWR Lifesciences)从细胞中分离RNA。第一链cDNA合成使用Verso cDNA synthesis kit(赛默飞世尔科技公司)进行。实时PCR反应在20µl的体积中进行,其中包含25 ng cDNA,每个特异性引物70 nM, 10µl的绝对蓝qPCR SYBR Green Mix (Thermo Fisher Scientific)。根据国家生物技术信息中心(NCBI)提供的序列数据,使用了以下引物对:
hCyclinD1F;5' -cgg TGT CCT act tca aat gt-3 ',
hCyclinD1R;5' -atg gag TTG TCG GTG标签at-3 ',
hc-MycF;5´-GGTCTTCCCCTACCCTCTCAACGA´3,
hc-MycR;5´-GGCAGCAGGATAGTCCTTCCGAGT´3,
hGAPDHF;5´-GAAGGTGAAGGTCGGAGTC——´3,。
hGAPDHR;5´-GAAGATGGTGATGGGATTTC——´3。
PCR方案包括95°C变性15 min, 95°C变性15 s, 55°C退火30 s, 72°C延伸30 s, 40个循环。在最后的扩增步骤后,对Eppendorf Mastercycler ep realplex 2进行熔化曲线分析,在0.5°C的增量步骤中使用60°C到95°C的温度梯度,并在每个温度下测量10 s的荧光。对目标转录本的相对表达进行归一化处理GAPDH基因。的△△根据公式2,采用ct法比较相对表达量−(△Ct目标−△Ct参考样品).所有实时PCR反应均在两个独立的重复反应转染实验中进行。
数据分析
使用ImageJ (NIH)软件处理数字图像,使用CorelDRAW Graphics Suite 2019创建数据图形。计算每个STAT3变量和刺激条件的平均值和标准差。使用GraphPad PRISM程序分析数据。两组之间的差异用Student 's进行评估t以及,p-value≤0.05为差异有统计学意义。
结果
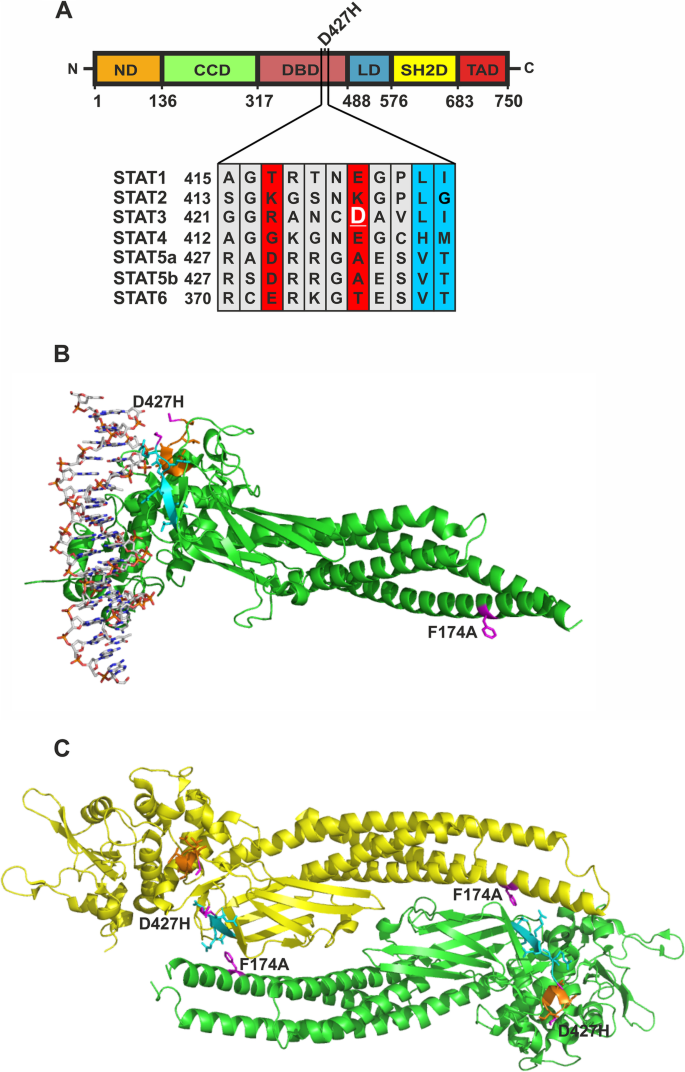
残基D427位于STAT3 DNA结合结构域的一个灵活区域,在空间上接近DNA
在常见的STAT模块结构中,所有STAT蛋白的dna结合域都相当保守。STAT3家族成员的序列比对显示,STAT3的427位有一个带负电的氨基酸残基。1A).在dna结合的STAT3二聚体的晶体结构中,D427残基的位置没有被解析,因为该区域的结构灵活性使其原子坐标无法精确定义。在无花果。1B和C,残基D427的相邻序列分别用青色(向n端)和橙色(向C端)标记。从图中可以看出这一点。1B点突变D427H的序列区域本身必须与DNA有密切的空间关系,尽管该区域具有空间灵活性。由于与DNA的空间距离较大(图。1B, C),线圈-线圈结构域的突变F174A对dna结合没有影响,但F174残基实质上参与了STAT3二聚体反平行构象的形成(图1)。1C)。
一个- - - - - -C: D427残基定位于STAT3的dna结合区域,但由于该区域的空间弹性,其原子坐标无法精确定义。一个对七个STAT家族成员D427残基周围区域的多重序列比对显示,STAT1、STAT3、STAT4和STAT6在同源位置上包含极性氨基酸。BSTAT3结合到DNA的晶体结构突出了突变D427H周围的区域和关键点突变F174A的位置(仅显示一个原聚体)。D427到氨基末端的周围区域用青色标记,而羧基末端的区域用橙色突出显示。两侧D427的相邻残基以及线圈结构域的F174残基用洋红色突出显示。CSTAT3的反平行二聚体的晶体结构显示如上所述的相同的残基和区域。并行STAT3二聚体的结构数据来自蛋白质数据库(pdb)文件4E68 [8和6TLC [11]用于STAT3反平行二聚体,并使用PyMOL进行修饰(De Lano Scientific)
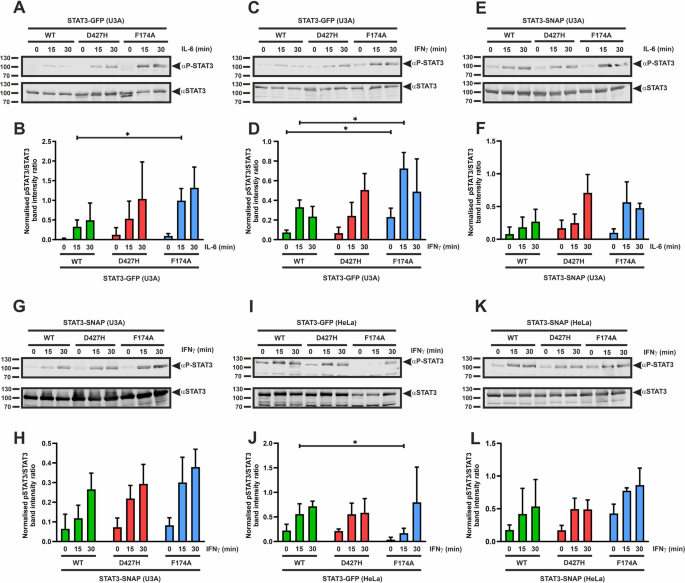
STAT3-D427H的磷酸化动力学与WT蛋白相比没有变化
为了研究dna结合区域D427残基突变后STAT3酪氨酸磷酸化的变化,我们使用IL-6或ifn γ刺激的表达STAT3变体的stat1缺陷U3A细胞的裂解液进行了Western-blotting实验(图1)。2).我们用编码gfp标记的STAT3变异的质粒瞬时转染U3A细胞,并在第二天用25 ng/ml的IL-6或50 ng/ml的ifn - γ刺激其0、15和30分钟,然后再提取总蛋白。如图所示。2a - d, STAT3-D427H显示酪氨酸磷酸化水平与WT蛋白相似。我们还检测了U3A细胞中表达的snap标记STAT3-D427H的酪氨酸磷酸化的时间依赖性,这与WT的磷酸化动力学没有显著变化(图1)。2情况)。此外,在ifn γ刺激的HeLa细胞的裂解物中也可以看到D427H突变体不变的磷酸化。2我)。相比之下,与WT和D427H蛋白相比,F174A突变体表现出过磷酸化,这是因为它未能稳定STAT3去磷酸化所必需的反平行二聚体构象[18].
一个- - - - - -l: D427H突变不会改变细胞因子刺激下STAT3的酪氨酸磷酸化。U3A和HeLa细胞转染GFP/ snap标记的STAT3变体,随后用不同的细胞因子在指定的时间内刺激。一个用25 ng/ml的重组IL-6处理0、15和30分钟后,表达gfp标记STAT3蛋白的U3A细胞全细胞提取物的代表性免疫印迹,并从三个独立转染实验中定量(B).采用gfp标记的STAT3变异在50 ng/ml IFNγ刺激后进行类似的实验,如代表性免疫印迹所示(C)和三个独立转染实验的量化结果(D).E用重组IL-6处理0、15和30分钟后表达snap标记STAT3变异的U3A细胞的全细胞提取物进行Western blot检测,并从三个独立转染实验中量化其数量(F).G表达snap标记STAT3突变体的U3A细胞在重组ifn - γ处理0、15和30分钟后的全细胞提取物的代表性免疫印迹,以及三个独立转染实验的定量结果(H).我- - - - - -lWestern-blotting实验显示,与WT和阳性对照F174A相比,表达STAT3变异体的HeLa细胞的STAT3- d427h酪氨酸磷酸化动力学不变,随后用50 ng/ml ifn - γ刺激相应的时间。我ifn - γ刺激表达gfp标记STAT3突变体的HeLa细胞全细胞提取物的代表性免疫印迹及其三个独立转染实验的定量(J).对snap标记的STAT3变体进行了类似的实验,如代表性免疫印迹所示(K)和三个独立转染实验的量化结果(l).三次独立实验的平均值±标准差p≤0.05。箭头表示各自感兴趣的STAT3-GFP或STAT3-SNAP条带
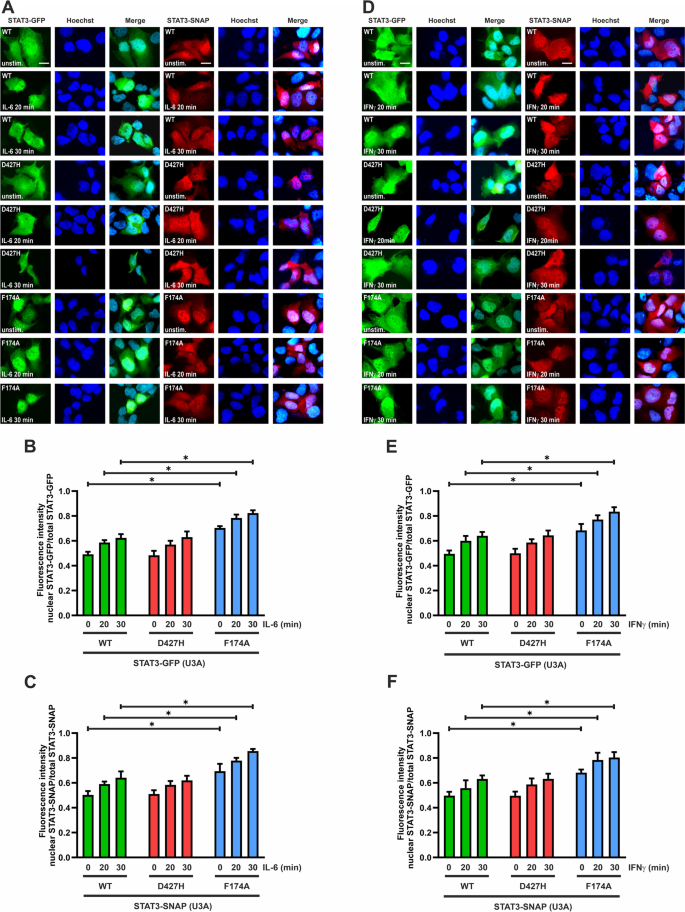
STAT3-D427H的核积累动力学与WT蛋白相似
STAT3过早或长时间的核积累可能与它的高活性和致癌潜力有关。因此,我们通过直接和间接免疫荧光实验检测了D427H突变对STAT3核质分布的影响。用表达GFP和snap标记的STAT3变异的质粒转染U3A细胞,并在第二天用IL-6或ifn - γ刺激,持续指定的时间。刺激后,表达SNAP标记结构的细胞被荧光标记的底物染色,用于SNAP标记的酶切和随后的可视化。随后,表达GFP和snap标记的STAT3变异体的细胞通过抗STAT3的磷酸酪氨酸705抗体进行间接免疫荧光染色。
图中的荧光显微照片。3.显示在细胞因子刺激之前,GFP和snap标记的STAT3-WT主要是细胞质的,并随着细胞因子暴露时间的增加在细胞核中逐渐积累。虽然WT和D427H突变体之间的静息分布没有观察到差异,但阳性对照STAT3-F174A在刺激前已经显示出明显的核存在。然而,尽管据报道具有增强的致癌潜力,gfp标记的STAT3-D427H在IL-6刺激下的核积累动力学方面与WT-GFP没有区别(图1)。3.A, B)。在IL-6暴露后,snap标记的STAT3-D427H也以与WT-SNAP蛋白类似的方式积累(图4)。3.A、C)。
一个- - - - - -F: D427H突变不改变细胞因子诱导的STAT3核易位。U3A细胞转染GFP和snap标记的STAT3变体,并用25 ng/ml的IL-6或50 ng/ml的ifn - γ按指示时间刺激。一个荧光显微图显示了GFP/ snap标记的WT和突变的STAT3在细胞内的分布,以及IL-6刺激细胞中相应的hoechst染色核的定位。直方图显示了D427H-GFP (B)和D427H-SNAP (C)核积累量与用IL-6刺激后的WT相比,由核与总荧光强度之比确定(n= 3个独立转染)。D荧光显微镜显示了GFP/ snap标记的WT和突变的STAT3细胞内的分布,以及IFNγ刺激后对应的hoechst染色核的定位。直方图显示了D427H-GFP (E)和D427H-SNAP (F)核积累量与WT蛋白相比,由核与总荧光强度之比确定(n= 3个独立转染)。的±标准差n= 20个*单元格p≤0.05
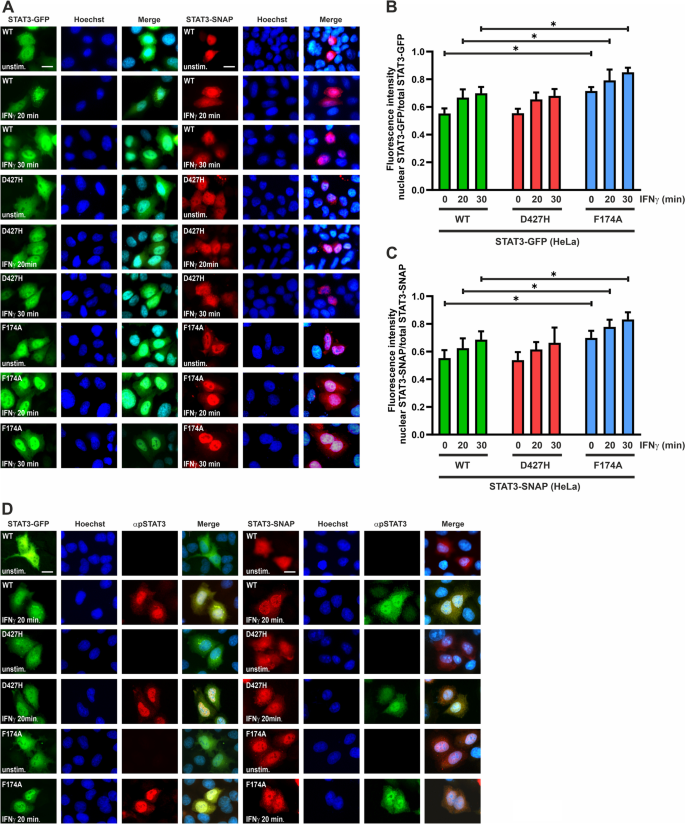
我们还测试了IFNγ刺激下STAT3变体的核积累。与相应的WT融合蛋白相比,SNAP和gfp标记的D427H突变体的核积累均未发生改变。3.D-F)。无论使用的细胞因子是什么,与WT相比,GFP和snap标记的F174A突变体都表现出了增强的核积累。我们还在表达GFP或snap标记的突变体的HeLa细胞中测试了IFNγ刺激后STAT3-D427H核积累的动力学。与WT蛋白相比,突变体D427H表现出细胞因子诱导的核积累动力学不变,而阳性对照F174A表现出过早的核存在和增强的核积累(图4)。4a - c)。另外,表达STAT3变体的HeLa细胞用抗磷酸化酪氨酸705表位的抗体进行染色,以进一步显示酪氨酸磷酸化的STAT3。随后用cy3标记的(红色)二抗体对表达STAT3-GFP的细胞进行染色,而表达STAT3-SNAP结构的细胞则用cy2标记的(绿色)二抗体进行染色。用磷酸酪氨酸特异性STAT3抗体对细胞进行染色,证实了IFNγ刺激后激活蛋白的易位。4D)。
一个- - - - - -D:细胞核-细胞质易位不变。得了用编码了GFP或snap标记的STAT3突变体的表达质粒转染HeLa细胞,并用50 ng/ml的重组IFNγ刺激指定的时间。荧光显微照片显示,与作为阳性对照的超磷酸化F174A突变体相比,D427H-GFP和D427H-SNAP的核积累未发生变化。直方图显示了三个独立实验中核STAT3-GFP/-SNAP作为细胞总GFP/SNAP强度的比率的量化结果(n= 3)。D使用针对STAT3中磷酸化酪氨酸705残基的抗体进行间接免疫荧光,证实了转染HeLa细胞中磷酸化STAT3在IFNγ刺激下的易位。在HeLa细胞中转染GFP和snap标记的STAT3变异体,并将其与50 ng/ml重组ifn - γ进行指示时间的刺激。这些细胞被固定,并用抗phospho-STAT3抗体染色,然后是二抗(表达STAT3-GFP的细胞为Cy3(红色),表达STAT3-SNAP的细胞为Cy2(绿色))。的±标准差n= 20个*单元格p≤0.05
STAT3-D427H显示dna结合活性增加,转录反应未改变
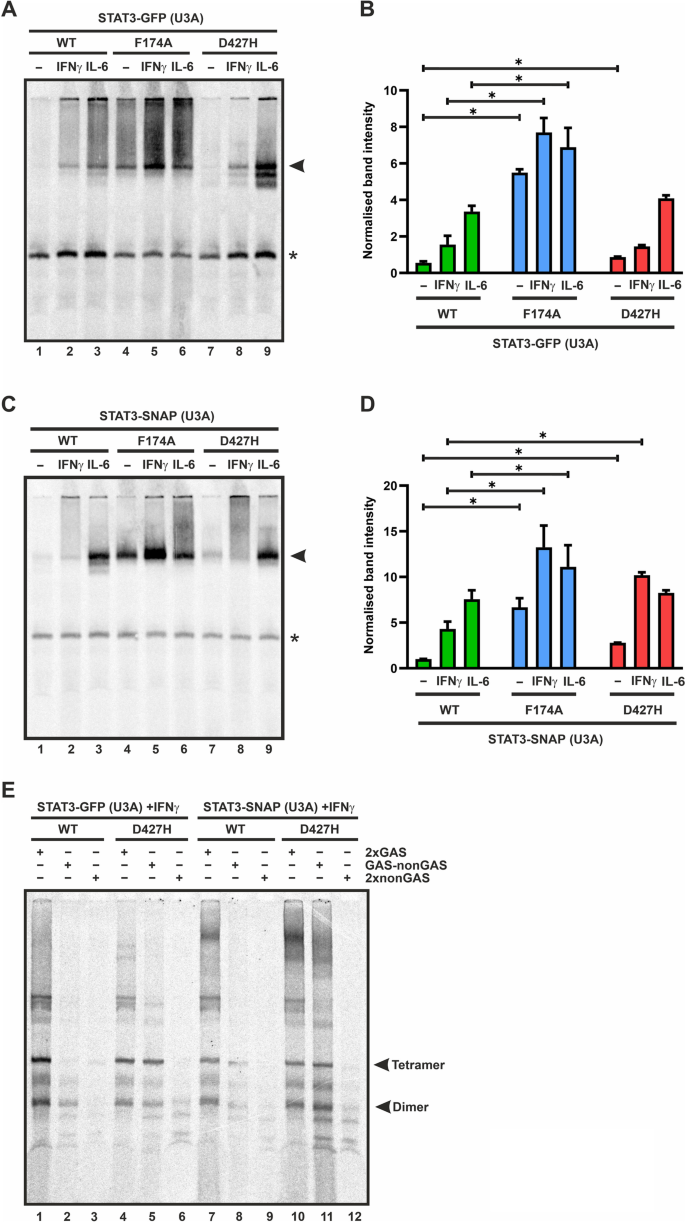
由于在DNA结合的STAT3的晶体结构中,它在空间上接近DNA(图。1B),我们研究了D427H突变体的dna结合活性,通过电泳迁移率移位测定。从表达STAT3变异的未处理或细胞因子处理的U3A细胞中提取的总细胞提取物用[33P]-放射性标记的M67探针,包括单一的高亲和力GAS结合位点。生成的dna结合的STAT3复合物通过电泳分离和放射自显影检测。在细胞因子的刺激下,与WT蛋白相比,STAT3-D427H突变体显示出了更高的dna结合能力。5模拟)。STAT1中同源突变体E421K的dna结合活性也有增强的报道[17].
一个- - - - - -E: D427H突变体DNA亲和力增加。使用IL-6-和ifn γ-刺激的表达STAT3-GFP/- snap变体的U3A细胞的裂解液进行电泳迁移率转移试验(EMSA)。33P]-含有一致GAS序列的放射性标记DNA探针。放射自显像显示D427H-GFP突变体的dna结合增加(一个,B)和D427H-SNAP突变体(C,D)对单个GAS元素(M67)进行细胞因子刺激,与WT蛋白相比,并与阳性对照F174A突变体相似,包括从三个独立转染实验中量化的结果。EGelshift显示STAT3-D427H突变体的序列特异性降低。转染GFP或snaps标记的STAT3变体的ifn γ刺激的U3A细胞的整个细胞提取物,用放射性标记的DNA探针孵育,其中包括两个串联定位的完整GAS位点(2xGAS),一个半GAS位点(GAS- nongas),或无GAS元素(2xnonGAS)。dna结合的STAT3通过电泳分离并在放射自显像中显示。三次独立实验的平均值±标准差p≤0.05。箭头表示各自感兴趣的STAT3-GFP或STAT3-SNAP条带
然后我们测试了D427H突变体与DNA上高亲和力stat特异性位点结合的特异性。这是通过孵育表达STAT3变异体的IFNγ刺激细胞的全部细胞提取物来实现的,DNA探针具有两个串联定向的完整GAS位点(2xGAS),或一个完整和一个部分GAS位点(GAS- nongas),或没有GAS位点(2xnonGAS)。如前所述,与STAT3-WT相比,STAT3-D427H与gas -non - As序列的四聚体和二聚体结合增强,而STAT3-WT结合弱且主要作为二聚体(图3- wt)。5E, 2号和5号车道,8号和11号车道)。D427H突变体甚至与2xnonGAS有弱结合(图。5E, 6车道和12车道)。
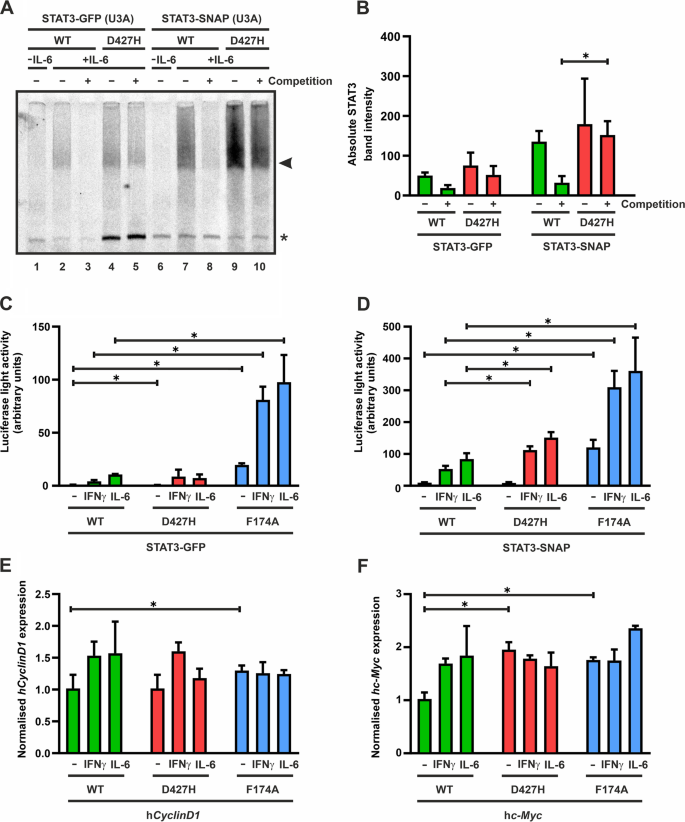
为了进一步研究D427H突变是否对DNA上GAS位点的解离有任何影响,我们进行了竞争实验,通过在放射性标记的M67 GAS探针上挑战预先形成的STAT3复合物,使用750倍摩尔多余的未标记的双链M67寡核苷酸。如图所示。6A和B,与WT蛋白相比,气体结合突变体D427H在竞争反应中完全丢失了放射性标记的气体结合STAT3,而在添加过量的未标记寡核苷酸时,D427H与DNA的解离显著减少,并抵抗竞争。这表明,带负电荷的天冬氨酸残基与带正电荷的组氨酸在427位的互换增加了STAT3对DNA上GAS位点的亲和力,同时降低了其特异性和从DNA上解离。
一个- - - - - -F: STAT3中的D427H突变显著减少了其与DNA的分离,但不显著改变转录活性。一个,B电泳迁移率移位实验显示,在与750倍摩尔剩余的未标记M67 GAS探针竞争时,D427H络合物从DNA上的放射性标记M67 GAS位点解离减少。表达il -6刺激的U3A细胞的GFP-和SNAP-STAT3提取物与[33P]-放射标记M67探针15分钟,然后加入多余的未标记GAS探针10分钟。放射自显像显示STAT3-D427H在DNA上停留时间增加(一个)和三个独立转染实验的量化结果(B).箭头表示各自感兴趣的STAT3-GFP或STAT3-SNAP条带。C,D荧光素酶报告基因在重组U3A细胞中表达gfp标记的(C)或snap标记的STAT3变体(D)归一化至组构共表达的β-半乳糖苷酶的表达水平。在这些实验中使用的报告结构包含三个GAS位点Ly6E基因(3xLy6E)。在荧光素酶发光前,用50 ng/ml的重组IFNγ或25 ng/ml的IL-6刺激细胞6小时,并在全细胞提取物中测定共表达的β-半乳糖苷酶的酶活性。该实验在6个独立的转染中重复了至少3次。E,F利用实时荧光定量PCR技术检测STAT3突变体的内源基因表达。数据描述的表达水平CyclinD1(E),原癌基因(F)基因在IL-6或IFNγ刺激3 h前后。基因诱导归一化为管家基因的表达GAPDH.直方图显示均值和标准差,其中与WT蛋白比较的显著差异用星号标出。实验在两次独立转染中重复三次
基于D427H突变对STAT3 dna结合的影响,我们下一步研究STAT3-D427H dna结合能力的增强是否对应于转录活性的增强。为此,我们在U3A细胞中通过合成的荧光素酶报告基因构建物3xLy6E进行报告基因检测,3xLy6E在其启动子区包含三个GAS结合位点[20.].由于在这些基因表达实验中,内源性STAT3可能会干扰过表达的重组GFP或snap标记变体的结果,我们首先用Western blot实验定量了内源性STAT3表达与细胞总STAT3表达的比例。与转染的重组GFP或snaps标记的STAT3变体相比,内源性STAT3表达非常低(il -6刺激的细胞中为14.7±3.9%,ifn γ刺激的U3A细胞中为11.5±3.4%)。在共表达重组snap标记STAT3的转染细胞中,与细胞内STAT3总池相比,原生STAT3的比例同样低(IL-6中为7.8±1.2%,ifn γ处理的细胞中为11.5±3.4%)。
用编码STAT3变异的质粒、荧光素酶报告构建物和编码β-半乳糖苷酶的质粒(作为转染对照)转染U3A细胞。第二天,IL-6或ifn - γ刺激细胞6小时。如图所示。6C、D、补充数据1,与相应的WT蛋白相比,GFP和snap标记的D427H突变体的报告活性没有或只有轻微的变化,而阳性对照的F174A突变体的报告活性最高,这与以往的研究一致[18].
我们还通过实时荧光定量PCR (real-time PCR, qPCR)实验检测了突变体D427H诱导STAT3靶基因的效果。转染STAT3变异体的U3A细胞血清饥饿18小时,然后用IL-6或ifn - γ刺激3小时。从受刺激的细胞中提取RNA,转化为cDNA进行qPCR实验。突变体D427H没有表现出诱导CyclinD1而且原癌基因这些基因超过了WT蛋白或F174A突变体诱导的水平。6E, F,补充数据2).令人惊讶的是,与WT蛋白相比,D427H突变体中dna结合的增加并没有转化为更高的转录激活。同源STAT1-E421K突变的行为也报告了这一点,其中DNA上较高的停留时间并不会导致更高的靶基因诱导[17].
讨论
在这项研究中,我们描述了STAT3 dna结合区域的D427H突变,该突变之前在成熟t细胞淋巴瘤患者中被发现,其中其表现出过磷酸化和转录反应增加[16].为了研究从427位天冬氨酸与组氨酸交换中产生的这种超活性的分子机制,我们在含有羧基末端GFP-或snap -融合标签的STAT3编码质粒中引入了这种突变。我们的研究结果表明,STAT3-D427H表现出未改变的细胞因子诱导的酪氨酸磷酸化和核积累,但显示出与WT分子相比,STAT3-D427H在STAT3-D427H特异性位点上的dna结合能力增强。此外,D427H突变降低了STAT3对高亲和力GAS位点的特异性和STAT3- dna复合物的解离率。因此,STAT3- d427h中与DNA结合的增强并没有反映为荧光素酶报告活性和STAT3靶基因诱导能力的相应增加,其诱导水平没有超过WT蛋白诱导的水平。
虽然由于D427残基在DNA结合区域内固有的结构灵活性,无法确定其在STAT3的晶体结构中的位置,但已有报道称STAT1分子中的同源残基E421与DNA分子相邻,其侧链指向DNA双螺旋的主干[17].STAT1-E421K突变体表现出过磷酸化,核积累延长,DNA结合活性增强,与DNA的分离率显著降低,转录激活未改变。这一现象可以用带负电荷的谷氨酸残基与带正电荷的赖氨酸交换来解释,这增加了突变体与带负电荷的DNA双螺旋的结合亲和力,而不依赖于序列的特异性。
同样,在STAT3-D427H中看到的增强的DNA结合可以解释为,与带负电荷的天然天冬氨酸残基相比,带正电荷的组氨酸具有更高的亲和力。然而,在我们的实验中,427位置的氨基酸交换既没有改变细胞因子诱导的酪氨酸磷酸化,也没有改变STAT3- d427h的核积累,这强调了STAT3和STAT1在同源突变周围的不同行为。虽然STAT3-D427H和STAT1-E421K突变体的dna结合活性增强,但我们也观察到突变体STAT3-DNA复合体的解离率相似,这表明这两个同源突变体显示出相似但不相同的表型。此外,在缺乏互易磷酸酪氨酸- sh2相互作用的未磷酸化STAT3平行二聚体的替代晶体结构中,D427残基似乎对该结构的稳定性没有贡献[22].
有趣的是,STAT3-D427H对DNA亲和力的增强并没有反映为其转录激活的增加。这一现象表明STAT依赖的基因转录不仅依赖于STAT蛋白对GAS元素的亲和力,还表明存在一种额外的机制,使STAT- dna相互作用具有特异性。STAT3-D427H突变体不仅在特定位点上与DNA强烈结合,而且在非特异性序列上也强烈结合,非特异性序列通常存在于启动子区域之外。因此,突变体显示的增加的DNA结合被非gas序列的非特异性结合所抵消,导致内源靶基因的转录激活基本不变。这种机制在STAT1中已经被发现,其中STAT1连接子结构域的残基E559和E563调节STAT1从低亲和力位点的解离,残基K567使STAT1获得GAS识别[23].然而,STAT3蛋白中是否存在类似的机制目前尚不清楚。
激活STAT3蛋白中报告的突变通常会改变其一个或多个下游信号活性和/或与其他蛋白质和JAK-STAT通路成分的相互作用。在我们对STAT3-D427H的实验中,除了增加了与DNA的结合亲和力外,所有其他信号转导过程都不受影响。因此,我们假设残基D427部分调节了STAT3-DNA复合体在转录惰性位点的强度。这种天冬氨酸残基可能有助于选择高亲和力的GAS位点,通过与邻近的有助于GAS识别的残基相互作用促进STAT3-DNA复合体的形成。这一机制可能确保gas类或非gas序列由于缺乏序列识别而被排除在强STAT3-DNA复合体的形成之外。427位带负电荷的天冬氨酸在带负电荷的DNA骨架释放STAT3中起作用。
在我们的实验中,我们使用内源性缺乏STAT1表达的U3A细胞,以消除STAT1/STAT3异质二聚体的干扰,STAT1/STAT3异质二聚体在保留STAT1表达的细胞中不可避免地形成。我们选择了STAT1阴性的U3A细胞系,以消除STAT1交叉作用对重组STAT3变体细胞内行为的任何潜在影响。尽管与转染的GFP或snap标记的变体相比,这些细胞中内源性STAT3的表达水平较低,但仍可检测到原生STAT3的残留表达,这一事实必须被认为是我们研究的一个重要局限性。
在我们所有的实验中,我们将STAT3- d427h的行为与WT蛋白以及之前描述的STAT3卷曲结构域的激活突变F174A进行了比较。F174残基(STAT1中的F172)与dna结合域中的残基相互作用,稳定STAT3的反平行二聚体[18].该突变破坏了STAT3的反平行结合界面,使其构成平行二聚体,从而使其过度磷酸化,在细胞因子刺激下选择性核化,导致转录反应增加。由于与WT蛋白相比,STAT3- d427h的转录激活相对没有变化,因此这种对STAT3的二聚或核定位没有精确作用,但对dna结合亲和力只有中等影响的残基不太可能具有显著增加的致癌潜力。
总之,从我们的数据可以明显看出,D427H突变增加了STAT3的dna结合亲和力,但降低了序列特异性。尽管STAT3- d427h突变已被报道在NK/ t细胞淋巴瘤的发病机制中,但这种突变的单独存在不太可能显著增加STAT3分子的致癌潜力。我们认为STAT3-D427H突变如果有的话,对NK/ t细胞淋巴瘤的病因学只有轻微的影响。此外,我们的数据支持之前的研究,即对DNA亲和力的增加并不直接转化为STAT蛋白诱导靶基因的增加。这些转录因子具有附加的序列识别机制,有助于区分惰性位点,以确保响应细胞因子信号的最佳基因诱导。
结论
使用位点定向突变,我们研究了STAT3 dna结合区域的点突变D427H的表型,该点突变在NK/ t细胞淋巴瘤患者中表现出GOF行为。与GOF突变体F174A相比,我们的研究没有发现该突变体在STAT3的卷曲线圈结构域的过度激活。D427H突变显示未改变的细胞因子诱导的酪氨酸磷酸化、核积累和随后的STAT3转录激活。与STAT1中的同源突变相似,STAT3- d427h对DNA上STAT3特异性高亲和力GAS位点的特异性降低,与这些位点的分离率降低,表明该突变不具有严重影响STAT3信号转导的潜力。基于这些发现,我们得出结论,STAT3-D427H可能没有超过WT蛋白的致癌潜力,可能在NK/ t细胞淋巴瘤的发病机制中几乎没有意义或辅助作用。
数据和材料的可用性
本研究中使用的原始数据可向通讯作者提出合理要求。
缩写
- APRF:
-
急性相位响应因子
- DMEM:
-
杜尔贝科改良的鹰培养基
- 德勤:
-
二硫苏糖醇
- EDTA:
-
乙二胺四乙酸
- EGTA:
-
乙二醇-双(β-氨基乙醚)-N,N,N ',N ' -四乙酸
- EMSA:
-
电泳迁移率迁移试验
- FATHMM:
-
隐马尔可夫模型的泛函分析
- FCS:
-
胎牛血清
- GAPDH:
-
Glyceraldehyde-3-phosphate脱氢酶
- 气体:
-
Gamma-activated网站
- 绿色荧光蛋白:
-
绿色荧光蛋白
- GOF:
-
功能
- 玫瑰:
-
(4) - 2-Hydroxyethyl 1-piperazineethanesulfonic酸
- 干扰素:
-
干扰素
- IL:
-
白介素
- 木菠萝:
-
Janus激酶
- NKTL:
-
NK / t细胞淋巴瘤
- 页面:
-
聚丙烯酰胺凝胶电泳
- PBS:
-
磷酸盐
- 竞购:
-
外周t细胞淋巴瘤
- RPMI:
-
罗斯威尔公园纪念研究所
- SDS:
-
钠十二烷基硫酸盐
- PVDF:
-
聚乙二烯diflouride
- RT:
-
室温
- 您:
-
Sis-inducible元素
- qPCR:
-
实时聚合酶链反应
- SH2:
-
Src-homology 2
- 统计:
-
信号换能器和转录激活器
- T-LGL:
-
t细胞大颗粒淋巴细胞白血病
- WT:
-
野生型
参考文献
Levy DE, Darnell JE。统计:转录控制和生物学影响。细胞生物学杂志2002;3:651-62。
陈鑫,Vinkemeier U,赵颖,Jeruzalmi D, Darnell JE, Kuriyan J.酪氨酸磷酸化的STAT-1二聚体与DNA结合的晶体结构。细胞。1998;93(5):827 - 39。
摩尔细胞。2005;17(6):761 - 71。
Wegenka UM, Lütticken C, Buschmann J, Yuan J, Lottspeich F, Müller-Esterl W, Schindler C, Roeb E, Heinrich PC, Horn F白细胞介素6激活的急性期反应因子在抗原性和功能上与转录信号转换器和激活因子(STAT)家族成员相关。分子细胞生物学,1994;14(5):3186-96。
Heinrich PC, Behrmann I, Müller-Newen G, Schaper F, graves L.白细胞介素6型细胞因子通过gp130/Jak/STAT通路的信号传导。生物化学学报。1998;32 (Pt 2): 369 - 371。
Lütticken C, Wegenka UM, Yuan J, Buschmann J, Schindler C, Ziemiecki A, Harpur AG, Wilks AF, Yasukawa K, Taga T, Kishimoto T, Barbieri G, Pellegrini S, Sendtner M, Heinrich PC, Horn f转录因子APRF和蛋白激酶Jak1与白细胞介素-6信号转导器gp130的关系。科学。1994;263(5143):89 - 92。
Stat3:在表皮生长因子和白细胞介素-6的作用下酪氨酸磷酸化激活的STAT家族成员。科学。1994;264(5155):95 - 8。
贝克尔S,格罗纳B, Müller CW。Stat3β同型二聚体与DNA结合的三维结构。大自然。1998;394(6689):145 - 51。
Kretzschmar AK, Dinger MC, Henze C, broke - heidrich K, Horn F.利用荧光共振能量转移分析活细胞中Stat3(信号转换器和转录激活器3)二聚。生物化学与工程学报,2004;32(4):369 - 371。
Domoszlai T, Martincuks A, francenkamp D, Schmitz-van de Leur HS, Küster A, Müller-Newen G.与疾病相关的L78R突变对STAT3二聚和活性的影响。中华细胞科学杂志2014;127:189 - 910。
La Sala G, Michiels C, Kükenshöner T, Brandstoetter T, Maurer B, Koide A, Lau K, Pojer F, Koide S, Sexl V, Dumoutier L, Hantschel o利用单体靶向卷曲线圈和n端结构域选择性抑制STAT3信号Nat Commun。2020;11:4115。
STATs在转录控制中的作用及其对细胞功能的影响。致癌基因。2000;19(21):2468 - 73。
Koskela HL, Eldfors S, Ellonen P, van Adrichem AJ, Kuusanmäki H, Andersson EI, Lagström S, Clemente MJ, Olson T, Jalkanen SE, Majumder MM, Almusa H, Edgren H, Lepistö M, Mattila P, Guinta K, Koistinen P, Kuittinen T, Penttinen K, Parsons A, Knowles J, Saarela J, Wennerberg K, Kallioniemi O, Porkka K, Loughran TP Jr, Heckman CA, Maciejewski JP, Mustjoki S大颗粒淋巴细胞白血病中体细胞STAT3突变。英国医学杂志2012;366:1905-13。
de Araujo ED, Orlova A, Neubauer HA, Bajusz D, Seo HS, Dhe-Paganon S, kesergm, Moriggl R, Gunning PT. STAT3和STAT5 SH2结构域突变的结构意义。癌症。2019;11:1757。
Jägle S, Heeg M, Grün S, ren辛格-埃尔A, Maccari ME, Klemann C, Jones N, Lehmberg K, Bettoni C, Warnatz K, Grimbacher B, Biebl A, Schauer U, Hague R, Neth O, Mauracher A, Pachlopnik Schmid J, Fabre A, Kostyuchenko L, Führer M, Lorenz MR, Schwarz K, Rohr J, Ehl S激活STAT3突变的不同分子响应模式与淋巴增殖和自身免疫外显相关。Immunol。2020;210:108316。
宋tl, Nairismägi ML, Laurensia Y, Lim JQ, Tan J, Li ZM, Pang WL, Kizhakeyil A, Wijaya GC, Huang DC, Nagarajan S, Chia BK, Cheah D,刘雅华,张芳,饶慧玲,Tang T, Wong EK, Bei JX, Iqbal J, Grigoropoulos NF, Ng SB, Chng WJ, Teh BT, Tan SY, Verma NK, Fan H, Lim ST, Ong CK。STAT3通路的致癌激活驱动PD-L1在自然杀手/ t细胞淋巴瘤中的表达。血。2018;132:1146-58。
Koch V, Staab J, Ruppert V, Meyer T. DNA结合区域的两个谷氨酸残基参与了DNA中STAT1二聚体的释放。细胞生物学杂志,2012;13:22。
Menon PR, Doudin A, Gregus A, Wirths O, Staab J, Meyer t。STAT3转录因子中的反平行二聚体结合界面是细胞因子介导的信号转导失活所必需的。生物化学生物物理学报Mol Cell Res. 2021;1868(12): 11918。
Müller M,拉克斯顿C,布里斯科J,辛德勒C, imta T, Darnell JE Jr, Stark GR, Kerr IM。突变细胞系的互补:ISGF3的91 kDa多肽在干扰素-α和-γ信号转导通路中的中心作用。EMBO j . 1993; 12:4221-8。
Khan KD,帅K, Lindwall G, Maher SE, Darnell JE, Bothwell ALM。干扰素α/β和γ诱导Ly-6A/E基因需要一个酪氨酸磷酸化的91-kDa蛋白结合的DNA元件。美国国家科学研究院。1993; 90:6806-10。
Stat1和Stat3转录的最大激活需要酪氨酸和丝氨酸的磷酸化。细胞。1995;82:241-50。
任卓,毛旭,Mertens C, Krishnaraj R,秦静,Mandal PK, Romanowski MJ, McMurray JS,陈旭。未磷STAT3核片段的晶体结构。生物化学与生物物理学报。2008;374:1-5。
Hüntelmann B, Staab J, Herrmann-Lingen C, Meyer T. STAT1转录因子连接子域中的保守基序是识别和释放高亲和力dna结合位点所必需的。PLoS ONE。2014; 9: e97633。
确认
我们感谢Göttingen大学开放获取出版基金的支持。
资金
由Projekt DEAL支持和组织的开放获取资金。该课题的研究由Grun Stiftung资助TM、德国forschunggemeinschaft (DFG)资助OW (WI3472/10-1)和TM (ME1648/4-3和ME1648/11-1)。
作者信息
作者和联系
贡献
LSB、PRM、TM和JS构思和设计了研究,LSB、PRM、TM和JS进行了实验,LSB、PRM、AG、JS、OW、MJK和TM对数据进行了分析和讨论,PRM、JS、OW、MJK和TM撰写了手稿,并由所有合著者共同投稿。所有作者都已阅读并认可最终版本的手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用,因为本研究中既没有使用人类样本也没有使用动物样本。
同意出版
不适用。
相互竞争的利益
作者声明他们没有竞争利益。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
补充信息
附加文件1:补充数据1。
来自代表性报告基因分析的原始数据来自转染STAT3-GFP或STAT3-SNAP变体的U3A细胞,归一化到各自共转染的b-半乳糖苷酶活性。
额外的文件2:
补充数据2。原始数据来自转染STAT3-GFP变体的U3A细胞的代表性qPCR实验,归一化到管家基因的表达GAPDH.
额外的文件3。
来自Western blot和gelshift的原始数据。
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
贝伦森,l.s.,梅农,p.r.,汗,M.J.et al。STAT3转录因子中推测的淋巴瘤相关点突变D427H的评估。BMC分子和细胞生物学23, 23(2022)。https://doi.org/10.1186/s12860-022-00422-9
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12860-022-00422-9
关键字
- Lymphoma-associated错义突变
- 信号换能器和转录激活器3 (STAT3)
- 白细胞介素- 6信号
- DNA结合
- 基因表达