摘要
背景
肝细胞癌是一种常见的恶性肿瘤。长链非编码rna (lncrna)参与HCC的进展。然而,lncRNA MAPKAPK5-AS1在HCC发展中的作用尚未完全阐明。
方法
采用RNA测序数据和定量实时聚合酶链反应(qRT-PCR)分析肝癌组织和细胞系中MAPKAPK5-AS1、miR-429和ZEB1 mRNA的表达。Western blot检测ZEB1、E-cadherin、N-cadherin蛋白表达。采用3-(4,5-二甲基噻唑-2-基)-2,5-二苯基溴化四唑(MTT)、Transwell和流式细胞术分析MAPKAPK5-AS1对细胞增殖、迁移、侵袭和凋亡的影响。此外,荧光素酶报告基因检测检测miR-429与MAPKAPK5-AS1或ZEB1 3'UTR的靶向关系。采用异种移植肿瘤小鼠模型,探讨MAPKAPK5-AS1对肝癌细胞肺转移的影响。
结果
肝癌组织中MAPKAPK5-AS1和ZEB1表达上调,miR-429表达下调。MAPKAPK5-AS1敲低可显著抑制HCC细胞的增殖、迁移、侵袭和上皮间质转化(EMT),促进细胞凋亡。MAPKAPK5-AS1过表达可增强L02细胞的增殖、迁移、侵袭和EMT,抑制细胞凋亡。MiR-429被证实是MAPKAPK5-AS1的靶标,MiR-429抑制剂可以部分抵消敲低MAPKAPK5-AS1对HCC细胞的影响。MAPKAPK5-AS1可通过抑制miR-429正向调节ZEB1的表达。此外,当肝癌细胞中MAPKAPK5-AS1基因被敲低时,裸鼠肺组织中肺转移结节减少。
结论
MAPKAPK5-AS1可吸附miR-429促进ZEB1表达参与HCC的发生发展。
介绍
原发性肝癌是癌症相关死亡的第三大原因。肝细胞癌(HCC)是一种侵袭性恶性肿瘤,预后较差,是肝癌最常见的病理类型[1]。虽然手术、肝移植、化疗、靶向治疗、免疫治疗等治疗手段取得了重大进展,但HCC患者根治性切除后的5年生存率仅为10-15% [2,3.]。因此,需要准确地识别HCC进展的分子机制。
长链非编码RNA (lncrna)是非编码RNA转录物,长度超过200个核苷酸,不具备编码蛋白质的能力[4]。近年来,越来越多的研究证实lncRNA参与了包括HCC在内的许多恶性肿瘤的进展[5,6,7,8,9]。例如,lncRNA MIAT可以通过海绵化miR-214促进HCC细胞的增殖和侵袭[7]。LncRNA-PDPK2P通过PDK1/AKT/Caspase 3通路促进HCC细胞增殖、迁移和侵袭[j]8]。LncRNA MCM3AP-AS1敲低抑制HCC细胞增殖、集落形成和细胞周期进程,诱导细胞凋亡[9]。因此,lncrna被认为是HCC治疗的潜在靶点。MAPKAPK5-AS1在结直肠癌组织中异常表达,与结直肠癌的进展有关[10]。通过对TCGA样本的分析,我们发现MAPKAPK5反义RNA 1 (MAPKAPK5- as1)在HCC组织中表达上调,并与HCC患者的晚期和较差的总生存率相关。然而,MAPKAPK5-AS1在HCC发展中的作用还远未完全阐明。
MicroRNAs (miRNAs)是长度为18-22个核苷酸的单链rna。它们可以通过结合靶mrna的3 ' -非翻译区(3 ' utr)来调节各种基因的表达[11]。许多mirna参与调节HCC细胞的分化、增殖、凋亡等生物学过程,如miR-490-3p、miR-29a、miR-449a [12,13,14]。其中,miR-429在HCC肿瘤组织中表达显著下调,miR-429可抑制HCC细胞的生长、迁移和侵袭,促进细胞凋亡[15,16]。我们检索了Starbase数据库,发现miR-429含有MAPKAPK5-AS1的互补结合位点。此外,我们发现在TCGA中HCC组织中miR-429的表达较正常组织下调。这些数据表明MAPKAPK5-AS1可能与miR-429相互作用,调节其在HCC中的表达。
锌指E-box binding homeobox 1 (ZEB1)(又称TCF8)是ZEB家族的一员。ZEB家族参与胚胎发育,例如,诱导细胞的上皮-间质转化(EMT) [17]。在EMT过程中,上皮细胞失去极性并具有侵袭性,这一过程被认为是癌细胞转移过程中的关键生物学事件[18]。ZEB1是HCC进展的重要调节因子[19]。据报道,SIAH1可以海绵化miR-3129-5p,上调ZEB1的表达,从而介导HCC细胞对阿霉素的耐药[20.]。在本研究中,UALCAN数据库和GEPIA数据库显示,与正常组织相比,ZEB1在HCC组织中高表达,这与HCC患者的总生存率较差有关。
LncRNAs可以作为miRNA海绵[competing endogenous RNAs (ceRNAs)]调节基因表达[21]。本研究检测了MAPKAPK5-AS1在HCC组织和细胞系中的表达,并探讨了MAPKAPK5-AS1、miR-429和ZEB1在HCC发展中的相互作用。我们假设MAPKAPK5-AS1可以通过调节miR-429和ZEB1来调节HCC的进展,本研究验证了这一科学假设。
材料与方法
样品收集
2018年11月至2019年6月,收集襄阳中心医院经组织病理活检确诊的肝癌患者肿瘤组织及匹配的癌旁组织36例,液氮冷冻后- 80℃保存。术前有放疗或化疗、免疫治疗、中药等抗癌治疗史的患者排除在研究之外。所有患者均签署知情同意书,本研究遵循《赫尔辛基宣言》,并得到襄阳中心医院伦理委员会的支持。
细胞培养和转染
人永生化肝细胞系L02、人肝癌细胞系HepG2和Huh7以及肾上皮细胞293 T细胞均来自北京的BioVector NTCC Inc.。这些细胞在Dulbecco 's Modified Eagle 's Medium (DMEM, Gibco, Grand Island, NY, USA)中培养,加入10%胎牛血清(FBS, Gibco, Grand Island, NY, USA), 100单位/ml青霉素和100 μg/ml链霉素,37℃,5% CO2。由Genepharma (Shanghai, China)构建了两个靶向MAPKAPK5-AS1的短发夹RNA (shRNA) (sh-MAPKAPK5-AS1#1和sh-MAPKAPK5-AS1#2)和shRNA scramble control (sh-NC);miR-429模拟物、miR-429抑制剂及其相应的阴性对照(miR-NC)来自RiboBio (Guangzhou, China)。使用Lipofectamine 2000试剂(Invitrogen, Carlsbad, CA, USA)按照说明书将它们转染到细胞中,并在24小时后收集用于后续实验。
RNA提取及定量实时聚合酶链反应(qRT-PCR)
采用TRIZol试剂(Invitrogen, Carlsbad, CA, USA)从HCC组织、邻近组织和细胞中提取RNA,利用M-MLV逆转录酶试剂盒(Invitrogen, Carlsbad, CA, USA)合成互补DNA (cDNA)。此外,使用SYBR Premix Ex Taq试剂盒(Takara, Dalian, China)进行qRT-PCR。2 .测定基因的相对表达量−ΔΔCT方法,以甘油醛-3-磷酸脱氢酶(GAPDH)和U6为内参。引物序列:MAPKAPK5-AS1:正向5′-AAGCCCGAGTCTGATGCTAA-3′,反向5′-CTGCACACCTCTTCTGGTCA-3′;miR-429:正向5 ' -UAAUACUGUCUGGUAAAACCGU-3 ',反向5 ' - ucuccgaacguguucacgutt -3 ';ZEB1:正向5 ' - GATGATGAATGCGAGTCAGATGC-3 ',反向5 ' - acagcagtgtcttgttgttgt -3 ';U6正向5 ' - ctcgcttcggcagcga -3 ',反向5 ' -ACGCTTCACGAATTTGCGT-3 ';GAPDH正向5 ' - aactttggcattgtgggag -3 ',反向5 ' -ACACATTGGGGGTAGGAACA-3 '。
免疫印迹
用RIPA缓冲液(Beyotime, Shanghai, China)在冰中提取HCC组织和细胞的总蛋白,并用BCA试剂盒(Millipore, Billerica, MA, USA)定量。然后将蛋白质样品与加载缓冲液混合,在沸水中加热。等量的蛋白通过SDS-PAGE分离,转移到PVDF膜(Millipore, Billerica, MA, USA)上,用5%脱脂牛奶在室温下阻断2小时。将ZEB1 (1:12 00, ab203829, Abcam, Cambridge, UK)、E-cadherin (1:15 00, ab133597, Abcam, Cambridge, UK)、N-cadherin (1:15 00, ab207608, Abcam, Cambridge, UK)和GAPDH (1:15 00, ab37168, Abcam, Cambridge, UK)的一抗与膜在4℃下孵育8 h。hrp -山羊抗兔IgG二抗(1:1400;ab6721;Abcam, Cambridge, UK)与膜在24℃下孵育2小时,使用ECL发光试剂(Sangon, Shanghai, China)显示蛋白信号。
细胞增殖试验
转染后的细胞在37℃、5% CO条件下转移到96孔板中2用10 μL 5 mg/mL 3-(4,5-二甲基噻唑-2-基)-2,5-二苯基溴化四唑(MTT)试剂(Sigma, MO, USA)在37℃下孵育4 h。离心后,丢弃上清,将样品加入150 μL DMSO (Sigma, MO, USA)中混合,轻轻摇板使甲醛溶解。最后,使用MRX II吸光度仪(DYNEX Technologies, Chantilly, VA, USA)测量490 nm波长处的吸光度。
细胞迁移和侵袭试验
Transwell实验箱(Corning, Corning, NY, USA)按照制造商的说明观察细胞迁移和侵袭。在迁移实验中,将悬浮于无血清培养基中的细胞接种于上腔,下腔内装500 μL含10%胎牛血清的DMEM。24 h后,用4%多聚甲醛固定迁移细胞,然后用0.2%结晶紫溶液染色15 min。在显微镜下,随机选择视野内的细胞数进行计数。在入侵实验中,将Matrigel (BD Bioscience, San Jose, CA, USA)预涂在滤网上,其他步骤与迁移实验相同。
流式细胞术
胰蛋白酶化后,转染的HCC细胞重新悬浮在结合缓冲液中。然后,用5 μL Annexin V-FITC染色液(Annexin V-FITC凋亡检测试剂盒,BD Biosciences, San Jose, CA, USA)和5 μL碘化丙啶(PI;Sigma-Aldrich, St. Louis, MO, USA)在黑暗中拍摄15分钟。细胞经磷酸盐缓冲盐水洗涤后,使用流式细胞仪(FACSCalibur, BD Biosciences Co., Franklin Lakes, NJ, USA)检测细胞凋亡。Q2和Q3的数据之和为细胞凋亡率(%)。
双荧光素酶报告基因测定
合成含有miR-429结合序列的野生或突变MAPKAPK5-AS1/ZEB1 3'UTR序列,并将其克隆到pmirGLO Vector (Promega, Shanghai, China)中。将构建的载体与miR-429模拟物或miR-NC共转染293 T细胞。48 h后,用双荧光素酶报告基因检测系统(Promega, Shanghai, China)检测荧光素酶活性。
数据库分析
美国人(http://ualcan.path.uab.edu)是一个基于TCGA数据分析癌症组学数据的在线网络工具。根据临床分期或其他临床特征,搜索分析MAPKAPK5-AS1、miR-429、ZEB1在HCC组织中的相对表达。P< 0.05认为有统计学意义。
GEPIA数据库
GEPIA (http://gepia.cancer-pku.cn/)是一个在线网络工具,用于分析来自TCGA的9736个肿瘤样本和8587个正常组织样本的RNA测序表达数据。使用GEPIA数据库检测MAPKAPK5-AS1或ZEB1表达与HCC患者总生存期的关系。
体内实验
选取4周龄雄性BALB/c裸鼠,随机分为两组,每组5只。然后是5 × 106将sh-MAPKAPK5-AS1#1或sh-NC转染到HepG2细胞中,将转染后的细胞注射到各组小鼠尾静脉中。4周后,对所有裸鼠实施安乐死,手术切除肺,10%中性磷酸盐缓冲福尔马林固定,苏木精&伊红(H&E)染色,显微镜下计数转移结节数。
统计分析
所有实验均进行三次,数据以均数±标准差(SD)表示。不同组间比较采用Student’s进行t-检验或单因素方差分析与Tukey事后检验。MAPKAPK5-AS1表达与HCC患者临床病理参数的相关性采用卡方检验,相关性采用Spearman相关分析。使用GraphPad Prism 7软件(GraphPad Inc., San Diego, CA, USA)进行统计分析。P< 0.05认为有统计学意义。
结果
MAPKAPK5-AS1和ZEB1在HCC组织和细胞系中表达升高,miR-429表达下调
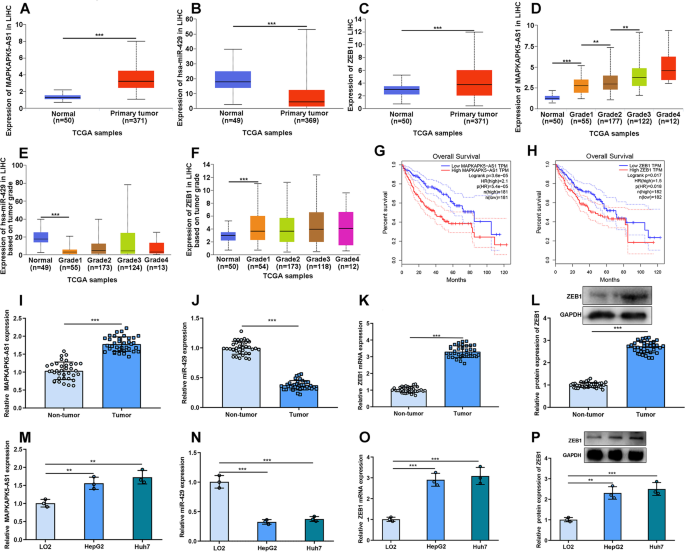
通过搜索UALCAN数据库,我们检测了MAPKAPK5-AS1、miR-429和ZEB1在HCC肿瘤组织和邻近正常组织中的表达。结果显示,肿瘤样本中MAPKAPK5-AS1和ZEB1表达显著上调,miR-429表达下调(图2)。1a - c)。接下来,我们根据肿瘤分级分析MAPKAPK5-AS1、miR-429和ZEB1的表达。MAPKAPK5-AS1表达在3级高于2级,2级高于1级,1级高于正常组织(图2)。1D)。1级肿瘤组织中miR-429的表达明显低于正常组织,ZEB1的表达高于正常组织(图2)。1E-F)。此外,我们还发现,MAPKAPK5-AS1或ZEB1的高表达与HCC患者的总生存率较差有关(图2)。1G-H)。
肝癌组织中MAPKAPK5-AS1和ZEB1表达上调,miR-429表达下调。得了UALCAN数据库显示MAPKAPK5-AS1、miR-429和ZEB1在HCC组织和正常组织中的表达。D-FUALCAN数据库显示,基于不同肿瘤分级,MAPKAPK5-AS1、miR-429和ZEB1在HCC组织和正常组织中的表达。G-HGEPIA数据库显示MAPKAPK5-AS1/ ZEB1表达与HCC患者总生存期之间的关系。i (k采用qRT-PCR检测肝癌组织及癌旁组织中MAPKAPK5-AS1、miR-429、ZEB1 mRNA的表达。lWestern blot检测肝癌组织及癌旁组织中ZEB1的表达。M-O采用qRT-PCR检测肝癌细胞系(HepG2和Huh7)和正常人肝细胞系(L02)中MAPKAPK5-AS1、miR-429和ZEB1 mRNA的表达。PWestern blot检测肝癌细胞系HepG2、Huh7和永生化肝细胞系L02中ZEB1的表达。**P< 0.01;和* * *P< 0.001
随后,我们采用qRT-PCR或Western blot对收集的肝癌组织及癌旁组织中MAPKAPK5-AS1、miR-429和ZEB1的表达进行分析,发现肝癌组织中MAPKAPK5-AS1和ZEB1 mRNA的表达明显升高,miR-429的表达明显降低(图2)。1我)。此外,我们发现hcc来源的细胞系HepG2和Huh7中MAPKAPK5-AS1和ZEB1 mRNA的表达与L02相比显著上调,miR-429的表达在hcc来源的细胞系中显著降低(图2)。1M-O)。Western blot结果显示,在hcc来源的细胞系中,ZEB1的表达显著增强(图2)。1P)。根据MAPKAPK5-AS1在HCC组织中的中位表达,将36例HCC患者分为高表达组(n低表达组(n = 18)。卡方检验显示,MAPKAPK5-AS1的高表达与肿瘤大小、晚期及淋巴结转移相关(表2)1)。
MAPKAPK5-AS1沉默抑制HCC细胞增殖、转移和EMT
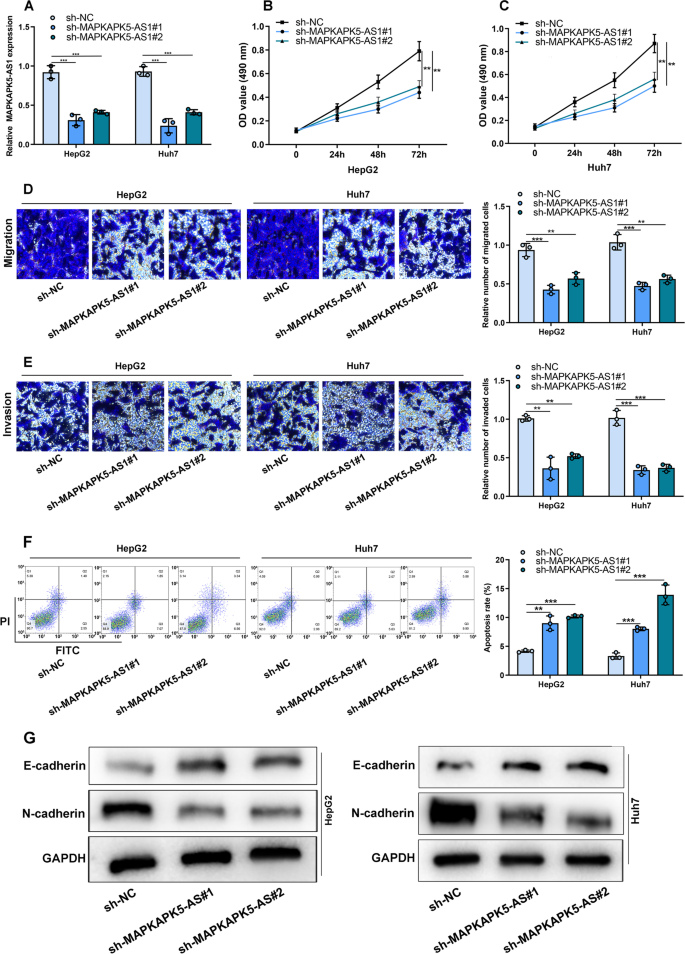
我们利用两个MAPKAPK5-AS1 shrna (sh-MAPKAPK5-AS1#1和sh-MAPKAPK5-AS1#2)在HCC细胞系中沉默MAPKAPK5-AS1,成功构建MAPKAPK5-AS1低表达模型(图2)。2MTT实验表明,与sh-NC组相比,敲低MAPKAPK5-AS1可显著抑制细胞增殖(图2)。2c)。Transwell实验证实,MAPKAPK5-AS1缺失可显著抑制细胞迁移和侵袭(图2)。2d e)。流式细胞术显示,抑制MAPKAPK5-AS1表达可显著促进HCC细胞的凋亡率(图2)。2此外,MAPKAPK5-AS1的敲低显著抑制了HepG2和Huh 7细胞中N-cadherin的蛋白表达水平,并增加了E-cadherin的表达(图7)。2G)。由此可见,抑制MAPKAPK5-AS1表达可抑制HCC细胞的增殖、迁移、侵袭和EMT。
MAPKAPK5-AS1沉默抑制HCC细胞增殖、迁移和侵袭。一个采用qRT-PCR检测MAPKAPK5-AS1在HepG2和Huh7细胞中的表达。cMTT法检测MAPKAPK5-AS1敲除后HepG2和Huh7细胞的增殖情况。d eTranswell法检测MAPKAPK5-AS1敲除后HepG2和Huh7细胞的迁移和侵袭情况。F流式细胞术检测MAPKAPK5-AS1敲低后HepG2和Huh7细胞的凋亡情况。GWestern blot检测MAPKAPK5-AS1敲除后HepG2和Huh7细胞中E-cadherin和N-cadherin的表达。*P< 0.05;**P< 0.01;* * *P< 0.001
MAPKAPK5-AS1过表达促进L02细胞增殖、迁移和侵袭
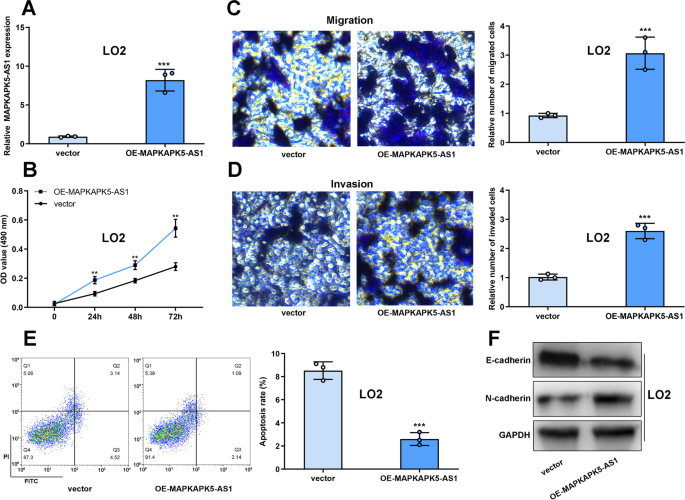
为了检测MAPKAPK5-AS1的致癌特性,我们将MAPKAPK5-AS1过表达质粒转染到L02细胞中(图2)。3.MTT和Transwell实验显示,与空载体组相比,过表达MAPKAPK5-AS1可显著提高L02细胞的增殖、迁移和侵袭能力(图2)。3.罪犯)。流式细胞术显示,MAPKAPK5-AS1过表达可抑制L02细胞的凋亡(图2)。3.E). Western blot结果显示,在L02细胞中过表达MAPKAPK5-AS1后,N-cadherin蛋白水平升高,E-cadherin蛋白水平降低(图2)。3.F).这些结果表明MAPKAPK5-AS1过表达促进了L02细胞的恶性肿瘤。
MiR-429是MAPKAPK5-AS1的靶标
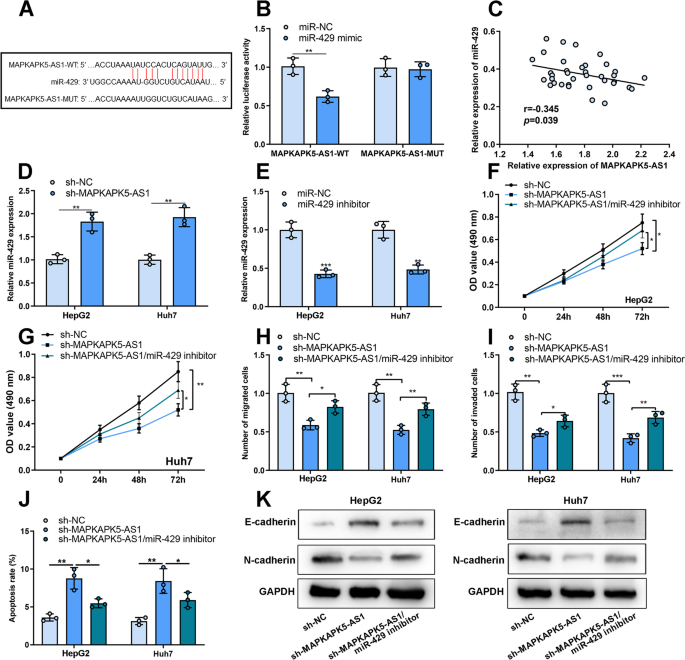
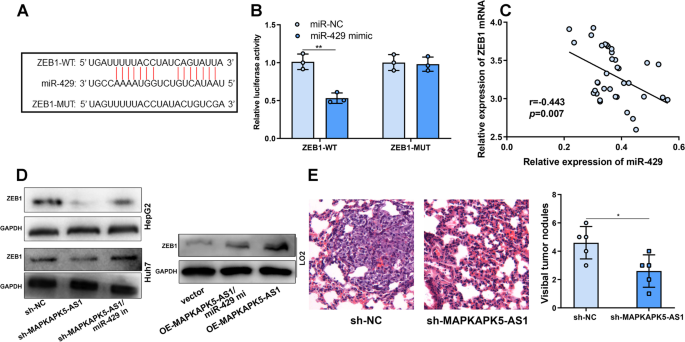
StarBase数据库提示miR-429是MAPKAPK5-AS1的潜在靶标(图2)。4A).荧光素酶报告基因检测证实MAPKAPK5-AS1与miR-429直接结合。然后,我们构建了含有MAPKAPK5-AS1野生型结合位点(MAPKAPK5-AS1- wt)或MAPKAPK5-AS1突变结合位点(MAPKAPK5-AS1- mut)的荧光素酶报告子。miR-429显著抑制MAPKAPK5-AS1-WT荧光素酶活性。然而,MAPKAPK5-AS1-MUT的荧光素酶活性不受miR-429的影响(图2)。4此外,肝癌组织中miR-429与MAPKAPK5-AS1表达呈负相关(图2)。4C)。与对照组相比,MAPKAPK5-AS1敲低组miR-429的表达显著增加(图2)。4D)。为了证实MAPKAPK5-AS1通过调节miR-429的表达参与了HCC的发展,我们使用miR-429抑制剂在HCC细胞系中成功构建了miR-429低表达模型(图4)。4E)。随后,研究发现抑制miR-429可显著逆转MAPKAPK5-AS1敲低对HCC细胞增殖、迁移、侵袭、凋亡和EMT过程的抑制作用(图2)。4f - k)。
MAPKAPK5-AS1通过调节miR-429的表达在HCC中发挥作用。一个MAPKAPK5-AS1与miR-429的结合位点。B在转染MAPKAPK5-AS1-WT或MAPKAPK5-AS1-MUT和miR-3429 mimic或miR-NC的293 T细胞中检测荧光素酶活性。C肝癌组织中MAPKAPK5-AS1表达与miR-429表达的Spearman相关性分析。D采用qRT-PCR检测si-MAPKAPK5-AS1或si-NC转染HCC细胞后miR-429的表达情况。E采用qRT-PCR检测转染miR-429抑制剂或miR-NC后HCC细胞中miR-429的表达。外:我采用MTT法和Transwell法检测肝癌细胞的增殖、迁移和侵袭。J采用流式细胞术检测肝癌细胞凋亡。KWestern blot检测HepG2和Huh7细胞中E-cadherin和N-cadherin的表达。*P< 0.05;**P< 0.01;* * *P< 0.001
MAPKAPK5-AS1通过吸附miR-429调控ZEB1的表达
我们检索了StarBase数据库,发现ZEB1 3'UTR包含一个与miR-429的结合序列(图2)。5A).我们通过荧光素酶活性报告实验进一步验证了miR-429与ZEB1的结合关系。结果显示,过表达miR-429可抑制ZEB1-WT报告基因的荧光素酶活性,但对ZEB1-MUT报告基因的荧光素酶活性无影响(图2)。5B)。qRT-PCR结果显示,miR-429与ZEB1 mRNA在HCC组织中的表达呈负相关(图2)。5C)。Western blot显示,与对照组相比,MAPKAPK5-AS1缺失后,ZEB1的表达显著下调,而转染miR-429抑制剂可消除HCC细胞中的作用,miR-429 mimic可逆转MAPKAPK5-AS1过表达对L02细胞中ZEB1表达的影响(图2)。5D)。
MAPKAPK5-AS1通过吸附miR-429调控ZEB1的表达。一个通过生物信息学分析预测ZEB1 3'UTR与miR-429之间的结合位点。B荧光素酶报告基因检测显示,miR-429可以直接结合ZEB1 3'UTR。C肝癌组织中ZEB1 mRNA表达与miR-429表达的Spearman相关性分析。DWestern blot检测转染si-MAPKAPK5-AS1和si-MAPKAPK5-AS1/miR-429抑制剂后的HepG2和Huh7细胞以及转染MAPKAPK5-AS1过表达质粒和MAPKAPK5-AS1过表达质粒/miR-429模拟物的L02细胞中ZEB1的表达情况。E进行体内肺转移试验,计数肿瘤结节数。*P< 0.05;**P< 0.01
MAPKAPK5-AS1在体内促进肝癌细胞肺转移
为了进一步确定MAPKAPK5-AS1在体内的致瘤潜能,我们将转染sh-NC或sh-MAPKAPK5-AS1的HepG2细胞注射到裸鼠尾静脉。肺切片H&E染色显示,与sh-NC组相比,降低MAPKAPK5-AS1的表达减少了肺转移结节的数量(图2)。5E).这一发现进一步支持MAPKAPK5-AS1调节HCC的进展。
讨论
文献充分证明lncrna在肿瘤发生和癌症进展中起着至关重要的作用,可能是有希望的生物标志物和治疗靶点[22]。LncRNA MAPKAPK5-AS1在许多肿瘤中异常表达,如结肠癌、胶质瘤、甲状腺癌等[10,23,24]。在HCC中,MAPKAPK5-AS1通过作为ceRNA诱骗miR-154-5p上调PLAG1样锌指2 (PLAGL2)的表达,从而激活EGFR/AKT信号通路,参与HCC进展[j]。25]。然而,MAPKAPK5-AS1在HCC中的作用尚不完全清楚。这项工作证实了MAPKAPK5-AS1在HCC组织和细胞系中的表达升高,与以往的研究一致[25]。MAPKAPK5-AS1的高表达与肿瘤大小、晚期及淋巴结转移有关,MAPKAPK5-AS1可促进HCC细胞的增殖、迁移、侵袭及EMT过程。
为了进一步明确MAPKAPK5-AS1在HCC中的作用机制,通过搜索StarBase数据库,发现MAPKAPK5-AS1可能可以调节多种mirna,然后选择miR-429进行进一步研究。大量研究证实,miR-429在许多恶性肿瘤中发挥肿瘤抑制作用。如miR-429可通过抑制TLN1表达抑制鼻咽癌细胞的增殖、迁移和侵袭[26]。另一项研究报道,miR-429在胰腺癌中表达下调,miR-429通过调节ZEB1表达影响胰腺癌的迁移、侵袭和EMT [27]。同样,作为肿瘤抑制因子,miR-429可以直接靶向ZEB1抑制甲状腺癌细胞的增殖并诱导其凋亡[28]。在HCC中,miR-429可通过抑制Raf/MEK/ERK通路,靶向CRKL抑制癌细胞迁移和侵袭[16]。此外,miR-429通过靶向RAB23抑制HCC细胞迁移[29]。另一项研究报道,miR-429在HCC中表达下调,miR-429通过靶向TRAF6,调节NF-κB通路抑制HCC细胞增殖和迁移[30.]。此前有研究报道,MAPKAPK5-AS1可以作为ceRNA抑制miRNA,反向调节miRNA对靶基因的抑制作用。具体来说,MAPKAPK5-AS1通过靶向miR-519e-5p/YWHAH轴促进甲状腺癌细胞的增殖和迁移[24]。MAPKAPK5-AS1通过海绵化let-7f-1-3p调控SNAI1的表达,促进结直肠癌的进展[j]31]。在我们的研究中,荧光素酶活性报告实验证实了MAPKAPK5-AS1可以直接与miR-429结合并负向调节miR-429的表达,抑制miR-429可以部分抵消MAPKAPK5-AS1敲低对HCC细胞增殖、迁移和侵袭的影响。因此,我们认为MAPKAPK5-AS1可能作为miR-429的分子海绵,在HCC中发挥调控靶基因表达的作用。
ZEB1是一种强大的emt相关转录因子,在肺癌、乳腺癌、胰腺癌等多种恶性肿瘤中均有高表达[32]。重要的是,ZEB1在HCC的肿瘤发生和癌症进展中是至关重要的调节因子。既往研究表明,ZEB1在HCC组织中的表达显著升高,且其高表达与HCC患者预后不良有关;ZEB1沉默通过调节vimentin表达抑制HCC细胞的增殖、迁移和侵袭[j]19]。此外,ZEB1可通过激活Wnt/β-catenin信号通路促进HCC细胞的增殖、迁移和侵袭[33]。MiR-429可能通过靶向ZEB1和CRKL参与调节乳腺癌细胞骨转移[34]。与此一致的是,在本研究中我们发现ZEB1 3'UTR是miR-429的靶点,miR-429可以抑制肝癌细胞中ZEB1的表达。MAPKAPK5-AS1可作为miR-429的分子海绵间接调控ZEB1的表达。我们的数据部分解释了肝癌细胞中ZEB1失调的机制。
结论
综上所述,本研究报道了MAPKAPK5-AS1在HCC中表达上调,MAPKAPK5-AS1通过抑制miR-429和上调ZEB1表达,作为肿瘤启动子促进HCC细胞的增殖、迁移、侵袭和EMT过程。我们的研究代表了一个新的参与HCC进展的ceRNA网络,可能为HCC的诊断和治疗提供有用的线索。
数据和材料的可用性
用于支持本研究结果的数据可应要求从通讯作者处获得。
参考文献
Seror O, N'Kontchou G, Ganne N, Beaugrand M.一项比较符合米兰标准的肝癌射频消融和手术切除的随机试验。中国生物医学工程学报,2011;34(5):837。
陈建军,李建军,李建军,等。肝细胞癌经皮穿刺治疗的临床研究进展。国际肝病杂志,2018;38(4):783 - 797。
Ghouri YA, Mian I, Rowe JH。肝细胞癌综述:流行病学、病因学和癌变。中华肿瘤杂志,2017;16:1。
[3]张建军,张建军。长链非编码rna在细胞分化和发育中的作用。学报,2014,15(1):7-21。
彭文霞,柯伊拉腊P,莫云英。lncrna介导的肿瘤细胞信号传导调控。致癌基因。2017;36(41):5661 - 7。
Abbastabar M, Sarfi M, Golestani A, Khalili E. lncRNA参与肝细胞癌转移和预后。[j] . 2018;17:90 - 13。
黄霞,高燕,秦军,陆生。lncRNA MIAT通过海绵介导miR-214促进肝癌细胞增殖和侵袭。[J] .中国生物医学工程学报,2018;31(5):559 - 565。
潘伟,李伟,赵军,黄铮,赵军,陈生,等。lncRNA-PDPK2P通过PDK1/AKT/Caspase 3通路促进肝癌进展。中华医学杂志,2019;13(10):2246-58。
王勇,杨玲,陈涛,刘霞,郭勇,朱强,等。一个新的lncRNA MCM3AP-AS1通过靶向miR-194-5p/FOXA1轴促进肝细胞癌的生长。癌症学报,2019;18(1):28。
季宏,惠斌,王军,朱勇,唐磊,彭鹏,等。长链非编码RNA MAPKAPK5-AS1通过部分沉默p21的表达促进结直肠癌的增殖。癌症科学,2019;39(1):72-85。
Rupaimoole R, Calin GA, Lopez-Berestein G, ood AK。miRNA在癌细胞和肿瘤微环境中的失调。中国癌症杂志,2016;6(3):235-46。
欧莹,何娟,刘颖。MiR-490-3p通过靶向ATG7抑制肝癌细胞自噬。[j] .生命科学学报,2018;70(6):468-78。
宋松,孙凯,董军,赵艳,刘峰,刘宏,等。microRNA-29a通过Bcl-2通路调控肝脏肿瘤启动细胞的增殖。生物质化学工程学报,2011;31(2):391 - 391。
韩波,黄军,杨忠,张军,王鑫,徐宁,等。miR-449a与肝癌短期复发有关,并通过靶向Notch1抑制迁移和侵袭。Onco Targets . 2019; 12:10975-87。
高宏,刘超。miR-429抑制hbv相关HCC细胞增殖并诱导细胞凋亡。生物医学杂志,2014;68(8):943-9。
郭超,赵东,张强,刘生,孙明志。miR-429通过抑制Raf/MEK/ERK通路和上皮-间质转化,靶向肝癌中的CRKL,抑制肿瘤的迁移和侵袭。科学通报,2018;8(1):2375。
范德华,范洛伊,王晓华,等。ZEB家族转录因子在发育和疾病中的作用。生物化学学报,2009;36(5):773-87。
Mittal V.肿瘤转移中的上皮间充质转移。中华病毒学杂志,2018;13:395-412。
秦燕,于娟,张敏,秦峰,兰霞。ZEB1通过调节vimentin的表达促进肝癌的发生和转移。中华医学杂志,2019;19(3):2297-306。
龙龙,向辉,刘军,张志,孙磊。ZEB1介导肝癌细胞对阿霉素(Dox)耐药及间质特性。中国生物医学工程学报,2019;26(6):1161 - 1161。
李建军,李建军,李建军,等。ceRNA串扰的多层复杂性及其竞争。大自然。2014;505(7483):344 - 52。
prenner JR, Chinnaiyan AM。lncrna在癌症生物学中的出现。中华癌症杂志,2011;1(5):391-407。
王伟,赵忠,杨峰,王宏,吴峰,梁涛,等。间变性胶质瘤患者的免疫相关lncRNA特征J Neuro-Oncol。2018, 136(2): 263 - 71。
周颖,刘松,罗毅,张敏,姜鑫,熊燕。IncRNA MAPKAPK5-AS1通过靶向miR-519e-5p/YWHAH促进甲状腺癌细胞的增殖和迁移。中国生物医学工程学报,2010;31(4):377。
王磊,孙磊,刘锐,莫红,牛勇,陈涛,等。长链非编码RNA MAPKAPK5-AS1/PLAGL2/HIF-1α信号环促进肝细胞癌进展中华肿瘤杂志;2011;31(1):1 - 4。
王震,朱震,林震,罗宇,梁震,张超,等。miR-429通过下调TLN1抑制鼻咽癌细胞增殖、迁移和侵袭。癌症杂志,2019;19(1):115。
沈静,洪磊,于东,曹涛,周志,何珊。LncRNA XIST通过介导miR-429调控ZEB1表达促进胰腺癌迁移、侵袭及EMT。中国生物医学工程学报,2019;33(3):417 - 426。
吴刚,郑华,徐军,郭勇,郑刚,马超,等。miR-429通过靶向ZEB1抑制人甲状腺癌细胞生长并诱导细胞凋亡。生物医学工程学报,2019;47(1):548 - 554。
薛华,田国光。MiR-429通过靶向RAB23调控HCC细胞的转移和EMT。生物化学学报。2018;37(4):448 - 455。
王鹏,曹军,刘生,潘华,刘霞,隋安,等。上调的microRNA-429通过NF-κB途径靶向TRAF6抑制HCC细胞的迁移。中国生物医学工程学报,2017;37(5):2883-90。
杨涛,陈文武,石鹏平,刘仁荣,蒋涛,宋辉,等。长链非编码RNA MAPKAPK5-AS1通过顺式调节附近的基因MK5和作为一个让-7f-1-3p海绵促进结直肠癌的进展。中华临床医学杂志,2014;39(1):391。
张艳,徐丽,李安,韩霞。ZEB1在肿瘤发生过程中的作用及表观遗传修饰。生物医学工程学报(英文版);2019;39(10):391 - 391。
李丽丽,杨建峰,荣峰,罗泽平,胡松,方华,等。ZEB1通过Wnt/β-catenin信号通路促进细胞增殖、迁移、抑制细胞凋亡,在HCC的肿瘤发生中起致瘤作用。药物学报,2021;42(10):1676-89。
叶志斌,马刚,赵玉华,肖燕,詹燕,景超,等。miR-429在体外抑制乳腺癌细胞的迁移和侵袭。中华医学杂志,2015;46(2):531 - 538。
致谢
感谢湖北一灿健康产业有限公司(中国武汉)在本文编写过程中提供的语言帮助。
资金
不适用。
作者信息
作者及单位
贡献
构思设计实验:ZQP、XHOY、QMF;进行实验:ZQP、YXW、XHOY;统计分析:ZQP和YXW;撰写论文:ZQP, XHOY和QMF。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
本研究经襄阳中心医院伦理审查委员会批准,所有患者均签署知情同意书。这项研究是按照《赫尔辛基宣言》进行的。
发表同意书
不适用。
相互竞争的利益
作者宣称他们没有竞争利益。
额外的信息
出版商的注意
伟德体育在线b施普林格《自然》杂志对已出版的地图和机构的管辖权要求保持中立。
补充信息
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/。创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
彭中,欧阳旭,王勇。et al。MAPKAPK5-AS1通过调控miR-429/ZEB1轴驱动肝细胞癌的进展。BMC Mol与细胞生物学23, 21(2022)。https://doi.org/10.1186/s12860-022-00420-x
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12860-022-00420-x
关键字
- 肝细胞癌
- MAPKAPK5-AS1
- mir - 429
- ZEB1