摘要
背景
志贺氏菌病是一种主要由志贺氏菌引起的急性胃肠道疾病弗氏志贺菌。摄入后,美国flexneri启动针对病原体脂多糖o抗原的血清型特异性免疫反应。o抗原亚基通过添加化学片段进行修饰,从而产生新的血清型美国flexneri。19种不同的血清型美国flexneri得到了认可。一种最近发现的o抗原修饰酶,O-乙酰转移酶B (acetyltransferase B, OacB),在鼠李糖的3或4位添加乙酰基残基3血清型1a、1b、2a、5a、7a、Y和6中N-乙酰氨基葡萄糖(3/4- o -乙酰化)和血清型2a、3a、Y和Yv中N-乙酰氨基(6- o -乙酰化)的位置6。参与o抗原修饰的其他蛋白质中的关键残基,如葡萄糖基转移酶(Gtrs)和乙酰基转移酶(Oac)美国flexneri而OacB功能中重要氨基酸的鉴定尚未确定。
结果
疏水性分析表明,OacB是一种跨膜蛋白,具有11个跨膜片段,12个环,以及细胞质周围的N-和C-端。生物信息学分析表明,OacB含有乙酰转移酶-3结构域和几个保守残基。利用定点诱变技术,将选择的氨基酸突变为丙氨酸,以阐明其在OacB作用机制中的作用。发现7个氨基酸R47、H58、F98、W71、R116、R119和S146对oach功能至关重要。
结论
由于缺乏血清型转化酶的三维结构,O-乙酰转移酶B (OacB),重要残基在作用机制中的明确作用被排除。因此,在本研究中,使用定点诱变技术,鉴定了7个对OacB功能至关重要的残基。在抗血清存在的情况下,表达OacB突变体的细胞缺乏凝集,表明相应残基的功能作用。因此,本研究提供了OacB中可能参与形成o抗原修饰酶催化位点的关键残基的重要信息美国flexneri。
介绍
弗氏志贺菌在美国,细菌性痢疾的主要致病生物是发展中国家2.7亿例志贺氏菌病,每年造成21.2万人死亡[1]。19种血清型美国flexneri每种血清型基于脂多糖(LPS)结构的变化而不同。LPS在细菌毒力中起重要作用,o抗原是其最远和可变的结构域,其次是核心寡糖和脂质a . o抗原是LPS的免疫显性部分,在感染过程中通过引起人类宿主血清型特异性体液和适应性免疫反应发挥重要作用,对o抗原的任何修饰都有助于细菌逃离人类免疫系统。
所有血清型美国flexneri除血清型6外,它们具有由n -乙酰氨基葡萄糖和三个鼠李糖残基(血清型Y)组成的重复四糖单元的共同o抗原主干。这种亲本结构可以通过将葡萄糖基、乙酰基或磷酸乙醇胺残基添加到一个或多个糖中来修饰,从而产生新的血清型[2,3.]。通过添加o -乙酰基或葡萄糖基残基对o抗原进行修饰是在温带噬菌体中进行的。这些噬菌体整合到宿主的染色体中,形成稳定表达血清型转化基因的前噬菌体[4]。而磷酸乙醇胺转移酶(Opt)介导的o抗原修饰是质粒传播的[5]。最近发现的o抗原修饰酶o -乙酰转移酶B (OacB)在鼠李糖III的3或4位(3/4- o -乙酰化)以及在o抗原亚基的2a、3a、Y和Yv的血清型中N-乙酰氨基葡萄糖的6位(6- o -乙酰化)添加乙酰基残基[6]。的oacB该基因由温带噬菌体Sf101携带,该噬菌体最近从一株菌株中分离出来美国flexneri[7]。OacB是一种完整的膜蛋白,属于Pfam家族Pf01757,被认为是乙酰转移酶-3 (AT3)结构域蛋白[7,8]。该酶具有独特的特点乙酰化底物(鼠李糖III的o抗原)在缺乏任何其他相关的酶或结构域。OacB使o抗原发生o -乙酰化的机制尚不清楚,由于缺乏OacB的x射线晶体学数据,因此有必要确定该酶中存在的重要残基。因此,有必要研究OacB的关键特征,以了解OacB转化血清型的机制。
因此,在本研究中,通过将OacB与存在于不同血清型的其他乙酰转移酶蛋白进行多次比对,确定了OacB中潜在不可或缺的残基美国flexneri以及其他相关细菌。然后使用位点定向突变(SDM)将鉴定出的残基突变为中性氨基酸。美国flexneri在载玻片凝集试验中,具有突变OacB蛋白的菌株显示无法与血清型特异性抗血清反应。观察到的这种蛋白质突变形式的影响表明单个氨基酸可能起催化或结构作用。本研究中观察到的功能作用可以作为识别OacB中形成酰基供体相互作用位点的残基的良好起点。
方法
细菌菌株,质粒和生长条件
本研究中使用的菌株在附加文件中列出1和2。本研究中的所有质粒(附加文件)3.)繁殖于大肠杆菌应变JM109。Luria-Bertani (LB)肉汤培养大肠杆菌和美国flexneri37°C (大肠杆菌)或30°C (美国flexneri)转速180转(rpm)。采用添加100 μg/ml氨苄西林的LBA培养基进行平板培养。
DNA的方法
采用Pfu Ultra II HS DNA聚合酶(Stratagene)进行PCR扩增。附加文件中提到的所有寡核苷酸4和5是由Sigma-Aldrich合成的。质粒载体来源于pBAD/Myc-他的A (Invitrogen)。使用Promega miniprep DNA试剂盒,采用Sambrook等人描述的方法分离质粒。,[9]。本研究中质粒结构的详细描述见附加文件3.。
改编自Sambrook等人的标准协议。,用于克隆、电穿孔和集落PCR [9]。根据制造商的说明进行限制性内切酶酶切和连接反应。定点诱变是按照Stratagene QuikChange的推荐方法进行的PfuUltra二世融合HS DNA聚合酶试剂盒(Stratagene)XLI蓝色电致细胞用于突变质粒的转化。桑格测序在澳大利亚国立大学约翰科廷医学研究学院生物分子资源设施进行,以确认正确突变的存在。
克隆oacB基因转化为pBAD/Myc他的一个
oacB基因克隆到pBAD/中Myc-HisA载体使用Sambrook等人提供的常规克隆协议。,[9]。采用Pfu聚合酶(Promega)集落PCR进行扩增oacB菌株SFL2535基因美国flexneri使用特定的引物对oacB pBADF和oacB pBADR(附加文件4)。纯化后的PCR产物克隆到表达载体pBAD/中Myc-他得了AXho我和EcoRI站点创建pNV2111。重组质粒转染新制备的JM109电致能细胞。在添加氨苄西林(100 μg/ml)的LB板上选择转化子。Sanger测序进一步证实了pNV2111中插入物的存在。
pNV2111红霉素抗性基因的克隆
红霉素基因(嗯从质粒pNV2074中提取Pfu聚合酶(Promega),引物对Em进行扩增R-SphI-Fwd和EmR附加文件4).质粒pNV2111用SphI (New England Biolabs),用Fermentas的小牛肠碱性磷酸酶(CIAP)去磷酸化,然后凝胶纯化。载体与插入物的连接使用New England Biolabs提供的T4 DNA连接酶。将结扎液转化为新鲜制备的JM109细胞,并在含有红霉素(250 μg/ml)的LB板上选择克隆。利用Sanger测序法对一个克隆进行测序,以确认红霉素基因的存在,并命名为pNV2132。进一步将pNV2132转化为美国flexneri菌株SFL1691(阴性oacB)电致能细胞创建重组菌株SFL2572进行下面描述的功能试验。
定点诱变
采用Quick-change Site-directed mutagenesis协议进行诱变(Stratagene)。用于创建突变的引物在附加文件中给出4。生成的构念用Dpn并转化为XLI蓝色超能力细胞来修复刻痕。突变结构完全通过Sanger测序,使用合适的引物进行测序,以确保在PCR过程中引入预期的突变,而不引入任何其他额外的突变。
生物信息学分析
o -乙酰转移酶B (OacB)的蛋白序列从(accession no. 9)中获得。AII27840.1) [7]。NCBI-CDD和pBLAST (https://blast.ncbi.nlm.nih.gov/Blast),通过将其与其他生物进化相关的类似蛋白质进行比较来确定任何保守结构域美国flexneri。欧米茄(EMBL-EBI) [10],然后使用默认参数对oach与其他乙酰转移酶蛋白进行多次比对。
拓扑预测
TOPCON (http://topcons.net/),用于检测OacB的氨基酸序列是否存在疏水区域。TOPCON使用了五个子集方法:OCTOPUS (http://octopus.cbr.su.se)、菲利乌斯(http://www.yeastrc.org/philius)、多角虫(http://phobius.cgb.ki.se/poly.html)、虾仁(http://topcons.cbr.su.se/)及SPOCTOPUS (http://octopus.cbr.su.se/)来预测蛋白质中跨膜和非跨膜区域的存在[11]。
o -乙酰化特异性抗血清的制备
用血清1c型菌株SFL1683免疫绵羊产生的粗抗血清oacB)收集并纯化,使其特异性为3/4 o -乙酰化的Rha III表位。将抗血清与热杀伤的SFL1691细胞混合,吸收抗血清中的所有非特异性抗体(oacB负1c株)。制备的抗血清用于玻片凝集实验,菌株SFL1683在1 min内凝集,认为对3/4 o -乙酰化具有特异性。SFL1691未见凝集,进一步证实了其抗血清特异性。
玻片凝集法测定OacB功能
通过将质粒电穿孔到pNV2132中,检测oach在pNV2132中的功能美国flexneri血清1c型菌株SFL1691对oacB基因(由其基因组序列证实)。在添加红霉素(250μg/ml)的LB板上选择转化子,30℃孵育。取单菌落SFL2572,在载玻片上滴入10ul 3/4 o -乙酰基特异性抗血清。在载玻片旋转1分钟内,抗血清出现明显的细菌细胞结块被认为是阳性的,这反过来表明功能性OacB的存在。将凝集水平与阳性对照菌株SFL1683(血清型1c携带株)的凝集水平进行比较oacB基因)加入抗血清后1分钟内。凝集记录为高(+++)、中(++)、低(+)或无凝集(−)。以SFL1691为阴性对照,加入抗血清1 min后仍无凝集现象。所有凝集试验均为三次。
OacB过度
将质粒构建物转化到新鲜制备的TOP10电致能细胞中大肠杆菌。将培养物接种于含有氨苄西林(100μg/mL)的LB中,在37℃孵育过夜,180 rpm摇匀。次日,取3 mL隔夜发酵剂加入200 mL(1:66稀释)含氨苄西林(100 μg/ mL)的温LB中,置500 mL Schott瓶中,37℃180 rpm孵育约3 h,至光密度(OD)600)达到0.4。然后用0.2% l -阿拉伯糖诱导培养,在37℃,180 rpm下培养4 h。细菌培养物在4°C下10000 x g离心15分钟。去除上清后,用10 mL 30 mM Tris-HCL (pH 8.0)离心(3000 x g)洗涤细胞球(2X);10分钟;4°C)。在30 mM Tris-HCl (pH 8.1)溶液中加入200 μl 20%蔗糖(w/v),在0.1 M EDTA (pH 7.3)溶液中加入20 μl 1 mg/ml溶菌酶,冰孵育30 min。孵育后,加入5 ml冰冷的Milli Q水,在emulsion - b15 (Avestin)高压均质机中双循环裂解细胞。所有样品的细胞碎片通过在4°C下15,000 x g离心15分钟去除。无细胞的上清液在4°C下,使用41个Ti转子在超离心机(Optima Xpn-100)中以100,000 x g离心60分钟,收集膜蛋白。 The supernatant was discarded, and the pellet was resuspended in 200 μl of Buffer A (50 mM Tris-HCl, (pH 8.0) containing 100 mM NaCl. The membrane protein samples were used immediately or stored at − 80 °C [12]。
蛋白质分析
将10 μl的2倍样品缓冲液(0.5 M Tris-HCl, pH 6.8,含10% (w/v) SDS, 20%甘油,0.1%溴酚蓝)加入到含有10或25 μg蛋白质的膜蛋白样品中。使用比肯霉素酸蛋白(BCA)测定试剂盒定量蛋白的量,所需体积上载于BioRAD预制SDS-PAGE凝胶(12-14%)进行分析。
Coomassie染色
膜蛋白样品经SDS-PAGE凝胶电泳后,用200 ml考马斯亮蓝染色剂[0.1% (w/v)]染色过夜。第二天用100ml脱色液脱色15 - 30min。
Western blot分析
直接在SDS-PAGE后,根据制造商的说明,使用BioRad Trans-Blot转移细胞装置将膜蛋白样品转移到带电的聚偏氟乙烯(PVDF)膜上。一旦转移完成,将膜浸泡在5% (w/v)脱脂牛奶(文凭)中,在磷酸盐缓冲盐水中进行阻断1小时或过夜。阻断后,用含有0.05% (v/v) Tween-20 (Sigma -Aldrich)的PBS洗涤3次,洗涤15分钟。清洗后,将膜与与辣根过氧化物酶结合的抗his抗体(研发技术)孵育过夜。
用含0.05% (v/v) Tween-20的PBS洗涤三次(每次15 min)。在化学发光相机底座(Vilber-Lourmat)和Vilber-Lourmat软件版本15.11下观察反应。
结果
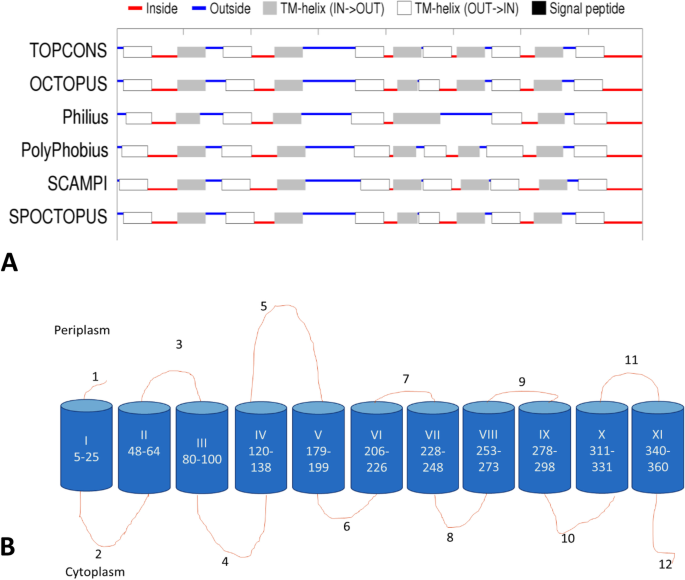
利用预测程序对OacB进行拓扑分析
利用5个拓扑预测程序建立了OacB的工作模型,该模型采用基于隐马尔可夫方法的算法。Philius预测了9个跨膜螺旋,而其他4个程序都预测了oach有11个跨膜螺旋。这种差异可能是因为除了Philius之外的所有其他程序都使用来自多序列比对(MSA)的蛋白质序列,而Philius仅使用一个蛋白质序列作为输入[11]。在此基础上,建立了具有11个跨膜螺旋和12个环的OacB共识模型,其中最长的环在质周侧为5个。此外,这五个程序分别将n端和c端定向定义为周质和细胞质(图2)。1).
OacB与其他蛋白质的相似性
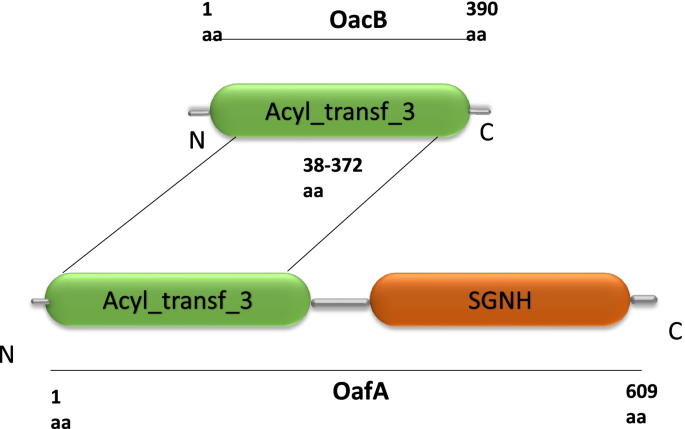
生物信息学工具NCBI-CDD搜索显示,OacB及其同源物聚集在蛋白质超家族COG1835或acyl_trans_3 (AT3)下,具有功能保守的乙酰转移酶结构域,跨越38至372个氨基酸(图2)。2) [7]。具有acyl_tranf_3结构域的蛋白质在原核生物和真核生物中并不罕见,并参与酰化修饰。OacB蛋白BLAST与OafA对应的AT3结构域(Pfam 01757)具有相似性。而OafA的SGNH水解酶型酯酶结构域(Superfamily: SSF52266)在OacB中缺失。
含有SGNH结构域和AT3结构域的蛋白质或含有其中任何一个结构域的蛋白质都参与乙酰转移酶的活性[8,13,14]。OacB与其他16种进化相关细菌的乙酰转移酶进行了多次比对,结果表明OacB与其他16种进化相关细菌的乙酰转移酶蛋白相同大肠杆菌,假单胞菌,志贺氏菌,不动杆菌baumanii,黄杆菌属,和其他几种细菌AT3蛋白(附加图2)。1).将OacB与类似的o -乙酰转移酶(Oac)进行配对比对,发现细胞质环4中的关键精氨酸R116和R119分别与Oac细胞质环3中的R73和R76相对应[3.]。
此外,o -乙酰转移酶的蛋白序列美国flexneri(表1),进行多次比对(图2)。3.).发现三个基序DGxRGxLAxxVxxHH, FFxITG (YorF) LFxxK和SRxxR存在于OacC, Oac1b, Oac和OacC中(图2)。3.).此外,在Oac功能中起关键作用的两种精氨酸(R73和R76)在所有的乙酰转移酶中也都是保守的美国flexneri属于不同的血清型。乙酰基转移酶中基序和其他氨基酸的保守性美国flexneri保证了他们的保守角色O乙酰化作用。此外,在所有其他基因中,OacC与OacB的同源性为97%,而在使用CLUSTAL Omega进行两两比对时,OacD的同源性最低(13%)。在不同血清型中,OacC和OacC都能乙酰化o抗原的Rha III片段美国flexneri它们之间的同源性表明了它们之间的密切关系。Oac和Oac1b与OacB的同源性为25%。
OacB中关键残留物的鉴定
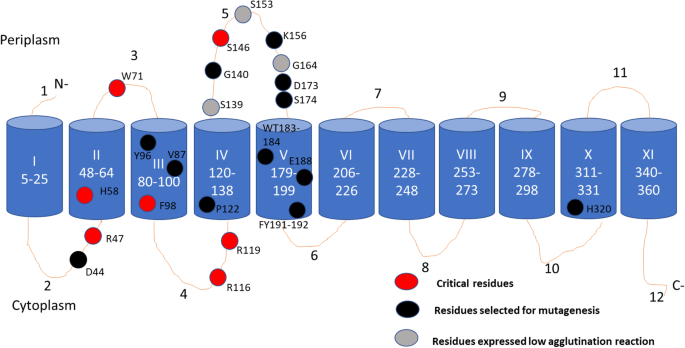
利用SDM将OacB中的多个残基突变为丙氨酸。选择用于诱变的残基的基本原理主要是它们在乙酰转移酶和化学性质上的保守性。然而,我们也选择了一些非保守残基来探讨它们在OacB功能中的作用。残留位置和选择原因的详细信息汇总在表中2。总共有22个带电荷的残基突变为丙氨酸,这是一种中性氨基酸。丙氨酸被选为OacB中氨基酸的替代品,因为它维持了蛋白质的天然空间结构。pNV2132窝藏野生型oacBpBAD中红霉素耐药基因Myc-HisA矢量(附加文件3.)作为模板创建单/双氨基酸点突变。在细胞质环2中选择了保守基序1的一部分天冬氨酸44 (D44)和碱性氨基酸精氨酸47 (R47)进行诱变。质周环3芳香残基色氨酸71 (W71);选取TM III的酪氨酸96 (Y96)和苯丙氨酸98 (F98)极性残基。胞质环4中选择精氨酸116 (R116)和119 (R119)。此外,不同带电荷的残基也突变为丙氨酸;TM IV中脯氨酸122 (P122);长环5中的赖氨酸156 (K156);芳香色氨酸183和苏氨酸184 (WT183-184);TM V中有谷氨酸188 (E188), TM x中有组氨酸320 (H320), TM V中有芳香对酪氨酸191和苯丙氨酸192 (YF191-192), TM x中有组氨酸320 (H320)2。
预计OacB中假定的环5是由40个氨基酸组成的最大环。环5中的大多数残基在其他细菌的乙酰转移酶中没有被发现是保守的(附加图2)。1).然而,长环已被发现在葡萄糖基转移酶中起重要作用[18,19]。因此,对OacB环5中的残基进行诱变以确定其在OacB功能中的作用[18,20.]。总的来说,在循环5中发生了7个突变。这些氨基酸包括极性氨基酸丝氨酸139 (S139)、甘氨酸140 (G140)、丝氨酸146 (S146)、丝氨酸153 (S153)、甘氨酸164 (G164)、酸性天冬氨酸173 (D173)和丝氨酸174 (S174)。
功能分析
为了确认OacB在突变体中的功能,用3/4 o -乙酰基特异性抗血清进行玻片凝集。在OacB的催化作用下,将突变质粒电孔插入血清型1c菌株SFL1691中,通过将血清型1c转化为1c“变体”菌株进行功能评估。美国flexneri1c血清型“变异”菌株SFL1683窝藏oacB以野生型基因为阳性对照。7株菌株SFL2583(突变R47)、SFL2595(突变H58)、SFL2584(突变W71)、SFL2589(突变F98)、SFL2585(突变R116)、SFl2586(突变R119)和SFL2617(突变S146)与抗血清凝集失败。SFL2618(突变G164)出现中等反应(++),SFL2620(突变S139)和SFL2621(突变S153)出现低凝集反应(+)2及附加图2).关键残差的位置在OacB的二维模型中突出显示(图2)。4)。然而,其他突变体D44、V87、Y96、P122、K156、D173、S174、WT183-184、E188和FY191-192与血清型特异性抗血清反应阳性,表明具有功能酶。
残基在膜内蛋白质组装中的作用
为了证实OacB无功能突变体在质膜上的组装和合成,制备了所有突变株的膜蛋白。将所有OacB无功能突变体和野生型OacB蛋白等量(~ 25 μg)进行SDS-PAGE凝胶电泳。采用抗his抗体进行Western blot检测。所有OacB的无功能突变体都被发现作为野生型蛋白在膜中组装(图2)。5及附加图3.).
OacB膜蛋白的SDS-PAGE和western blot。制备OacB突变体的膜蛋白,用抗his抗体进行western blot检测。每种蛋白的等量约25 μg被加载到SDS-PAGE凝胶上。B2607(野生型= WT)为阳性对照,B2372为阴性对照。使用预染色的PageRuler™作为分子质量标记。OacB蛋白带在35 kDa处运行。(由于“凝胶位移”,膜蛋白在SDS-PAGE上的表现往往与实际分子量不同)。B,等量的蛋白质装载到另一个SDS-PAGE凝胶上并进行考马斯氏染色。C, OacB中关键残留物位置汇总表。(图中显示了western blot和考马斯氏染色凝胶的裁剪图像。这些未裁剪的全长图像显示在附加图中。3.)
讨论
在本研究中,使用位点定向突变(SDM)和凝集试验鉴定了OacB中的几个关键残基。与OacB同源的蛋白质比对有助于鉴定存在于TM螺旋区、质周环和细胞质环中的几个保守残基。然后对选定的残基进行SDM以确认其在oach功能中的作用。功能分析显示OacB中存在7个关键残基。western blotting证实了所有OacB无功能突变体在质膜上的组装和合成。
在OacB中鉴定出的非必需残基有D44、Y96、V87、K156、P122、D173、S174、WT183-184、E188和FY191-192。通过负凝集反应检测到的关键氨基酸包括三个精氨酸残基(R47、R116和R119);苯丙氨酸(F98);色氨酸残基;组氨酸(H58)和丝氨酸(S146)。精氨酸残基在蛋白质组装和催化中的重要性已得到充分证明[21,22]。因此,我们将三个保守的精氨酸残基替换为丙氨酸R47、R116和R119,以确认它们在oach中的作用。结果表明,任何三个精氨酸残基的替换都会影响蛋白质的功能,因为突变体不能与血清型特异性抗血清反应。残基R47、R116和R119也被发现在其他生命结构域中含有单(AT3) /双(AT3- sgnh)结构域乙酰转移酶的蛋白质中相当保守[8,13]。另一项调查Oac拓扑特征的研究表明,精氨酸可以根据其在蛋白质中的位置发挥不同的作用,并在保守的细胞质RxRR基序中发现了对Oac功能重要的残基[3.,21];R75和R76起结构作用,而R73起催化作用。在本研究中,细胞质环4中OacB的两个精氨酸残基R116和R119分别对应于Oac残基R73和R76突变为丙氨酸。功能分析显示一个无功能蛋白,表明这些残基在OacB功能中的作用。近年来,跨膜螺旋I中相应的/等效的精氨酸残基R69和R72也被发现在双结构域蛋白OafA中起重要作用,OafA将o抗原的水糖残基乙酰化肠沙门氏菌血清型副伤寒[8]。同样,在另一种蛋白OafB中,当保守的RxxR基序中对应的精氨酸R71和R74被丙氨酸取代时,得到的蛋白不能补充短o抗原表型[13]。此外,R47在OacB中的替换也影响了功能,因此表明它在OacB中的重要性。然而,在Oac中没有评价相应的残留物对R47的作用。R47、R116和R119在近30种属于其他细菌和植物乙酰转移酶的其他乙酰转移酶中保守[8]。的五种乙酰转移酶中美国flexneriR116和R119都是保守的,唯一不同的是,在OacD的R119的相应位置存在另一种类似的氨基酸赖氨酸(K),而不是精氨酸(R)。
精氨酸已被报道为催化残渣,可作为一般碱催化剂[23]。在一项研究中,精氨酸残基(R359)的作用被解释为在含SGNH结构域蛋白的PatB1酶中形成氧阴离子空穴的残基,该残基负责细胞中次级细胞壁多糖的o -乙酰化蜡样芽胞杆菌[22]。当R359突变为丙氨酸以研究其在实验中的作用时,变异蛋白不具有酯酶或转移酶活性,这表明R359作为活性位点残基的重要性。在OacB中,细胞质R116可能参与催化作用,而R47和R119可能参与结构作用。然而,这两种精氨酸在OacB中所起的作用需要进一步的生化实验来证实。
在本研究中,W71存在于质周环3中,由于其在其他乙酰转移酶中的保守位置而成为诱变的目标。本研究结果显示W71在OacB功能中的关键作用。因此,尚不确定W71在OacB中起催化或结构作用。色氨酸是一种具有大环状侧链的芳香氨基酸,能够通过其大的疏水极性侧链与邻近残基进行蛋白质与蛋白质/配体的相互作用[24,25]。W71残基在OacB中的替换导致了蛋白质功能的丧失,可能该残基对维持与附近残基的相互作用至关重要,其突变导致了OacB的结构变化。
本研究发现的另一个重要残留是F98。苯丙氨酸侧链被认为是蛋白质充分催化活性的关键。跨膜III中保守的苯丙氨酸残基F98被OacB中的丙氨酸取代。该残基的突变影响了OacB功能,这在玻片凝集试验中是可识别的。在一项评估苯丙氨酸残基作用的研究中,Shmara等人。,对氨基糖苷6′- n -乙酰转移酶1b型进行丙氨酸扫描诱变,该型对氨基糖苷类抗生素产生耐药性,F171的替代导致对卡那霉素和阿米卡星的抗性丧失[26];他们假设这种残基参与受体底物特异性。苯丙氨酸被认为在乙酰基向底物转移的过程中起着核心作用[27]。此外,对芳胺乙酰转移酶NAT1和NAT2的研究也支持了F125残基参与人芳胺乙酰转移酶NAT1和NAT2活性位点的形成并在底物选择中发挥作用[28]。F98在OacB中也有类似的作用,因为它靠近保守的精氨酸残基(R116和R119)。
我们还研究了在OacB大质周环5中发现的4个丝氨酸残基S139、S146、S153和S174的作用。发现丝氨酸残基对许多蛋白质的活性至关重要[3.,8,29]。SGNH水解酶中Ser-Lys二联体或催化三联体中的保守丝氨酸残基参与酶的催化活性。在PatB1对次级细胞壁多糖(SCWP) o -乙酰化的研究中,丝氨酸337被鉴定为以PatB1晶体形式存在的催化亲核试剂。同样,在另一项研究中,OafA中的丝氨酸残基肠沙门氏菌血清型伤寒发现(O:5)在c端SGNH质周结构域中构成一个氧阴离子空穴[30.]。在我们的研究中,将存在于大质周环5中的4个非保守丝氨酸残基S139、S146、S153和S174替换为丙氨酸,并在玻片凝集实验中检测每个突变体的功能,只有S146突变体(SFL2617)不能与血清型特异性抗血清凝集。氨基酸方面,突变体S174被丙氨酸取代,不影响OacB的功能,而突变体S139和S153的凝集反应较弱。后两者的取代可能导致与质周环中底物相互作用有关的催化位点的破坏5。在S146突变中观察到的功能完全缺失表明该残基发挥了重要作用。考虑到o -乙酰化发生在周质中,我们假设大周质环5中的残基S146可能负责在o -抗原的Rha III片段上添加乙酰基。大的质周环在葡萄糖基转移酶中的关键作用先前已被报道美国flexneri[19,31]。
此外,在我们的研究中,当大质周环5中的两个甘氨酸突变为丙氨酸时,G164与阳性对照相比发生了中等凝集反应,而G140则发生了强烈的凝集反应。甘氨酸是一种非极性氨基酸,它的侧链是一个氢原子而不是碳原子。这一特性使甘氨酸能够适应可能限制其他氨基酸的蛋白质的紧密旋转。甘氨酸在OacB中的确切作用尚不清楚,人们认为突变体G164中检测到的凝集反应减少可能是由于该残基与活性位点残基(S146)的结构连接,当突变为丙氨酸时,与活性位点残基的相互作用受到影响。
组氨酸58 (H58)在OacB中的确切作用尚不清楚,然而,该残基在其他生物体中发现的30种其他乙酰转移酶中的保守状态表明它的重要作用[8]。在我们的研究中,用丙氨酸取代H58后OacB功能的丧失证实了它的关键作用。在OafA和OatA中,组氨酸是SGNH结构域催化三联体的一部分,参与催化[8,32]。此外,在OafA中有相当的残基H25肠炎沙门氏菌血清型鼠伤寒沙门氏菌最近发现在TMH1中将结合的醋酸盐加工成精氨酸残基- r14并将其转移到内膜的质周侧中发挥作用[8]。
结论
本研究评估了保守和非保守氨基酸在OacB中的作用,并对单个氨基酸所起的功能作用提供了有价值的信息。在OacB的跨膜结构域、细胞质和质周环中发现了重要的功能残基。替换R47、R116、R119、H58、W71、F98和S146导致蛋白功能丧失。我们的结果重申了严格保守的精氨酸残基在乙酰转移酶中的重要性。对该蛋白的关键残基和结构域的了解有助于支持未来的研究,以了解OacB和随后的其他乙酰转移酶修饰o抗原的机制。
数据和材料的可用性
本研究分析的数据集可在GenBank数据库中获得,数据集的登录号如下:来自Sf101噬菌体的OacB蛋白(AII27840.1);Oac (P23214);OacC (EFW62204);OacD (WP_000282635);Oac1b (AFM56533.1);大肠杆菌(EFC1419592.1);Rhodobacter capsulatus(WP_023921362.1);Competibacter denitrificansRun_A_D11 (WP_071243973.1);Methyloversatilis thermotolerans(WP_018410755.1);Paraburkholderia heleia(WP_052405754.1);Pseudomonas_corrugata(WP_055136861.1);Pseudomonas_aeruginosa(DK1WP_071537607.1);荧光假单胞菌F113 (WP_014337242.1);黄杆菌属columnareATCC_49512 (WP_014166569.1);Dechloromonas aromaticaRCB (AAZ46617.1);黄杆菌属columnare(WP 060383091.1);会茁壮地生长CH34 (WP_011517319.1);Burkholderiales细菌GJ-E10 (BAP89224.1);鲍曼不动杆菌299505 (WP32009270.1);Azospirillum lipoferum(WP_012978429.1)。
缩写
- OacB / OacB:
-
O-acetyltransferase B
- Gtr Gtr /:
-
葡糖基转移酶
- 有限合伙人:
-
脂多糖
- GlcNAc:
-
N-acetylglucosamine
- AT3:
-
乙酰转移酶3
- CIAP:
-
犊牛肠道碱性磷酸酶
- 长效磺胺:
-
定点诱变
- Rha:
-
鼠李糖
- 聚合酶链反应:
-
聚合酶链反应
- SDS:
-
Sodium-dodecyl硫酸
- PVDF:
-
聚偏二氟乙烯
- PBS:
-
磷酸盐缓冲盐水
- aa:
-
氨基酸
参考文献
李建军,李建军,李建军,等。志贺氏菌和肠毒素引起的发病率和死亡率大肠杆菌腹泻:全球疾病负担研究1990 & 2013;2016。《柳叶刀与感染杂志》,2018;18(11):1229-40。
Knirel YA,王军,罗旭,Senchenkova SN, Lan R, Shpirt AM,等。6型福氏志贺氏菌鼠李糖3/4- o -乙酰化的o -酰基转移酶基因(oacC)的遗传和结构鉴定中国生物医学工程学报,2014;14(4):626。
Thanweer F, Verma NK。福氏志贺氏菌血清型修饰o -乙酰转移酶关键残基的鉴定。生物化学学报,2012;13:13。
Perepelov AV, Shekht ME, Liu B, Shevelev SD, Ledov VA, Senchenkova SN,等。福氏志贺氏菌o型抗原重访:o -乙酰化谱的最终阐明和o型抗原结构多样性的调查。中国生物医学工程学报,2012;32(2):391 - 391。
孙强,兰荣,王杰,夏生,王勇,王勇,等。中国一株新型福氏志贺氏菌Yv血清型的鉴定与特征分析。科学通报,2013;8(7):e70238。
王杰,Knirel YA, Lan R, Senchenkova SN, Luo X, Perepelov AV,等。在福氏志贺氏菌O型抗原中介导鼠李糖III 3-和4-O-乙酰化的O-酰基转移酶基因(oacB)的鉴定。中国生物医学工程学报,2014;31(8):925 - 931。
jjakhetia R, Marri A, Stahle J, Widmalm G, Verma N.弗氏志贺氏菌血清型转化:一种新型噬菌体Sf101的鉴定。生物医学工程学报,2014;15(1):742。
张建军,张建军,张建军,张建军,等。细菌表面碳水化合物乙酰化酶的研究进展[j] .中国生物医学工程学报,2016,31(4):559 - 559。
陈建军,陈建军,李建军,等。分子克隆技术的研究进展。冷泉港:冷泉港实验室出版社;1989.
马德拉F,朴玉梅,李J, Buso N, Gur T, Madhusoodanan N,等。2019年EMBL-EBI搜索和序列分析工具api。核酸学报,2019;47(1):636 - 41。
张建军,张建军,李建军,等。基于TOPCONS的膜蛋白拓扑结构预测方法研究。核酸学报,2015;43(1):771 - 771。
Rusden AD, Stephenson DP, Verma NK用取代半胱氨酸接近法研究福氏志贺氏菌葡萄糖基转移酶V的拓扑结构。生物化学。2013;52(15):2655 - 61。
Kintz E, Davies MR, Hammarlof DL, Canals R, Hinton JC, van der Woude MW。侵袭性非伤寒沙门氏菌中存在的BTP1噬菌体基因决定了脂多糖o抗原的组成和长度。中国生物医学工程学报,2015;36(2):663 - 668。
Jones CS, Sychantha D, Howell PL, Clarke AJ。金黄色葡萄球菌OatA胞外质域o -乙酰转移酶功能的结构基础。生物化学学报,2020;29(24):8204-13。
孙强,Knirel YA,王杰,罗旭,Senchenkova SN,兰瑞,等。血清型转换噬菌体SfII编码一种酰基转移酶蛋白,介导福氏志贺氏菌o型抗原GlcNAc的6- o -乙酰化,赋予宿主一个新的o型抗原表位。中国生物医学工程学报,2014;31(2):366 - 366。
孙强,Knirel YA,王杰,罗旭,Senchenkova SN,兰瑞,等。血清型转换噬菌体SfII编码酰基转移酶蛋白,介导福氏志贺氏菌o型抗原GlcNAc的6- o -乙酰化,赋予宿主一个新的o型抗原表位。中国生物医学工程学报,2014;31(2):366 - 366。
孙强,兰荣,王勇,王健,夏生,王勇,等。福氏志贺氏菌血清型1b株o -乙酰转移酶基因oac 1b的分离鉴定中华微生物学杂志,2012;1(9):921。
Korres H, Verma NK。福氏志贺氏菌葡萄糖基转移酶V (GtrV)基本环和残基的鉴定。分子生物学杂志,2006;23(5):407-19。
Nair A, Korres H, Verma NK。福氏志贺氏菌葡萄糖基转移酶IV (GtrIV)的拓扑特征和关键结构域的鉴定。生物化学,2011;12:67。
Lairson LL, Henrissat B, Davies GJ, Withers SG。糖基转移酶:结构、功能和机制。生物化学学报,2008,31(1):521 - 555。
Thanweer F, Tahiliani V, Korres H, Verma NK。福氏志贺氏菌血清型转化噬菌体SF6 o -乙酰转移酶关键残基的拓扑结构和鉴定生物化学学报,2008;37(4):591 - 591。
Sychantha D, Little DJ, Chapman RN, Boons GJ, Robinson H, Howell PL,等。PatB1是一种o -乙酰基转移酶,修饰次级细胞壁多糖。化学学报,2018;14(1):79-85。
王晓明,王晓明,王晓明,等。鼠伤寒沙门菌n -羟乙胺o -乙酰转移酶的研究进展。氨基酸水平上的序列相似性提示鼠伤寒沙门氏菌和高等生物乙酰转移酶具有共同的催化机制。中国生物医学工程学报,2009;32(2):444 - 444。
Englert M, Nakamura A,王云山,Eiler D, Söll D,郭丽婷。用类似物探测金黄色葡萄球菌硫氧还蛋白活性位点色氨酸。核酸学报,2015;43(22):11061-7。
高超,兰东,刘磊,张宏,杨波,王勇。球形马拉色菌脂肪酶活性位点芳香残基的定点诱变研究。Biochimie。2014;102:29-36。
Shmara A, Weinsetel N, Dery KJ, Chavideh R, Tolmasky ME。氨基糖苷6′-的一个保守区域的系统分析N−Acetyltransferase type Ib. antimicrobial Agents Chemother. 2001;45(12): 3287-92。
李建军,李建军,李建军,等。gcn5相关n -乙酰基转移酶的研究进展。生物化学学报,2009;29(1):81-103。
杨建军,杨建军,李建军,等。人芳胺乙酰转移酶NAT1和NAT2受体底物选择性的氨基酸鉴定。生物化学学报(英文版);2009;32(1):359 - 361。
Bardy SL, Ng SYM, Carnegie DS, Jarrell KF。古细菌伏曲甲烷球菌I型信号肽酶活性关键氨基酸的定点诱变分析。中国生物医学工程学报,2009;31(3):1186 - 1186。
Slauch JM, Lee AA, Mahan MJ, Mekalanos JJ。负责鼠伤寒沙门氏菌o型抗原乙酰化的oafA位点的分子特征:oafA是一个完整膜反式酰基化酶家族的成员。中华微生物学杂志。1996;32(2):391 - 391。
Moscoso JA, Korres H, George DT, Verma NK。志贺氏菌葡萄糖基转移酶GtrV活性位点残基的鉴定。分子生物学,2010;27(2-3):104-13。
Sychantha D, Clarke AJ。肺炎链球菌OatA催化结构域对肽聚糖的修饰遵循乒乓bi-bi作用机制。生物化学。2018;57(16):2394 - 401。
致谢
我们感谢A El-Gendy博士提供的信息美国flexneri血清型1c菌株,以及Farid Rahimi博士对手稿的校对。
资金
MI博士研究由沙特阿拉伯伊斯兰开发银行(IDB)和澳大利亚国立大学(ANU)资助。资助者在研究设计、数据收集/分析和手稿撰写中没有任何作用。
作者信息
作者及单位
贡献
MIR进行了所有实验和生物信息学分析。NKV构思并指导了这项研究。MIR和NKV起草了手稿。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用
相互竞争的利益
作者宣称他们没有竞争利益。
额外的信息
出版商的注意
伟德体育在线施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。
补充信息
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/。创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
Rajput, m.i., Verma, N.K. o -抗原修饰关键残基的鉴定O-乙酰转移酶B (OacB弗氏志贺菌。BMC Mol与细胞生物学23, 16(2022)。https://doi.org/10.1186/s12860-022-00415-8
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12860-022-00415-8
关键字
- 膜蛋白
- o抗原
- O-acetyltransferase
- 血清型转换
- 弗氏志贺菌