摘要
背景
肿瘤相关巨噬细胞被认为是影响肿瘤发展的主要因素。近年来,大量研究表明,肿瘤细胞能够通过递送大量外泌体来教育其微环境,然而,来自PCa细胞的外泌体在巨噬细胞极化中的作用机制仍不清楚。因此,我们试图确定外泌体生物发生抑制剂GW4869阻断外泌体生成是否会阻碍巨噬细胞分化为M2细胞。
结果
在本研究中,我们首先使用Magcapture™Exosome Isolation Kit PS从与无外泌体血清培养的PCa细胞的上清培养基中获得外泌体,然后研究它们对巨噬细胞的影响。我们的数据证实了前列腺癌细胞释放的外泌体可以诱导巨噬细胞向M2细胞分化。从机制上讲,外泌体通过激活AKT和STAT3信号通路对巨噬细胞发挥作用。重要的是,GW4869显著抑制了PCa细胞释放外泌体,并进一步削弱了巨噬细胞的M2分化及其促肿瘤活性。我们还证明GW4869能够抑制M2巨噬细胞的教育,从而抑制前列腺癌的进展。
结论
总之,我们的研究结果表明,GW4869抑制了PCa外泌体诱导的巨噬细胞M2分化和前列腺癌的进展,表明GW4869可能作为肿瘤外泌体分泌抑制剂在治疗前列腺癌转移中发挥重要作用。
背景
目前,前列腺癌仍是全球男性癌症相关死亡的主要原因之一,特别是由于缺乏有效的治疗方法,转移性前列腺癌的管理具有挑战性[1].因此,探索前列腺癌的分子机制对前列腺癌的诊断和治疗具有重要意义。
肿瘤微环境中的巨噬细胞,肿瘤相关巨噬细胞(tumor-associated Macrophages, TAMs),被认为是促进多种肿瘤进展的主要因素。多项研究支持肿瘤组织及邻近组织中的TAMs与M2巨噬细胞类似,在促进肿瘤细胞增殖、侵袭和转移方面具有促肿瘤表型[2,3.].此外,多份报告证实TAM浸润是前列腺癌复发的独立危险因素[4],且TAM数目减少的患者预后明显好于TAM数目较多的患者,提示TAM数目与PCa的预后相关[5].
巨噬细胞通常可分为M1(经典激活的巨噬细胞)和M2(交替激活的巨噬细胞)表型[6].前者分泌多种炎症因子和酶分子,包括iNOS和TNF-α,杀死感染性病原体和肿瘤细胞,后者分泌多种肿瘤细胞生长促进因子、血管活性物质和一些基质金属蛋白酶(MMPs),促进肿瘤生长、迁移和侵袭。巨噬细胞极化是表型转变的动态过程。影响巨噬细胞M1/M2转变的因素有很多,如肿瘤微环境中的关键细胞因子和巨噬细胞信号转导通路的激活[7,8,9].最近有证据表明,外泌体是一类30 - 150nm的细胞外囊泡,可以作为细胞间信号交换的载体,在教育肿瘤微环境方面发挥重要作用[10].外泌体通过与其他细胞的细胞膜融合,可以很容易地将蛋白质、脂类、rna等生物活性物质选择性地递送到受体细胞,传递信息,进而影响受体细胞的生理过程[11,12].许多研究证实,肿瘤细胞可以通过分泌比正常细胞更多的外泌体来调节免疫细胞,并培养出适合其生长和转移的肿瘤微环境[13].例如,胃癌细胞的外泌体促进胃癌的肝转移[14],而胰腺癌细胞的外泌体在体外可诱导巨噬细胞表现出M2表型[15].近期研究表明,前列腺癌外泌体可促进前列腺癌的增殖和转移[16],并诱导巨噬细胞向M2表型分化,然而,PCa外泌体介导巨噬细胞分化的分子机制尚未完全阐明。
2010年,中性鞘磷脂酶抑制剂GW4869 [17],最初由Kosaka等人使用。[18]成功抑制HEK293细胞中多泡体(MVBs)中成熟外泌体的释放。因此,我们试图确定在PCa细胞中封锁外泌体释放是否能够影响巨噬细胞极化。
在本研究中,我们证实了前列腺癌细胞的外泌体可以通过STAT3信号通路诱导巨噬细胞向M2表型分化。特别是,GW4869可以抑制这种诱导,它逆转了巨噬细胞的极化。
材料与方法
实验细胞系
PC-3M-2B4(一种人类前列腺癌低转移细胞系)细胞和PC-3M-1E8(一种人类前列腺癌高转移细胞系)细胞来自国家细胞系资源基础设施(NICR)。THP-1(一种人急性单核白血病细胞系)和HUVEC(一种人脐静脉内皮细胞系)细胞购自ATCC。
THP-1细胞分化
THP-1细胞在RPMI1640中加入10%去外泌体FBS和0.05 mmol/L β-巯基乙醇,用10 ng/mL PMA诱导分化为巨噬细胞72 h后,用IFN-γ (50 ng/mL) + LPS (15 ng/mL)或IL-4 (25 ng/mL)处理,分别分化为M1或M2巨噬细胞,未处理的细胞作为对照组(M0)。将GW4869处理过的PCa细胞的外泌体或细胞上清加入巨噬细胞中,观察其对巨噬细胞功能的影响。
GW4869处理PCa细胞
PC-3M-2B4和PC-3M-1E8细胞在RPMI1640和10%去外泌体FBS中培养。当PC-3M-2B4和PC-3M-1E8细胞的生长密度达到70%时,以10 μM添加GW4869。48 h后收集细胞上清液,400 g离心10 min去除沉淀,用0.22 μm孔径过滤器过滤上清液。根据细胞来源的不同,这些上清液被命名为2B4-GW4869或1E8-GW4869。
外泌体的提取
过滤后,用Amicon滤液过滤细胞上清80 mL®超滤装置采用4000g离心30 - 80min,并加入PBS继续离心,得到1.5 mL的前列腺癌外泌体(PCa-exos)悬浮液[19].将移液管插入过滤器底部,在底部来回扫取样本,以确保外泌体完全回收。然后,根据说明书使用Magcapture™Exosome Isolation Kit PS (Fujifilm Wako, Osaka, Japan)进一步纯化这些外泌体。获得的外泌体保存在−20°C。
透射电子显微镜
取10 μL ca -exos移液管至铜网上沉淀1 min,移去浮液,在铜网中加入1%磷钨酸染色液滴,对外泌体染色5 min。去除多余染料后,晾干,电镜下观察。
纳米颗粒尺寸分析
从PC-3-M-2B4或PC-3-M-1E8中分离纯化外泌体,然后在3ml PBS中重悬。摇晃和混合后,使用Zetasizer Nano ZS9003030810分析仪(Malvern Panalytical, Malvern, UK)确定这些外泌体的直径。
免疫荧光染色
96孔板中巨噬细胞用PBS冲洗3次,用200 μL 4%多聚甲醛室温固定15 min。在室温下用2% BSA阻断30min后,加入CD206一抗(Abcam, USA), 4℃孵育过夜。第二天,用PBS冲洗这些细胞3次,然后在荧光显微镜上拍照。
西方墨点法
用含有PMSF和磷酸酶抑制剂(100:1:1)的RIPA缓冲液在冰上裂解细胞5分钟,然后立即收集到1.5 mL Eppendorf管中。在冰盒中摇动30分钟后,在4°C下以12000 g离心10分钟去除细胞碎片。收集上清液,保存于−20°C;将30 μg总蛋白涂在10% SDS-PAGE上,然后转移到PVDF膜上。根据靶分子的分子量差异,将PVDF膜切割成含有指定靶抗原的多个横条纹。用5%脱脂牛奶阻断2小时后,PVDF条纹中的蛋白质与以下一抗孵育:β-actin、AKT、P-AKT、STAT3和P-STAT3 (Abcam,美国),在4℃下以1:1000的比例孵育过夜。TBST洗涤3次后,相应的二抗孵育2 h, ECL化学发光检测目标蛋白。
酶联免疫吸附试验(ELISA)
我们按照ELISA试剂盒的说明,将每组的样品添加到96孔板中。ELISA试剂盒(联科生物,中国)检测特异性细胞因子浓度。使用SpectraMax M4 Multimode Microplate reader (Molecular Devices, USA)测定各孔OD值,并将OD值与相应标准曲线进行比较,计算细胞因子浓度。
流式细胞分析
用GW4869处理PCa细胞后,用流式细胞仪检测这些细胞CM中的PCa外泌体。我们遵循外泌体分离分析试剂盒-流式细胞仪(ab267478, Abcam)的说明。使用珠结合的抗cd63抗体捕获PCa外泌体,然后与抗cd9 PE在4℃下孵育1小时。接下来,使用CytoFLEX (Beckman Coulter, Inc., Brea, CA, USA)测定CM中PCa外泌体的数量。
Transwell化验
在24孔板中放置跨孔室后,PC-3M-2B4或PC-3M-1E8细胞(3 × 106)重悬于不同巨噬细胞的100 μl CM中,接种于基质包被的上腔中。接下来,500ul的RPMI-1640介质被添加到腔室的下部。将带转孔的24孔板置于37℃培养箱中48 h。转孔室中的细胞固定,0.1%结晶紫染色10 min, PBS洗涤3次,倒置显微镜下观察。
体外血管生成实验
HUEVC和前列腺癌细胞(PC-3M-2B4或PC-3M-1E8)与不同巨噬细胞的CM重悬,按1:1比例混合。取100 μl混合细胞(3.0 × 104/well)接种到96孔预涂有Matrigel的板中,然后培养24 h。使用配备CCD光学和数字分析系统的倒置显微镜观察内皮细胞的管状结构(Olympus, Tokyo, Japan)。通过计算每口井三个油田的节理或导管数量,对结果进行了评估。
皮下肿瘤发生试验
雄性BALB/c-nu小鼠(4周龄)购自长沙实验动物有限公司(中国湖南长沙),江西省医学科学院实验动物资源繁育。本研究由江西省医学科学院伦理委员会批准。jxams -以- 2019012)。一个ll animal experiments were performed in compliance with the guidelines for handling animal experimentation-based research in China and the ARRIVE guidelines. The PC-3M-1E8 cell line was cultured in RPMI-1640 (10% exosome-free serum). After mixing with 10 uM GW4869, 5 × 106在小鼠右侧皮下注射PC-3M-1E8细胞。注射后每隔一天观察肿瘤发展情况。肿瘤形成后,每5天测量一次肿瘤体积,计算公式为:肿瘤体积(mm3.) =直径较短2×长直径/2,采用免疫组化法检测肿瘤组织中CD206的表达。
免疫组织化学
制备小鼠肿瘤组织,制成3mm石蜡包埋切片,浸于柠檬酸缓冲液(pH 6.0)中提取抗原。分别用3%双氧水或5%牛血清白蛋白阻断内源性过氧化物酶活性和非特异性结合位点后,切片用CD206抗体在4℃孵育过夜。然后将合适的二抗在室温下孵育1 h。以四盐酸二氨基联苯胺为底物,评价这些切片的免疫反应性。
统计分析
采用Prism 5.0统计软件进行统计分析。测量数据以均数±标准差表示,at两组间比较采用正态分布和总方差检验。Mann-Whitney U检验用于两组非正态分布的比较。p< 0.05为差异有统计学意义。
结果
PCa外泌体特征
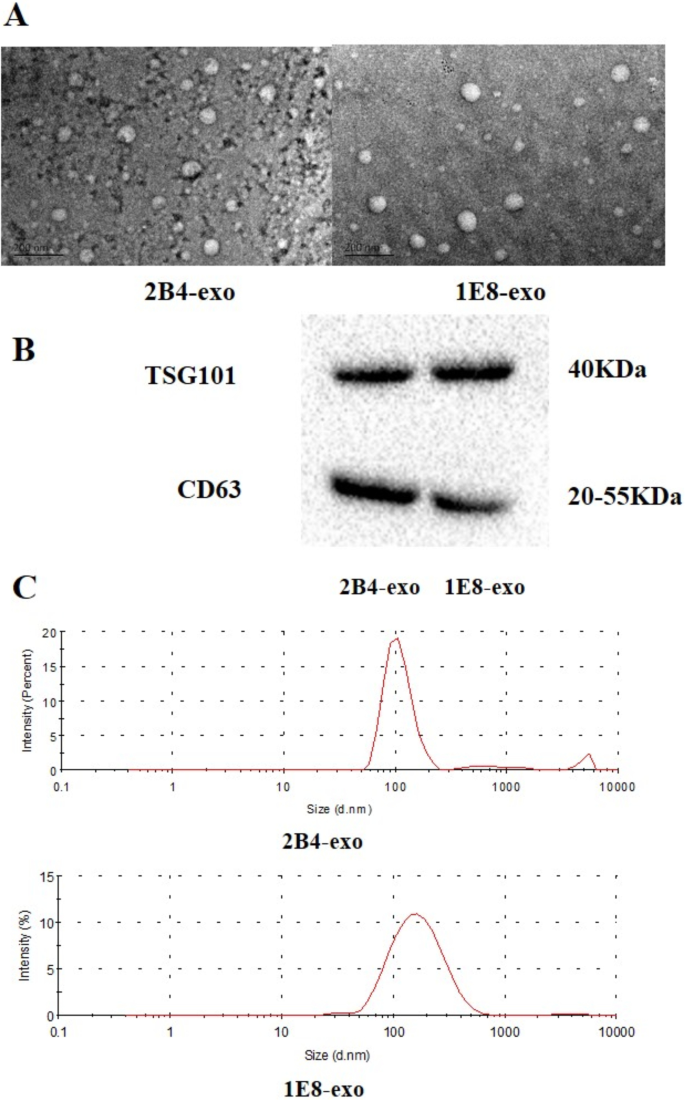
外泌体是前列腺癌细胞调节微环境的重要手段。为获得PCa外泌体,用无外泌体血清培养2株前列腺癌细胞2B4和1E8,各取80 ml上清培养基。培养基通过Millipore超滤管(Amicon Ultra-15, Millipore,美国),浓缩至1ml,然后使用magcapture™Exosome Isolation Kit PS (Fujifilm Wako,大阪,日本)对这些PCa外泌体进行分类。电镜结果表明,这些PCa外泌体呈圆形,具有明显的碟状结构。纳米颗粒尺寸分析表明,2B4-exos和IE8-exos的直径约为90 ~ 135 nm。此外,Western blot分析显示特异性分子标记物(TSG101和CD63)的分泌表达(图。1).
PCa外泌体的鉴定。一个PC-3-M-2B4或PC-3-M-1E8细胞外泌体透射电镜图像。BWestern blotting检测特异性分子标记TSG101和CD63在外泌体膜上的表达。使用Bio-Rad image Lab 3.0 (beta 3)分析数据。完整的印迹显示在附加文件中1:图S1和原始数据。CPCa外泌体的直径分布。在获得Pca外泌体后,使用纳米颗粒尺寸分析仪测定Pca外泌体的直径
PCa外泌体诱导巨噬细胞向M2巨噬细胞分化
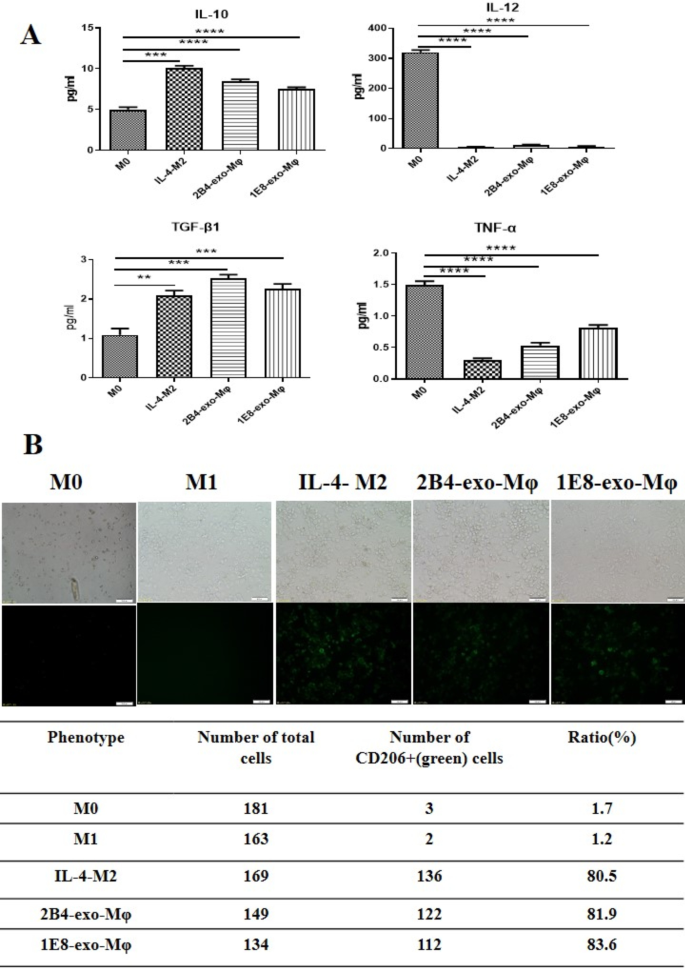
目前研究表明,肿瘤细胞通过多种机制调节巨噬细胞的极化过程。为了了解前列腺癌外泌体在巨噬细胞极化中的作用,我们首先用10 ng/ml PMA诱导THP1细胞进入巨噬细胞72 h [20.],然后分别用IFN-γ (50 ng/mL)、IL-4 (25 ng/mL)、2B4-exos (100 μg/ mL)、IE8-exos (100 μg/ mL)处理这些巨噬细胞[21].培养48 h后,我们观察到,与IL-4诱导的巨噬细胞相似,2B4-exos或IE8-exos处理的巨噬细胞明显过表达M2表型的分子标记CD206, IL-10 (M0 vs. 2B4-exo-Mφ,p< 0.0001;M0 vs.1E8-exo-Mφ,p= 0.0004)和TGF-β1 (M0 vs. 2B4-exo-Mφ,p= 0.0001;M0 vs. 1e8 - exp - m φ,p= 0.0004)2).这些结果证实了前列腺癌细胞的外泌体可以诱导巨噬细胞向M2细胞分化。
GW4869降低了PCa外泌体的分泌和CD206的数量+巨噬细胞
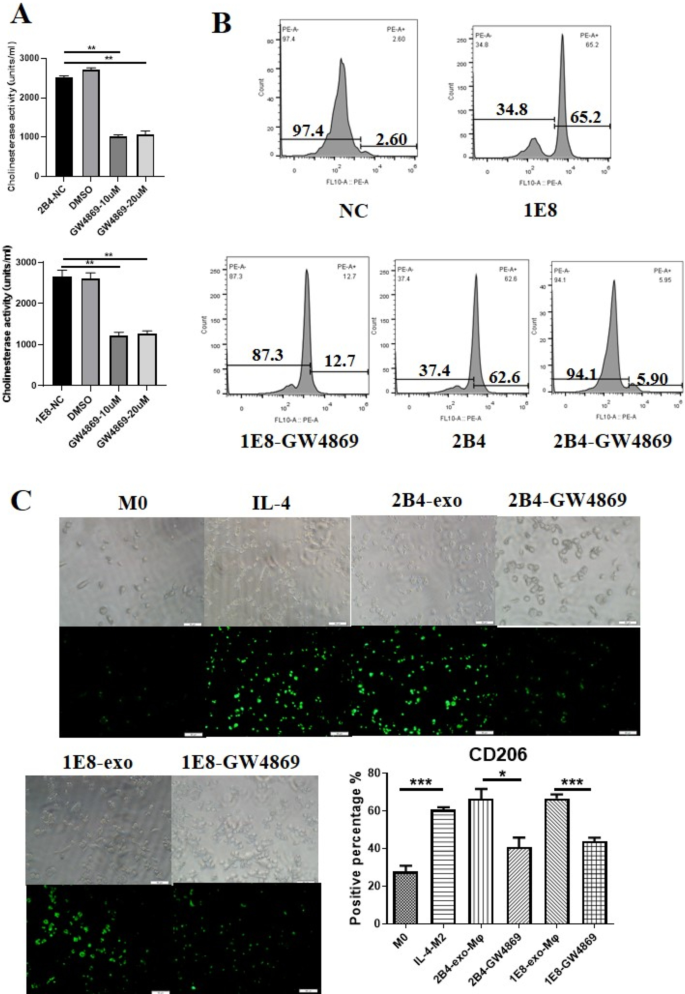
GW4869被认为可以抑制细胞内神经氨酸酶的活性,从而抑制肿瘤细胞外泌体的分泌。为了了解GW4869对前列腺癌细胞的作用,我们分别用10 μM和20 μM的GW4869处理前列腺癌细胞株PC-3-M-2B4和PC-3-M-1E8。48 h后,测定两株细胞株培养基上清液中胆碱酯酶活性。胆碱酯酶在外泌体中含量丰富,其活性被认为代表了外泌体的数量。如图所示。3.A, GW4869处理后PCa细胞培养上清液中胆碱酯酶活性显著降低(GW4869- 10um /20uM vs 2B4-NC,p= 0.0010 /p= 0.0022;GW4869-10uM/20uM vs. 1E8-NCp< 0.0001 /p< 0.0001),间接证实GW4869抑制了PCa细胞外泌体的分泌,且10 μM处理与20 μM处理之间无明显差异。随后,我们进一步用流式细胞仪分析了10 μM GW4869处理的PCa细胞上清液中外泌体的数量。经GW4869处理后,PC-3-M-2B4或PC-3-M-1E8细胞的外泌体数量分别减少了56.7%和52.5%(图2)。3.B).最后,我们观察GW4869对前列腺癌细胞介导的巨噬细胞极化的影响。图的结果。3.C实验表明,10 μM GW4869显著减少了CD206+巨噬细胞(2B4-GW4869 vs. 2B4-exo-Mφ)的数量,p= 0.0182;1E8-GW4869 vs. 1E8-exo-Mφ,p= 0.0003),表明GW4869可以通过阻断PCa细胞分泌外泌体来抑制巨噬细胞向M2细胞分化。
GW4869对外泌体分泌及CD206+巨噬细胞数量的影响一个GW4869对AChE活性的影响。GW4869处理PCa细胞48 h后,采集PC-3-M-2B4或PC-3-M-1E8中的CM, ELISA法检测上述CM中的AChE活性。*p≤0.05,**p≤0.01,***p≤0.001,****p≤0.0001。BGW4869对PCa外泌体释放的影响。GW4869处理后,采用流式细胞术检测PC-3-M-2B4或PC-3-M-1E8细胞CM中外泌体的数量。CGW4869处理的PCa细胞CM可降低巨噬细胞CD206的表达。巨噬细胞分别与CM-2B4-GW4869或CM-1E8-GW4869共培养后,我们用抗cd -206- fitc抗体(绿色)检测巨噬细胞亚型CD206的表达。
用GW4869阻断PCa外泌体的释放降低了肿瘤相关巨噬细胞的促瘤能力
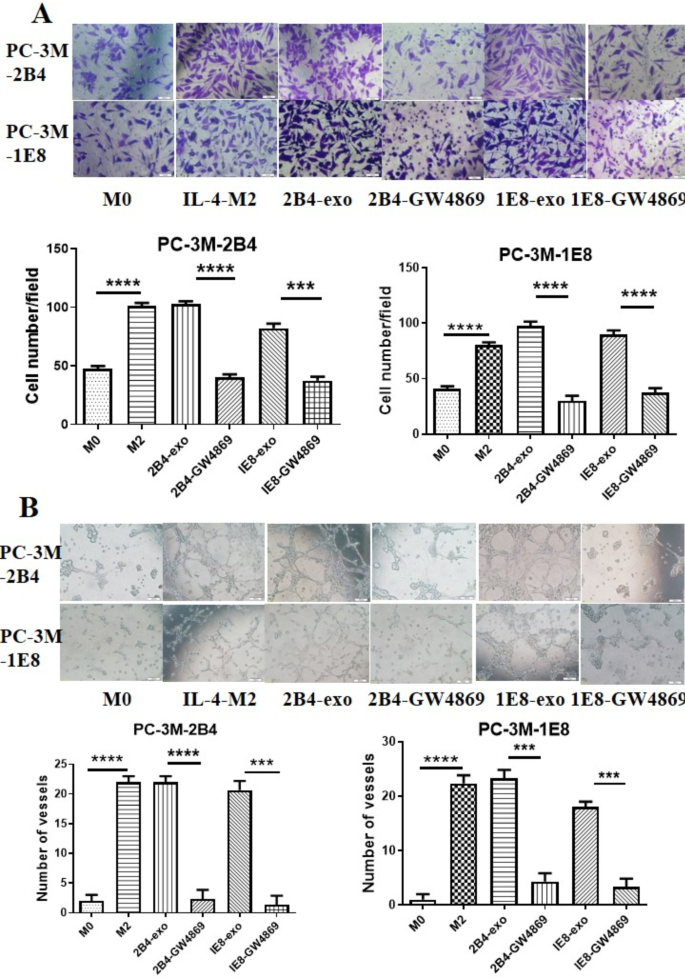
肿瘤微环境中的巨噬细胞促进肿瘤的发生和发展。为了验证GW4869对PCa外泌体调控巨噬细胞功能的影响,我们从GW4869处理的PCa细胞上清液中分离纯化了外泌体。接下来,将这些外泌体与巨噬细胞孵育,并收集条件培养基观察其对前列腺癌细胞的影响。我们的数据(图;4A)表明,经GW4869处理后,PCa细胞上清液显著降低了巨噬细胞促进PC-3-2B4的能力(2B4-GW4869 vs. 2B4-exo,p< 0.0001;1 e8-gw4869 vs.1E8-exo,p= 0.0001)和PC-3-1E8细胞侵袭(2B4-GW4869 vs. 2B4-exo,p< 0.0001;1E8-GW4869 vs. 1E8-exop= 0.0001)。同样,巨噬细胞促进PC-3-2B4的能力(2B4-GW4869 vs. 2B4-exo,p< 0.0001;1 e8-gw4869 vs.1E8-exo,p= 0.0001)和PC-3-1E8血管生成(2B4-GW4869 vs. 2B4-exo,p= 0.0001;1E8-GW4869 vs. 1E8-exop= 0.0002)也显著降低(图;4B)。
用GW4869阻断PCa外泌体的释放影响肿瘤相关巨噬细胞的促瘤能力。一个GW4869处理过的PCa用CM诱导的巨噬细胞降低了PCa细胞的侵袭能力。巨噬细胞与pc -exos、CM- 2b4 - gw4869 /CM- 1e8 - gw4869和IL-4孵育48小时。收集各组的CM,在transwell室中加入PCa细胞。48小时后,从三个随机选择的视野(原始放大倍率为100倍)对transwell腔内的细胞进行染色和观察。BGW4869处理的PCa细胞经CM诱导的巨噬细胞抑制了PCa细胞的促血管生成作用。将HUVECs和PC-3M-2B4或PC-3M-1E8细胞接种于基质预先包被的96孔板中,然后加入上述巨噬细胞的CM,孵育24 h。使用装有CCD光学和数字分析系统的倒置显微镜对内皮细胞的管状结构进行成像。通过计算每口井三个区域的节理或血管数量(原始放大倍数为100倍)来评估结果。*p≤0.05,**p≤0.01,***p≤0.001,****p≤0.0001
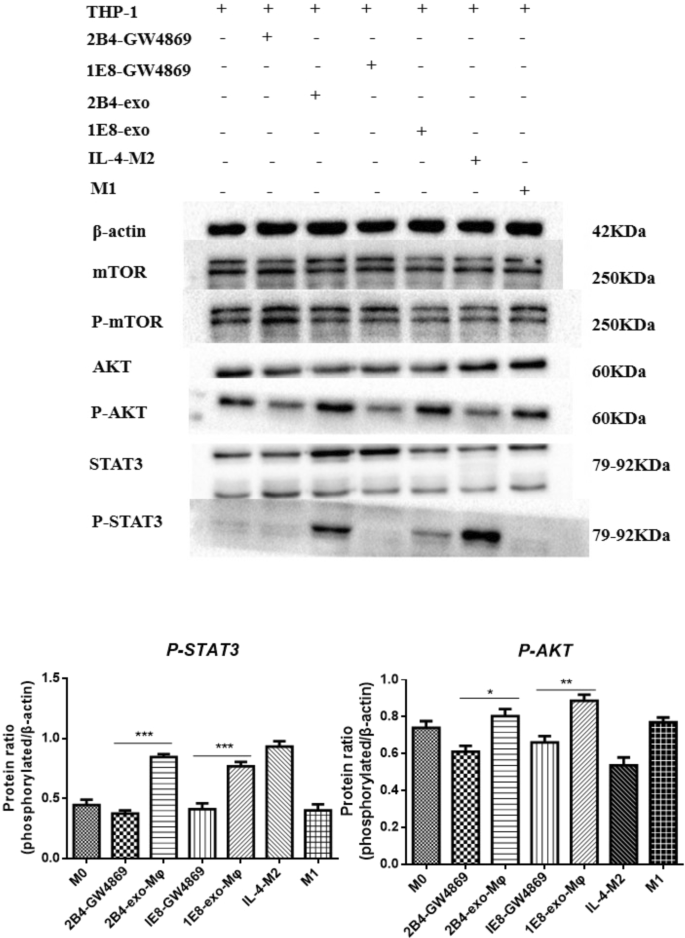
GW4869阻断PCa外泌体的释放可抑制巨噬细胞中的AKT和STAT3信号通路
GW4869在前列腺癌中影响肿瘤相关巨噬细胞分化的潜在机制仍不清楚。因此,我们用GW4869或PCa外泌体处理的PCa细胞培养上清诱导巨噬细胞,并分析其分子变化。结果表明,外泌体主要通过激活AKT和STAT3信号通路诱导巨噬细胞M2分化。相反,GW4869处理PCa上清后,AKT和STAT3在巨噬细胞中被抑制,表明GW4869抑制了AKT的激活(2B4-GW4869 vs. 2B4-exo-Mφ,p= 0.0182;1E8-GW4869 vs. 1E8-exo-Mφ,p= 0.0092)和STAT3 (2B4-GW4869 vs. 2B4-exo-Mφ,p< 0.0001;1E8-GW4869 vs. 1E8-exo-Mφ,p= 0.0005)信号通路通过减少PCa外泌体的分泌(图。5).
用GW4869阻断PCa外泌体的释放可以抑制巨噬细胞中的AKT和STAT3信号通路。巨噬细胞与PCa外泌体或CM-2B4-GW4869/CM-1E8-GW4869共培养48小时。收集各组细胞,用RIPA缓冲液裂解,然后使用Bio-Rad蛋白法测定蛋白浓度。我们使用20µg细胞裂解液,通过Western blotting分析AKT/STAT3信号通路在不同巨噬细胞中的活性。使用Bio-Rad image Lab 3.0 (beta 3)分析数据。完整的印迹显示在附加文件中1:图S2和原始数据
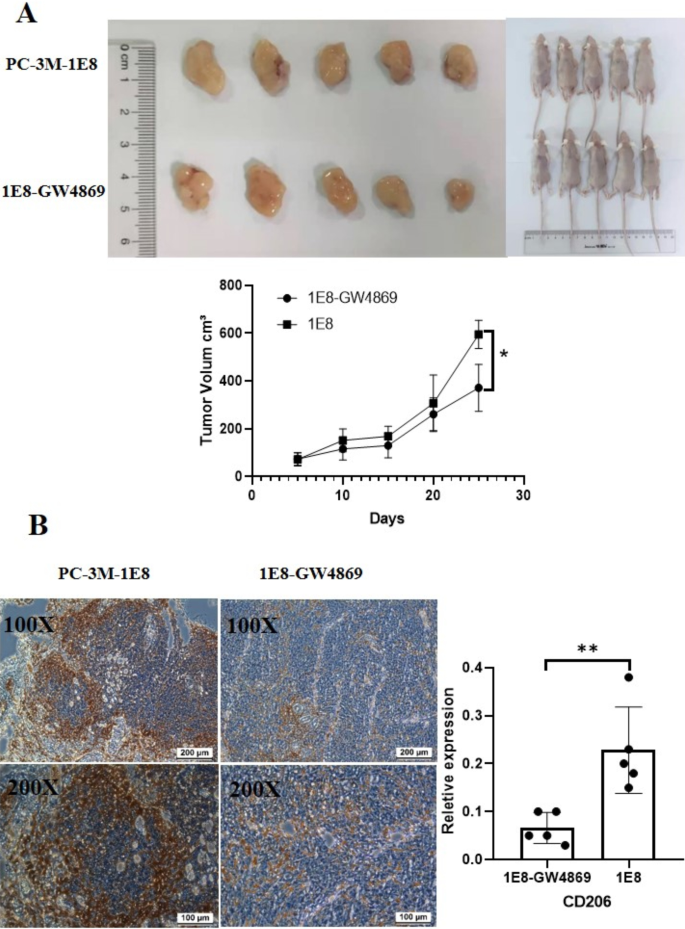
GW4869在体内抑制肿瘤相关巨噬细胞向M2表型的分化
为了进一步证实GW4869对前列腺癌肿瘤相关巨噬细胞的作用,我们建立了前列腺癌裸鼠模型。用GW4869处理PCa细胞后,注射到裸鼠体内,观察GW4869对巨噬细胞分化的影响。如图所示。6A,与对照组相比,GW4869治疗组肿瘤大小明显减小(Day = 25,p= 0.0071)。GW4869治疗组肿瘤组织中CD206+巨噬细胞数量减少3.45倍(p= 0.0053)(图6B).这些结果进一步证实GW4869抑制肿瘤相关巨噬细胞向M2表型分化。
讨论
肿瘤微环境中的巨噬细胞具有特征性的表型,功能为M2细胞,这些TAMs促进肿瘤生长因子的分泌,增强前列腺肿瘤细胞的侵袭转移[22,23].值得注意的是,肿瘤来源的外泌体作为环境信号的主要来源,驱动巨噬细胞获得M2表型[24,25].因此,阻断外泌体的释放可以抑制肿瘤细胞与基质细胞之间的高效通讯。在本研究中,我们证明了ca -exos可以通过AKT和STAT3途径有效诱导巨噬细胞向M2细胞分化。重要的是,我们发现GW4869在体外和体内均能有效抑制前列腺癌细胞外泌体的生成,并阻断前列腺癌细胞对M2巨噬细胞的诱导。结果表明,GW4869处理减弱了ca -exos诱导的这些TAMs的促瘤能力。
我们前期研究表明前列腺癌细胞CM可诱导血单核细胞分化为M2细胞[21].我们推测,除了CM中的一些细胞因子外,来自PCa细胞的外泌体也可能在巨噬细胞极化中发挥重要作用。为此,我们采用PS亲和层析法从PCa细胞系PC-3M-2B4和1E8细胞中获得外泌体,并分析其特征。如图所示。1,前列腺癌细胞的外泌体多为圆形,具有典型的碟状结构,直径约40-160 nm,特异性分子标记CD63和tgs101在外泌体膜上表达。这些结果表明,通过上述方法,我们获得了符合实验要求的PCa外泌体。
为了了解PCa外泌体对巨噬细胞的作用,我们用PMA诱导THP1细胞进入巨噬细胞,并将上述外泌体与这些诱导的巨噬细胞共培养。我们的数据显示,在外泌体的作用下,巨噬细胞中的CD206、TGF-β、IL-10明显升高,TNF-α则下降(图。2).IL-10、TGF、CD206的表达升高被认为是M2巨噬细胞的重要标志物。我们的结果证实了PCa外泌体具有类似IL-4的诱导作用,可以促进巨噬细胞的M2分化。
Essandoh等报道RAW264.7细胞经GW4869处理后,产生的外泌体数量显著减少,严重影响TNF α、IL-1beta、IL-6等细胞因子的分泌[26].为了进一步了解GW4869对前列腺相关巨噬细胞的影响,我们首先评估了GW4869对前列腺癌外泌体生成的影响。我们用10 μM GW4869处理PC-3M-2B4和PC-3M-1E8细胞48 h,然后从这些细胞中采集CM。由于胆碱酯酶通常位于外泌体中,被认为是外泌体含量的间接指标[27],我们测定了上述CM中胆碱酯酶的活性。正如预期的那样,10 μM GW4869对外泌体的分泌有显著的抑制作用,可达65%(图5)。3.A).我们还用流式细胞术分析了10 μM GW4869处理的PCa细胞上清液中外泌体的数量。经GW4869处理后,PC-3-M-2B4或PC-3-M-1E8细胞的外泌体数量分别减少了57.7%和52.5%。3.B).其次,观察GW4869对前列腺癌细胞介导的巨噬细胞极化的影响。图的结果。3.C证实,10 μM GW4869能显著减少CD206+巨噬细胞的数量,说明GW4869可以通过阻断PCa细胞分泌外泌体来抑制巨噬细胞向M2细胞分化。最后,我们分别用处理过GW4869的PCa细胞的PCa外泌体或CM培养巨噬细胞。48 h后,我们从这些巨噬细胞中收集CM,并研究其对前列腺癌细胞的影响。如图所示。4, ca -exos诱导的巨噬细胞能显著促进前列腺癌细胞的侵袭和血管生成,但GW4869-CM无此作用。我们的结果表明,GW4869可以影响肿瘤相关巨噬细胞的分化,抑制肿瘤的进展。
我们试图确定pc -exos/GW4869对巨噬细胞的作用机制。我们的数据显示(图。5)发现pc -exos与IL-4一样可以显著激活巨噬细胞中的AKT和STAT3信号通路,而这两种信号蛋白的磷酸化水平在GW4869-CM中被抑制。AKT和STAT3通路与巨噬细胞的极化过程密切相关[28,29,30.,31],我们的数据进一步证实了前列腺癌细胞可以通过外泌体激活AKT和STAT3通路培养M2巨噬细胞。GW4869可抑制肿瘤微环境的这种调控。外泌体特异性分子已被报道通过PTEN/PI3Kγ途径介导巨噬细胞极化[32]或gp130/STAT3信号[33].然而,这一结果更有可能是外泌体中多个分子联合作用的结果。在这方面,GW4869作为调节肿瘤微环境的工具应该得到更多的关注。
最后,我们用裸鼠模型观察GW4869对巨噬细胞极化的影响。体内实验结果进一步证实,在我们的GW4869治疗前列腺癌模型裸鼠中,肿瘤组织中M2巨噬细胞的数量和体内肿瘤的大小明显降低(图。6).有研究者报道用GW4869治疗裸鼠可抑制肿瘤生长,这可能与GW4869通过抑制肿瘤细胞外泌体分泌对肿瘤微环境的调控有关[34,35].我们的数据进一步证实了GW4869在前列腺癌中可以抑制M2巨噬细胞的教育,进而在体内抑制肿瘤的进展。
综上所述,我们的研究表明,前列腺癌细胞来源的外泌体可以通过激活AKT/STAT3信号通路诱导巨噬细胞进入M2亚型,促进前列腺癌的发生和发展,但这一过程可以被GW4869抑制。GW4869可能在前列腺癌特别是晚期前列腺癌的临床治疗中发挥重要作用,甚至在其他肿瘤的治疗中也有类似的作用,但这还需要更多的实验和临床研究来证实。
数据和材料的可用性
在当前研究期间生成和/或分析的数据集可作为补充文件原始数据。
缩写
- 时差:
-
肿瘤微环境
- TAM:
-
肿瘤相关巨噬细胞
- 主成分分析:
-
前列腺癌
- ELISA:
-
酶联免疫吸附试验
- MMP的:
-
基质金属蛋白酶
- 统计:
-
信号转换器和转录激活剂
- PCa-exo:
-
前列腺癌外泌体
- CM-2B4-GW4869:
-
PC-3-M-2B4细胞条件培养基经GW4869处理
- CM-1E8-GW4869:
-
PC-3-M-1E8细胞条件培养基经GW4869处理
参考文献
鲍尔我。前列腺癌存活、死亡和医疗管理。癌症。2021;127(16):2870 - 2。
Hinshaw DC, Hanna A, Lama-Sherpa T, Metge B, Kammerud SC, Benavides GA, Kumar A, Alsheikh HA, Mota M, Chen D,等。Hedgehog信号通路调控乳腺肿瘤相关巨噬细胞的代谢和极化。癌症研究,2021;81(21):5425-37。
lopez -里约热内卢A, Padilla-Ansala C, de Andrea CE, Hardisson D, Melero I.巨噬细胞极化标志物在上皮性肿瘤和黑色素瘤中的预后价值。系统回顾和荟萃分析。中国病毒学杂志。2020;33(8):1458-65。
Lanciotti M, Masieri L, Raspollini MR, Minervini A, Mari A, Comito G, Giannoni E, Carini M, Chiarugi P, Serni S.前列腺癌中M1和M2巨噬细胞与根治性前列腺切除术后肿瘤囊外扩张和生化复发的关系。生物医学学报(英文版)。2014;
Nonomura N, Takayama H, Nakayama M, Nakai Y, Kawashima A, Mukai M, Nagahara A, Aozasa K, Tsujimura A前列腺活检标本中肿瘤相关巨噬细胞浸润是前列腺癌激素治疗后疾病进展的预测。中国生物医学工程学报。2011;26(3):344 - 344。
袁旭,李勇,张安智,江春春,李福富,谢玉峰,李建峰,梁文华,张海军,刘彩霞,等。肿瘤相关巨噬细胞极化促进食管癌的进展。老龄化(奥尔巴尼纽约)。2020; 13(2): 2049 - 72。
徐红,李东,马娟,赵艳,徐玲,田锐,刘勇,孙玲,苏娟。IL-33/ST2轴通过调节巨噬细胞有丝分裂和重编程极化来影响肿瘤生长。中国生物医学杂志,2018;18(1):172-83。
Tartey S, Neale G, Vogel P, Malireddi RKS, Kanneganti TD。MyD88/IL1R轴调节肿瘤相关巨噬细胞PD-1的表达,并维持其在黑色素瘤中的免疫抑制功能。癌症研究,2021;81(9):2358-72。
Wolfsberger J, Sakil HAM, Zhou L, van Bree N, Baldisseri E, de Souza Ferreira S, Zubillaga V, Stantic M, Fritz N, Hartman J,等。TAp73抑制nf - kapab介导的乳腺癌肿瘤相关巨噬细胞的募集中国科学:自然科学与工程学报,2016;29(3):379 - 379。
杨亚平,阮培宁,马海,何文杰,陈玉文,钱勇,雅米善AA,黄皮,罗伟林,王春春,等。肿瘤间充质间质细胞通过外泌体介导的miR155/SMARCA4通路调节不典型畸胎瘤的细胞迁移。癌症。2019;11(5):720。
Tkach M, Thery C.通过细胞外囊泡进行通信:我们在哪里,我们需要去哪里。细胞。2016;164(6):1226 - 32。
王志刚,王志刚,王志刚。外泌体:细胞外细胞器,在细胞间通讯中很重要。蛋白质组学杂志,2010;73(10):1907-20。
Peinado H, Aleckovic M, Lavotshkin S, Matei I, Costa-Silva B, Moreno-Bueno G, Hergueta-Redondo M, Williams C, Garcia-Santos G, Ghajar C,等。黑色素瘤外泌体通过MET将骨髓祖细胞培养成转移性表型。中华外科杂志,2012;18(6):883-91。
张宏,邓涛,刘蓉,白敏,周林,王鑫,李松,王旭,杨辉,李静,等。外泌体EGFR调控肝脏微环境促进胃癌肝转移Nat Commun. 2017;8:15016。
Gabrusiewicz K, Li X, Wei J, Hashimoto Y, Marisetty AL, Ott M, Wang F, Hawke D, Yu J, Healy LM,等。胶质母细胞瘤干细胞来源的外泌体诱导M2巨噬细胞和人单核细胞上PD-L1的表达。Oncoimmunology。2018;7 (4):e1412909。
水谷K,寺泽R,龟山K,加藤T,堀江K,土屋T, Seike K, Ehara H,藤田Y,川上K,等。前列腺癌相关外泌体的分离。抗癌决议2014;34(7):3419-23。
李娟,刘凯,刘勇,徐勇,张峰,杨辉,刘杰,潘涛,陈娟,吴敏,等。外泌体介导ifn - α诱导的抗病毒活性的细胞间传递。中华免疫杂志,2013;14(8):793-803。
Kosaka N, Iguchi H, Yoshioka Y, Takeshita F, Matsuki Y, Ochiya T. microrna在活细胞中的分泌机制和细胞间转移。中国生物医学工程学报,2010;29(3):344 - 344。
舒舒,陈晓明,陈晓明,陈晓明,等。利用超滤和尺寸排除色谱法分离黑素瘤细胞外泌体的研究进展。方法Mol生物学2021;2265:289-304。
肖玲,冈村浩,熊泽勇。三维炎性组织的牙龈等效物。J Vis Exp JoVE。2018; 134: e57157。
王震,徐磊,胡艳,黄艳,张艳,郑旭,王珊珊,王艳,余艳,张敏,等。miRNA let-7b调节巨噬细胞极化,增强肿瘤相关巨噬细胞促进前列腺癌血管生成和流动性。科学通报2016;6:25602。
Al-Janabi H, Lewis CE。巨噬细胞对去势抵抗性前列腺癌发展的调控。癌症研究,2021;81(21):5399-400。
Siefert JC, Cioni B, Muraro MJ, Alshalalfa M, Vivie J, van der Poel HG, Schoots IG, Bekers E,冯飞,Wessels LFA,等。由单细胞转录组揭示的人类前列腺癌相关巨噬细胞亚型的预后潜力。Mol Cancer Res MCR。2021; 19(10): 1778 - 91。
陈强,李勇,高伟,陈玲,徐伟,朱霞。外泌体介导的肿瘤与肿瘤相关巨噬细胞之间的相互作用。前沿Mol生物科学,2021;8:764222。
徐志刚,李志刚,李志刚。外泌体介导的肿瘤免疫调控。中国生物医学工程学报,2018;29(3):344 - 344。
Essandoh K,杨林,王旭,黄伟,秦东,郝杰,王勇,Zingarelli B,彭涛,范春春。GW4869阻断外泌体生成可抑制脓毒症诱导的炎症和心功能障碍。生物化学学报,2015;1852(11):2362-71。
Savina A, Vidal M, Colombo MI. K562细胞外泌体通路受Rab11调控。中国生物医学工程学报(英文版),2002;
Vergadi E, Ieronymaki E, Lyroni K, Vaporidi K, Tsatsanis C. Akt信号通路在巨噬细胞活化和M1/M2极化中的作用。中华免疫杂志,2017;198(3):1006-14。
Ruckerl D, Jenkins SJ, Laqtom NN, Gallagher IJ, Sutherland TE, Duncan S, Buck AH, Allen JE。il - 4ralpha依赖的microRNAs的诱导表明PI3K/Akt信号通路对il -4驱动的小鼠巨噬细胞增殖至关重要。血。2012;120(11):2307 - 16。
刘瑞敏,孙丹,焦亚良,王鹏,张娟,王敏,马娟,孙敏,顾宝林,陈鹏,等。巨噬细胞迁移抑制因子通过激活Akt和失活GSK3beta促进食管鳞癌的侵袭性。癌症杂志2018;412:289-96。
Campana L, Starkey Lewis PJ, Pellicoro A, Aucott RL, Man J, O 'Duibhir E, Mok SE, Ferreira-Gonzalez S, Livingstone E, Greenhalgh SN,等。STAT3-IL-10-IL-6通路是无菌肝损伤中巨噬细胞泡腾作用和表型转化的一种新型调节因子。中华免疫杂志,2018;200(3):1169-87。
王霞,罗刚,张凯,曹娟,黄超,姜涛,刘波,苏玲,邱卓。低氧肿瘤源性外泌体miR-301a通过PTEN/PI3Kgamma介导M2巨噬细胞极化促进胰腺癌转移癌症决议2018;78(16):4586-98。
Ham S, Lima LG, Chai EPZ, Muller A, Lobb RJ, Krumeich S, Wen SW, Wiegmans AP, Moller A.乳腺癌来源的外泌体通过gp130/STAT3信号改变巨噬细胞极化。前沿免疫,2018;9:871。
顾YY,于J,王张摩根富林明,c抑制分泌exosomal miR-19b gw4869可以调节铂敏感在结肠直肠癌。赘生物。2019;66(1):39-45。
Vuckovic S, Vandyke K, Rickards DA, McCauley Winter P, Brown SHJ, Mitchell TW, Liu J, Lu J, Askenase PW, Yuriev E,等。阳离子小分子GW4869对高磷脂酰丝氨酸表达的骨髓瘤细胞具有细胞毒作用。中国生物医学工程杂志,2017;29(3):344 - 344。
确认
不适用。
资金
本研究得到国家自然科学基金(NSFC, No. 81860521)和江西省自然科学基金(20192ACBL20022)的资助。资助者在研究设计、数据收集和分析、解释和撰写手稿中没有任何作用。
作者信息
作者及隶属关系
贡献
所有作者都对这份手稿有贡献。Z-GW和YCH构想并设计了实验;Y-LP、MZ、H-YG、Y-YH、Y-YZ、Y-QH进行实验;Y-LP和MZ对数据进行分析;Z-GW、YCH、LZ贡献了试剂/材料/分析工具;Y-LP, MZ, YCH和Z-GW撰写了论文。YCH和Z-GW审阅了手稿。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
本研究是在江西省医学科学院伦理委员会批准下发起的。jxams -以- 2019012)。所有实验均在江西省医学科学院伦理委员会指导下进行。
相互竞争的利益
作者宣称他们之间没有利益冲突。
发表同意书
不适用。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1。
补充材料。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
彭勇,赵敏,胡勇。et al。GW4869阻断外泌体生成抑制前列腺癌M2巨噬细胞的教育BMC Immunol23, 37(2022)。https://doi.org/10.1186/s12865-022-00514-3
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12865-022-00514-3
关键字
- 外来体
- GW4869
- 巨噬细胞极化
- 前列腺癌