摘要
背景
MicroRNAs (miRNAs)是一种小的非编码rna,通过调节包括骨骼肌在内的基因表达在多种生物过程中发挥关键作用。在目前的研究中,研究miRNA在肌肉代谢特性明显的恶性热热综合征阴性杜洛克猪和Pietrain猪的最长肌活检中的表达谱,以探索与骨骼肌中线粒体呼吸活性和代谢酶活性相关的miRNA的调节作用。
结果
对杜洛克猪和皮特兰猪的miRNA表达谱进行了比较分析,然后基于它们的成对相关性和计算目标预测与mRNA表达谱进行了整合。鉴定的靶基因在蛋白质泛素化途径、干细胞多能性和香叶酰二磷酸生物合成以及骨骼和肌肉系统发育中富集。接下来,我们分析了个体mirna与肌纤维类型、线粒体呼吸活性、代谢酶活性和磷酸腺苷浓度等表型性状的相关性,构建了与能量代谢相关的调控miRNA-mRNA网络。值得注意的是,miR-25靶向BMPR2而且IRS1, miR-363靶向USP24, miR-28靶向HECW2和miR-210靶向ATP5I,ME3,MTCH1而且CPT2与慢缩氧化纤维、快缩氧化纤维、ADP和ATP浓度高度相关,提示miRNA-mRNA调节网络在调节猪肌肉线粒体能量消耗中起重要作用。在鉴定的miRNA-mRNA网络中,我们观察到线粒体与泛素蛋白酶体系统在基因表达水平上的紧密关系。它揭示了这两个系统之间的联系,有助于骨骼肌在生理条件下的能量代谢。
结论
我们根据不同猪品种之间的肌肉特性差异,进一步通过表达基因和表型测量的相关性分析,组装了miRNA-mRNA调控网络。这些复杂的网络与肌纤维类型、代谢酶活性和ATP产生有关,并可能通过微调基因表达来促进不同的肌肉表型。总而言之,这些结果为mirna在肌肉能量代谢中的调节作用提供了一个深入的了解,并可能对肉质和产量产生影响。
背景
MicroRNAs (miRNAs)是一种内源性长约22 nt的小的非编码rna,通过表观遗传调控基因表达在多种生物过程中发挥重要作用。前体mirna (pre-miRNA)最初在细胞核中产生,并加工成大约70 nt长的茎环结构。然后将其输出到细胞质中,由Dicer处理生成miRNA/miRNA双工。其中一条链与Agonaute结合形成rna诱导沉默复合体(RISC),通过碱基对互补靶向mRNA,通常是针对其3 '非翻译区(3 ' utr)或cd,并通过mRNA降解或翻译抑制下调基因表达,而另一条链通常被丢弃[1].
骨骼肌具有高度的代谢活性,对肉类生产动物很有价值。猪的肌肉纤维类型主要有慢跳氧化纤维(STO)、快跳氧化纤维(FTO)和快跳糖酵解纤维(FTG)。肌肉纤维与肌肉代谢活动和肉质(如嫩度、多汁性和颜色)密切相关。含有高比例氧化纤维的肌肉通常与较高的脂肪含量、氧化酶活性和线粒体密度有关[2- - - - - -4];高比例的FTG纤维与高糖酵解酶活性相关。先前的研究已经发现猪骨骼肌中的miR-133、miR-221和miR-103等几种miRNAs与肉质相关[5].猪miR-133和miR-208的多态性被认为是影响肌肉纤维和肉质性状的遗传因素[6,7].由于在猪骨骼肌中发现了诸如肌肉生成、脂肪生成和肌肉发育等mirna的关键作用[8- - - - - -11],了解miRNA对骨骼肌纤维代谢特性的调控可能是改善肉品质的关键[12].MiR-210和miR-338可以调节氧化磷酸化(OXPHOS)机制的基因表达,包括复杂IV亚基COX10、COXIV和ATP合酶亚基ATP5G1 [13,14].MiR-15a和miR-15b调节细胞ATP水平[15,16].MiR-696通过靶向过氧化物酶体增殖物激活受体- γ辅激活物-1α (PGC-1α)调控脂肪酸氧化和线粒体生物发生[17].随着这些miRNA的识别,缺乏与骨骼肌能量代谢相关的全面和系统的miRNA分析仍未解开。
我们之前对肌肉转录谱的研究揭示了许多与肌肉纤维类型、线粒体呼吸活性和代谢酶显著相关的生物学途径[18].进一步研究mirna如何通过微调基因表达参与能量代谢是很有趣的。在本研究中,屠宰前24小时获得的最长肌(LM)样本的miRNA转录组分析提供了对与肌肉纤维、线粒体呼吸活性和代谢酶活性相关的miRNA发现的全面洞察。杜洛克猪肌肉中含有较高的STO纤维百分比、线粒体呼吸活性和较高的脂肪含量,以改善肉质的嫩度和多汁性。相比之下,PiNN猪肌肉更发达,有利于肉类工业。他们的骨骼肌更瘦,含有更多的FTG纤维[18- - - - - -20.].因此,杜洛克猪和Pietrain猪是研究骨骼肌能量代谢的良好模型。然后,根据miRNA和mRNA的成对相关性和计算目标预测,整合它们的表达谱,构建可能影响骨骼肌代谢特性从而影响肉品质的调控miRNA-mRNA网络。基于mirna的调节代谢的阐明可以丰富我们对mirna在实现不同品种骨骼肌表型多样性中的作用的认识。
方法
动物和样本采集
该实验和肌肉活检采集得到了德国和欧洲动物福利法规对动物饲养、运输和屠宰的批准和授权[19- - - - - -21].所有实验程序,包括动物护理和组织样本收集,均遵循由动物护理委员会和当局正式授权的德国动物保护法[Niedersächsischen Landesamt für Verbraucherschutz und Lebensmittelsicherheit (LAVES) 33.42502/01-47.05]所规定的保护准则和良好科学实践。
如前所述[19- - - - - -21]、杜洛克猪和Pietrain (PiNN)猪饲养至180日龄。为了排除磁流体热热综合征(MHS)位点的影响,只研究了MHS阴性基因型猪的肌肉样本。肌肉活组织切片取自每个品种的五头母猪和公猪(n= 20)用于表型测量(见附加文件1详细的表型定义和测量)[18- - - - - -21].屠宰前24小时采集第13至14胸椎之间的最长肌活检。肌肉样本在液氮中冷冻,并在- 80°C保存,直到分析。
RNA隔离
根据制造商的协议,使用miReasy Mini试剂盒和RNeasy MinElute Cleanup试剂盒(Qiagen)从最长肌活检中分离和富集小rna。使用Agilent小RNA试剂盒,使用Agilent 2100生物分析仪(Agilent)评估小RNA的质量和数量。
MicroRNA微阵列分析
使用Affymetrix GeneChip miRNA 3.0阵列(Affymetrix)测定杜洛克猪和PiNN猪死前24小时LM的miRNA表达谱。它由16,772个代表发夹前体的条目组成,总探针集19,724个用于检测153个物种的大多数miRNA (miRBase V.17)。使用FlashTag Biotin HSR RNA标记试剂盒(Genisphere)用于Affymetrix GeneChip miRNA阵列,使用200 ng小RNA进行样品制备。每个被标记的RNA (n= 20)然后根据制造商的建议(Affymetrix)与Affymetrix GeneChip miRNA阵列杂交16小时,在Affymetrix fluics 450站中洗涤和染色,并在Affymetrix G3000基因阵列扫描仪上扫描。使用Expression Console软件进行鲁棒多芯片平均(RMA)归一化,并应用DABG (detection above background)算法检测现有mirna。通过排除每个品种中存在于不到70%样本中的探针和序列长度大于或等于30 nt的注释mirna来进行进一步筛选。3587个探针通过质量过滤,用于进一步分析。表达数据的可用性在Gene expression Omnibus公共存储库中,GEO登录号为GSE80198: GSM2120718-GSM2120737。
统计学和生物信息学分析
在JMP基因组学7(SAS研究所)中使用ANOVA程序对miRNA进行差异表达分析。品种被视为一种固定效应。根据Benjamin & Hochberg的研究,错误发现率(FDR)被用来控制多假设检验的错误率[22].我们使用之前基于微阵列的mRNA表达数据与差异表达的mirna整合,并扫描潜在的靶基因。计算miRNA和mRNA表达水平的Pearson相关性。
RNAhybrid 2.1.2和TargetScan 7.0均用于预测miRNAs的靶点。RNAhybrid (http://bibiserv.techfak.uni-bielefeld.de/rnahybrid)是一种计算软件,可在大RNA中检测小RNA在能量上最有利的杂交位点[23,24].miRNA探针组使用以下参数进行测试:每个目标的命中次数= 1,能量截止=−25千卡/摩尔,每边最大内部或膨胀环大小= 4。TargetScan (http://targetscan.org/),根据miRNA种子序列(miRNA 5 '端2-8位)和猪mRNA序列5 ' UTR、3 ' UTR和蛋白质编码区靶结合位点的互补性,预测候选靶基因(Sus scrofa 10.2下载自NCBI:http://www.ncbi.nlm.nih.gov/2015年9月1日)[25].Hafner等和Chi等人发现,在HEK293细胞中,编码序列(cd)中argonaute结合的靶位点与位于3 ' UTR中的靶位点一样多(50% CDs vs 46% 3 ' UTR) [26]和小鼠大脑(25% cd vs 32% 3'UTR) [27].其他研究表明,3'UTR中的miRNA靶点更有效地触发mrna降解,而cd和5'UTR中的靶点可以有效地抑制翻译[28,29].Xu等人开发了一种新的计算方法,用于沿着整个基因序列定位的靶点预测,以增加真阳性靶点的百分比[30.].因此,本研究将5’UTR、CDs和3’UTR纳入研究,以提高miRNA靶点识别的敏感性,避免大量缺失靶点。与miRNA负相关并预测为潜在靶标的转录本进一步传递给功能分析。
IPA软件(匠心系统,https://www.ingenuity.com)用于潜在miRNA靶基因的功能分析。它基于注释的基因功能对基因进行分类,并使用Fisher精确测试对基因列表中功能术语的过度表示进行统计测试。miRNA-mRNA调控网络使用Cytoscape V3.2.1 (http://cytoscape.org) [31].
定量实时PCR (qPCR)用于microRNA芯片(miChip)验证
四种与能量代谢相关的miRNAs (ssc-miR-24-3p, ssc-miR-30a-5p, ssc-miR-126和ssc-miR-145)通过每个样本的qPCR验证(n= 20)。同样的样本用于qPCR验证和mirna芯片。cDNA由250 ng分离的mirna使用NCode合成TM很TMmiRNA cDNA合成试剂盒(Invitrogen)根据制造商的协议。采用EXPRESS SYBR GreenER进行实时PCRTMmiRNA qRT-PCR试剂盒与预混ROX (Invitrogen)根据制造商的协议。所有测量都是一式两份。热参数分别为50°C, 95°C, 2 min, 95°C, 15 s, 60°C, 1 min, 45个循环。试剂盒中提供通用qPCR引物,针对感兴趣的mirna设计mirna特异性正向引物。所设计引物序列信息可在附加文件中查阅2.以5S和U6转录水平的几何平均值作为内标,归一化miRNA表达值。采用SAS 9.3 (SAS Institute)软件计算miChip与qPCR数据之间的相关系数。
结果
Duroc和Pietrain之间差异表达的mirna
在3587个质量筛选的探针中,58个探针属于27个独特的成熟miRNA序列,差异表达(pJMP Genomics的方差分析显示,Duroc和PiNN之间的差异< 0.05,FDR < 0.2)。其中,属于8个成熟miRNA序列的33个探针在杜洛克猪中上调,而属于19个不同成熟miRNA序列的25个探针在PiNN猪中上调(补充文件)3.).其中,miR-363、miR-423和miR-34是杜洛克猪中表达上调最多的3个mirna,其倍数变化范围为3.29 - 1.68。而PiNN中上调前三位的mirna分别为miR-4687、miR-3619和miR-22,其倍数变化范围为3.45 ~ 2.71。
差异表达mirna与目标mrna之间的相关性
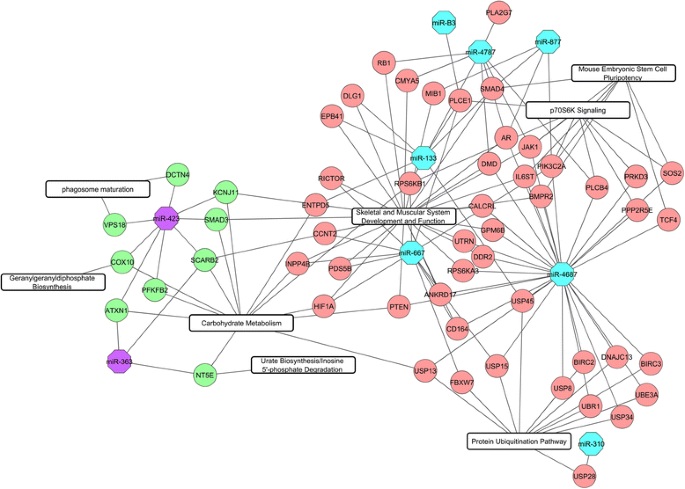
使用我们前期研究中匹配样本的mRNA表达数据(GEO登录号GSE69840: GSM1709900 - GSM1709919)进行两两相关分析[18].总共有2345个mRNA探针有差异表达(p两品种间FDR < 0.05)。对58个miRNA探针和2345个mRNA探针进行了配对相关系数分析。在136010个Pearson相关系数中,检测到12408个负相关miRNA-mRNA对pmiRNA与mRNA的相关性< 0.05,FDR < 0.05。利用Targetscan和RNA杂交技术进行计算目标预测。结合相关分析和靶点预测结果,保留了598对miRNA- mrna,包含340个基因和11个成熟miRNA序列(附加文件4).miRNA-mRNA对基于表达水平(lsmean)的热图和分层聚类如图所示。1显示了mRNA和mRNA候选靶标之间的反比关系。用IPA进一步分析了所有的靶基因,以确定可能导致两个品种之间不同肌肉代谢特性的突出功能和途径。重点研究了与骨骼和肌肉系统发育和功能以及碳水化合物代谢相关的功能类别的靶基因。Duroc上调靶基因的前3个典型通路为蛋白泛素化途径、p70S6K信号通路和小鼠胚胎干细胞多能性,PiNN上调靶基因的前3个典型通路为香叶酰香叶酰二磷酸生物合成、吞噬体成熟和尿酸盐生物合成/肌苷5’-磷酸降解。图中描述了一个具有代表性的miRNA-mRNA调控网络。2说明了两种生物分子类型的复杂关系和网络。
miRNA表达与表型性状的相关性
我们计算了3587个miRNA探针的表达与杜洛克猪和PiNN猪的肌肉纤维组成、线粒体呼吸活性和代谢酶活性的相关性。共鉴定出3263个miRNA-表型对,包含1864个miRNA探针,属于757个成熟miRNA序列p< 0.05表明miRNA与19种表型中的至少一种具有相关性。与表型相关的前100个显著miRNAs在附加文件中显示5(p< ~ 0.001)。表格1显示前5个miRNAs与每种表型显著相关。
相关miRNAs、mrna和表型性状的整合
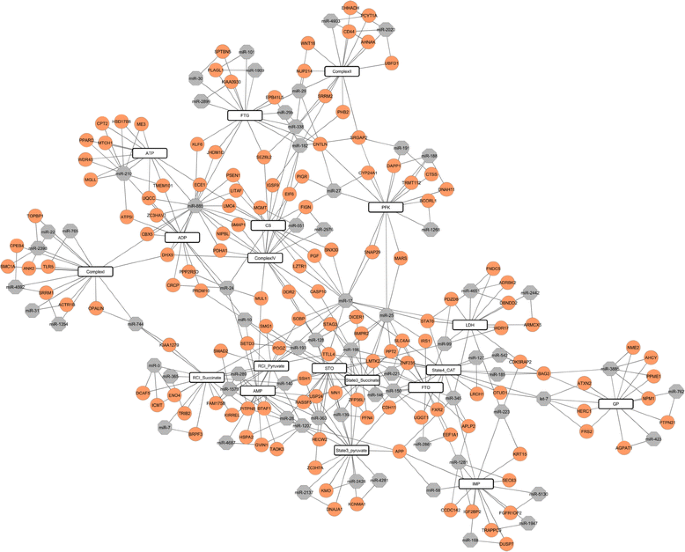
在杜洛克猪和PiNN猪中计算了经过质量过滤的17820个mRNA探针的基因表达与每个表型性状之间的相关性。共鉴定出24374个mRNA-表型对,包含11091个mRNA探针,属于7489个基因p< 0.05。与表型相关的前100个显著mrna可在附加文件中获得6(p< 0.0002)。然后在鉴定的1864个miRNA探针和11091个mRNA探针之间进行成对相关系数分析,这些mRNA探针至少与19种表型中的一种相关。结合靶点预测结果,得到26861对miRNA-mRNA,包含3182个基因和387个mirna (p< 0.05)与至少一种表型相关。每种表型的前十位miRNA-mRNA对如图所示。3.和附加文件7(p< 0.05, fdr < 0.24)。
线粒体与UPS相关基因的相关关系
从所有确定的与每个表型性状相关的前10个miRNA-mRNA对(图。3.),计算9个选择的核编码线粒体相关基因与7个选择的ups相关基因的表达相关性。在表2、线粒体相关基因:ATP合成酶、线粒体F0复合体、亚单位E (ATP5I)、苹果酶3 (ME3)、线粒体载体1 (MTCH1),细胞色素P450,家族24,亚家族A,肽1 (CYP24A1)、驱动蛋白家族成员1结合蛋白(KIAA1279),禁止2 (PHB2)、丙酮酸脱氢酶α 1 (PDHA1)和泛醇-细胞色素c还原酶复合物伴侣(UQCC)与6个ups相关基因中的至少一个显著相关:Sus scrofa类似于E3泛素蛋白连接酶HECW2 (HECW2)、泛素特异性肽酶24 (USP24),包含1 (UBFD1), NFKB 1-like线粒体泛素连接酶激活因子(MUL1)、β淀粉样蛋白(A4)前体蛋白(应用程序)和热休克70 kDa蛋白2 (HSPA2)p< 0.05。
中存在的验证
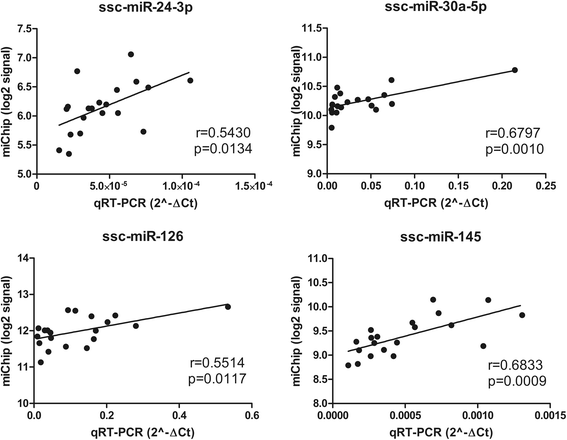
随机选取ssc-miR-24-3p、ssc-miR-30a-5p、ssc-miR-126和ssc-miR-145的表达进行qRT-PCR验证。qPCR与miChip数据的相关系数为0.543 (p= 0.0134)至0.6833 (p= 0.0009),表明miChip与qPCR结果具有良好的一致性,如图所示。4.
讨论
Duroc和Pietrain在肌肉特性和肉质上存在差异。杜洛克猪较肥,骨骼肌中含有较多的STO纤维,这通常与较高的氧化酶活性、线粒体呼吸活性和脂肪的储存有关,以改善肉的嫩度和多汁性,而皮特雷恩猪肌肉更发达,肌肉更瘦,含有较高比例的FTG纤维,这与较高的糖酵解酶活性有关[2,18- - - - - -20.,32,33].较高比例的FTG纤维可能导致毛细化降低、氧气输送不足和糖原消耗,最终导致肉干、硬、黑[34,35].由于microrna被认为是骨骼肌能量代谢的关键调控因子,本研究通过miRNA表达谱分析和功能分析,可能揭示基于miRNA的肌纤维类型和代谢酶活性的表观遗传调控机制,进而可能转化为肉质的改善。
几项研究已经对猪骨骼肌的miRNA谱进行了研究,并构建了miRNA- mrna网络[36- - - - - -38].Hou等人分析了长白猪(瘦型)和同程猪(肥胖型)的miRNA和mRNA谱[36].在Hou等人的研究和我们目前的研究中,肌肉发育的生物学过程都显示在鉴定的差异表达miRNA-mRNA网络中,这突出了mirna在肥胖型和瘦肉型猪肌肉发育分化中的调节作用的重要性。此外,在两项研究的网络中都发现了一些miRNAs,如miR-363、miR-133和miR-423。Tang等研究长白猪和桐城猪在33天、65天和90天骨骼肌的miRNA和mRNA表达,以探索出产前肌肉发育情况,Jing等构建了猪不同剩余采食量之间的差异表达miRNA-mRNA网络[37,38].
差异表达的mirna及其靶基因在不同肌肉特征中的作用
为了解不同猪品种骨骼肌表型变异中mirna的调控作用,对两个猪品种间差异表达的mirna和mrna进行整合,筛选出关键mirna调控的关键靶基因。功能分析结果显示,靶基因在各种肌肉相关生物功能上均显著富集,提示其结果与生物相关,而非随机噪声。Duroc-up调控基因的最权威途径是含有Duroc-up基因的蛋白泛素化途径USP28,USP8,USP45,USP15,USP13,UBR1,DNAJC13,FBXW7,BIRC3,USP34,UBE3A, BIRC2。依赖于atp的泛素由泛素激活酶E1、特异性泛素结合酶E2和泛素蛋白E3介导,通过26 s蛋白酶体促进蛋白质降解,并影响肉质和肌肉萎缩[39- - - - - -42].在我们的研究中,USP45而且USP28分别被预测为miR-133和miR-310的直接靶标。MiR-133b可同时影响主要细胞凋亡途径和创面愈合[43,44],最重要的是,猪MiR206/MiR133b簇的多态性被认为是影响肌肉纤维和肉质性状的遗传因素[6].MiR-311-3p属于miR-310 miRNA家族,其功能缺失可导致能量代谢缺陷和营养稳态相关基因的调控紊乱[45].MiR-363通过直接靶向E2F3的3'UTR被发现是脂肪组织来源的基质细胞中脂肪形成的负调控因子[46].这与我们的研究一致,miR-363在Duroc中表达水平高于PiNN,平均折叠变化大于3。其他杜洛克上调基因如CMYA5,基于“增大化现实”技术,RB1而且BMPR2在功能类别中,骨骼和肌肉系统的发育和功能受到miR-4787、miR-877和miR-4687等的调控。心肌病相关5 (CMYA5),也被称为TRIM76,属于蛋白质三重基序超级家族(TRIM)。其与m带Titin和calpain3的相互作用提示其与肢体肌营养不良症相关[47].的一个SNP (A7189C)CMYA5与水分流失和肌内脂肪显著相关,这就提出了猪CMYA5作为潜在的肉类品质候选基因[48].雄激素受体(AR)是一种类固醇激素激活的转录因子。雄激素- ar信号通路通过增加慢抽搐特异性基因的表达和抑制快抽搐特异性基因的表达促进骨骼肌中慢抽搐肌纤维的形成[49) . .此外,通过基因共表达分析,视网膜母细胞瘤1 (RB1)已被确定与牛的大理石花纹性状有关[50].骨形态发生蛋白受体II (BMPR2)编码跨膜丝氨酸/苏氨酸激酶的骨形态发生蛋白受体家族的一个成员。它对BMP信号传导至关重要,并可能参与脂肪形成的调节,从而参与肥胖[51].上述duroc上调调控基因及其对应的下调调控mirna均可导致氧化肌纤维和脂肪含量升高。另一方面,羽状up调节基因SMAD3而且PFKFB2均由miR-423调控。这两个基因不仅参与肌纤维特异性,还参与骨骼肌糖酵解的促进。SMAD家族成员3 (SMAD3)通过调节atroin -1、mTOR和蛋白质合成促进体内肌肉萎缩[52].抑制过氧化物酶体增殖物激活受体γ共激活因子1-α (包括-1α) [53],它是控制线粒体生物发生和驱动慢肌纤维形成的主协调器[54,55].果糖- 2,6 -双磷酸酶2 (PFKFB2)可通过控制果糖2,6 -二磷酸的水平来促进糖酵解,果糖2,6 -二磷酸是磷酸果糖激酶(PFK-1)的变构激活剂[56].总的来说,我们证明了差异miRNAs和靶基因候选组合的调控网络,可以微调通路内的基因表达,并塑造猪品种之间的相关表型。
表型相关的microRNAs与能量代谢的各种过程有关
大量研究揭示了miRNA在骨骼肌发育中的关键作用,不规则的miRNA表达有助于各种肌肉疾病[57].表格1显示前5个miRNAs与杜洛克猪和PiNN猪的肌肉纤维类型、线粒体呼吸活性(MRA)和代谢酶活性等各表型性状显著相关。包括正相关和负相关,以发现mirna和表型之间的任何潜在联系。STO、FTO和FTG纤维是猪的三种主要肌肉纤维类型,与肌肉代谢活动和肉质密切相关。miR-208、miR-499、miR-130和miR-363等mirna与肌纤维类型呈高度显著相关。MiR-208和miR-499通过靶向Sox6来诱导I型纤维程序,从而在肌肉纤维特性的规范中发挥主导作用,Sox6作为慢肌纤维基因的抑制因子[58- - - - - -60].MiR-130b属于miR-130家族,直接靶向基因PGC-1α,该基因是线粒体生物发生的主要调节因子,其激活促进小鼠体内缓慢的氧化性肌生成程序,并驱动培养肌细胞中慢肌纤维的形成[54,61].在C2C12细胞中,miR-130b可以通过靶向电子传递链亚基Ndufb7和Cox6a2调节细胞ATP水平[16].如前所述,miR-363已被发现通过直接靶向E2F3的3'UTR,在脂肪组织来源的基质细胞中作为脂肪生成的负调控因子[46].由于脂质主要储存在STO肌肉纤维中,以改善肉的嫩度和多汁性[33],而含有更多STO纤维的肌肉与较高的氧化酶活性和线粒体呼吸活性有关[2],预计miR-363与STO肌纤维类型和线粒体呼吸活性(包括状态3丙酮酸和状态3琥珀酸)高度相关。MiR-30家族成员已被证明通过直接抑制钙信号通路来控制钙信号2 +转运体TRPC6等。62].考虑到钙信号在线粒体ATP生成中的关键调节作用,miR-30与线粒体呼吸活动(包括丙酮酸状态3和琥珀酸状态3)相关,以及TCA参与CS酶活性也就不足为奇了。此外,miR-30直接靶向Prdm1促进快速肌肉形成,因为Prdm1通过抑制转录因子Sox6调节肌肉纤维分化,Sox6是慢抽搐特异性基因表达的抑制因子[60,63].所有这些都加强了STO纤维、线粒体呼吸活性和脂肪含量之间的联系。MiR-196与线粒体状态3和状态4呼吸频率和Complex IV活性高度相关。MiR-196a在猪中表现出组织特异性表达模式,并通过诱导脂肪细胞特异性标记物的表达、脂质积累和甘油三酯含量在猪脂肪发育中发挥作用[64].MiR-542与RCI琥珀酸显著相关。MiR-542-3p直接靶向骨形态发生蛋白7 (BMP7), BMP7诱导脂肪来源的间充质干细胞向棕色脂肪细胞分化,并增加成熟棕色脂肪细胞的线粒体活性[65- - - - - -67].在本研究中,MiR-1与Complex II活性相关。MiR-1家族在心脏和骨骼肌中大量表达。转录后抑制抗氧化网络基因的表达,从而影响miR-1转基因小鼠对心脏氧化应激的敏感性[68].此外,它被认为是与肌肉纤维类型组成相关的候选基因[69].MiR-7、miR-194和miR-25被证实与GP活性相关。miR-7和miR-194都可以直接靶向并抑制胰岛素样生长因子1受体(IGF-1R)的表达,而miR-25则在其mRNA水平上调控胰岛素合成[70- - - - - -72].由于胰岛素和胰岛素样生长因子系统对正常的葡萄糖稳态至关重要[73,74],很可能miR-7和miR-194通过IGF-1R和胰岛素在葡萄糖代谢中发挥作用。MiR-210、miR-15和miR-338与肌细胞中ADP和ATP浓度高度相关。MiR-210和miR-338调节氧化磷酸化(OXPHOS)机制的表达,包括复合物IV亚基COX10,COXIV和ATP合酶亚基ATP5G1相应的(13,14].OXPHOS系统的完全组装可以直接促进ATP的生产。此外,miR-15b对细胞ATP水平的调节也得到了其他工作的支持[15].总的来说,我们的研究结果和之前的报道在功能上将mirna与肌纤维特异性、线粒体呼吸、脂肪生成、葡萄糖代谢和ATP生成联系起来,并进一步表明mirna在能量代谢中起着重要作用。
表型相关的miRNA-mRNA调节网络与能量代谢相关
在鉴定出与表型高度相关的miRNA的基础上,我们进一步整合了miRNA和mRNA的表达谱,以鉴定影响能量代谢的miRNA调控基因。构建microRNA-mRNA调控网络的标准如下:1)miRNA和靶mrna的表达均与表型性状相关2)基因表达水平与其miRNA调控基因的表达呈负相关3)计算预测该基因为相应miRNA的靶基因。值得注意的是,miR-25与其靶基因骨形态发生蛋白受体II型(BMPR2)和胰岛素受体底物1 (IRS1)与STO和FTO肌纤维相关。MiR-25已被证实在心肌细胞中大量存在。它以线粒体钙单转运蛋白(MCU)和钙为靶点2 +转运atp酶(ATP2A2),并在心脏收缩力中发挥作用[75,76].在本研究中,miR-25被提议靶向这两个基因BMPR2而且IRS1。BMPR2编码跨膜丝氨酸/苏氨酸激酶的骨形态发生蛋白受体家族的一个成员。它对BMP信号传递至关重要,并可能参与脂肪形成的调节,从而参与肥胖[51].IRS1是介导胰岛素信号通路的主要分子。胰岛素不仅调节蛋白质合成和葡萄糖储存的刺激[77],还可通过增加复合物I和复合物IV的表达水平从而产生ATP,从而影响骨骼肌的线粒体功能和氧化能力[78].MiR-363及其靶基因泛素特异性肽酶24 (USP24)与STO纤维、线粒体呼吸活性(包括状态3丙酮酸和状态3琥珀酸)和肌细胞AMP浓度相关,而miR-28及其靶基因HECW2与STO肌纤维相关。USP24属于半胱氨酸蛋白酶的一个大家族,其功能是去泛素化酶。HECW2编码HECT、C2和WW结构域,包含E3泛素蛋白连接酶2,是泛素蛋白酶体系统(UPS)的主要组成部分。UPS利用ATP促进蛋白质降解,调节肌肉质量。快速到慢速转化兔肌肉中积累的泛素蛋白揭示了UPS在肌纤维特异性中的可能作用[79].有趣的是,如前所述,miR-363已被发现为脂肪形成的负调节因子[46].属于miR-23a/27a/24-2簇的miRNAs的失调最近与肥厚性心肌病和骨骼肌萎缩有关[80].MiR-27在体内慢抽搐肌肉中的表达几乎是快抽搐肌肉中的6倍。它在转录后调节快速特异性肌肉生长抑制素(MSTN)的表达,在快肌中成熟的mRNA水平比慢肌高6倍[81].在这项研究中,miR-27被确定与PFK活性相关,PFK活性是糖酵解中的一种限速酶,并可能靶向细胞色素P450,家族24,亚家族a,多肽1 (CYP24A1),可催化维生素D的侧链氧化[82].维生素D通路对棕色脂肪细胞分化和线粒体呼吸有抑制作用[83].MiR-210及其预测靶标ATP5I,ME3,MTCH1而且CPT2均与ADP和ATP浓度高度相关。MiR-210调节线粒体功能,降低COX10表达并激活活性氧(ROS)的生成[14].ATP5I编码ATP合酶线粒体F0复合体亚基E,它是ATP合酶完全组装和ATP生产所必需的[84].ME3编码线粒体NADP(+)依赖的苹果酶3。ATP和富马酸对人类线粒体NADP(+)依赖的苹果酶的调节可能对谷氨酰胺代谢产生能量至关重要[85].MTCH1而且CPT2分别编码线粒体载体1和肉碱棕榈酰转移酶2。MTCH1也称为早老素1相关蛋白(PSAP),作为促凋亡线粒体蛋白诱导凋亡,独立于促凋亡蛋白Bax和Bak [86].MTCH1的两种亚型共享两个促凋亡结构域和多个输入线粒体外膜的内部信号[87].脂肪酸是热量和骨骼肌的主要能量来源。CPT2和CPT1共同参与线粒体中长链脂肪酸的β -氧化[88].综上所述,miR-210及其靶基因ATP5I,ME3,MTCH1而且CPT2可能与线粒体中长脂肪酸的ATP生成、凋亡和β -氧化有关。我们已经证明了miRNA和目标mRNA之间的相关关系可以用于功能链接感兴趣的表型,如肌肉纤维类型规格,线粒体呼吸活性和与ATP产生相关的代谢酶。
骨骼肌中线粒体与UPS的串扰
到目前为止,我们已经证明了所识别的miRNA-mRNA网络与肌肉纤维类型、氧化酶活性和ATP生成有关。其中一些靶基因参与线粒体功能和UPS。一个有趣的发现是线粒体与UPS相关基因表达之间的显著相关性。更具体地说,线粒体相关基因包括ATP5I,ME3,MTCH1,CYP24A KIAA1279,PHB2,PDHA1而且UQCC与至少一种ups相关基因高度相关,包括HECW2,USP24,UBFD1,MUL1,应用程序而且HSPA2.
线粒体与UPS系统之间的紧密相互依存关系已在许多与年龄相关的疾病中被描述,如阿尔茨海默病和帕金森病[89- - - - - -91].我们的研究表明,在正常状态下,这两个系统在基因表达水平上存在联系,因为所有被研究的动物都是健康的。也就是说,在生理条件下,线粒体和UPS都可能通过mirna对基因表达进行微调,从而参与骨骼肌的能量代谢。
含有E3泛素蛋白连接酶2 (HECW2)的HECT、C2和WW结构域、泛素特异性肽酶24 (USP24)、含泛素家族结构域1 (UBFD1)和线粒体泛素连接酶激活因子NFKB 1-like (MUL1)、淀粉样β前体蛋白(APP)和热休克70 kDa蛋白2 (HSPA2)要么是UPS系统的主要组成部分,要么与UPS系统有关[92,93].miR-28、miR-363、miR-2020、miR-24、miR-1207、miR-345和miR-58等几种miRNAs靶向的基因可能是泛素蛋白酶体依赖分子UPS降解波动的原因[94如转录辅激活因子PGC-1α,作为线粒体生物发生的主要调节因子,间接控制线粒体基因表达。另一方面,miR-210和miR-885靶向ATP合酶线粒体F0复合物亚基E (ATP5I)、丙酮酸脱氢酶α 1 (PDHA1)和泛醇-细胞色素c还原酶复合物伴侣(UQCC)的基因[95]会影响细胞ATP生成,进而影响ATP依赖的UPS系统[96].然而,线粒体与UPS相互作用的进一步细节信息仍然是难以捉摸的。
结论
在这项研究中,我们利用表达的mirna和靶mrna之间的相关信息以及杜洛克猪和PiNN猪的肌肉表型测量,建立了与肌纤维类型、代谢酶活性和ATP产生相关的miRNA-mRNA调控网络模型。这些复杂的网络可能通过微调基因的表达来促进肌肉表型的变化。总而言之,这些结果为mirna在肌肉能量代谢中的调节作用提供了一种见解。
缩写
microRNA, microRNA;国标,slow-twitch-oxidative;FTO, fast-twitch-oxidative;基础,fast-twitch-glycolytic;PiNN:大;UPS,泛素蛋白酶体系统。
参考文献
杨晓明,杨晓明,杨晓明,等。MicroRNAs的加工、成熟、目标识别和调控功能。《Mol Cell Pharmacol》2011;3:83-92。
郭根,李志刚,李志刚,李志刚。腺嘌呤核苷酸对猪骨骼肌线粒体呼吸的影响:腺苷二磷酸和三磷酸腺苷对猪肌肉收缩类型的影响。中国生物化学杂志,2005;
Picard M, Hepple RT, Burelle Y.线粒体功能专业化在糖酵解和氧化肌纤维:裁剪细胞器的最佳功能。中国生物医学工程学报(英文版)。2012;
施韦兹曼K,霍珀勒H,卡雅尔SR,魏贝尔ER。肌肉和线粒体的氧化能力:生理、生化和形态特征的相关性。中国科学院学报(自然科学版)1989;86:1583-7。
Ponsuksili S, Du Y, Hadlich F, Siengdee P, Murani E, Schwerin M, Wimmers K.来自共表达和调控网络的相关mrna和miRNAs影响猪肌肉,最终影响肉类特性。BMC Genomics. 2013;14:533。
李俊杰,金建民,林ks,洪俊杰,洪建昌,李ys。猪microRNA MIR206 / MIR133B簇多态性对肌肉纤维和肉质性状的影响阿尼姆·热内,2013;44:101-6。
Kim JM, Lim KS, Hong JS, Kang JH, Lee YS, Hong KC.猪miR-208b多态性与microRNA生物发生和SOX-6和MYH7表达相关,并影响肌纤维特性和肉质。阿尼姆·热内,2015;46:73-7。
侯旭,唐志,刘红,王宁,鞠红,李凯。猪发育骨骼肌深度测序发现与肌肉发生相关的microrna。科学通报。2012;7,e52123。
黄涛,朱明梅,李晓霞,赵双生。猪骨骼肌组织发育过程中microrna的发现及分析。科学通报。2008;3,e3225。
McDaneld TG, Smith TP, Doumit ME, Miles JR, Coutinho LL, Sonstegard TS, Matukumalli LK, Nonneman DJ, Wiedmann RT.猪骨骼肌发育过程中的MicroRNA转录组谱。BMC基因组学。2009;10:77。
李海燕,奚启勇,熊云云,刘小林,程旭,舒刚,王素生,王丽宁,高鹏,朱晓涛,等。来自两个猪品种骨骼肌和脂肪组织的microrna鉴定和比较。阿尼姆·热内。2012;43:704-13。
霍奎特JF, Ortigues-Marty I, Vermorel M.组织能量代谢的操纵在肉类生产反刍动物-综述。亚洲动物科学,2001;14:720-32。
Aschrafi A, Kar AN, Natera-Naranjo O, MacGibeny MA, Gioio AE, Kaplan BB。MicroRNA-338调节多种核编码线粒体mrna的轴突表达,编码氧化磷酸化机制的亚基。中国生物医学工程学报,2012;
陈忠,李艳,张海华,黄鹏,黄鹏。低氧调控microRNA-210调节线粒体功能,降低ISCU和COX10表达。致癌基因。2010;29:4362-8。
西西H,小野K,岩永Y,堀江文T,长尾K,竹村G,木下M,葵原Y,森RT,长谷川K,等。MicroRNA-15b通过Arl2调节新生大鼠心肌细胞ATP水平并退化线粒体。中国生物医学工程学报,2010;
Siengdee P, Trakooljul N, Murani E, Schwerin M, Wimmers K, Ponsuksili S. MicroRNAs在C2C12成肌细胞分化过程中通过靶向线粒体能量代谢基因调控细胞ATP水平。科学通报。2015;10,e0127850。
Aoi W, Naito Y, Mizushima K, Takanami Y, Kawai Y, Ichikawa H, Yoshikawa T. microRNA miR-696在小鼠骨骼肌中调节PGC-1{alpha}以响应物理活动。中华内分泌杂志,2010;29(2):397 - 397。
Liu X, Du Y, Trakooljul N, Brand B, Murani E, Krischek C, Wicke M, Schwerin M, Wimmers K, Ponsuksili S.基于肌纤维、线粒体呼吸活性和代谢酶的肌肉转录谱中国生物医学工程学报(英文版);2015;
Werner C, Natter R, Schellander K, wickke M.不同遗传猪最长肌纤维线粒体呼吸活性与肉质的关系。肉类科学,2010;85:127-33。
韦纳C, Natter R, wickke M.屠宰前后Pietrain、Duroc猪和Duroc-Pietrain杂交猪最长肌中糖酵解酶和氧化酶活性的变化。中国动物科学,2010;
Krischek C, Natter R, Wigger R, wickke M.屠宰前后采集的不同基因型猪最长肌样本中腺嘌呤核苷酸浓度和糖酵解酶活性。肉类科学,2011;89:217-20。
Benjamini Y, Hochberg Y.控制错误发现率:一种实用而强大的多重测试方法。中国科学院学报(自然科学版),2001;
李志强,李志强,李志强,等。microRNA/目标双工结构的快速预测。RNA。2004; 10:1507-17。
Kruger J, Rehmsmeier M. rna杂交:简单、快速、灵活的microRNA目标预测。核酸决议2006;34:w441 - 4。
Lewis BP, Burge CB, Bartel DP。保守的种子配对通常带有腺苷,这表明成千上万的人类基因都是microRNA的靶标。细胞。2005;120:15-20。
Hafner M, Landthaler M, Burger L, Khorshid M, Hausser J, Berninger P, Rothballer A, Ascano Jr M, Jungkamp AC, Munschauer M,等。通过PAR-CLIP在转录组范围内鉴定rna结合蛋白和microRNA靶位点。细胞。2010;141:129-41。
Chi SW, Zang JB, Mele A, Darnell RB。Argonaute HITS-CLIP解码microRNA-mRNA相互作用图。大自然。2009;460:479 - 86。
Hausser J, Syed AP, Bilen B, Zavolan M.对cds定位的miRNA靶位点的分析表明,它们可以有效地抑制翻译。Genome res 2013; 23:604-15。
Lytle JR, Yario TA, Steitz JA。靶mrna被5 ' UTR中的microrna结合位点与3 ' UTR中的microrna结合位点同样有效地抑制。中国科学院学报(自然科学版)2007;104:9667-72。
徐伟,王智,刘艳,王智。不同基因区域microRNA靶点的鉴定。BMC生物信息学。2014;15增刊7:S4。
Cline MS, Smoot M, Cerami E, Kuchinsky A, Landys N, Workman C, Christmas R, Avila-Campilo I, Creech M, Gross B,等。利用Cytoscape集成生物网络和基因表达数据。Nat protocol . 2007; 2:2366-82。
胡贝尔K, Petzold J, Rehfeldt C, Ender K, Fiedler I.肌肉能量代谢:不同类型的猪横纹肌的结构和功能特征。中华肌肉科学杂志。2007;28:249-58。
艾森-古斯塔夫森B, Karlsson A, Lundstrom K, Enfalt AC.无卤代烷基因饲粮饲喂高或低蛋白质日粮猪肌内脂肪和肌肉纤维脂质含量及其与肉质质的关系。肉类科学,1994;38:269-77。
Karlsson AH, klonre, Fernandez X.骨骼肌纤维作为猪肉品质的因素。环境科学学报,1999;30(2):344 - 344。
卡尔森A, Essen-Gustavsson B, Lundstrom K.无卤代烷基因猪屠宰时肌糖原消耗模式及其与肉质的关系。肉类科学,1994;38:91-101。
侯旭,杨勇,朱松,华春,周瑞,穆勇,唐志,李凯。3个猪品种骨骼肌miRNA和mRNA谱的比较。Mol Genet Genomics, 2016; 291:559-73。
唐志,杨颖,王志,赵松,穆艳,李凯。三种基因型猪产前骨骼肌发育miRNA和mRNA配对表达谱的综合分析。科学通报2015;5:15544。
景玲,侯颖,吴红,苗勇,李霞,曹军,Brameld JM, Parr T,赵山。骨骼肌mRNA和miRNA转录组分析表明,猪剩余采食量差异存在重要网络。科学通报2015;5:11953。
莱克尔,所罗门V,米切,戈德堡AL.肌肉蛋白分解和泛素-蛋白酶体途径在正常和疾病状态下的关键作用。张志强。1999;29(2):379 - 379。
王志强,王志强,王志强,等。泛素蛋白酶体系统在人体骨骼肌重构和萎缩中的作用。生物化学学报。2008;1782:730-43。
Huynh TP, Murani E, Maak S, Ponsuksili S, Wimmers K. UBE3B和ZRANB1基因多态性和转录本丰度与猪背最长肌保水能力相关。肉类科学,2013;95:166-72。
Loan HT、Murani E、Maak S、Ponsuksili S、Wimmers K. UBXN1多态性及其在猪背最长猕猴猴中的表达与持水能力相关。Mol Biol rep 2014; 41:1411-8。
Patron JP, Fendler A, Bild M, Jung U, Muller H, Arntzen MO, Piso C, Stephan C, Thiede B, Mollenkopf HJ,等。MiR-133b靶向抗凋亡基因并增强死亡受体诱导的凋亡。科学通报,2012;7,e35345。
Robinson PM, Chuang TD, Sriram S, Pi L, Luo XP, Petersen BE, Schultz GS。准分子激光消融后创面愈合中的MicroRNA特征:miR-133b对兔角膜成纤维细胞中TGFbeta1、CTGF、SMA和COL1A1表达水平的作用中国眼科杂志,2013;
Cicek IO, Karaca S, Brankatschk M, Eaton S, Urlaub H, Shcherbata HR。Hedgehog信号强度是由mir-310 microRNAs簇在对饮食的响应中协调的。遗传学。2016;202:1167 - 83。
陈玲,崔娟,侯娟,龙娟,李超,刘玲。一种新的脂肪形成负调控因子:microRNA-363。干细胞。2014;32:510-20。
Sarparanta J, brandin G, Charton K, Vihola A, Marchand S, Milic A, Hackman P, Ehler E, Richard I, Udd B.肌spryn (CMYA5)与胫骨和肢体带肌营养不良的相互作用。中国生物医学工程学报。2010;
徐旭,徐旭,尹强,孙玲,刘波,王艳。猪心肌病相关基因5 (CMYA5)与胴体性状和肉品质的分子特征及其相关性。Mol bio . 2011; 38:2085-90。
Altuwaijri S, Lee DK, Chuang KH, Ting HJ, Yang Z, Xu Q, Tsai MY, Yeh S, Hanchett LA, Chang HC,等。雄激素受体调节骨骼肌特异性蛋白和肌肉细胞类型的表达。内分泌。2004;25:27-32。
林丹,李士生,金nk,赵延明,柴洪辉,成辉,金汉。韩牛大理石纹性状相关基因共表达分析。动物科学,2013;26:19-29。
Schleinitz D, Kloting N, Bottcher Y, Wolf S, Dietrich K, Tonjes A, Breitfeld J, Enigk B, Halbritter J, Korner A,等。肥胖病理生理学中人骨形态发生蛋白受体2 (BMPR2)的遗传和进化分析。《公共科学杂志》2011;6,e16155。
古德曼CA,麦克纳利RM,霍夫曼FM,霍恩伯格TA。Smad3在体内诱导atrogin1,抑制mTOR和蛋白合成,促进肌肉萎缩。分子内分泌。2013;27:46 - 57。
Tiano JP,施普林格DA, Rane SG。SMAD3在运动过程中负向调节血清鸢尾素和骨骼肌FNDC5和过氧化物酶体增殖物激活受体γ共激活因子1- α (PGC-1alpha)。中国生物医学工程学报。2015;29:771 - 84。
林杰,吴华,Tarr PT,张春春,吴震,Boss O, Michael LF, Puigserver P, Isotani E, Olson EN,等。转录共激活因子PGC-1 α驱动慢肌纤维的形成。大自然。2002;418:797 - 801。
LeBleu VS, O 'Connell JT, Gonzalez Herrera KN, Wikman H, Pantel K, Haigis MC, de Carvalho FM, Damascena A, Domingos Chinen LT, Rocha RM,等。PGC-1alpha在癌细胞中介导线粒体生物发生和氧化磷酸化以促进转移。中国生物医学工程学报,2014;1001 - 1015。
Ros S, Schulze A.平衡糖酵解通量:6-磷酸果糖-2-激酶/果糖2,6-二磷酸酶在癌症代谢中的作用。癌症meta, 2013;1:8。
王伟,刘宁,范鲁杰,王志强。MicroRNA对肌肉发育和疾病的控制。中国生物医学杂志,2009;21:461-9。
刘健,梁旭,甘志。控制肌纤维类型转换的转录调节回路。中国生命科学,2015;
van Rooij E, Quiat D, Johnson BA, Sutherland LB, Qi X, Richardson JA, Kelm Jr RJ, Olson EN。一个由肌凝蛋白基因编码的microRNAs家族控制着肌凝蛋白的表达和肌肉性能。开发技术。2009;17:662-73。
von Hofsten J, Elworthy S, Gilchrist MJ, Smith JC, Wardle FC, Ingham PW。Prdm1-和sox6介导的转录抑制指定了斑马鱼胚胎中的肌纤维类型。EMBO代表2008;9:683-9。
柳比西奇V,伯特M,伦德JA,茉莉BJ。白藜芦醇诱导mdx小鼠肌肉中缓慢氧化表型的表达,同时增强sirt1 - pgc -1 α轴的活性。中国生物医学工程杂志,2014;
吴J,郑C,王X, Yun年代,赵Y,刘L,陆Y, Y,朱X,张C, et al。MicroRNA-30家族成员调节足细胞中的钙/钙调神经磷酸酶信号。中国临床医学杂志,2015;
王旭,王凯,韩玲,张安,史志,张凯,张宏,杨松,蒲萍,沈超,等。PRDM1被miR-30a-5p直接靶向,并在胶质瘤生长过程中以dkk1依赖的方式调节Wnt/ β -连环蛋白通路。癌症杂志2013;331:211-9。
Ning X,刘年代,邱Y,李G,李Y,李米,杨G .表达谱和生物角色mir - 196 a的猪。基因(巴塞尔)。2016; 7:5。
Kureel J, Dixit M, Tyagi AM, Mansoori MN, Srivastava K, Raghuvanshi A, Maurya R, Trivedi R, Goel A, Singh D. miR-542-3p抑制成骨细胞增殖和分化,靶向BMP-7信号通路并抑制骨形成。细胞死亡,2014;5:e1050。
郑丽,刘建民,王建新,李明志,连卫国,谢鹏,刘顺丰。骨形态发生蛋白7对大鼠脂肪来源间充质干细胞向棕色脂肪细胞分化的影响。中国学科学园学报。2014;36:654-9。
Townsend KL, An D, Lynes MD, Huang TL, Zhang H, Goodyear LJ,曾耀华。由于增加了CPT1-和cd36介导的脂肪酸摄取,bmp7处理的棕色脂肪细胞线粒体活性增加。抗氧化氧化还原信号。2013;19:243-57。
王玲,袁勇,李娟,任宏,蔡强,陈鑫,梁辉,单辉,付志东,高旭,等。MicroRNA-1通过抗氧化网络的转录后修饰加重心脏氧化应激。细胞应激伴侣。2015;20:411-20。
洪俊杰,卢旭,李俊杰,金建民,洪建昌,李玉生。猪microRNA miR-1位点多态性对肌纤维类型组成和miR-1表达的影响基因。2012;506:211-6。
王波,孙芳,董宁,孙卓,刁艳,郑超,孙军,杨艳,姜东。MicroRNA-7直接靶向胰岛素样生长因子1受体抑制胶质瘤细胞生长和糖代谢。《诊断病理学》2014;9:211。
于艳,柴娟,张慧,褚伟,刘玲,马玲,段红,李波,李迪。miR-194通过降低IGF-IR表达促进烧伤所致高血糖冲击。2014;42:578 - 84。
Setyowati Karolina D, Sepramaniam S, Tan HZ, Armugam A, Jeyaseelan K. miR-25和miR-92a调节大鼠胰岛素I的生物合成。中国生物工程学报。2013;10:1365-78。
Rajpathak SN, Gunter MJ, wyly - rosett J, Ho GY, Kaplan RC, Muzumdar R, Rohan TE, Strickler HD。胰岛素样生长因子- i及其结合蛋白在葡萄糖稳态和2型糖尿病中的作用糖尿病Metab Res Rev. 2009; 25:3-12。
胰岛素样生长因子在维持正常葡萄糖稳态中的作用。Horm res 2004;62增刊1:77-82。
潘玲,黄丙军,马晓星,王玉生,冯杰,吕峰,刘颖,刘颖,李春明,梁德东,等。MiR-25通过靶向线粒体钙单转运体保护心肌细胞免受氧化损伤。中国生物化学学报(英文版);2015;
Wahlquist C, Jeong D, Rojas-Munoz A, Kho C, Lee A, Mitsuyama S, van Mil A, Park WJ, Sluijter JP, Doevendans PA,等。抑制miR-25可改善衰竭心脏的心脏收缩能力。大自然。2014;508:531-5。
郑震,曾勇,白文明。胰岛素信号在代谢过程中与线粒体相遇。《内分泌代谢趋势》2010;21:589-98。
Stump CS, Short KR, Bigelow ML, Schimke JM, Nair KS。胰岛素对人骨骼肌线粒体ATP生成、蛋白质合成和mRNA转录的影响。中国环境科学学报,2003;21(2):366 - 366。
苏丹KR, Dittrich BT, Leisner E, Paul N, Pette D.纤维类型特异性蛋白水解系统在快到慢转化兔肌肉中的表达。中国生物医学工程学报。2001;29(2):349 - 349。
Hernandez-Torres F, Aranega AE, Franco D. miR-23a-miR-27a-miR-24-2在肌肉肥厚刺激应答中的转录调控调控元件的鉴定。生物化学学报2014;1839:885-97。
戴志强,陆志强。涉及microRNA-27a和b的转录后机制有助于骨骼肌中快速特异性和糖皮质激素介导的肌肉生长抑制素表达。中国生物医学工程学报。2011;29(3):344 - 344。
张强,洪文霞,张强,张晓霞,陈晓明。维生素D代谢过程中线粒体细胞色素P450 CYP24A1的晶体结构。中华分子生物学杂志,2010;
陈娟,赵玲,李志刚,李志刚,赵玲。1,25-二羟基维生素D3/维生素D受体抑制棕色脂肪细胞分化和线粒体呼吸。中国农业大学学报(自然科学版),2015;
杨晓明,王晓明,王晓明,等。F1FO-ATP合成酶在全基因组中的组装因子。蛋白质。2005;59:393 - 402。
杨志刚,杨志刚,童林。ATP和富马酸调节人线粒体NAD(P) +−依赖性苹果酶的分子机制。结构。2002;10:951-60。
徐旭,石玉春,高伟,毛刚,赵刚,Agrawal S, Chisolm GM,隋东,崔明哲。这种新的早老素-1相关蛋白是一种促凋亡的线粒体蛋白。中国生物化学杂志,2002;
Lamarca V, Sanz-Clemente A, Perez-Pe R, Martinez-Lorenzo MJ, Halaihel N, Muniesa P, Carrodeguas JA。PSAP/MTCH1的两种亚型共享两个促凋亡结构域和多个输入线粒体外膜的内部信号。中国生物医学工程学报。2007;29(2):344 - 344。
克纳J,霍佩尔C.脂肪酸输入线粒体。生物化学与生物物理学报-脂质的分子与细胞生物学2000;1486:1-17。
Branco DM, Arduino DM, Esteves AR, Silva DF, Cardoso SM, Oliveira CR.帕金森病发病机制中线粒体与蛋白酶体之间的交叉对话。前沿衰老神经科学。2010;2:17。
罗斯JM, Olson L, Coppotelli G.线粒体和泛素蛋白酶体系统在衰老和疾病中的功能障碍:一枚硬币的两面?中国生物化学学报(自然科学版)2015;
Duke DC, Moran LB, Kalaitzakis ME, Deprez M, Dexter DT, Pearce RK, Graeber MB。转录组分析揭示了帕金森病中蛋白酶体和线粒体途径之间的联系。神经遗传学。2006;7:139-48。
洪磊,黄兴华,姜泽峰。阿尔茨海默病中-淀粉样蛋白和泛素-蛋白酶体系统的关系。神经科学,2014;36:276-82。
Shiber A, Ravid T.破坏的伴侣蛋白:Hsp70伴侣蛋白及其联合伴侣蛋白在靶向错误折叠蛋白到蛋白酶体中的不同作用。生物分子。2014;4:704-24。
trusch - azar J, Leone TC, Kelly DP, Schwartz AL.泛素蛋白酶体通过n端途径降解转录辅激活子PGC-1{α}。中国生物化学杂志,2010;
Tucker EJ, Wanschers BF, Szklarczyk R, Mountford HS, Wijeyeratne XW, van den Brand MA, Leenders AM, Rodenburg RJ, Reljic B, Compton AG,等。uqcc1相互作用蛋白UQCC2的突变导致与细胞色素b蛋白表达紊乱相关的人类复合物III缺陷。公共科学图书馆,2013;9,e1004034。
黄慧,张旭,李松,刘宁,连伟,McDowell E,周鹏,赵超,郭宏,张超,等。ATP生理水平负向调节蛋白酶体功能。Cell Res. 2010; 20:1372-85。
确认
作者感谢Annette Jugert和Joana Bittner出色的技术帮助。
资金
线粒体呼吸活性和代谢酶活性的测量由德国研究基金会(WE 4079/1-1) (Deutsche Forschungsgemeinschaft, DFG)发起并领导的项目由迈克尔·威克教授(动物科学系,动物源性食品质量,乔治-奥古斯特-哥廷根大学)发起并支持,他永远离开了我们。
本文的出版由莱布尼茨协会和莱布尼茨农场动物生物学研究所(FBN)的开放获取基金资助。
数据和材料的可用性
表达数据的可用性在Gene expression Omnibus公共存储库中,GEO登录号为GSE80198: GSM2120718-GSM2120737。
作者的贡献
XL分析了微阵列数据并起草了手稿;FH有助于目标预测分析。NT、EM、KW协助取样、数据收集和起草手稿;SP对数据进行了讨论和解释,并帮助起草了手稿。所有作者均已阅读并批准最终稿。
相互竞争的利益
作者宣称他们之间没有利益冲突。
发表同意书
不适用。
伦理批准并同意参与
所有实验程序,包括动物护理和组织样本收集,均遵循由动物护理委员会和当局正式授权的德国动物保护法[Niedersächsischen Landesamt für Verbraucherschutz und Lebensmittelsicherheit (LAVES) 33.42502/01-47.05]所规定的保护准则和良好科学实践。
作者信息
作者及隶属关系
相应的作者
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
刘,X, Trakooljul, N, Hadlich, F。et al。MicroRNA-mRNA调控网络微调猪肌肉纤维类型,肌肉线粒体呼吸和代谢酶活性。BMC基因组学17, 531(2016)。https://doi.org/10.1186/s12864-016-2850-8
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12864-016-2850-8
关键字
- 肌肉
- 线粒体呼吸活动
- miRNA-mRNA网络