摘要
背景
个性化和有效的治疗胰腺导管腺癌(PDAC)仍然是难以捉摸的。需要新的临床试验设计,能够持续和快速评估新的治疗方法。在这里,我们描述了一个平台临床试验来解决这一未满足的需求。
方法
这是一项II期研究,使用贝叶斯平台设计来评估PDAC患者的多个实验臂和对照臂。我们首先将患者分为局部PDAC的三个临床分期组(可切除、可边缘切除和局部晚期疾病),并根据治疗史(治疗naïve或以前治疗过)进一步划分每个分期组。因此,临床阶段和治疗史定义了6个不同的队列,每个队列有一个对照组,但可能同时有一个或多个实验组。在每个队列中,应用自适应随机化规则,患者将相应地随机分配到实验组或控制组。每个队列的实验组仅与适用的队列特定控制组进行比较。在研究过程中,实验组可以独立地加入一个或多个队列。同时也纳入了组织、血液、影像等方面的多项相关研究。
讨论
到目前为止,PDAC一直被视为一种单一疾病,尽管知道在疾病表现和生物学上存在很大的异质性。目前的单臂II期临床试验和传统的III期随机研究方法不适用于PDAC中更加个性化的治疗策略。PIONEER Panc平台的临床试验旨在克服这些挑战,并帮助推进我们对这种致命疾病的治疗策略。
试验注册
本研究由MD安德森癌症中心机构审查委员会(IRB)批准,IRB批准方案2020-0075。PIONEER试验在美国国立卫生研究院注册(ClinicalTrials.gov)。NCT04481204.
背景
大约20-30%的胰腺导管腺癌(PDAC)患者表现为可切除或边缘可切除的PDAC,另外20-30%的患者表现为局部晚期疾病。大多数药物开发工作的重点是针对转移性疾病患者。目前很少有针对新型非转移性PDAC分期治疗的试验,更少的试验进行了广泛的相关研究,以阐明对特定治疗的反应或耐药性的生物学基础。局部PDAC的新辅助术前方法的出现和接受为评估早期疾病的新疗法创造了机会,可能有助于推进所有阶段PDAC的治疗策略。
局部PDAC新辅助治疗越来越多使用的一个原因是,在大多数患者诊断时,这种疾病通常被认为是系统性扩散,即使转移在诊断影像学上不明显。事实上,许多接受前期手术的患者在6个月内发生远处转移的几率很高。这一事实强调了更好地选择手术管理的必要性,并为术前治疗提供了合理的理论基础。新辅助入路在治疗微转移疾病、减小R1切除、选择适合手术的患者方面具有优势[1,2].最近,PREOPANC研究表明,与可切除/边缘可切除疾病的前期手术相比,接受新辅助治疗的患者无病生存期有所改善[3.].这项研究强调了新辅助治疗对影像学局限性疾病患者的潜在有益作用。然而,仍然需要改进患者的全身治疗方法。即使在接受新辅助治疗的PREOPANC实验组中,中位生存期仅为16.0个月,而直接手术组为14.3个月。在这里,我们详细介绍了一项名为PIONEER-Panc的多机构II期随机对照贝叶斯平台试验,用于研究新的和新兴疗法。
方法/设计(图。1)
试验设计
概述
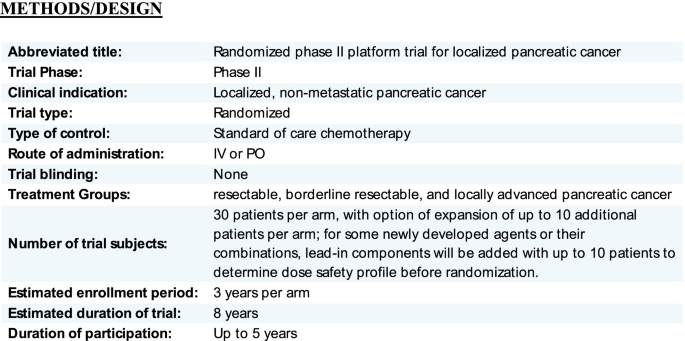
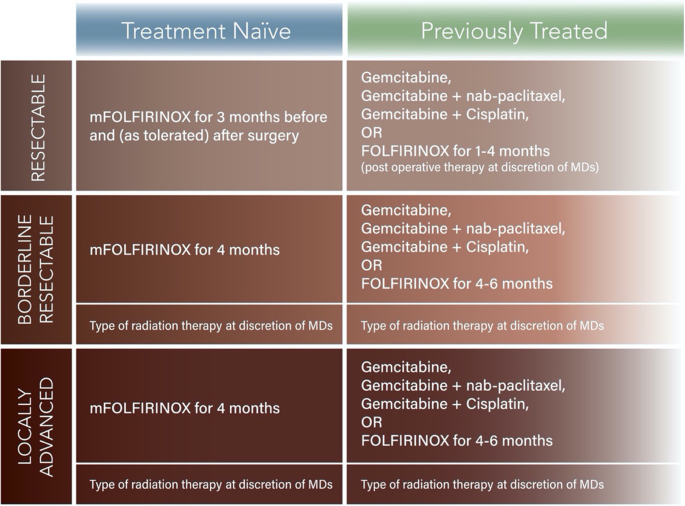
这是使用贝叶斯平台设计的第二阶段研究[4].局部胰腺癌有三个临床分期:可切除、边缘可切除和局部晚期。此外,对于每个阶段组,我们将患者分为治疗组naïve和以前治疗组。治疗组naïve和先前治疗组将有专门为他们设计的实验方案(图。2),因为以前接受过治疗的患者将在入组前被选择接受特定的化疗方案,这与naïve治疗组不同,如果两组合并可能会引入偏倚。实际上,允许先前接受过治疗的患者接受治疗将使我们的研究获得更强劲的收益,因为一些在参与医院就诊的患者只是在其他地方接受化疗后才来接受放疗和/或手术。另一个将naïve治疗组和以前治疗组分开的原因是,我们预计将会有只与辐射结合的实验性药物。我们不打算让病人或医生盲目接受实验药物。
因此,我们将有3个分期组,每个分期组将分为治疗naïve和以前治疗的队列。这使得总共有6个不同的队列将被研究(图。2(1)治疗naïve可切除PDAC,(2)以前治疗过的可切除PDAC,(3)治疗naïve边缘可切除PDAC,(4)以前治疗过的边缘可切除PDAC,(5)治疗naïve局部晚期PDAC,(6)以前治疗过的局部晚期PDAC。六个亚组中的每一个都有一个明确的对照组的护理标准化疗方案,作为比较的基础。每个组可以有一个或多个试验组。在研究过程中,可以在平台上增加实验臂,并将实验处理的效果与每组的对照组进行比较(图2)。1)。
对于相关研究,我们将在可行的情况下获取治疗前和治疗后的活检或组织,在整个治疗过程中进行连续抽血进行液体活检分析,收集放射学数据,并通过验证的问卷获得生活质量测量。一般来说,在全身治疗期间,患者将接受1-3个月的随访。在放射治疗期间,每周检查一次,放射治疗后随访每1-6个月检查一次。可切除和边缘可切除疾病的患者将评估主要病理缓解率的主要终点[5],以及无进展生存期和总生存期的次要终点。评估局部晚期患者的主要终点为6个月疾病控制率(DCR),次要终点为无进展生存期(progression - free survival)和总生存期(overall survival)。
试验图
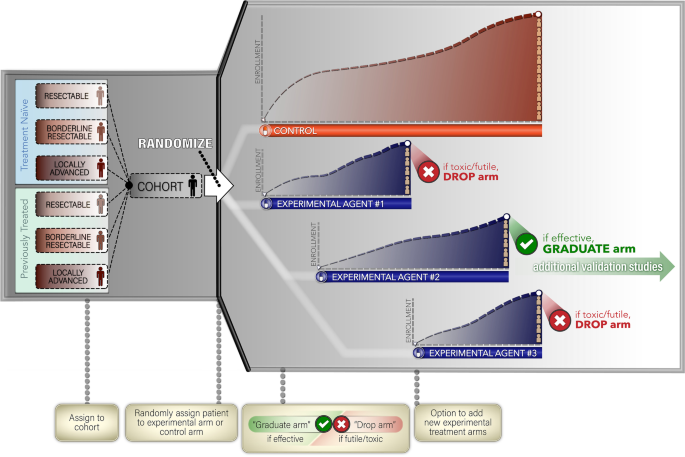
符合条件的患者将按照前面讨论的阶段和治疗史被分为六个队列之一;在纳入试验后,每位患者将被随机分为相应模块的对照组或实验组(图2)。3.)。随着时间的推移,每个队列的控制组的收益将持续下去,直到达到预先指定的限制,而当增加一个新的实验组时,控制组的随机化概率将逐渐降低。虽然不期望控制臂的治疗方法会随着时间的推移而改变,但如果从本试验收集的即将到来的数据或其他试验/研究的并发证据需要我们改变/更新控制臂,我们可能会通过修订来改变/更新控制臂。
目标和假设
审判影响
该研究将比较实验性治疗方案(可能包括化合物/生物制剂、放射技术和治疗设备)与两种最常用的术前方案(全身化疗和放疗)的效果。我们预计,这些实验性治疗将为更大规模的验证研究提供信号,相关科学将为疾病的生物学以及个性化治疗策略提供新的见解。
主要和次要目标
可切除和边缘可切除组(治疗naïve或既往治疗)的主要和次要目标:
- 1.
主要目的:估计主要病理反应率
- 2.
次要目标:衡量无进展生存期和总生存期
本地晚期患者(治疗naïve或以前治疗过)的主要和次要目标:
- 1.
主要目的:评估6个月疾病控制率
- 2.
次要目标:衡量无进展生存期和总生存期
对患者的探索性目标也同意进行相关研究
- 1.
通过外泌体和循环肿瘤DNA来证明反应
- 2.
目的:将患者预后与基线及随访CT图像定量分析联系起来
- 3.
将患者的临床和病理结果与放射测量值的变化联系起来
病人的选择
疾病状态标准表
要被认为是每个亚组的一部分,患者必须具有如下所述的:潜在可切除亚组的所有特征,可切除边缘亚组的一个或多个特征,但不具有局部晚期亚组的任何特征,或局部晚期亚组的任何特征(图2)。4)。
符合资格及不符合资格的准则
平台试验的一般标准如图所示。5对六个队列中的每一个,分别。
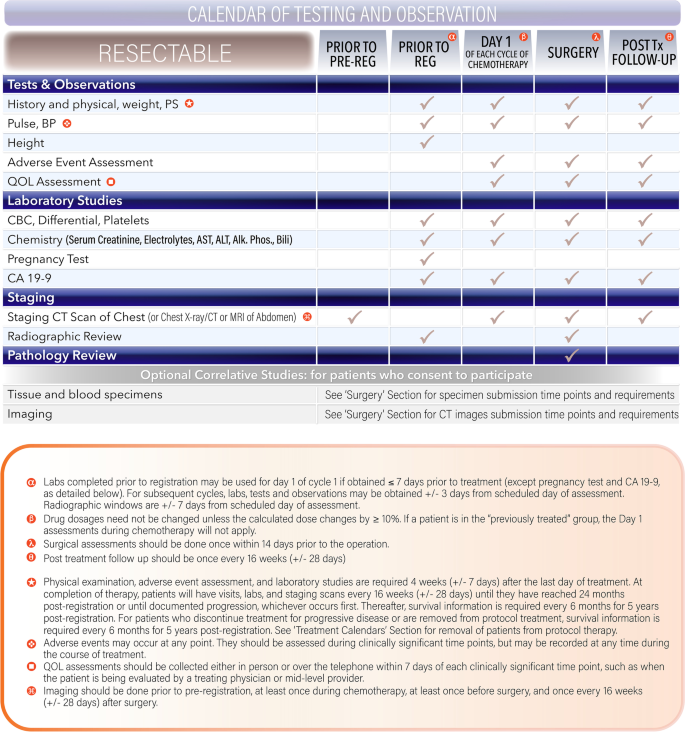
治疗日历
以下研究日历(图;6)代表与议定书有关的评估的一般准则。数字6特别与可切除组有关;其他组的日历可能略有不同。特定的模块可能有额外的要求。
治疗最后一天后4周(+/−7天)需要进行体检、不良事件评估和实验室研究。治疗结束后,患者将每16周(+/−28天)进行一次访问、实验室和分期扫描,直到注册后达到24个月或直到有记录的进展,以先发生者为准。此后,在注册后的5年内,每6个月需要提供一次生存信息。对于因进展性疾病而停止治疗或停止方案治疗的患者,注册后5年内每6个月需要提供一次生存信息。对于边缘性可切除或局部晚期疾病的患者,在协议文件中也有类似的日历。
诊断成像
CT扫描将是标准护理胰腺造影扫描[6].胰腺CT包括碘基IV造影剂方案,以达到正常胰腺组织与病变的最佳区分,同时充分显示胰腺血管,以便进行局部分期。本研究将在静脉注射造影剂后以3 - 5ml /s的流速进行双期CT采集,以获得最佳的胰腺CT增强[7].
化疗
PDAC的标准治疗方案包括吉西他滨/nab-紫杉醇和mFOLFIRINOX。在本适应性试验中,我们将使用mFOLFIRINOX作为“治疗naïve”“潜在可切除”、“边缘可切除”和“局部晚期”疾病患者的对照组标准。对于“既往治疗”组,我们将根据以下接受的指南,将接受吉西他滨、吉西他滨/顺铂、吉西他滨/nab-紫杉醇、吉西他滨/卡培他滨或FOLFIRINOX的患者纳入试验。“先前治疗”组的患者将在完成适当剂量的标准化疗并进行重新安置后入组。然后,他们将根据诊断时的临床分期随机分配到试验组或控制组。
给药时间表和修改:所有商业供应的药物在贮存和稳定性、制备、处理和给药方面都应遵循制造商提供的标签。关于剂量调整和延迟的决定将由主治医生酌情为每个患者做出。所有其他治疗,包括化疗前药物治疗,将由主治医生自行决定。
放射治疗
作为试验的一部分,患者可能会接受放射治疗。放射技术可包括立体定向全身放射治疗、低分馏放射治疗[8],以及标准放射分馏疗法[9]同时进行化疗。递送技术可以针对特定的实验臂进行定制。在对照组中,放射治疗将是可切除疾病的标准治疗方法。对于可切除疾病的患者,这不是必需的,但如果医生认为合适,可以在对照组中使用。
手术
在化疗和/或放疗后4-8周没有疾病进展的情况下,手术切除原发肿瘤和区域淋巴结。手术质量保证将以与联盟A021501相同的方式进行[10].
相关研究
生物标本和成像将作为IRB批准的生物标本收集方案(PA11-0670)的一部分进行收集。知情同意文件(见补充材料),如果患者同意参加本适应性临床试验的任何相关研究,则将明确声明患者与PA11-0670共同注册。在这里,我们将描述如何分析生物标本和成像。
液体活检
通过外泌体和循环游离的肿瘤细胞来证明反应。我们将在临床重要时间点获得一系列液体活检,并根据既定协议提取外泌体和循环游离肿瘤细胞[11].外泌体和循环游离肿瘤细胞的水平将与试验过程中观察到的临床结果和病理反应相关。
成像
- 1.
目的:将患者预后与基于CT图像的基线定量分析联系起来。作为临床重要时间点标准护理的一部分,将为患者获取CT图像。我们之前已经证明,基线增强的测量(例如,增强曲线下的面积)和PDAC肿瘤的形态(例如,存在或不存在一个明显的边界,分别称为高delta PDAC或低delta PDAC)与疾病的基质、遗传、物理和临床特征相关[12,13].我们将在本研究中验证这些关联。
- 2.
将患者的临床和病理结果与放射测量值的变化联系起来。我们之前的研究表明,与肿瘤/实质界面模糊相比,肿瘤/实质界面锐化的发展与更长的PFS和OS有关[14].我们将把新辅助治疗后的影像学特征与试验中的病理测量和临床结果联系起来。
不良事件
根据联邦法规的要求,及时报告不良事件是每个参与临床研究的研究者的责任。必须使用NCI不良事件通用术语标准(CTCAE) 5.0版中定义的术语和分级类别来描述和分级不良事件。CTCAE可在ctep.cancer.gov / protocolDevelopment electronic_applications / ctc.htm.研究者必须确定每种不良事件的治疗方案,并在要求的表格上报告。请参阅NCI指南:不良事件报告要求,以了解有关不良事件报告程序的进一步细节。所有毒性将根据现有的机构算法或最佳实践进行管理。
统计方面的考虑
在这项研究中,我们有六个基于临床分期和治疗史的患者试验设计部分。对于每个队列,贝叶斯第二阶段平台设计将用于评估一系列实验药剂。该研究的目的是收集数据并评估实验性治疗的疗效,在早期PDAC中获得相对快速的治疗决定。可切除或边缘可切除疾病临床分期患者的主要终点是随机分组后12周的主要病理反应(MPR),局部晚期或不可切除疾病临床分期患者的主要终点是6个月DCR,定义为治疗后6个月内无进展患者的比例。
基于平台设计,我们可以同时将患者随机分为多个实验治疗组。对于每个疾病队列,我们将从一个对照组和一个试验性治疗组开始,同时在研究期间可以开放额外的试验性治疗组。我们将同等地将患者随机分为对照组和实验组,并假设在实验组开放6个月后,可能会有新的实验药物组进入研究。为了在研究过程中保持主动对照,我们将继续将患者随机入对照组,而随机化概率将随着对照组治疗的患者数量和实验活跃组数量的增加而逐渐降低。一旦控制臂处理了预先指定的数字(例如,n= 30)的患者,我们将重新调整随机化概率,以便将更多的患者分配到实验组。具体而言,控制臂的随机化概率将降低为1/(1 + 3 m),每个实验臂的随机化概率将降低为3/(1 + 3 m),其中m为研究中活动实验臂的数量。即当研究中有2个实验臂时,控制臂的随机化概率减小为1/7,当研究中有3个实验臂时,随机化概率减小为1/10,以此类推。实验药剂臂的随机化方案和时间轴如图所示。3..
在一个试验组治疗了计划中的30名患者后,我们将其与对照组进行比较,看看试验性治疗是否改善了MPR或DCR。在以下情况下,试验处理将被认为成功:
在哪里πe而且πc分别为实验臂和控制臂的MPR或DCR。我们选择使用贝叶斯范式,这样我们就可以使用Beta先验分布自然地结合我们对治疗组MPR或DCR的知识或假设。在本研究中,假设为非信息先验分布πe而且πc,也就是说,πe~ Beta(1,1),和πc~β(1,1),分别。Beta(1,1)分布可以认为是2例患者的研究,仅观察到1例反应。它的平均值为0.50,95%置信区间宽为(0.02,0.98)。由于我们对治疗组的疗效没有任何明确的了解,这种非信息性的先验只能表达关于主要终点的模糊信息。当实验臂达到最大样本量时,我们将计算(中的后验概率(PP)1),并与阈值进行比较θt.如果PP大于θt,与控制臂相比,实验臂被认为是成功的。阈值θt需要校准,以使试验的假阳性率(I型错误)不超过15%。对于那些从研究中“毕业”并似乎优于对照组的实验治疗,由联合主要研究者和科学顾问组成的指导委员会将开会决定是否扩大实验组(例如,到n=另外10名患者)来证实这一发现。
随机分组将使用临床试验指导(CTC)网站(https://biostatistics.mdanderson.org/ClinicalTrialConduct),储存在MDACC的安全服务器上,由MDACC生物统计部门维护。通过MDACC生物统计部门提供给临床团队的用户名和密码,可以访问该网站。生物统计学合作伙伴将提供使用CTC网站随机分配患者的培训。该研究将由MD Anderson数据安全监测委员会(DSMB)进行监控。
模拟研究
每个实验臂的计划样本量为30个。我们假设一个新的实验臂可能在前一个实验臂开放6个月后进入研究。阈值θtMPR和DCR分别为0.67和0.72。
对于每个场景,模拟1000次试验,声称成功的概率总结为后验概率大于阈值的试验的比例θt.具体来说,对于每个模拟试验,我们计算后验概率Pr(πe>πc+ 0.05 |数据),并与阈值进行比较θt(例如,0.67)使用决策规则(1)。声称成功的概率是满足(1)。需要注意的是,选择实验治疗药物是因为其在以往的研究中已经有疗效的证据,因此不执行疗效的早期停药规则。
主要病理反应率
基于MD Anderson的历史数据,我们假设控制臂的MPR为13% [15].我们预计一些实验组的反应率将分别提高到19.5%(1.5倍)、26%(2倍)和30%。仿真结果如表所示1在下面。与θt= 0.67时,I型误差≤15%。也就是说,如果一个实验臂(例如,实验臂3)的响应率与控制臂相同,则声称其成功的概率小于或等于15%。在这种情况下,我们将有67.6%的权力宣称响应率为26%的实验臂成功(实验臂2)。如果响应率为30%的实验臂(实验臂4),权力将为79.4%。
六个月疾病控制率
基于MD Anderson的局部晚期疾病的历史数据,我们假设对照组的6个月DCR为70% [16].我们预计一些实验武器的DCR将提高到90%。仿真结果如表所示2在下面。与θt= 0.72时,I型误差≤15%。也就是说,如果一个实验臂(例如实验臂1)与控制臂具有相同的DCR,则声称其成功的概率小于或等于15%。在此设置中,我们将有85.6%的能力声称DCR为90%的实验臂成功(实验臂3)。
安全导入阶段和毒性监测
对于一些新开发的药物或其组合,将在随机化之前应用安全导入阶段。我们将应用BOIN设计来确定随机化部分的剂量/时间表[4,17].具体细节将在该实验臂的具体方案中进行描述。
此外,对于研究人员、科学顾问和统计人员认为必要的实验武器,也可以实施贝叶斯毒性监测规则。根据不良事件通用术语标准(CTCAE) v4.0,这些事件将包括从治疗开始到治疗结束后30天时间窗口内至少可能与治疗有关的3级或更高级别的血液学、胃肠或任何其他毒性。让π托克斯为Beta(0.6,1.4)先验分布的毒性概率,则如果Pr (π托克斯> 0.3]) > 0.8,我们将提前终止实验臂。患者将按10个队列进行监测。基于这些假设和监测条件,如果我们观察到[#患者出现毒性反应]/[#患者正在接受治疗]> = 5/ 10,8 /20或12/30,我们会尽早停止实验臂。运行特性如表所示3..内部软件(https://trialdesign.org/one-page-shell.html#BTOX)生成毒性边界和操作特性。
分析计划
将使用计数频率、百分比、平均值、标准差、中位数和范围的描述性统计来总结患者的人口统计学和临床特征。对于分类变量,将使用x平方分布检验或Fisher精确检验,对于连续变量,将使用t检验或Wilcoxon秩和检验来评估组间的关联。对于主要结局变量,我们将使用Clopper和Pearson方法估计MPR和DCR及其95%精确置信区间(ci)。在接受治疗的30例患者中,假设6例患者发生MPR, 95% ci为(0.077,0.386);假设30例患者中有27例病情得到控制,则DCR的95%置信区间为(0.735,0.979)。将探讨广义线性回归模型,以评估MPR/DCR终点与相关协变量之间的关联。
计算每位患者的总生存时间和无进展生存时间。总生存时间定义为患者从开始治疗到死亡或最后一次随访(如果患者活着)的时间。无进展生存时间定义为从治疗开始之日起至疾病进展、术后复发或任何原因死亡之日(以先发生者为准)的时间段。总生存期和无进展生存期的分布将使用Kaplan-Meier方法进行估计。通过重要协变量子组对这些时间到事件终点进行比较,将使用log-rank检验。将探讨Cox比例风险回归模型,以评估时间到事件终点和感兴趣的协变量之间的关联。
此外,对于探索性分析,我们可以在数据分析中应用贝叶斯分类和信息共享方法,特别是在评估治疗的潜在预测标记物效应时。等级模型将允许我们在类似的动作中借用力量。它将提供一种更有效和更有力的方法来评估和测试结果,特别是当我们有几个实验组与对照组相比显示出类似的临床益处时。
讨论
这种贝叶斯平台适应性临床试验设计比传统的临床试验设计有几个优点。主要优势包括(1)随着时间的推移资源分配的效率,(2)能够根据预先指定的标准(临床终点,开放分支的数量)自适应随机患者,以及(3)统一收集跨多个治疗分支的相关研究。我们在试验过程中自适应消除无效或毒性过大的药剂,并将有效的药剂毕业到下一阶段的开发。就获得的效率而言,自适应试验设计能够将多个实验处理臂与单个控制臂进行比较,从而消除了重复控制臂的需要,如果每个实验臂都在传统的随机II期设计中进行,则需要重复控制臂[18].由于这是2期设计,我们打算在未来纳入的实验药物预计将具有强大的临床前理论基础,并且理想情况下,从先前的1期研究中获得一些初步的疗效迹象。
虽然这项研究寻求针对局部胰腺癌的创新治疗方法,但另一项研究具有类似的设计特征,但重点是转移性胰腺癌。转移性胰腺癌的Precision Promise平台试验是一项正在进行的介入性临床试验,利用2/3期平台试验来评估第一和第二转移性患者的多种方案[19].
Precision Promise和PIONEER Panc等新颖的试验设计旨在为胰腺癌患者提供治疗。快速、可靠的统计设计有望帮助实现这种致命疾病患者个性化护理的潜力。
数据和材料的可用性
本研究中使用和/或分析的数据集可根据合理要求从通讯作者处获得。
缩写
- AE:
-
不良事件
- 保盈:
-
贝叶斯最优区间设计
- BR:
-
边缘可切除的
- BRPC:
-
边缘性可切除胰腺癌
- CA:
-
腹腔动脉
- 置信区间:
-
置信区间
- CT:
-
计算机断层扫描
- CTC:
-
临床试验进行
- CTCAE:
-
不良事件的通用术语标准
- DSMB:
-
资料安全监察委员会
- DCR:
-
疾病控制率
- FOLFIRINOX:
-
氟脲嘧啶,伊立替康,奥沙利铂
- 哈:
-
肝动脉
- 四:
-
静脉注射
- 拉:
-
局部晚期
- LAPC:
-
局部晚期胰腺癌
- MDACC:
-
MD安德森癌症中心
- MPR:
-
主要病理反应
- NCI:
-
国家癌症研究所
- 操作系统:
-
总生存期
- PDAC:
-
胰导管腺癌
- PFS:
-
无进展生存
- PV:
-
门静脉
- 拉尔夫-舒马赫:
-
可切除的
- SMA:
-
肠系膜上动脉
- SMV:
-
肠系膜上静脉
参考文献
活塞PW,等。术前紫杉醇和同时快速分割放射治疗可切除胰腺腺癌:毒性、组织学反应率和无事件结局。中华临床杂志,2002;20(10):2537-44。
Ashman JB,等。术前放化疗和IOERT治疗不能切除或边缘可切除胰腺癌。中华胃肠杂志,2013;4(4):352-60。
Versteijne E,等人。可切除和边缘可切除胰腺癌的术前放化疗与立即手术:荷兰随机III期PREOPANC试验结果中华临床杂志,2020;38(16):1763-73。
袁Y,等。贝叶斯最优间隔设计:一种简单而性能良好的一期肿瘤试验设计。临床癌症杂志2016;22(17):4291-301。
Hahn SA,等。家族性胰腺癌中的BRCA2种系突变。中华肿瘤学杂志,2003;29(3):344 - 344。
阿尔梅达RR,等。胰腺CT成像研究进展。中国中医药大学学报(自然科学版)。2018;21(1):52-66。
Schueller G,等。胰腺多层CT:造影剂流速和个体化扫描延迟对胰腺和肿瘤造影增强的影响。放射学。2006;241(2):441 - 8。
王世林,等。在现代治疗时代,保乳手术后的低分割放疗与传统分割放疗:来自中国的多中心随机对照试验中华临床肿瘤学杂志,2020;38(31):3604-14。
吉尔伯特先生等。贝伐单抗治疗新诊断的胶质母细胞瘤的随机试验。中华实用医学杂志,2014;29(8):699-708。
Katz MHG等人。肿瘤临床试验联盟(Alliance)试验A021501:术前延长化疗vs.化疗加低分割放疗治疗胰腺头部边缘可切除腺癌BMC癌症杂志,2017;17(1):505。
伯纳德V等人。循环核酸与胰腺癌患者预后相关。胃肠病学。2019;156 (1):108 - 118. - e4。
Koay EJ,等。一个视觉上明显的和可量化的CT成像特征识别胰腺导管腺癌的生物物理亚型。临床癌症杂志2018;24(23):5883-94。
Koay EJ,等。胰腺癌的转运特性描述了吉西他滨的传递和反应。中国临床医学杂志。2014;29(4):344 - 344。
Amer AM,等。基于成像的生物标志物:计算机断层扫描胰腺导管腺癌肿瘤界面的变化表明对细胞毒性治疗的反应。癌症。2018;124(8):1701 - 9。
Cloyd JM,等。胰管腺癌术前治疗及胰十二指肠切除术:25年单一机构经验。中华胃肠外科杂志,2017;21(1):164-74。
Krishnan S等人。局灶放射治疗剂量增加提高局部晚期胰腺癌患者接受诱导化疗和巩固放化疗的总生存率。中华放射医学杂志,2016;44(4):755-65。
刘松,袁勇。I期临床试验的贝叶斯最优区间设计。J R Stat Soc: Ser C: application Stat. 2015;64(3): 507-23。
袁Y,等。MIDAS:分子靶向药物平台试验的实用贝叶斯设计。中华医学杂志2016;35(22):3892-906。
一项评估转移性胰腺癌多种治疗方案的多中心试验。可以从:https://ClinicalTrials.gov/show/NCT04229004.
致谢
我们感谢来自安德鲁·萨宾家族奖学金、谢赫·艾哈迈德胰腺癌研究中心、德克萨斯大学MD安德森癌症中心、哈利法基金会的机构资金、GE医疗保健和先进生物医学成像中心、飞利浦医疗保健的设备支持,以及国家癌症研究所对MD安德森癌症中心支持(核心)拨款CA016672的支持。Eugene Koay博士得到了NIH (U54CA210181, U54CA143837, U01CA200468, U01CA196403, U01CA214263, R01CA221971, R01CA248917和R01CA218004)和胰腺癌行动网络(16-65-SING)的支持。我们要感谢马克·赫德博士和帕梅拉·帕帕佐普洛斯博士对这项工作的支持。
资金
作者感谢德克萨斯大学MD安德森癌症中心“登月计划”的资助。资助机构将不参与数据收集或分析。
作者信息
作者及隶属关系
贡献
所有作者(JD, SL, JM, RW, SP, AM, ET, PB, MK, GV, EK)都批准了提交的手稿版本,每个人都同意对每个作者自己的贡献负责,并确保与工作的任何部分的准确性或完整性相关的问题,即使是作者没有亲自参与的问题,都得到了适当的调查,解决,并在文献中记录了解决方案。SL、JM、RW、SP、AM、ET、PB、MK、GV、EK对这个概念做出了重大贡献。在EK的批准下,JD为起草工作做出了重大贡献。SL和JM对修订工作做出了重大贡献。采用SL和JM软件进行仿真研究和相关统计。所有的人物和插图都是由JD设计和创作的,并得到了EK的批准。资金由EK, AM, MK, GV, SL获得。
相应的作者
道德声明
伦理批准并同意参与
本研究由MD安德森癌症中心机构审查委员会(IRB)批准,IRB批准方案2020-0075。受试者将在IRB批准的知情同意文件上签字,并经过充分讨论后给予参与的书面同意。
发表同意书
不适用(本手稿不包含任何个人的数据)。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1。
参与研究的知情同意/授权,可选择程序。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
杜志恩,刘绍生,马俊。et al。PIONEER-Panc:一项针对局部胰腺癌新疗法和新兴疗法的II期随机研究平台试验。BMC癌症22, 14(2022)。https://doi.org/10.1186/s12885-021-09095-7
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12885-021-09095-7
关键字
- 胰腺癌
- 先锋
- 二期
- 随机平台试验
- 可切除的
- 边缘可切除的
- 局部晚期
- FOLFIRINOX
- 吉西他滨/ nab-paclitaxel
- 胰导管腺癌(PDAC)