摘要
背景
肿瘤相关巨噬细胞(Tumor associated macrophages, tam)在实体瘤中高密度存在。tam与交替活化的巨噬细胞(也称为M2)有许多共同的特征。它们已被证明有利于肿瘤的发展,并在化疗耐药中发挥作用。在这里,我们研究了M2与M1巨噬细胞对癌细胞对依托泊苷敏感性的影响。
方法
我们建立巨噬细胞极化模型,从THP-1单核细胞向巨噬细胞分化开始,使用PMA (Phorbol 12-肉豆酸酯13-乙酸酯)。一旦分化(M0巨噬细胞),将它们与IL-4和IL-13孵育以获得M2极化的巨噬细胞,或与ifn - γ和LPS孵育以获得经典的巨噬细胞激活(M1)。为了模拟癌细胞与tam之间的交流,M0、M1或M2巨噬细胞分别与HepG2或A549癌细胞共培养16 (HepG2)或24 (A549)小时,然后依托opo苷暴露24 (HepG2)或16 (A549)小时。孵育后研究依托波苷对巨噬细胞极化的影响,通过western-blot检测裂解caspase-3和裂解PARP-1蛋白,Annexin V和PI染色caspase活性测定和FACS分析评估癌细胞凋亡。
结果
M1和M2标记物的mRNA和蛋白表达证实了thp -1来源的巨噬细胞的极化,这为人类巨噬细胞极化提供了一种新的、简单的、表征良好的模型。THP-1 M2巨噬细胞存在时,依托泊苷诱导的癌细胞凋亡明显减少,而与M1巨噬细胞共培养的细胞凋亡增加。另一方面,依托泊苷对M1和M2极化没有影响。
结论
这些结果首次证明了M2对依托泊苷诱导的癌细胞凋亡的保护作用,而不是M1巨噬细胞。
背景
巨噬细胞是先天免疫系统中由骨髓细胞组成的异质群体,参与了生理和病理条件下的几个过程。它们在炎症和感染中特别活跃。在这种情况下,血液单核细胞被招募到组织中,在那里它们分化成巨噬细胞[1]。巨噬细胞表现出高度的可塑性,这使得它们能够适应不同的环境刺激而改变其表型[2]。巨噬细胞有两种主要的极化状态,即经典激活的1型(M1)和交替激活的2型(M2)。2002年,Mantovani等人。[3.将这两种巨噬细胞表型描述为功能状态连续体的极端。典型的巨噬细胞激活发生在损伤或感染后。巨噬细胞通常在体外使用细菌细胞壁成分(如LPS)和IFN-γ或TNF-α激活。M1巨噬细胞的特点是产生促炎细胞因子,如TNF-α、IL-1β、IL-6和IL-12。它们还会产生大量的活性氧和活性氮[4]。然而,M1巨噬细胞产生NO的酶iNOS的表达是小鼠巨噬细胞所特有的,而在人巨噬细胞中不存在[5]。M2巨噬细胞极化可由不同刺激诱导:IL-4和/或IL-13、免疫复合物和toll样受体、IL-1受体配体或IL-10 [6]。被IL-4和IL-13极化的交替活化的巨噬细胞的特点是促炎细胞因子的产生有限,但它们分泌抗炎细胞因子,如IL-10、CCL18和CCL22。它们的特征还包括几种受体的表达,如甘露糖受体CD206(或MRC1)、清除受体CD163、dectin-1和DC-SIGN(树突状细胞特异性细胞间粘附分子-3捕获非整合素)[7,8]。
实体瘤不仅包括恶性细胞,还包括来自血管的基质宿主细胞,如脂肪细胞、成纤维细胞和造血细胞。在这些肿瘤浸润的免疫细胞中,巨噬细胞数量最多,称为肿瘤相关巨噬细胞(tumor associated macrophages, tam) [9]。许多研究表明,在恶性肿瘤中,巨噬细胞主要表现为m2样表型[3.]。与具有促炎和细胞毒性的M1细胞相反,M2巨噬细胞具有免疫抑制作用,有利于血管生成和组织修复[10]。许多研究表明,肿瘤相关的M2巨噬细胞促进肿瘤细胞生长和存活,刺激血管生成和转移。2011年,Shree等人发现表达cathepcin的巨噬细胞可保护乳腺癌细胞免受紫杉醇或鲸泊苷等多种化疗药物诱导的细胞死亡[11]。最近,Mantovani和Allavena发表了一篇综述,总结了抗癌疗法对tam的实际作用[12]。然而,为了设计更有效的治疗策略,仍然需要更好地了解这种化学保护作用。
为了研究巨噬细胞如何调节肿瘤细胞,特别是肿瘤细胞对化疗药物的反应,我们首先建立了一个新的、方便的人巨噬细胞极化模型。巨噬细胞是从人单核细胞系THP-1开始分化的。一旦在PMA存在下分化,它们可以极化为M1或M2巨噬细胞,表达类似于从新鲜分离的单核细胞中获得的极化巨噬细胞的标记物。当HepG2肝癌细胞或A549肺腺瘤细胞与THP-1 M1或M2巨噬细胞共培养时,它们对依托泊苷的反应不同。THP-1 M1巨噬细胞存在时,依托泊苷诱导的癌细胞凋亡增加。相反,M2 - THP-1巨噬细胞具有保护作用。这是首次证明THP-1极化巨噬细胞显示出与极化tam相似的功能。
方法
细胞培养
人单核THP-1细胞在Roswell Park Memorial Institute培养基(RPMI 1640, Invitrogen)中培养,培养基中含有10%的热灭活胎牛血清(Invitrogen),并添加10 mM Hepes (Gibco, #15630-056), 1 mM丙酮酸(Gibco, #11360-039), 2.5 g/l d -葡萄糖(默克)和50 pM ß-巯基乙醇(Gibco;31350 - 010)。THP-1单核细胞经150 nM phorbol 12-肉豆酸酯13-醋酸酯(PMA, Sigma, P8139)孵育24 h后,在RPMI培养基中孵育24 h,分化为巨噬细胞。通过20 ng/ml IFN-γ (R&D系统,#285-IF)和10 pg/ml LPS (Sigma, #8630)孵育,巨噬细胞在M1巨噬细胞中极化。用20 ng/ml白介素4 (R&D Systems, #204-IL)和20 ng/ml白介素13 (R&D Systems, #213-ILB)孵育巨噬细胞M2极化。HepG2和A549细胞分别在Dulbecco 's modified Eagle's minimal essential medium (DMEM medium 1 g glucose/l) (Gibco)和Minimum essential medium Eagle medium (MEM) (Gibco)培养基中培养,两者均含有10%胎牛血清。共培养实验中,THP-1单核细胞在6个Transwell插入物(膜孔径0.4 μm, Corning, #3450)中分化。巨噬细胞与HepG2细胞在CO中共培养2在独立培养基中添加0.5 mM l -谷氨酰胺(Sigma, # G3126)和3.75 g/l d -葡萄糖(Sigma, #50-99-7) 16 h,然后加或不加50 μM依托泊苷(Sigma, #E1383)孵育24 h。巨噬细胞和A549细胞在CO中共培养2在独立培养基中添加0.5 mM的l -谷氨酰胺和2.5 g/l的d -葡萄糖24 h,然后加或不加50 μM依托泊苷孵育16 h6THP-1单核细胞在6孔板上分化和极化。接下来,它们在CO中孵育2独立培养基中添加0.5 mM l -谷氨酰胺(Sigma, # G3126)和3.75 g/l d -葡萄糖(Sigma, #50-99-7) 16小时,然后加或不加50 μM依托泊苷(Sigma, #E1383)孵育24小时。
免疫荧光标记和共聚焦显微镜
将THP-1单核细胞以10万细胞/孔的速度接种于24孔板中,并按照上文所述进行分化。将含有10万个细胞的PBS液滴干燥后,将未分化的单核细胞附着在盖片上。为了标记,细胞用4%的多聚醛在冷PBS中固定10分钟,用2% PBS- bsa(牛血清白蛋白)洗涤3次,在4°C下孵育过夜,一抗1:100稀释2% PBS- bsa: Abcam (ab955)抗cd68 (KP1), Santa Cruz (sc-9099)抗cd71 (H300), Santa Cruz (sc-9154)抗cd36 (H300), Abcam (ab181470)抗cd14 (1H5D8)。用2% PBS-BSA洗涤细胞3次,用二抗孵育1h。使用Alexa fluor -488偶联抗兔IgG抗体(Molecular Probes, #A11034),稀释倍数为1/1000。然后用PBS洗涤细胞三次,盖片装于Mowiol (Sigma)中,用共聚焦显微镜(SP5, Leica)观察。
细胞活力(MTT法)
将THP-1单核细胞以18万个/孔的速度接种于24孔板中,并按照上述方法分化为巨噬细胞。IFN-γ±LPS孵育后,用500 μl MTT试剂(2.5 mg/ml PBS, Sigma #M2128)在CO中孵育2 h2孵化器。然后除去培养基,每孔加入1 ml裂解缓冲液(SDS 30% /N,N-二甲基甲酰胺2:1 pH 4.7)。37℃孵育,70 rpm轻摇1 h,在570 nm处测定吸光度。
RT-qPCR
孵育后,使用RNeasy迷你试剂盒和DNase程序(Qiagen, #74104)提取总RNA。用转录第一链cDNA合成试剂盒(Roche, #4379012001)逆转录2 μg总RNA中的mRNA。扩增反应检测包含SYBRGreen PCR Master Mix (Applied Biosystem, #4309155)和引物(IDT, 300 nM)。以40S核糖体蛋白S9 (RPS9)为内参基因进行归一化,采用阈值循环法定量mRNA丰度。
ELISA
根据供应商推荐的程序(CXCL10 (R&D System, #DIP100)、IL-6 (R&D System, D6050)、IL-10 (R&D System, D1000B)、CCL18 (Abnova, #KA1757)),使用ELISA试剂盒检测培养基中的细胞因子分泌。
使用60 μl哺乳动物蛋白提取试剂(Thermo Scientific公司的78501)裂解细胞后,采用Pierce法测定的每μg蛋白中细胞因子的归一化表达量为pg。
流式细胞术分析CD206质膜表达
THP-1单核细胞接种于2.5 × 10的T25烧瓶中6细胞/T25分化为PMA。在有或没有IL-4和IL-13孵育后,用冷PBS洗涤细胞,并用EDTA分离5 mM。冷PBS含有5%人热灭活血清(his)和0.1% NaN3.在烧瓶中加入细胞悬液,将细胞悬液放入FACS管中。细胞计数,0.5 × 106将细胞重悬在共1ml 5%他的0.1% NaN的PBS中3..细胞悬液在200 g和4℃下离心5分钟,用1ml 5% his 0.1% NaN的PBS重悬3..这个洗涤步骤进行了两次。然后用PBS稀释20倍的人truStain FcX (biolgend, #422301)重悬微球。用总体积50 μl进行重悬。在室温下孵育10分钟,细胞在200 g、4℃条件下离心5分钟。用50 μl抗cd206一抗在5%的PBS中稀释5倍(0.1% NaN)重悬3.在4℃下孵育30分钟。细胞也与每个一抗对应的对照同型孵育。主抗体为PE (Phycoerythrin)小鼠抗人CD206 (BD Pharmingen, #555954)和PE小鼠IgG1 κ同型控制(BD Pharmingen #555749)。孵育后,PBS 5%他0.1% NaN3.加入悬浮液,在200 g、4℃条件下离心5分钟。用5% PBS和0.1% NaN洗涤三次3.接下来的表演。将颗粒用2%多聚甲醛(冷PBS)重悬,在4°C下孵育20分钟。悬浮液在200 g 4℃下离心5分钟,用0.1 M甘氨酸(冷PBS)重悬,在4℃下孵育10分钟。最后在200 g和4°C下离心5分钟,然后用1ml 5% his 0.1% NaN的PBS重悬细胞3..用FACScalibur (BD Biosciences)流式细胞术分析细胞。
西方墨点法
细胞接种于6孔板(Costar;250000个HepG2细胞/孔和125000个A549细胞/孔)与巨噬细胞孵育前1天。孵育后,提取蛋白,采用western blotting方法检测PARP-1和caspase-3蛋白的丰度[13]。主要抗体为兔抗caspase-3抗体(Cell Signaling, #9662)和小鼠抗parp1抗体(BD Pharmingen, #551025)。一抗小鼠抗-β用-肌动蛋白(Sigma, #A5441)或小鼠抗α-微管蛋白(Sigma, # T5168)归一化。IRDye 800cw偶联山羊抗兔抗体(H + L;Licor, #926-32211), IRDye 800cw偶联山羊抗小鼠抗体(H + L;Licor, #926-32210)和IRDye 680lt偶联山羊抗小鼠抗体(H + L;Licor, # 926-68020)作为二抗。荧光强度定量分析采用奥德赛经典红外成像系统(Licor)测量。
半胱天冬酶活性测定
采用荧光底物Ac-DEVD-AFC检测caspase-3和caspase-7活性et al。[14]。按照Wellington的描述制备细胞提取物et al。[15]。HepG2或A549细胞接种于6孔板(Costar;250000 HepG2细胞/孔- 125000 A549细胞/孔)与巨噬细胞孵育前1天。孵育后,提取蛋白质,并在不同样品中测量caspase活性,如前所述[13]。
膜联蛋白V/碘化丙啶染色的流式细胞术分析
HepG2或A549细胞接种于6孔板(Costar;250000 HepG2细胞/孔- 125000 A549细胞/孔)与巨噬细胞孵育前1天。培养后,用胰蛋白酶/EDTA收集肿瘤细胞,用FITC Annexin V凋亡检测试剂盒I (BD Pharmingen #556547)染色。流式细胞术(FACSCalibur, BD)分析结果。
统计分析
使用Sigma Stat软件进行统计分析。对于某些分析,值不遵循高斯分布。为了处理这种正态性缺失,对对数转换数据进行统计分析。为了便于解释,显示了未转换的数据。
结果与讨论
单核细胞分化为巨噬细胞
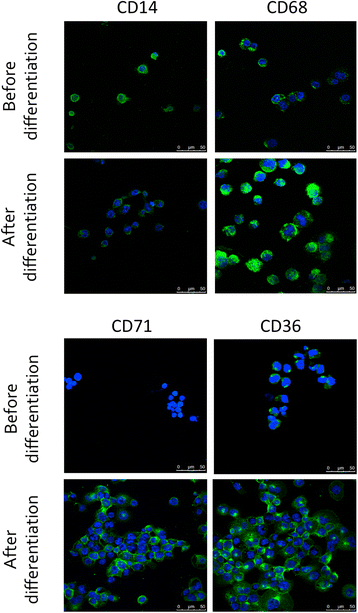
人THP-1单核细胞在12-肉豆蔻酸13-醋酸phorbol 12-肉豆蔻酸13-醋酸酯(PMA)存在下孵育分化为巨噬细胞。测试了不同的PMA浓度和孵育时间(数据未显示)。最终选择150 nM PMA孵育24 h,然后在对照培养基中孵育24 h作为分化方案。细胞开始贴壁,可识别的巨噬细胞标志物CD68 (cluster of differentiation 68)的表达[16], cd71 [17]及CD36 [18],免疫荧光染色分析证实单核细胞向巨噬细胞分化,也明显增加。CD14的表达随着巨噬细胞分化而降低[19],也进行了研究并证实了其分化(图2)。1).
THP-1极化进入促炎M1巨噬细胞
M1极化的经典方案是在IFN-γ单独存在或与LPS联合存在的情况下培养巨噬细胞[6],一般为24小时。在大多数研究中,IFN-γ的浓度为20 ng/ml,而根据报告,LPS的浓度在10 ng至1 μg/ml之间变化[20.,21]。
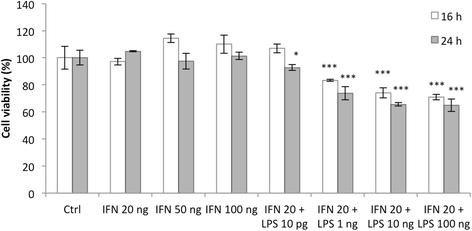
根据文献,我们测试了不同浓度的LPS,从1到100 ng/ml,结合20 ng/ml的IFN-γ,我们在16或24小时内培养THP-1巨噬细胞。我们观察到高细胞毒性,随着LPS浓度的增加,细胞毒性增加:通过MTT测定,在10 ng/ml LPS + 20 ng/ml IFN-γ孵育24小时后,细胞存活率从对照细胞的100%下降到65%。单独使用IFN-γ未观察到毒性(图3)。2).LPS对巨噬细胞的细胞毒性已经被描述[22,23]。为了降低LPS诱导的细胞毒性,Hirose和同事在较低的LPS浓度下,用10 pg/ml LPS + 20 ng/ml INF-γ培养巨噬细胞M1极化18小时[22]。因此,我们用10 pg/ml LPS + 20 ng/ml IFN-γ培养M0 THP-1巨噬细胞16或24小时。在这些条件下,16小时孵育后细胞活力不受影响,24小时孵育后仅略有影响(93%细胞活力)。2).
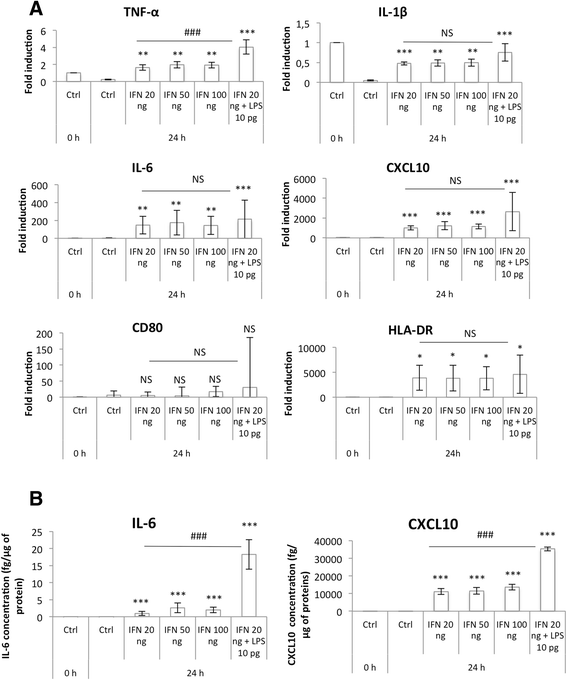
然后通过测量几种经典M1标记物的表达来评估巨噬细胞M1极化:TNF-α, IL-1β, IL-6和CXCL10,它们是促炎细胞因子,以及CD80和HLA-DR,两种膜受体,均在mRNA水平上使用RT-qPCR(图2)。3)和蛋白水平(IL-6和CXCL10)(图2)。3 b).与单独使用IFN-γ相比,IFN-γ联合10 pg/ml LPS孵育后,促炎标志物表达谱增加。TNF-α和IL-1β在对照M0巨噬细胞中表达,但在对照培养基中24 h后表达降低。这可能是由于PMA用于单核细胞向巨噬细胞分化,已被描述为上调其表达[24]。另一方面,在LPS和IFN-γ作用下培养的巨噬细胞中,它们的表达高度增加。
M1巨噬细胞标志物表达。用IFN-γ(20、50、100 ng)和/或LPS (10 pg/ml)孵育THP-1巨噬细胞24小时。一个) RT-qPCR检测M1巨噬细胞标志物mRNA表达,RPS9表达归一化。结果以均数±1标准差表示(n= 3)。(b)用ELISA法检测培养基中IL-6和CXCL10的分泌情况。结果以均数±1标准差表示(n= 3)。统计分析采用单因素方差分析和Holm-Sidak后验检验。NS:没有显著差异。*、**或***:分别与相应对照(Ctrl)有显著差异,p < 0.05、0.01或0.001;###:显著差异,p < 0.001。对未转化的TNF-α (一个), il-1ß (一个), il-6 (b)及CXCL10 (b)和IL-6的对数转换数据(一个), cxcl10 (一个), cd80 (一个)及HLD-DR (一个)
我们还在mRNA水平上检测了M1巨噬细胞中几种M2标记(CD206、CD163、纤维连接蛋白、IL-10、CCL18和CCL22)的表达,但在我们的条件下,我们没有观察到这些基因的显著表达(图2)。4).当使用较高浓度的LPS使巨噬细胞极化时,情况并非如此。事实上,在10 ng/ml LPS + 20 ng/ml IFN-γ孵育24小时后,CCL18的mRNA丰度增加(数据未显示)。CCL18经常被描述为一种M2巨噬细胞标志物,由IL-4、IL-13和IL-10诱导[6,25]。2013年,Chanputet al。[26]发表了M1和M2巨噬细胞中THP-1巨噬细胞极化模型。为了使M1细胞中的巨噬细胞极化,他们用20 ng/ml IFN-γ和1 μg/ml LPS孵育细胞。在这些条件下,他们测量了M1巨噬细胞中几种M2巨噬细胞标志物(IL-10, CCL17, CCL18)的表达水平高于M2(在20 ng/ml IL-4孵育24小时后极化)。这一结果证实了我们的假设,即高浓度LPS孵育THP-1巨噬细胞可能诱导促炎巨噬细胞中M2巨噬细胞标志物的非特异性表达。
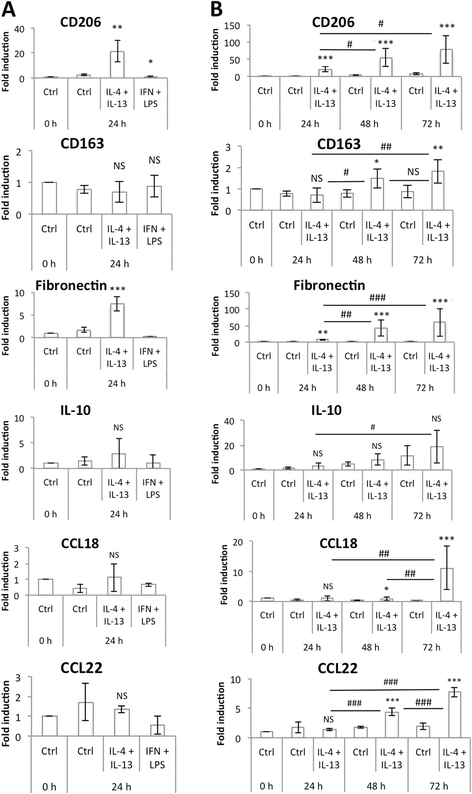
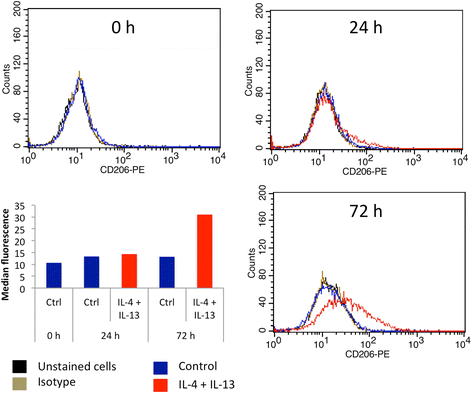
M2巨噬细胞标志物mRNA表达。(一个)将THP-1巨噬细胞分别与IL-4和IL-13(各20 ng/ml)或IFN-γ (20 ng/ml)和LPS (10 pg/ml)孵育24 h,采用RT-qPCR检测巨噬细胞M2标记物mRNA的表达,并通过RPS9的表达进行标准化。结果以均数±1标准差表示(n= 3)。(b)将THP-1巨噬细胞与IL-4和IL-13(各20 ng/ml)孵育24、48和72 h,采用RT-qPCR检测巨噬细胞M2标记物mRNA的表达,并采用RPS9表达标准化。结果以均数±1标准差表示(n= 3)。对图a进行单因素方差分析,对图B进行双因素方差分析,然后进行Holm-Sidak后验。NS:没有显著差异。*、**或***:分别与相应对照(Ctrl)有显著差异,p < 0.05、0.01或0.001;###:显著差异,p < 0.001。对CD206 (b),纤维连接蛋白(b)及CCL18 (b)
综上所述,IFN-γ 20 ng/ml和LPS 10 pg/ml孵育THP-1巨噬细胞24 h后,THP-1巨噬细胞极化为M1巨噬细胞。
THP-1极化成抗炎M2巨噬细胞
诱导巨噬细胞极化为交替活化的巨噬细胞,也称为M2细胞在活的有机体内和在体外IL-4和IL-13刺激[6]。在大多数将小鼠或人原代巨噬细胞极化为M2巨噬细胞的研究中,一般采用单独或联合20 ng/ml IL-4孵育16或24 h [20.,22,23]。
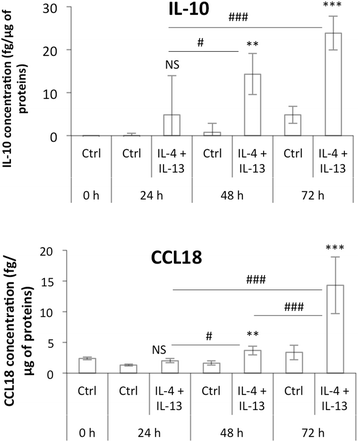
我们将M0 THP-1巨噬细胞与浓度为20 ng/ml的IL-4和IL-13孵生24、48和72 h。通过研究几种M2标记物CD206、CD163、纤维连接蛋白、IL-10、CCL18和CCL22的mRNA和蛋白丰度来表征M2表型。孵育24 h后,CD206、纤维连接蛋白和IL-10的表达略有升高,而CD163、CCL18和CCL22的表达不变。如果将与IL-4和IL-13的孵育时间延长至48 h,甚至进一步延长至72 h,则所有M2标记物的mRNA丰度都要高得多(图2)。4 b).CD206的FACS分析证实了CD206、IL-10和CCL18在蛋白水平上的表达模式(图2)。5)和ELISA法检测IL-10和CCL18(图2)。6).与IL-4和IL-13孵育72小时后,M2极化巨噬细胞中未发现任何M1巨噬细胞标志物的表达(数据未显示)。
与从血分离单核细胞分化的原代巨噬细胞相比,THP-1衍生的巨噬细胞的极化似乎需要更长的孵育时间(数据未显示,[20.])。的确,Martinez和同事在20 ng/ml的IL-4 (M1:M2比为- 19)中培养16 h的原代巨噬细胞中检测到CCL18 mRNA的高表达,而在与IL-4和IL-13培养72 h后,诱导CCL18表达并检测到thp -1来源的M2巨噬细胞培养基中有CCL18的分泌。
巨噬细胞M1和M2对癌细胞凋亡的影响
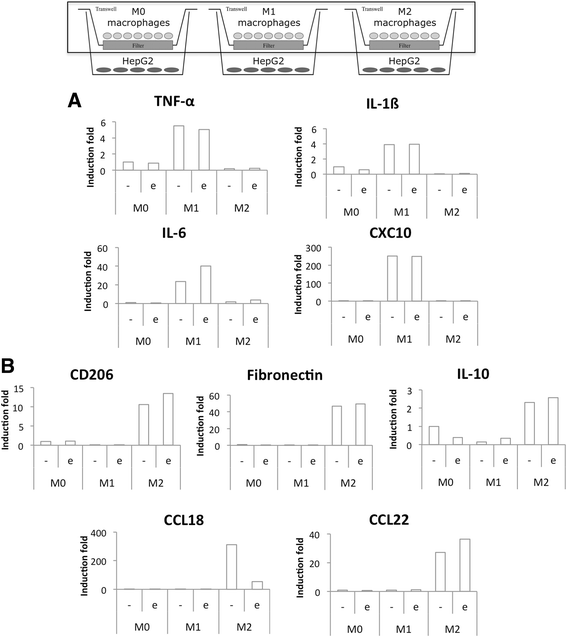
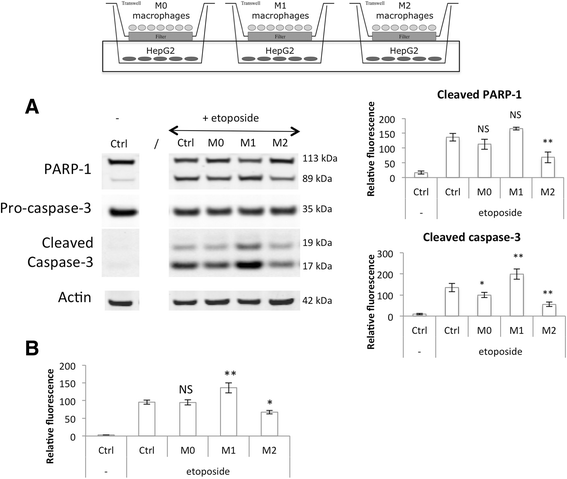
为了研究M1(促炎和抗肿瘤)和M2(抗炎和促肿瘤)THP-1巨噬细胞对癌细胞对化疗药物反应的影响,每个细胞群使用Transwell插入物与HepG2(人肝癌)细胞间接接触共培养。单核细胞被植入由0.4 μm孔的膜制成的插入物中,这允许可溶性因子的交换,但不允许细胞的迁移。M2、M1、M0巨噬细胞分别在不同的时间启动THP-1单核细胞分化,以便在同一天获得分化极化的巨噬细胞。在巨噬细胞极化结束前24 h,将25万个HepG2细胞接种于6孔板中。选择这种细胞密度是为了使肿瘤细胞和巨噬细胞在无血清培养基中共培养成1:1的比例。使用无血清培养基,因为血清可以保护HepG2细胞免受依托泊苷诱导的凋亡(数据未显示)。共培养16 h后,两个细胞群在直接加入50 μM依托泊苷的条件下孵育。细胞进一步与依托泊苷孵育24小时。
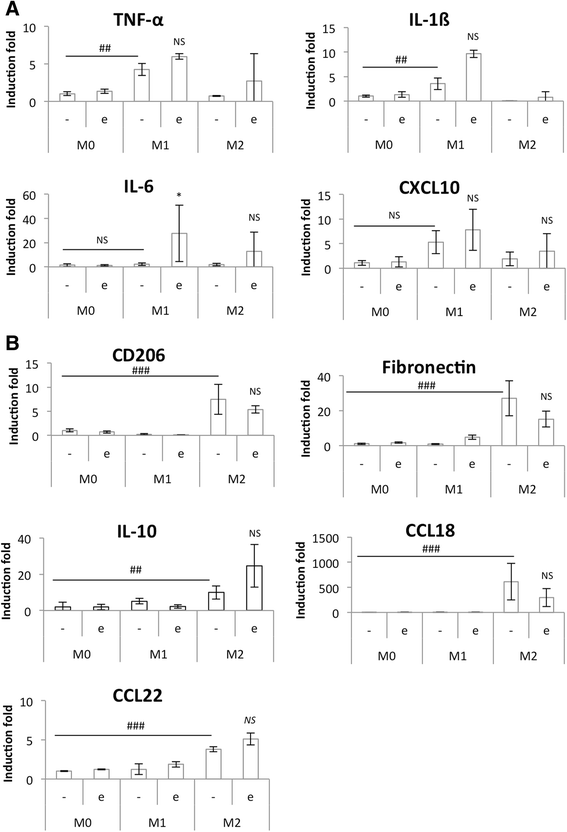
孵育结束时,从巨噬细胞中提取RNA,采用RT-qPCR检测巨噬细胞M1和M2标记物的表达(图2)。7).CO中孵育2添加或不添加依托泊苷的独立培养基对巨噬细胞极性无影响。事实上,IL-6是唯一明显受依托泊苷影响的M1标记物。对于M2巨噬细胞标志物,只有CCL18在依托泊苷培养的细胞中表达强烈降低。对在相同条件下孵育的巨噬细胞进行了同样的实验,M1和M2标记物的表达与共培养时相似(图2)。8).在依托泊苷存在的情况下,促炎M1巨噬细胞的IL-6和IL-1ß mRNA的表达没有显著增加。这种增加可能是由于依托泊苷激活了p38 MAPK [5]。一旦被激活,p38 MAPK诱导TNF-α、IL-ß和IL-6的表达。此外,与HepG2细胞共培养的M1巨噬细胞中IL-6和CXCL10水平高于单独培养。
M1 (一个)及M2 (b)极化标记物mRNA在依托泊苷培养巨噬细胞中的表达。IFN-γ (20 ng/ml) + LPS (10 pg/ml) (M1)作用24 h, IL-4和IL-13(各20 ng/ml - M2)作用72 h, THP-1巨噬细胞在M1和M2巨噬细胞中分化(M0)和极化。极化后,它们在CO中孵育2与50 μM依托泊苷(+/−e)孵育24 h前,分别在+3,75 g d -葡萄糖/l培养基中孵育16 h。孵育后,采用RT-qPCR检测巨噬细胞M1和M2标记物mRNA的表达,并采用RPS9表达标准化。结果以均数±1标准差表示(n= 3)。统计学分析采用双因素方差分析及Holm-Sidak后验NS:差异无统计学意义。*:与相应对照差异显著(p < 0.05);##或###分别有显著差异,p < 0.01或0.001。对所有基因的对数转换数据进行统计分析
同时,对HepG2细胞进行蛋白提取,检测共培养巨噬细胞对细胞凋亡的影响及分泌因子对细胞凋亡的影响。进行Western blotting分析以测定裂解的caspase-3和裂解的PARP-1蛋白丰度(图2)。9),用荧光底物定量检测caspase-3/7活性(图2)。9 b).与没有巨噬细胞孵育的对照癌细胞相比,在M1巨噬细胞存在下孵育的HepG2细胞中观察到裂解的caspase-3丰度增加。然而,PARP-1蛋白丰度的轻微增加并不显著。M1巨噬细胞也增加了依托泊苷暴露的HepG2细胞的caspase活性。需要注意的是,在不含依托泊苷的情况下,与M1巨噬细胞孵育HepG2细胞,观察到细胞凋亡略有增加(数据未显示)。当HepG2细胞与M2巨噬细胞孵育时,与对照细胞相比,癌细胞凋亡明显减少。事实上,在M2巨噬细胞存在下培养的细胞中,裂解的caspase-3和裂解的PARP-1蛋白的含量要少得多。Western blot结果由caspase活性测定证实。
共培养M0、M1和M2巨噬细胞对依托泊苷诱导HepG2细胞凋亡的调节作用。巨噬细胞与HepG2细胞间接接触共培养16 h后,在24 h内分别添加或不添加50 μM依托泊苷(+/−e)。一个)提取HepG2细胞蛋白,用特异性抗体进行western blotting检测PARP-1和caspase-3蛋白的丰度。以ß-actin为加载对照。图中表示了三个独立实验中被切割的PARP-1和被切割的caspase-3丰度被相应的ß-actin归一化的定量。结果以均数±1标准差表示(n= 3)。(b)与依托opo苷孵育后,通过测定Ac-DEVD-AFC裂解后释放的游离AFC的荧光强度,检测HepG2细胞中caspase-3和7的活性。结果以相对caspase-3/-7活性表示,平均±1 S.D. (n= 3)。统计学分析采用单因素方差分析和Holm-Sidak后验检验。NS:与用依托泊苷孵育的对照细胞无显著差异;*或**:分别与依托泊苷培养的对照细胞差异显著(p < 0.05或0.01)
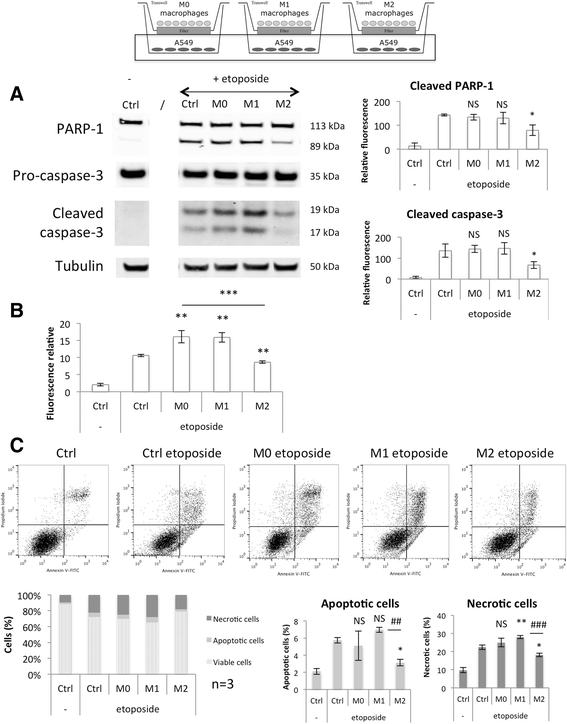
这些结果在第二种癌细胞系A549细胞中重现,在加入依托泊苷之前与巨噬细胞共培养24小时,并孵育16小时(图2)。10).由于A549细胞对依托泊苷诱导的凋亡比HepG2细胞更敏感,因此孵育动力学发生了变化。M0巨噬细胞对依托泊苷诱导的HepG2细胞凋亡无影响(图2)。9),通过caspase-3和PARP-1切割检测,对依托泊苷诱导的A549细胞凋亡无影响(图2)。10)和丙啶碘膜联蛋白v标记(图。10 c).然而,在A549细胞中观察到caspase-3/7活性分析增加(图2)。10 b),这确实与另外两个观察结果不一致。这可能是由于caspase-3以外的其他caspase如caspase-7的活性。
共培养M0、M1和M2巨噬细胞对依托泊苷诱导A549细胞凋亡的调节作用。将巨噬细胞与A549细胞间接接触共培养24 h,然后分别添加或不添加50 μM依托泊苷(+/−e)孵育16 h。一个)提取A549细胞蛋白,采用特异性抗体进行western blotting检测PARP-1和caspase-3蛋白的丰度。α-微管蛋白作为加载对照。图中为三次独立实验中被α-微管蛋白归一化的被切割的PARP-1和caspase-3丰度的定量。结果以均数±1标准差表示(n= 3)。(b)与依托opo苷孵育后,通过测定Ac-DEVD-AFC裂解后释放的游离AFC的荧光强度,在A549细胞中检测caspase-3和7的活性。结果以相对caspase-3/-7活性表示,平均±1 S.D. (n= 3)。(c)与巨噬细胞孵育后,分离A549细胞,用Annexin V-FITC和碘化丙啶染色,流式细胞仪荧光分析。计算四个不同象限的细胞百分比,结果呈现在不同的直方图中,其中活细胞为Annexin V-/PI-,凋亡细胞为Annexin V+/PI-,坏死细胞为PI +。结果以平均±1标准差表示(n= 3)。统计学分析采用单因素方差分析和Holm-Sidak后验检验。NS:与用依托泊苷孵育的对照细胞无显著差异;*、**或***:分别与依托泊苷培养的对照细胞差异显著(p < 0.05、0.01或0.001)
与A549细胞共培养时,M1巨噬细胞的细胞毒作用比与HepG2细胞共培养时小。然而,与不含巨噬细胞的依托泊苷孵育的对照细胞相比,M1巨噬细胞显著增加了caspase活性以及碘化丙啶阳性A549细胞(坏死细胞)的百分比(图2)。10 c).M1巨噬细胞增加依托泊苷诱导的HepG2细胞凋亡(图2)。9),以及通过caspase-3活性测定依托泊苷诱导的A549细胞凋亡(图2)。10 b)和丙啶碘膜联蛋白v标记(图。10 c).然而,在A549细胞中,未观察到对裂解caspase-3和裂解PARP-1蛋白丰度的显著影响(图2)。10),这确实与另外两个观察结果不一致。然而,对于三个独立实验中的两个western blot分析,这种效应是可以观察到的。
相反,M2巨噬细胞对这三个参数均表现出较强的保护作用。
综上所述,这些结果表明,从THP-1单核细胞分化和极化的M1和M2巨噬细胞调节HepG2和A549两种癌细胞对依托泊苷的凋亡反应。M1巨噬细胞具有细胞毒性作用,增加依托泊苷诱导的细胞凋亡。相反,M2巨噬细胞对暴露于该药物的癌细胞具有保护作用,并减少其凋亡。
使用这个在体外在共培养模型中,我们能够重现巨噬细胞在临床研究中观察到的或与之不同的作用在活的有机体内动物模型。许多研究表明,肿瘤中巨噬细胞丰度一方面与患者预后和生存呈负相关,另一方面与化疗耐药性呈正相关[11,27- - - - - -29]。在可能发生肿瘤的慢性炎症部位,巨噬细胞具有M1表型[30.]。M1巨噬细胞对病原体和肿瘤细胞具有细胞毒性。它们的杀瘤活性与它们分泌活性氮、活性氧和促炎细胞因子的能力有关[7]。10 pg/ml LPS和20 ng/ml IFN-γ孵育24 h后极化的THP-1 M1巨噬细胞与HepG2或A549细胞孵育后,能够增加etopo苷诱导的癌细胞凋亡。
在恶性肿瘤中,巨噬细胞主要表现为m2样表型[3.,31,32]。M2巨噬细胞通过分泌多种生长因子如EGF、FGF家族成员、TGF-ß或VEGF(血管内皮生长因子)等促进肿瘤细胞生长和存活[10,33]。存在于肿瘤微环境中并由巨噬细胞分泌的许多可溶性因子已经被描述为降低癌细胞对IL-1ß等化疗的反应[34,35], vegf [36], tgf -ß [37], il-4 [38]以及组织蛋白酶B和S [11]。然而,并非所有这些基因都是典型的M2巨噬细胞标志物。事实上,在IFN-γ和LPS刺激后,M1巨噬细胞中IL-1ß上调,组织蛋白酶S略有上调(数据未显示)。
20 ng/ml IL-4和IL-13孵育72 h后,THP-1 M2巨噬细胞与HepG2或A549细胞孵育后,THP-1 M2巨噬细胞的凋亡水平显著降低。必须指出的是,在人类巨噬细胞中,一氧化氮的产生不像在小鼠巨噬细胞中所描述的那样受极化调节[5]。这一点很重要,因为依托泊苷已被证明可被一氧化氮衍生物进行化学修饰,并形成毒性活性降低的产物[39]。
本研究中使用的依托泊苷浓度对巨噬细胞极化没有影响。此外,在相同的孵育条件下进行的共培养和单培养实验中,巨噬细胞的表达谱非常相似。说明肿瘤细胞经依托泊苷孵育后对THP-1巨噬细胞极化无影响。来自Weigert的结果等.[40]表明,当原代巨噬细胞与MCF-7细胞直接共培养时,巨噬细胞产生TNF-α,诱导MCF-7细胞凋亡。凋亡细胞释放鞘氨醇-1-磷酸(S1P),引起巨噬细胞表型从M1向M2转换。在我们的共培养系统中,THP-1 M0巨噬细胞没有诱导癌细胞凋亡,与乙甲苷共培养后没有观察到表型开关。然而,该研究中使用的动能比我们的研究长3天以上。同一研究小组还描述了S1P可以促进依托泊苷孵育后巨噬细胞的存活[39]。我们没有研究S1P对THP-1巨噬细胞存活的影响,THP-1巨噬细胞在50 μM的依托泊苷中孵育24小时似乎没有影响,但我们研究了HepG2细胞对依托泊苷的反应。S1P对依托泊苷诱导的HepG2细胞凋亡无影响(数据未显示)。因此,我们观察到的差异效应不是由于从一种表型到另一种表型的转变。
我们的模型是原创的,因为它使用了THP-1分化的巨噬细胞,这种细胞容易获得、分化和极化。M1和M2型THP-1巨噬细胞的表达谱与极化原代巨噬细胞相同。我们研究了巨噬细胞对肿瘤细胞对依托泊苷反应的影响。为了获得M2巨噬细胞对依托泊苷诱导的细胞凋亡的保护作用,需要与癌细胞进行巨噬细胞预孵育。这意味着两个细胞群必须交换可溶性因子,这将激活促生存途径,使癌细胞抵抗依托泊苷诱导的凋亡。该模型为研究巨噬细胞对癌细胞的保护或细胞毒性作用中特定途径的影响提供了一个很好的工具。我们用它来研究COX-I通路(在M2巨噬细胞中上调,数据未显示)的影响,未观察到COX-I抑制对M2巨噬细胞保护作用的影响。
结论
综上所述,我们建立了一种简单、可重复且表征良好的THP-1单核细胞分化为M1和M2巨噬细胞的模型。通过该模型,我们证明了M1和M2巨噬细胞对癌细胞对化疗药物的反应具有相反的作用。
缩写
- BSA:
-
牛血清白蛋白
- CD206 (= MRC1):
-
甘露糖受体
- IRDye:
-
红外染料
- PARP1:
-
聚[adp -核糖]聚合酶
- PMA:
-
佛波12-肉豆蔻酸13-醋酸酯
- RPS9:
-
40S核糖体蛋白S9
- TAM:
-
肿瘤相关巨噬细胞
参考文献
巨噬细胞:过去,现在和未来。中华免疫学杂志。2007;37(1):9 - 17。
高氏,Taylor PR.单核细胞和巨噬细胞异质性。中华免疫学杂志,2005;5(12):953-64。
李建军,李建军,李建军,等。巨噬细胞极化:肿瘤相关巨噬细胞中M2单核细胞的极化模式。免疫学杂志,2002;23(11):549-55。
Gordon S.巨噬细胞的选择性活化。中华免疫学杂志,2003;3(1):23-35。
张建军,张建军,张建军,等。肿瘤相关巨噬细胞:功能多样性、临床意义和开放问题。免疫学杂志,2013;35(5):585-600。
Mantovani A, Sica A, Sozzani S, Allavena P, Vecchi A, Locati M.巨噬细胞激活和极化的趋化因子系统。免疫学杂志,2004;25(12):677-86。
Van Ginderachter JA, Movahedi K, Hassanzadeh Ghassabeh G, Meerschaut S, Beschin A, Raes G,等。单核吞噬细胞的经典和替代激活:选择最好的两个世界的肿瘤促进。免疫生物学。2006;211(6 - 8):487 - 501。
王晓明,王晓明,王晓明,等。巨噬细胞免疫功能的研究进展。免疫学杂志,2009;27:451-83。
波拉德JW。肿瘤诱导的巨噬细胞促进肿瘤的进展和转移。中华癌症杂志,2004;4(1):71-8。
Hagemann T, Biswas SK, Lawrence T, Sica A, Lewis CE。肿瘤中巨噬细胞功能的调控:NF-kappaB的多方面作用。血。2009;113(14):3139 - 46所示。
Shree T, Olson OC, Elie BT, Kester JC, Garfall AL, Simpson K,等。巨噬细胞和组织蛋白酶抑制乳腺癌化疗反应。基因学报,2011;25(23):2465-79。
张建军,张建军,张建军,等。肿瘤相关巨噬细胞与抗癌药物的相互作用。中华检验医学杂志,2015;22(2):444 - 444。
张建军,张建军,张建军,等。紫杉醇诱导乳腺癌细胞凋亡的研究进展。细胞死亡杂志,2013;4,638。
Lozano J, Menendez S, Morales A, Ehleiter D, Liao WC, Wagman R,等。酸性鞘磷脂酶敲除成纤维细胞的细胞自主凋亡缺陷。中国生物医学工程学报,2009;31(1):444 - 444。
Wellington CL, Ellerby LM, Hackam AS, Margolis RL, Trifiro MA, Singaraja R,等。半胱天冬酶切割与三联体扩增障碍相关的基因产物产生含有聚谷氨酰胺束的截短片段。中国生物医学工程学报,2009;22(3):391 - 391。
霍利斯CL,西蒙斯DL。人巨噬细胞溶酶体糖蛋白相关标志物CD68的分子克隆。血。1993;81(6):1607 - 13所示。
Andreesen R, Osterholz J, Bodemann H, Bross KJ, Costabel U, Lohr GW。人单核细胞终末分化过程中转铁蛋白受体和胞内铁蛋白的表达。血液。1984;49(3):195 - 202。
许海,Pearce SF, Yesner LM, Schindler JL, Silverstein RL。单核细胞向巨噬细胞分化过程中CD36的调控表达:CD36在泡沫细胞形成中的潜在作用。血。1996;87(5):2020 - 8。
施泰因巴赫F, Thiele B.流式细胞术研究单核吞噬细胞的表型。中华免疫学杂志,1994;17(1):1 - 4。
李建军,李建军,李建军,等。单核细胞向巨噬细胞分化和分化的转录谱分析:新分子和基因表达模式。中国生物医学工程学报,2006;32(3):444 - 444。
Rey-Giraud F, Hafner M, Ries CH.无血清条件下单核细胞源性巨噬细胞体外生成提高其促肿瘤功能。科学通报,2012;7(8),e42656。
Hirose K, Iwabuchi K, Shimada K, Kiyanagi T, Iwahara C, Nakayama H,等。人极化巨噬细胞对氧化低密度脂蛋白的不同反应。血脂与健康杂志2011;10:1。
Deshmukh VA, Tardif V, Lyssiotis CA, Green CC, Kerman B, Kim HJ,等。一种治疗多发性硬化的再生方法。大自然。2013;502(7471):327 - 32。
Park EK, Jung HS, Yang HI, Yoo MC, Kim C, Kim KS。对弱刺激反应的检测需要优化THP-1分化。炎症研究:欧洲组胺研究学会官方期刊[等]。2007; 56(1): 45 - 50。
Kodelja V, Muller C, Politz O, Hakij N, Orfanos CE, Goerdt S.巨噬细胞炎症蛋白α -1 α的结构同源物。中华免疫学杂志,1998;16(3):391 - 391。
刘建军,刘建军,刘建军。极化THP-1巨噬细胞的表征及LPS和食物化合物的极化能力。食物和功能。2013; 4(2): 266 - 76。
刘易斯CE,波拉德JW。巨噬细胞在不同肿瘤微环境中的独特作用。中华癌症杂志,2006;32(2):559 - 561。
鲁菲尔B,阿夫拉尼,库森斯m。肿瘤微环境中巨噬细胞的差异性编程。免疫学杂志,2012;33(3):119-26。
Mitchem JB, Brennan DJ, Knolhoff BL, Belt BA, Zhu Y, Sanford DE,等。靶向肿瘤浸润的巨噬细胞减少肿瘤启动细胞,缓解免疫抑制,改善化疗反应。中国癌症杂志,2013;33(3):1145 - 1145。
Biswas SK, Sica A, Lewis CE。肿瘤进展过程中巨噬细胞功能的可塑性:不同分子机制的调控。中国生物医学工程学报,2008;31(4):391 - 391。
Biswas SK, Gangi L, Paul S, Schioppa T, Saccani A, Sironi M,等。一个由肿瘤相关巨噬细胞表达的独特的转录程序(NF-kappaB缺陷和IRF-3/STAT1激活增强)。血。2006;107(5):2112 - 22所示。
Saccani A, Schioppa T, Porta C, Biswas SK, Nebuloni M, Vago L,等。肿瘤相关巨噬细胞p50核因子- kappab过表达抑制M1炎症反应和抗肿瘤耐药。中国癌症杂志,2006;32(3):444 - 444。
Sica A, Schioppa T, Mantovani A, Allavena P.肿瘤相关巨噬细胞是一种独特的M2极化群体,促进肿瘤进展:抗癌治疗的潜在靶点。中华医学杂志,2006;42(6):717 - 727。
Kaler P, Galea V, Augenlicht L, Klampfer L.肿瘤相关巨噬细胞通过il -1 β依赖性稳定肿瘤细胞保护trail诱导的结肠癌细胞凋亡。科学通报,2010;5(7),e11700。
张建军,张建军,张建军,等。单核细胞源性白细胞介素-1 β通过表达环氧化酶-2介导胰腺癌细胞化疗耐药。手术。2008;144(1):57 - 65。
Dias S, Choy M, Alitalo K, Rafii S.血管内皮生长因子(VEGF)-C信号通过FLT-4 (VEGFR-3)介导白血病细胞增殖、生存和化疗耐药。血。2002;99(6):2179 - 84。
杨建林,张建平,张建平。阻断肿瘤细胞转化生长因子- β可促进细胞周期进程并使人乳腺癌细胞对细胞毒性化疗敏感。中国生物医学工程学报,1998;22(2):391 - 391。
刘建军,刘建军,刘建军,等。靶向IL-4/IL-13信号通路使霍奇金淋巴瘤细胞对化疗药物敏感。中华医学杂志,2013;33(8):1245 - 1245。
Sinha BK, Kumar A, Bhattacharjee S, Espey MG, Mason RP。一氧化氮对拓扑异构酶活性药物依托泊苷和阿霉素在人黑色素瘤细胞中抗癌活性的影响。中国药理学杂志,2013;37(3):357 - 357。
耆那教的家乡。肿瘤血管正常化:抗血管生成治疗中的新概念。科学。2005;307(5706):58 - 62。
致谢
Marie Genin是FRIA-FNRS (Fonds de la Recherche Scientifique, Belgium)的研究员。弗朗索瓦·克莱门特(Francois Clement)是一项tsami基金的接受者。在Noelle Ninane的帮助下,使用“形态学”技术平台(University of Namur)进行共聚焦显微镜下的免疫荧光染色观察。FACS分析是在Christian Didembourg的帮助下使用“形态学”技术平台(University of Namur)完成的。作者要感谢Muriel Moser (ULB, Gosselies)对手稿的有益讨论和校对。他们也感谢Caroline Peyrode (UMR 990, Clermont-Ferrand)的科学贡献。
作者信息
作者及单位
相应的作者
额外的信息
相互竞争的利益
作者宣称他们没有竞争利益。
作者的贡献
MG、FC和AF进行了实验。MG写了手稿。MR和CM构思了这项研究,并参与了它的设计和协调,并帮助起草了手稿。所有作者都阅读并批准了最终的手稿。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上不受限制地使用、分发和复制,前提是您要适当地注明原作者和来源,提供到知识共享许可协议的链接,并注明是否进行了修改。创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有说明。
关于本文
引用本文
Genin, M., Clement, F., Fattaccioli, A.。et al。来自THP-1细胞的M1和M2巨噬细胞差异调节癌细胞对依托泊苷的反应。BMC癌症15, 577(2015)。https://doi.org/10.1186/s12885-015-1546-9
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12885-015-1546-9
关键字
- THP-1
- 巨噬细胞极化
- 癌症细胞
- 共培养
- 细胞凋亡