摘要
神经接口设备与中枢神经系统(CNS)相互作用,以替代某种功能缺陷,提高残疾人的生活质量。设计安全、生物相容的神经接口装置是神经科学研究的一个快速发展的领域。侵入性植入材料的开发旨在直接连接大脑或脊髓组织,重点是减轻神经胶质疤痕对植入物本身的反应性,但在文献中几乎没有直接记录电刺激对神经胶质细胞的影响。在这篇综述中,对记录这种影响的研究进行了汇编和分类,基于所使用的各种类型的刺激范式及其对神经胶质的观察效果。混合神经科学细胞生物工程的角度提供了突出的考虑,必须在这两个学科在安全植入的发展。为了进一步了解电刺激如何影响神经胶质,我们还建议进行实验,阐明电刺激可能导致的电化学反应以及这种反应如何影响神经胶质。设计一种生物兼容的刺激模式应该是开发一种提高安全性和寿命的设备的首要考虑因素。
背景
神经接口是一项快速发展的技术,它允许外部设备与神经系统进行通信,从而进一步缩小人与机器之间的差距[1,2].神经接口经常被讨论在改善患有神经系统残疾的人的生活质量,损伤后功能的恢复或功能的增强的背景下。电活动的测量和/或应用,以促进外部设备和感兴趣的器官(大脑和/或脊髓)之间的通信,目的是诱导目标神经元集的活动,从而影响功能或行为的变化。
神经元是在中枢神经系统(CNS)中发现的一种主要细胞群,另一种是神经胶质细胞。总的来说,神经胶质细胞对中枢神经系统的发育、生长和安全至关重要[3.,4,5,6].胶质细胞的亚型,如小胶质细胞、星形胶质细胞和少突胶质细胞,都有不同的和众多的作用,使和增强神经元的功能、命运和生存[7从而对认知和行为产生重要影响。
虽然神经胶质细胞与神经元有很大的不同,因为它们不能被经典的电刺激所兴奋(即它们不产生动作电位),但它们对电刺激对神经组织的直接影响和对受刺激影响的附近神经元的间接影响都高度敏感。此外,以前已经证明[8,9,10,11,12,13所有神经胶质细胞上都存在电压门控离子通道,并且它们能够通过细胞内离子通量相互通信。离子(如钙离子)的跨膜运动2 +, Na+K+)在中枢神经系统的所有细胞中都很常见;电荷通过这些离子,从而使它们负责中枢神经系统的膜电位变化[14].
神经元在结构上与神经胶质细胞不同——最明显的区别之一是神经元具有树突和轴突,以促进动作电位从一个细胞传播到另一个细胞。神经元和胶质细胞通过释放可溶性分子和受体-配体相互作用相互交流[15].小胶质细胞对神经元发育、修剪和维持稳态至关重要[16].它们也时刻监视着周围的环境[17].尽管小胶质细胞不像神经元那样传导动作电位,但它们的功能同样受到膜电位和膜上离子通道的影响[18,19].通过调节K等离子的流动+、钙2 +和Cl−(因此也包括膜电位和细胞内离子浓度),离子通道是细胞活动的关键效应因子,如迁移、增殖、形态改变以及细胞因子和活性氧的产生[18].类似地,星形胶质细胞也具有离子通道,用于调节离子的流动(如K+, Na+、钙2 +)细胞质间隙与细胞外间隙之间的[20.,21].例如,星形胶质细胞中钙离子浓度的短暂增加已被证明通过影响神经递质和胶质递质的可塑性和释放等现象对突触产生影响[22,23].
针对神经系统的电刺激有很多应用。每个应用程序在目标区域、刺激强度、刺激持续时间以及应用程序是否需要使用侵入性植入物方面都有所不同。当需要侵入性植入物时,例如在深部脑刺激(DBS)中,它提供了与靶细胞更直接和更集中的接口,并降低了靶部位附近区域不必要的弥漫性刺激的可能性[24].这种方法的主要问题是胶质瘢痕现象[25,26].小胶质细胞和星形胶质细胞将植入/损伤部位隔离开来,并将其与邻近的健康组织隔离开来。虽然这种对外来物体的正常反应可以减轻损伤向邻近健康组织的扩散,但它也阻止了附近的神经元访问接口位置。这使得神经胶质疤痕成为这种植入物所经历的低信噪比和设备在较长时间内全部失效的重要因素。许多新的侵入性设备的延伸目标包括提高植入组织的生物相容性——这是为了提高它们的使用寿命,减少任何麻烦的翻修手术的需要。已经做了很多工作来减轻材料科学方法中胶质瘢痕现象的影响[27,28,29,30.].
然而,在考虑神经接口装置的生物相容性概念时,还有另一个问题必须进一步和更彻底地解决:神经胶质细胞对电刺激有何反应?在更广泛的文献中,足够的注意力被给予了神经元如何对电刺激模式做出反应,以及这如何转化为被试生物体的修改功能和行为,但很少是神经胶质细胞对刺激的反应。由于神经胶质细胞是神经系统的守护者和捍卫者,在电刺激后,它们也在决定周围其他细胞的命运方面发挥着重要作用。
本文综述了外源性电刺激如何影响神经胶质细胞的现有文献。本文提供了体外和体内实验的摘要,并考虑了不同的刺激范式(例如直流电vs交流电),侵入性与非侵入性实验方法,以及对神经胶质对刺激反应的潜在细胞机制的讨论。
主要内容
神经胶质细胞对电刺激有反应
非侵入性和侵入性电刺激
神经胶质对神经接口装置的反应有两个主要因素:细胞对电刺激的反应,以及对植入物的物理存在的反应。虽然一些刺激模式绕过植入电极(例如硬膜外刺激,一种非侵入性方法),但侵入性植入物的额外存在引发了由小胶质细胞和星形胶质细胞协调的异物反应。这无疑会加剧组织对该装置的反应。已经发表了许多关于侵入性植入物对神经胶质细胞反应性影响的研究[24,25,31,32],但进一步将电刺激整合到他们的实验中的研究更加有限[33].有侵入性植入物研究更广泛地关注神经胶质细胞对电刺激的反应,而较少关注植入物本身的反应。一些研究使用电极与细胞接触[34],并对它们施加电场刺激,但缺乏指向异物反应证据的数据。据我们所知,似乎很少有研究同时详细介绍神经胶质细胞对植入物和任何应用电刺激的反应。进行这样的同时评估将大大增加一项研究对新型神经接口设备的评估价值。
也有一些侵入性研究,提供了一些关于神经胶质细胞在细胞水平上对电刺激做出反应的有趣方式的见解[35].电刺激可诱发胶质细胞钙离子波;本文研究了是否包括小胶质细胞。钙波的产生是通过三磷酸腺苷(ATP)的释放和嘌呤能受体的激活。Schipke等人.的实验表明,星形胶质细胞和胶质前体细胞都参与了Ca2 +波。电刺激诱导Ca2 +波,膜片钳记录也揭示了向外整流K的瞬态感应+电流在小胶质细胞中,尽管这只在13个被研究的小胶质细胞中发现了5个。推测ATP从胶质细胞中释放出来,部分或全部作为Ca的载体2 +波。河豚毒素(TTX)和Cd2 +被引入大脑切片,以排除可能的神经元对Ca2 +波(例如,产生作用电位和突触释放)。尽管有研究表明,来自星形胶质细胞的ATP导致附近细胞的嘌呤能受体激活,从而导致这些细胞内钙水平上升[36],确定刺激诱导的细胞外ATP水平的增加是否足以作为小胶质细胞的损伤相关分子模式(DAMP),从而潜在地触发它们的激活是有兴趣的。
在Roitbak和Fanardjian的研究中,用植入的银线对猫的皮层进行电刺激[37].神经胶质的电生理学记录没有显示出指示通常在神经元中看到的动作电位的尖峰。然而,当受到振幅和频率更高的刺激范式时,在受影响的胶质细胞中观察到去极化(尽管膜电压衰减非常快)。提示神经胶质细胞的去极化主要是由于钾离子的贡献——通过增加细胞外钾离子浓度可以诱导神经胶质细胞运动+.
高频刺激(HFS)是一种广泛记录的DBS [23,38]用于通过靶向基底神经节(丘脑、苍白球、丘脑下核)的结构来抑制与帕金森氏病相关的震颤。一般来说,脑起搏器的使用已被认为是一种安全有效的干预方法[38].刺激对神经胶质的慢性影响似乎高度局限于电极-组织界面,Orlowski等人对猪进行的为期12个月的DBS研究就是一个例证。[39].在过去的大约15年里,HFS对星形胶质细胞的影响已被广泛讨论。它们被高度怀疑参与了ATP (ATP的下游产物腺苷)的增加释放,以及随后的A1受体激活,从而导致震颤的减少[40].星形胶质细胞也被怀疑通过增加钙的流入负责谷氨酸的释放2 +刺激后进入细胞[41],以及介导细胞外K+[42].以小胶质细胞为例,Vedam-Mai等人的研究[43]表明,与小病变和假动物相比,DBS有助于减少病变处和周围激活的小胶质细胞数量。关于其对植入电极的炎症反应的能力,小胶质细胞在电极-组织界面的活性也严重依赖于嘌呤能信号。Silchenko和Tass报道的计算模型[44]显示了植入物周围神经胶质瘢痕的大小与装置植入和刺激产生的ATP量之间的有趣相关性。Chen等人也假设了由于DBS导致的fractalkine信号衰减。[45有助于降低小胶质细胞的激活水平。DBS对大脑某些部位小胶质细胞密度和细胞大小的影响也已被证实;根据哈达尔等人。[46],在内侧前额叶皮层引入电极会导致局部小胶质细胞密度和细胞大小的增加,而DBS阻止了这一点。他们还有趣地发现,即使在引入电极和刺激后,伏隔核的相同实验也没有产生小胶质细胞密度和细胞大小的显著变化。该研究暗示了小胶质细胞在中枢神经系统中是一个异质群体[47,他们的行为方式至少在一定程度上取决于受试者的年龄、受影响的中枢神经系统区域,以及相关的病理。
非侵入性植入物也需要使用电极,但它们的应用没有穿透中枢神经系统组织(例如经颅直流电刺激,tDCS),因此在组织内没有穿透接触。这种方法的体外模型使用琼脂或盐制成的桥将电解质溶液连接到培养物本身[48,49,50].在2015年的一项研究中,Pelletier等人利用琼脂桥将小鼠N2a成神经细胞瘤细胞、BV2微胶质细胞和C8-D1A星形细胞暴露在直流场中培养[49].受到电刺激后,神经胶质细胞类型发生了形态学变化——细胞要么平行于电场(小胶质细胞),要么垂直于电场(星形胶质细胞)。进一步观察,结果表明,这种电场能够同时影响小胶质细胞和星形胶质细胞:电刺激和脂多糖启动后,小胶质细胞中环氧合酶-2的表达上调,而星形胶质细胞代谢增加[51].这些观察结果分别提示炎症作用和增生性作用。
一些方法,如硬膜外电刺激(EES),在手术侵入性方面处于中等程度[52,53].EES需要通过手术将植入物放置在脊髓背表面,并且必然比tDCS等应用更具侵入性,但缺乏穿透电极所提供的目标特异性,如在深部脑刺激(DBS)和椎管内微刺激(ISMS)等手术中所使用的电极。Baba等人的研究表明,大鼠脑硬膜外电刺激在缺血性中风后具有神经保护作用[52].由于抗凋亡级联被激活(pi3k /Akt信号通路),电刺激导致凋亡细胞减少。观察神经营养因子(神经胶质细胞系源性神经营养因子、脑源性神经营养因子、血管内皮生长因子)水平上调。电刺激还能促进血管生成,抑制小胶质细胞和星形胶质细胞增殖。
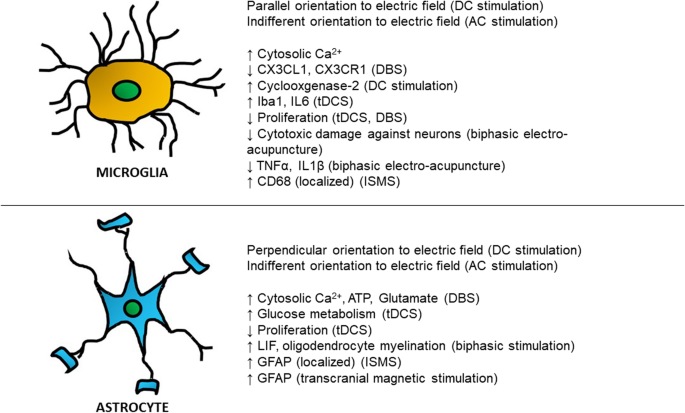
无论刺激是否使用侵入性植入物(图2)。1),有令人信服的证据表明,电刺激范式可以操纵胶质细胞的形态和方向,并引发胶质细胞之间的细胞间信号。然而,目前尚不清楚这些观察结果是否意味着胶质细胞可能发挥更促炎或抗炎的作用,以及周围的细胞或组织将如何受到影响。进一步的体内证据表明,电刺激能够在一定程度上减轻中风患者炎症相关的神经胶质细胞增殖,从而获得治疗效果——这种概念是否可以应用于其他损伤和神经退行性疾病,值得进一步广泛的研究。
直流电和交流电
电流对组织的应用通常使用直流电(DC)和交流电(AC)来完成。对于特定的刺激模式,选择哪种方法取决于应用程序。直流电通常用于经颅直流电刺激(tDCS)等应用,tDCS(在临床环境中)利用放置在头部外侧的电极,旨在治疗抑郁症和帕金森病等疾病。Latchoumane等人研究了tDCS治疗效果的分子途径[54].在兴奋毒性介质l-谷氨酸盐的存在下,对胚胎干细胞来源的神经元-胶质细胞共培养物进行慢性低频刺激和直流刺激范式,以模拟中枢神经系统损伤。培养的胶质细胞分化为O4 +少突胶质细胞和GFAP +星形胶质细胞,NMDA受体亚基NR2A、脑源性神经营养因子(BDNF)和ras相关蛋白RAB3A转录本上调,表明电刺激可以改变神经元网络的可塑性。有关主要tDCS研究结果的进一步摘要,请参阅其他资料[55].研究表明,低强度短暂tDCS可增加培养的小鼠星形胶质细胞的葡萄糖代谢[56],高强度阳极和阴极tDCS激活小胶质细胞[57].在他们自己的实验中,盖尔纳等人.将成年雄性大鼠暴露于20分钟的阳极tDCS中,观察到小胶质细胞和星形胶质细胞的形态变化[55].他们的研究还表明,变形虫小胶质细胞可能更容易受到tDCS的影响,因为它们具有更高丰度的电压门控离子通道。
另一项有创直流刺激研究利用单相刺激范式对大鼠背角c纤维进行刺激[58仅仅是对这些纤维的刺激,即使没有任何神经损伤,也足以激活小胶质细胞(上调的Iba1, IL6等),使动物对疼痛敏感。直流电场也被证明是背根神经节神经元神经突延伸的有益的指导性机制,电刺激的雪旺氏细胞有助于提高神经营养素的水平[59].是否有可能通过中枢神经系统中的电刺激胶质细胞来实现类似的轴突再生/神经突延伸,这将是非常有趣的。
在一个更简单的实验中,Kearns等人展示了巨噬细胞系的短期直流刺激如何诱导具有M1和M2表型特征的标记物的表达[50].M1和M2,分别被称为“经典”和“替代”表型,描述了巨噬细胞如何在促炎和抗炎之间过渡。这个术语也被应用于小胶质细胞[60,61],并已在其他刺激的背景下使用。在中枢神经系统中,M1小胶质细胞与神经毒性和细胞死亡有关,而M2小胶质细胞被评估为发挥神经保护作用[62].过去几年的大量争论表明,小胶质细胞(实际上还有外周巨噬细胞)并不能很好地符合促炎/抗炎的二分法(甚至是二元滑动尺度)。相反,小胶质细胞对某种刺激的反应方式是高度相关的;这取决于小胶质细胞在中枢神经系统中的位置,刺激/损伤的性质,感兴趣的小胶质细胞离损伤有多远,以及在损伤期间或损伤后的什么时候观察小胶质细胞。也就是说,之前的研究表明,直流刺激有可能被应用于修饰小胶质细胞活动,以促进组织愈合。
电刺激范例,利用交流特征相正极和负极性。这种模式通常在设计时考虑到电荷平衡——相反的相位提供了一种从任何受影响的细胞或组织中循环电荷的方法,从而避免损伤。在最近的一项研究中,Ishibashi等人发现星形胶质细胞提升双相电脉冲作用下的髓鞘形成[63].细胞因子白血病抑制因子(LIF)被发现由星形胶质细胞大量释放,因为ATP从发射轴突释放-然后发现LIF促进成熟少突胶质细胞的髓鞘形成。在另一项研究中,使用各种平衡和不平衡波形刺激C6胶质瘤细胞,表明电范式的设计方式对细胞氧化应激和神经保护行为有影响[64].
在电针刺激大鼠帕金森病模型的情况下,交流电模式也被用于评估炎症和损伤[65].通过将不锈钢电极插入2个穴位对内侧前脑束横切的大鼠进行电刺激:一个在头部(两耳之间),另一个在脊髓的颈部。这些电极是否与中枢神经系统组织直接接触尚不清楚。在这项研究中,双相电刺激保护多巴胺能神经元免受小胶质细胞介导的细胞毒性损伤。研究发现,有电刺激的多巴胺能神经元的存活率高于没有电刺激的多巴胺能神经元的存活率——这与刺激显著减少TNFα和IL1β释放以及小胶质细胞激活的观察相结合。
另一种利用电荷平衡双相波形的应用是椎管内微刺激(ISMS),这是一种功能性电刺激技术,使用微线(直径数十μm)植入脊髓,在脊髓损伤后诱导下肢运动。该技术已被广泛证明可有效地诱导脊髓横断后的运动[66,67]并且,在撰写本文时,正在临床试验中进行评估。然而,ISMS范式对神经胶质细胞的作用似乎仍然有限。Bamford等人的一项研究为作者提供了关于这一问题的唯一已知证据[33].微丝被活性星形胶质细胞包围,微丝周围发现CD68 +细胞,这表明小胶质细胞/巨噬细胞招募和胶质细胞瘢痕形成。刺激后力量的招募没有改变,这表明没有足够的组织损伤来损害潜在的神经网络。刺激列车每天运行4小时,持续30天;在更长期的时间过程中,对神经胶质反应性和力量招募的进一步研究将有助于确定在由于神经胶质瘢痕导致设备故障之前,植入物设计在脊髓中的最大寿命。
细胞方向相对于电场方向的差异已被注意到作为直流和交流范例之间的一个对比点。虽然胶质细胞的方向(平行或垂直于场)已被记录,并且在直流场中是可预测的[49], AC刺激并没有以一致的方式指导迁移方向[68].有趣的是,Ariza等人还发现,暴露在直流场刺激下的神经干/祖细胞(NSCs)更倾向于分化成神经元而不是胶质细胞,而AC刺激并不倾向于分化成一种细胞类型[48].这一观察结果将对在受损神经系统中指导神经元生长/修复的设计策略产生影响。
体外和体内工作的注意事项
最后,还应注意设计体外和体内电刺激实验的创造性方法,以及由此产生的与神经胶质细胞反应性有关的输出。
Bertucci等人对明确评估神经胶质细胞对电刺激反应的体外实验进行了很好的总结。[69].简单地说,这些实验从极化、细胞形态、细胞突起长度和细胞体大小等方面描述了胶质细胞的反应。综述中列出的实验时间间隔规定了最长24小时的刺激间隔,然后进行最长48小时的刺激后监测。有了这样的实验,确定神经胶质细胞的反应超过24小时的时间窗口将是有趣的;例如,在类似的模型中发生胶质瘢痕/细胞死亡的时间过程是什么?重复(例如每天)的电刺激会如何改变这些现象?如果这些问题得到解决,未来任何研究神经胶质细胞对电刺激反应性的体外实验都将更好地模拟慢性反应。
细胞培养系统也被开发用于研究神经元-神经胶质对电刺激的反应。Lee等人利用微流体系统创建空间受限的细胞培养物,然后接受电刺激[70].他们的研究显著地表明,暴露在电场中,少突胶质细胞更有效地成熟和成髓鞘神经元。在Xu等人的实验中,电刺激电纺聚吡咯/聚丙烯腈纳米纤维制成的皮质3D培养物[34].电刺激阻止了细胞团块/簇的形成,但它并没有分散已经形成的团块。电刺激还能增加神经胶质细胞的增殖程度,加速神经元的成熟。在另一项研究中,由聚(l -乳酸-羟基乙酸)/氧化石墨烯组成的纳米复合膜与神经干细胞一起培养,作为用于电刺激神经修复的候选复合材料[71].底物促进了神经干细胞的增殖和向神经元的分化(以向星形胶质细胞分化为代价),以及神经突的延伸。
在脊髓损伤(SCI)体内研究中,中枢神经系统中现有胶质细胞的电刺激导致损伤后1周GFAP表达增加(即星形胶质细胞肥大增加)[72,73].通过电刺激预处理SCI大鼠,星形胶质细胞被激活,但水肿和坏死等继发症状减轻。短时间的电刺激也被发现有利于神经元再生。水蛭模型被用来检查电刺激对神经元的影响[74].不同的神经元(Retzius和P细胞)对相同的电刺激模式有不同的反应,但无论使用哪种模式,每次在刺激电极周围都能看到更多的水蛭小胶质细胞,这意味着神经元再生至少部分是由于小胶质细胞的分布和活性。
设备开发
材料和电化学方面的考虑
除了理解如上所述的电刺激对神经胶质细胞行为的影响之外,还必须承认神经电极植入物的工程和设计方面。就有创神经电极植入物的发展而言,需要考虑的因素包括电极材料的选择、刺激模式和电极的几何形状。这些考虑因素的详细文档和更多内容可以在Merrill等人的综合摘要中找到。[75].神经组织损伤来自机械(组织/设备不匹配和插入损伤)和电化学手段。
从安全角度考虑,电极材料的选择很重要。不用说,应该使用导电材料;然而,其他考虑因素包括潜在的材料腐蚀、离子浸出、降解和电化学反应的副产物形成。一种导电材料降解并将有毒副产物浸出到其目标环境中,将不可避免地引起植入物排斥反应,并加剧植入部位的炎症和损伤。
常见的电极材料有铂、铱、金和硅。碳基材料(如石墨烯、碳纳米管)和有机材料(如聚苯胺、聚(3,4-乙烯二氧噻吩))最近也在文献中有所描述[29,31,76,77,78,79].一般认为,这些材料在中枢神经系统组织中使用是相容和安全的[80].然而,上面列出的材料通常会引起胶质细胞的异物反应——也就是说,胶质细胞增生会随之而来,并形成包裹植入物的疤痕。这种反应的程度部分取决于材料的刚度——对于较硬的材料,如金属,植入物和组织之间的机械不匹配进一步加剧了微运动诱导的应力。这些材料本身通常是惰性的——它们本身不会将细胞毒性颗粒渗到周围的组织中。电刺激是否会在界面处产生产生细胞毒性化合物的电化学反应取决于构成植入物的材料以及范例本身的参数[75,81].在文献中,评估胶质细胞反应性的常用方法包括细胞因子释放/表达[79],细胞活力[82],形态比较(例如小胶质细胞的分枝形与变形形形态)[83],以及探针的小区面积覆盖[84].
美林等人。[75]解释并比较了不同刺激波形在动作电位启动概率、组织损伤和腐蚀风险之间的权衡。刺激模式设计也必须考虑到目标细胞群。由于电极植入物主要针对神经元,接触部位的刺激参数必须对电极植入的组织类型敏感——这将转化为参数的差异,如每相电荷和脉冲宽度[81].
探针的几何形状是很重要的,特别是对于植入物的插入。探针应该足够坚硬,便于插入组织,但也不能太硬,导致组织/设备不匹配成为问题[85].另一种有趣的做法是,一些研究已经成功地将PEDOT等新材料原位聚合,与神经组织形成集成网络[86从而有效地模糊了设备和组织之间的边界。其结果是形成了一个遍布局部细胞外空间的导电网络,达到了可以避免疤痕组织和可以接触健康神经元的程度。
电化学方面的考虑也与器件材料的选择有关。如果电刺激模式导致化学物质的氧化或还原,特别是在电荷在电极和电解质之间传递的法拉第反应中,最好添加一个相反的平衡相来逆转可能发生的任何反应。除了涉及电极材料的氧化还原反应外,周围电解质中的其他化学物质也可能受到电刺激的影响。一个经常讨论的主题是需要避免水分裂成氢气和氧气的组成物种(即保持电压在水窗口内)。产气会导致电极附近pH值的局部变化,对细胞产生不利影响[87].在同一篇论文中,有机化合物也被认为容易发生氧化还原反应(例如,葡萄糖氧化为葡萄糖酸,CO2).在刺激脉冲过程中也会发生氧还原[88].氧的减少会对组织造成损害。在体外(不同的细胞培养基配方)和体内(细胞外液),电刺激可能衍生出更多的化学物质[75,87].
结论
对今后工作的考虑
在本综述中调查的文献中,关于上述研究中探索的输出,出现了共同的主题(表2)1).虽然有几篇论文表明电刺激对神经胶质细胞是一种诱导炎症的作用,但其他论文利用电刺激的角度认为,它可以通过使用神经胶质细胞作为中介来促进神经再生和组织愈合。然而,应该谨慎——神经胶质对电刺激的反应方式在很大程度上取决于刺激本身的性质(图2)。2)、应用、中枢神经系统内的目标区域和目标细胞-其复杂性尚待探索。
在过去大约10年的时间里,大量关于侵入性电极生物材料修饰神经组织的文献已经出现和发展。所调查的研究采取了广泛的方法来减轻胶质瘢痕的问题(例如,对基础材料进行机械改性,将生物活性底物偶联到电极表面,插入后进行抗炎治疗)[29].我们建议,这一研究领域需要进一步发展,以开发更有意义的设备,有一天可以看到临床转化-更具体地说,采用生物材料方法调节神经胶质瘢痕形成的研究最终也应该将电刺激整合到拟议的实验中。事实上,许多这类设备的主要功能就是将电流输送到组织中。因此,有兴趣知道,例如,是否有任何电化学活性的差异,在电极-组织界面周围的生物材料的修改,可能会对这种设备的生物相容性产生负面影响。此外,频繁的电刺激会使这些电极退化并导致它们的结构变弱或失效吗?目前对电极-组织界面上发生的电化学反应范围的了解有限,但可以使用Cogan关于神经电极表征的综述中概述的方法(例如循环伏安法,电阻抗谱,电压瞬态测量)[81].还要考虑香农方程所概述的刺激诱导损伤的阈值[89],以及生物体中其他可能导致对植入物产生炎症反应的加重因素:植入物被拴在相对固定的表面(例如头骨),电极线微动等。
任何未来的体内和体外电刺激研究都将在刺激(用于监测细胞反应)和多轮刺激进入实验后实施延长时间的过程中增加价值。预计多轮刺激将更能反映预期频繁(每日)使用外源电流的临床应用,并且体外和体内模型显示这将更准确地概括由植入物插入和电刺激引起的任何慢性细胞或组织反应。
不同电刺激参数对中枢神经系统细胞的影响还有待进一步研究。由于神经元在中枢神经系统中具有不同的形状和大小,因此设计/引用定制的范例来刺激中枢神经系统中特定的神经元组是一种最终的结果。同样令人感兴趣的是由于刺激参数的差异(例如AC/DC,不同的电荷平衡方案,电流振幅,频率,脉冲宽度,占空比,间相延迟等)而导致的胶质细胞反应性的任何变化;中枢神经系统中胶质细胞异质性的证据进一步加剧了这一情况[47].更深入地了解上述因素将为开发新型电极和增产设计打开大门。这将降低神经胶质细胞的反应性,并转化为更持久(和更有效)的植入物。
数据和材料的可用性
数据共享不适用于本文,因为在当前的研究中没有生成或分析数据集。
缩写
- 交流:
-
交流电
- 一种蛋白激酶:
-
蛋白激酶B
- ATP:
-
三磷酸腺苷
- 脑源性神经营养因子:
-
脑源性神经营养因子
- CD68:
-
分化簇68
- 中枢神经系统:
-
中枢神经系统
- 潮湿:
-
损伤相关分子模式
- 星展银行:
-
深部脑刺激
- DC:
-
直流电
- ee:
-
硬膜外电刺激
- GFAP:
-
胶质纤维酸性蛋白
- HFS中:
-
高频刺激
- Iba1:
-
离子钙结合接头分子1
- 摘要意思β:
-
白介素- 1β
- 白细胞介素6:
-
白介素- 6
- 主义:
-
脊柱内的microstimulation
- 生活:
-
白血病抑制因子
- 国家安全委员会:
-
神经干细胞
- PEDOT:
-
材料间是的运动)
- Pi3:
-
磷脂酰肌醇3
- 科学:
-
脊髓损伤
- tDCS:
-
经颅直流电刺激
- 肿瘤坏死因子α:
-
肿瘤坏死因子α
- TTX:
-
河豚毒素
参考文献
多诺霍JP。连接大脑与世界:神经接口系统的视角。神经元。2008;60:511-21。
Hatsopoulos NG, Donoghue JP。神经界面系统科学“,”神经科学,2009;32:249-66。
Cotter DR, Pariante CM, Everall IP。主要精神疾病中的神经胶质细胞异常:证据和意义。Brain Res Bull. 2001; 55:585-95。
Geloso MC, Corvino V, Marchese E, Serrano A, Michetti F, D 'Ambrosi N.小胶质细胞在ALS中的双重作用:机制和治疗方法。前沿衰老神经科学,2017;9:242。
小胶质细胞和衰老的大脑:衰老的小胶质细胞是神经退行性变的关键吗?神经化学杂志2019;151:676-88。
李志强,李志强,李志强。小胶质细胞在阿尔茨海默病中的作用。前沿衰老神经科学2019;11:233。
John GR, Lee SC, Brosnan CF.细胞因子:神经胶质细胞激活的强大调节因子。神经学家。2003;9:10-22。
李志强,李志强,李志强,等。小鼠星形胶质细胞离子通道的研究。神经科学杂志,1987;7:101-9。
巴尔英航。胶质离子通道。神经生物学杂志。1991;1:354-9。
Bevan S, Chiu SY, Gray PTA, Ritchie JM。大鼠培养星形胶质细胞中电压门控钠、钾和氯通道的存在。生物化学学报,1985;25(2):349 - 349。
Gautron S, Dos Santos G, pto - henrique D, Koulakoff A, Gros F, Berwald-Netter Y.神经胶质电压门控钠通道:细胞和组织特异性mRNA表达。中国科学:自然科学,2001;
Sontheimer H, Fernandez-Marques E, Ullrich N, Pappas C, Waxman S.星形胶质细胞Na+通道是维持Na+/K(+)- atp酶活性所必需的。中华神经科学杂志,1994;
Sontheimer H, Black JA, Waxman SG。神经胶质细胞电压门控钠离子通道的性质和可能功能。神经科学1996;19:325-31。
陈晓明,陈志伟,陈志伟,等。神经胶质细胞功能:细胞外K+浓度的主动控制。Brain Res. 1972; 43:437-43。
谢佩西,马诺切赫里安O,巴赫勒S, Deierborg .双向小胶质细胞神经元通信在健康与疾病。前沿细胞神经科学。2018;12:323。
Casali BT, Reed-Geaghan EG;发育过程中的小胶质细胞功能与调节。内稳态与阿尔茨海默病细胞。2021;10:957。
A Nimmerjahn F Kirchhoff F Helmchen 2005静息小胶质细胞是大脑实质的高度动态监控器308
离子通道活性对小胶质细胞行为的调节。中华神经科学杂志,2005;
王志刚,王志刚。离子通道和受体对小胶质细胞功能的影响。神经科学,2019;42:278-92。
周敏,李佳杰,周敏。星形胶质细胞离子通道对稳态和神经元-胶质细胞信号通路的影响。神经科学杂志,2015;35:13827-35。
McNeill J, Rudyk C, Hildebrand ME, Salmaso N.星形胶质细胞的离子通道和电生理特性:紧急刺激技术的意义。神经科学学报。2021;15:644126。
格拉-戈麦斯,索萨,平托,奥利维拉。星形胶质细胞钙升高的功能作用:从突触到行为。前沿细胞神经科学。2018;11:427。
Vedam-Mai V, van Battum EY, Kamphuis W, Feenstra MGP, Denys D, Reynolds BA,等。深部脑刺激和星形胶质细胞的作用。Mol精神病学,2012;17:124-31。
Salatino JW, Ludwig KA, Kozai TDY, Purcell EK。大脑中植入电极的神经胶质反应。中国生物医学工程学报,2017;
Polikov VS, Block ML, Fellous J-M, Hong J-S, Reichert WM。长期植入中枢神经系统神经电极周围神经胶质瘢痕的体外模型。生物材料。2006;27:5368 - 76。
Spencer KC, Sy JC, Falcón-Banchs R, Cima MJ。三维体外神经胶质瘢痕模型研究神经植入物周围微运动的局部应变效应。实验室芯片。2017;17:795-804。
田丽玲,吴峰,唐晓梅,尹永强,张晓明。丝作为减少脑穿透电极周围胶质瘢痕的多功能生物材料衬底。科学通报。2013;23:3185-93。
栾玲,魏晓霞,赵泽,西格尔·JJ, Potnis O, Tuppen CA,等。超柔性纳米电子探针形成可靠的,胶质无疤痕神经集成。科学通报2017;3:e1601966。
徐超,柯国强,马宗华,KG。生物材料和神经胶质:调节神经炎症的设计进展。生物学报,2019;83:13-28。
马贺佳,王彤,陈晓明,王晓明,等。混合金刚石/碳纤维微电极可实现多模态电/化学神经接口。生物材料。2020;230:119648。
格里菲斯RW,汉弗莱博士在恒河猕猴运动皮层长期植入铂电极周围的胶质瘤。神经科学杂志2006;406:81-6。
Harris JP, Capadona JR, Miller RH, Healy BC, Shanmuganathan K, Rowan SJ,等。机械适应性皮质内植入物提高了神经元细胞体的邻近性。神经科学学报,2011;8:066011。
Bamford JA, Todd KG, Mushahwar VK。椎管内微刺激对大鼠脊髓组织的影响。生物材料。2010;31:5552 - 63。
徐强,金玲,李超,库丹纳亚艾,张艳。电刺激对三维纳米纤维支架中皮层细胞的影响。RSC ad2018; 8:11027-35。
Schipke CG, Boucsein C, Ohlemeyer C, Kirchhoff F, Kettenmann h2 +波在大脑切片中的小胶质细胞中引发反应。王志强,2002;16:1-16。
林俊杰,杨晓明,杨晓明,等。atp介导的神经胶质信号通路的研究进展[J] .中国生物医学工程学报,2000;
Roitbak AI, Fanardjian VV。皮层神经胶质细胞对皮层表面电刺激的去极化反应。神经科学。1981;6:2529-37。
Blumenfeld Z, Brontë-Stewart H.帕金森病的高频脑深部刺激与神经节律。神经精神科学,2015;25:384-97。
Orlowski D, Michalis A, Glud AN, Korshøj AR, Fitting LM, Mikkelsen TW,等。深部脑刺激对脑组织的反应——哥廷根迷你猪DBS的纵向研究。神经调节技术。2017;20:417-23。
Bekar L, Libionka W,田国峰,徐强,Torres A,王旭,等。腺苷在脑深部刺激介导的震颤减弱中起重要作用。中华医学杂志,2008;14:75-80。
李志刚,李志刚,李志刚。高频刺激诱发大鼠丘脑腹侧部局部谷氨酸释放。神经科学学报,2010;7:026009。
Etiévant A, Lucas G, Dkhissi-Benyahya O, Haddjeri N.星形胶质细胞在深部脑刺激抗抑郁作用中的作用。9.前细胞神经科学,2016;
Vedam-Mai V, Baradaran-Shoraka M, Reynolds BA, Okun MS.深部脑刺激和微损伤的组织反应的比较研究。神经调节技术。2016;19:451-8。
Silchenko AN,塔斯社记者。脑深部刺激中趋化信号和小胶质细胞在植入部位周围聚集的计算模型。欧洲物理学报。2013;22(2):349 - 349。
陈勇,朱刚,刘东,张旭,刘勇,袁涛,等。丘脑下核深部脑刺激对大鼠帕金森病模型神经炎症的抑制作用《大脑行为学》,2020;90:16-25。
张晓东,张晓东,张晓东,张晓明,等。青春期早期的脑深部刺激可防止母细胞免疫激活模型中的微胶质细胞改变。大脑行为,Immun, 2017; 63:71-80。
刘志刚,刘志刚,刘志刚。微胶质细胞亚型的研究进展。38. Embo j . 2019;
Ariza CA, Fleury AT, Tormos CJ, Petruk V, Chawla S, Oh J,等。电场对海马神经祖细胞的影响。干细胞Rev . 2010; 6:585-600。
Pelletier SJ, Lagace M, St-Amour I, Arsenault D, Cisbani G, Chabrat A,等。直流电刺激下脑细胞的形态和分子变化。中华神经精神药物杂志。2015;18:pyu090-pyu090。
Kearns KR, Thompson DM,巨噬细胞对电刺激的反应。在,。第41届东北生物医学工程会议。特洛伊,纽约,美国:IEEE。2015; 2015:1-2。
Pelletier SJ, Cicchetti F.经颅直流电刺激作用的细胞和分子机制:来自体外和体内模型的证据。中华神经精神药理学杂志。2015;18:pyu047-pyu047。
巴巴T,神田M,安原T,森本T,近藤A,信吾T,等。脑皮质电刺激通过磷酸肌醇3-激酶/Akt信号通路对缺血性卒中大鼠产生抗凋亡、血管生成和抗炎作用中风。2009;40岁。
Colmenárez-Raga AC, Díaz I, Pernia M, Pérez-González D, Delgado-García JM, Carro J,等。硬膜外直流电刺激大鼠听觉皮层诱发的可逆功能改变。前沿神经科学。2019;13:356。
拉查曼·C-FV, Jackson L, Sendi MSE, Tehrani KF, Mortensen LJ,斯蒂斯·SL,等。慢性电刺激促进体外谷氨酸诱导抑制后esc衍生神经元的兴奋性和可塑性。科学通报2018;8:10957。
格尔纳A- k, Reis J, Fritsch B.胶质细胞:在非侵入性直流电脑刺激中被忽视的玩家。10.前细胞神经科学,2016;
黄蓉,彭丽丽,赫兹。低压静电场对星形胶质细胞能量代谢的影响。Bioelectromagnetics。1997;18:77 - 80。
Rueger MA, Keuters MH, Walberer M, Braun R, Klein R, Sparing R,等。多段经颅直流电刺激(tDCS)诱发大鼠脑炎症和再生过程。PLoS ONE。2012; 7: e43776。
Hathway GJ, Vega-Avelaira D, Moss A, Ingram R, Fitzgerald M.简而言之,低频刺激大鼠外周c纤维在成人中引起长时间的小胶质细胞诱导的中枢敏化,但在新生儿中没有。痛苦。2009;144:110-8。
Koppes AN, Zaccor NW, Rivet CJ, Williams LA, Piselli JM, Gilbert RJ,等。外源电刺激促进了电纺聚乳酸纤维的神经突生长。神经工程学报,2014;11:046002
马丁内斯FO,戈登S. M1和M2模式的巨噬细胞激活:时间重新评估。5 . F1000Prime众议员2014;
凯蒂RM。一个两极分化的问题:M1和M2小胶质细胞存在吗?神经科学,2016;19:987-91。
郭松,王辉,尹勇。神经退行性疾病中小胶质细胞从M1到M2的极化。前沿衰老神经科学。2022;14:815347。
石桥T, Dakin KA, Stevens B, Lee PR, Kozlov SV, Stewart CL,等。星形胶质细胞对电脉冲的反应促进髓鞘形成。神经元。2006;49:823-32。
Vallejo R, Platt DC, Rink JA, Jones MA, Kelley CA, Gupta A,等。体外电刺激C6胶质前体细胞差异调节与慢性疼痛通路相关的基因表达。脑科学2019;9:303。
刘晓云,周海峰,潘玉林,梁晓波,牛德波,薛波,等。电针刺激对内侧前脑束横断大鼠炎症介导的多巴胺能神经元的保护作用。神经科学,2004;39(3):389 - 396。
Bamford JA, Mushahwar VK。椎管内微刺激对脊髓损伤后功能恢复的作用。见:大脑研究的进展。爱思唯尔;2011.227 - 39页。
李文杰,李文杰,张文杰,等。椎管内微刺激可使麻醉猫在地上行走。神经科学学报,2016;13:056016。
Ryan CNM, Doulgkeroglou MN, Zeugolis DI。电场刺激在组织工程中的应用。BMC生物医学工程。2021;3:1。
Bertucci C, Koppes R, Dumont C, Koppes A.体外环境对电刺激的神经反应。Brain Res Bull, 2019; 152:265-84。
胡李,Blasiak A, Agrawal DR, Loong DTB, Thakor NV, All AH,等。亚细胞电刺激神经元可增强少突胶质细胞对轴突的髓鞘形成。PLoS ONE。2017; 12: e0179642。
付超,潘松,马勇,孔伟,齐震,杨霞。电刺激联合氧化石墨烯膜对神经干细胞增殖分化的影响。中国生物医学杂志。2019;47:1867-76。
Fujiki M, Kobayashi H, Inoue R, Goda M.电预处理减弱脊髓损伤后进行性坏死和空化。神经创伤杂志2004;21:459-70。
李志强,陈志强,陈志强。电刺激对损伤脊髓可塑性的影响。神经创伤杂志2020;37:1933-53。
柯恒,李志强,李志强。电刺激对水蛭中枢神经系统再生的影响。eneuro。7: eneuro.0030 2020; 19.2020。
Merrill DR, Bikson M, Jefferys JGR。可兴奋组织的电刺激:设计有效和安全的方案。中华神经科学杂志,2005;
陈海燕,陈海燕,陈海燕,李志强,等。纳米多孔金作为神经界面涂层:形貌、表面化学和特征尺寸的影响。计算机应用技术。2015;7:7093-100
Biran R, Martin DC, Tresco PA。当该装置系在颅骨上时,大脑组织对植入硅微电极阵列的反应会增加。中国生物医学工程学报,2007;29(2):366 - 366。
Saracino E, Zuppolini S, Guarino V, Benfenati V, Borriello A, Zamboni R,等。聚苯胺纳米针成静电纺生物活性纤维支撑在体外星形胶质细胞的反应。RSC公告2021;11:11 1347 - 55。
Vallejo-Giraldo C, Krukiewicz K, Calaresu I, Zhu J, Palma M, Fernandez-Yague M,等。微压印技术制备的聚(3,4-乙烯二氧噻吩):对甲苯磺酸(PEDOT:PTS)神经电极上减弱的胶质反应性。小。2018;14:1800863。
杨伟,龚毅,李伟。神经生理记录植入物的电极和包装材料综述。清华大学学报(自然科学版)。2021;8:622923
意识的科幻小说。神经刺激和记录电极。生物工程学报。2008;10:275-309。
Bendali A, Agnès C, Meffert S, Forster V, Bongrain A, Arnault J-C,等。纳米金刚石上独特的胶质和神经元界面。PLoS ONE。2014; 9: e92562。
He W, McConnell GC, Bellamkonda RV。纳米层粘连蛋白涂层调节植入硅微电极阵列周围的皮质瘢痕反应。神经科学学报。2006;3:16 - 26。
Sridar S, Churchward MA, Mushahwar VK, Todd KG, Elias AL.多肽修饰聚酰亚胺绝缘微线:通过减少胶质瘢痕改善生物相容性。生物学报,2017;
刘志强,李志强,李志强,等。神经探针与脑组织界面微运动诱导的动态效应。J微纳米光刻MEMS。2014; 13: 023009。
Richardson-Burns SM, Hendricks JL, Martin DC。活体神经组织中导电聚合物的电化学聚合。神经工程学报,2007;4:L6-13。
布鲁默SB,特纳MJ。铂电极对神经系统安全电刺激的电化学考虑。IEEE生物工程学报。1977;BME-24:59-63。
莫顿SL,达鲁ML,莫蒂默JT。氧还原在神经组织电刺激中的作用。化学工程学报,1994;
Cogan SF, Ludwig KA, Welle CG, Takmakov P.治疗性电刺激的组织损伤阈值。神经工程学报,2016;13:021001。
确认
不适用。
资金
作者感谢加拿大自然科学与工程研究委员会(NSERC)、加拿大创新基金会、艾伯塔省卫生服务机构和戴维脑研究基金会的财政支持。没有一个资助机构在研究设计、数据收集、分析和解释以及撰写手稿方面发挥了任何作用。
作者信息
作者及隶属关系
贡献
CTT对文献进行了调查,撰写并编辑了手稿。PL对文献进行了调查。KVF对文献进行了调查,并在手稿中准备了表格。MAC和KGT编辑并校对了最终的手稿。所有作者均已阅读并批准最终稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
徐克,c.t.,拉尔,P.,福克斯,K.V.R.et al。电刺激对神经胶质细胞行为的影响。BMC生物医学工程4, 7(2022)。https://doi.org/10.1186/s42490-022-00064-0
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s42490-022-00064-0
关键字
- 神经接口
- 小神经胶质细胞
- 星形胶质细胞
- 少突细胞
- 生物相容性
- 电刺激