摘要
背景
冷冻保存的外周血单个核细胞(pmcs)经常被收集,并在临床研究中提供疾病和治疗相关的数据。在这里,我们在pbmc中开发了组合蛋白(40个抗体)和转录单细胞(sc)RNA测序(scRNA-seq)。
结果
在妇女跨机构艾滋病毒研究(WIHS)的31名参与者中,我们对41611个细胞进行了测序。使用布尔门控、Seurat UMAPs(高维数据可视化工具)和Louvain聚类,我们在CD4+ T、CD8+ T、B、NK细胞和单核细胞中鉴定出50个亚群。这种分辨率优于流式细胞仪、大规模细胞仪或无抗体的scRNA-seq。结合蛋白和转录scRNA-seq可以评估转录组和细胞类型比例的疾病相关变化。作为概念证明,我们展示了健康和匹配的艾滋病毒感染者之间的这种差异,有和没有心血管疾病。
结论
综上所述,结合蛋白质和转录scRNA测序是一种适用于临床研究的有效方法。
背景
pbmc是疾病和治疗相关信息的丰富来源[6,19,36,48,57,76,84,85,86].pmcs可以在没有机械或酶解的情况下进行分析,已知机械或酶解可以改变细胞表面标记物和转录组[79].pmcs可以低温保存而不丧失活力。在最基本的层面上,通过使用自动细胞计数器(血细胞计数器,CBC)从形态学上区分淋巴细胞和单核细胞[7].目前的做法是同时使用8到30个标记的流式细胞术[41,46,51,60,64]甚至用光谱细胞仪检测43个标记[66].大规模细胞术[2,23,71,80]允许分析多达50个标记,但没有转录组[23,61].单细胞RNA测序(scRNA-seq)可以查询表达基因[17,45,53,72,87]和表面标记(转录表位测序的细胞索引,CITE-Seq) [67,72,87].
在免疫细胞中,在大多数情况下,mRNA与任何给定表面标记物的表面表达之间的相关性很弱[42,67].哺乳动物免疫细胞中mRNA和蛋白质水平的相关性约为40% [69].这是因为细胞表面表达不仅由基因表达决定,还由翻译后蛋白质修饰决定[43],转运到细胞表面,蛋白质稳定性和蛋白水解修饰。mRNA的捕获效率并不完美,mRNA的缺失进一步削弱了基因与表面蛋白的相关性[87].流式细胞术已经确定了pbmc中的细胞类型,并且主要细胞类型的表面标记物是众所周知的。然而,通过scRNA-seq甚至很难判断主要的细胞类型。例如,CD4+ T细胞不能从CD8+ T细胞和自然杀伤(NK)细胞中分解[83].为了利用在流式细胞术和大规模细胞术方面的广泛知识和大量文献,有必要评估细胞表面表型以及转录组。
目前,只有两篇文章报道了动脉粥样硬化患者的单细胞转录组和蛋白质(抗体)。第一个[19]包括人颈动脉内膜切除术标本和匹配的pbmc,其中10x Genomics 3 '和CITE-seq分析了来自一名患者的1652个pbmc(没有来自健康对照组的pbmc) [53,72],使用21个寡核苷酸标记抗体面板。第二篇论文用10x基因组学和11个寡核苷酸标记抗体组分析了来自移植心脏的人颈动脉。它主要针对平滑肌细胞和纤维肌细胞,而不是免疫细胞[81].最近的一项研究报告了HIV感染对PBMC转录组的影响[33],重点关注急性HIV感染(在抗逆转录病毒治疗开始之前),并报告了4名患者在8个确定的时间点的PBMC转录组(平均每个参与者和疾病有1976个PBMC转录组)。目前还没有关于慢性HIV感染者外周血单核细胞的scRNA-seq或CITE-seq研究报道,也没有关于HIV与心血管疾病(CVD)相互作用的单细胞研究。
在这里,我们使用靶向scRNA-seq BD Rhapsody平台报告了近42,000个pmcs的转录组和细胞表面表型[17,45同时在同一细胞中提供单细胞表面表型(40个单克隆抗体,单克隆抗体)和转录组(485个免疫和炎症转录本)。作为概念证明,我们从WIHS心血管亚研究中发现,健康受试者与感染艾滋病毒或患有心血管疾病的匹配受试者之间的细胞比例和细胞转录组存在显著差异。WIHS是一项正在进行的多中心、前瞻性、观察性队列研究,研究对象是艾滋病毒感染或有感染风险的妇女。pmcs在N液上冷冻保存2,遵循严格的标准操作程序,确保细胞表面表型、活力和转录组的保存。
方法
研究特征和样本选择
妇女跨机构艾滋病毒研究(WIHS)于1994年在美国6个(现已扩大至10个)地点启动[25,28].这是一项正在进行的前瞻性研究,涉及4000多名感染艾滋病毒或有感染风险的妇女。WIHS的招募工作分四个阶段(1994-1995年、2001-2002年、2010-2012年和2013-2015年),分别来自艾滋病毒初级保健诊所、以医院为基础的项目以及社区外展和支持团体。简单地说,WIHS包括半年一次的随访,在此期间,参与者进行类似的详细检查、标本收集和结构化访谈,评估健康行为、病史和药物使用。所有参与者都提供了知情同意,每个站点的机构审查委员会批准了这些研究。
当前分析的所有参与者都是WIHS内嵌套的血管子研究的一部分[25,28,32].血管亚研究的基线随访发生在2004年至2006年之间,平均7年后进行随访。参与者接受高分辨率b型颈动脉超声成像右侧颈动脉的六个位置:颈总动脉的近壁和远壁、颈动脉分叉和颈内动脉。所有地点均采用标准化协议[32],颈动脉局灶斑块的测量,亚临床动脉粥样硬化的标志,是在中央阅读中心(南加州大学)获得的。亚临床CVD (sCVD)的定义是基于存在一个或多个颈动脉病变[32].
从最初的1865名WIHS血管亚研究参与者中,挑选了32名参与者进行scRNA-seq分析。sCVD定义为在任何一次血管亚研究访问中存在颈动脉局灶性斑块,以定义四组参与者,每组8人:HIV -、HIV+CVD -、HIV+CVD+和HIV+CVD+降低胆固醇治疗(CRT)。由于我们对HIV感染和sCVD与不同细胞亚型的表面标志物和RNA表达的联合关系感兴趣,我们基于HIV、sCVD和CRT(主要是他汀类药物)选择了匹配的样本(附加文件)1:图S1)。之所以进行后者是因为我们发现CRT对单核细胞转录组有重大影响[16].采用酶联免疫吸附试验(ELISA)检测HIV感染情况,Western blot检测。自我报告有冠心病或目前正在使用降脂治疗的非scvd参与者被排除在外。参与者按种族/民族(除一组外)、基线血管亚研究年龄(±5岁)、就诊次数、吸烟史和标本采集日期(1年内)组成四组(除一组年龄差异较大但均为绝经后的四组外)。
采用标准化方案对同一研究访视的人口学、临床和实验室变量进行评估。基线研究访问的中位年龄为55岁,96%的参与者为黑人或西班牙裔。大多数(86%)报告有吸烟史。药物使用非常普遍,43%的HIV+和50%的HIV -参与者报告有注射吸毒史;吸食快克、可卡因或海洛因的;或饮酒(每周≥14杯)。在HIV阳性参与者中,超过80%的人报告在获得pbmc时使用了高效抗逆转录病毒疗法(HAART), 59%的人报告检测不到HIV-1 RNA水平。无sCVD的HIV+女性中位CD4+ t细胞计数为585 cells/μL (IQR 382-816),有sCVD的HIV+女性中位CD4+ t细胞计数为535 cells/μL (IQR 265-792)。从现在开始沿着文本,sCVD将被称为CVD。
用于CITE-seq的PBMC样品制备
为了避免批次效应,在同一天分别处理了16个样品。PBMC管在37°C水浴中解冻,管中填充8 mL完整的rmi -1640溶液(crpsi -1640),其中含有人血清白蛋白、HEPES、丙酮酸钠、MEM-NEAA、青霉素-链霉素、谷氨酰胺和巯基乙醇。主要试剂、生产商和目录编号列在附加文件中1:表S1。试管在400 ×g下离心5分钟,球丸在冷染色缓冲液(2%胎牛血清(FBS)在磷酸盐缓冲盐水(PBS)中)中重悬。手工细胞计数(台盼蓝溶液,0.4%)通过稀释细胞浓度来实现每个血细胞计计数100-400个细胞。细胞计数为100万个,用Fc Block试剂在冰上培养(BD Biosciences,附加文件)1:表S1)以1:20稀释,400 ×g离心5分钟,在180 μL染色缓冲液中重悬,转移到各自的样品多路氧化试剂盒管中(BD Biosciences)。细胞在室温下孵育20 min,转移到5 ml聚苯乙烯管中,洗涤3次,400 ×g离心5 min。细胞在400 μL染色缓冲液中重悬,每管中加入2 μL 0.3mM DRAQ7和2 μL 2mM Calcein AM。使用BD Rhapsody扫描仪测定每个试管的活力和细胞计数(附加文件1:表S2)。试管内容物按等比例混合,总细胞计数不超过100万个细胞。然后将试管在400 ×g下离心5分钟,并重新悬浮在40个寡核苷酸标记抗体的鸡尾酒中(在附加文件中列出)1:表S3)(每种抗体2 μL和染色缓冲液20 μL),按制造商的建议在冰上放置30-60分钟。然后用2 mL染色缓冲液清洗试管,然后在400 ×g下离心5分钟。重复两次,总共清洗3次。然后使用扫描仪再次计数细胞,并将其装入Rhapsody纳米孔板(每个板4个样本)。
图书馆准备
按照BD用户指南将细胞以800-1000个/μL的速度加载到底漆板中。用磁铁将珠子分离,并除去上清。在37°C的温度下,在1200转/分钟的温度下,在恒温器上进行逆转录20分钟。外切酶I在37°C的温度下,在1200转/分钟的温度下孵育30分钟,然后立即放在80°C的热块上,20分钟。将试管放在冰上,去除上清液,同时将珠珠放在磁铁上。珠子在BD珠子重悬液中重悬。试管在4°C保存,直到进一步加工。
根据BD的协议,用于PCR1的试剂包括BD人类免疫反应小组和约100个基因的定制小组(附加文件)1:表S4)添加到珠子中。将样品倒入条状PCR管中,按照BD的PCR1方案孵育10个周期。在PCR产物中加入0.7×体积的AMPure XP SPRI珠,进行双尺寸选择,去除高基因组DNA片段。孵育后,回收上清液并转移到新管中,再加入100 μL AMPure XP珠对上清液进行纯化。用30 μL BD洗脱液洗脱珠上的内容物,然后转移到1.5 ml管中。
测序前质量控制(QC)
根据BD的用户指南,每个试管有12个PCR循环。用AMPure XP珠在0.8X的mRNA和1.2X的样本标签下清洗试管。在80%乙醇的清洗过程中,每个样品进行两次200 μ l的洗涤。cDNA用BD洗脱缓冲液洗脱。采用Agilent TapeStation高灵敏度D1000筛选胶带和Qubit双链高灵敏度DNA检测试剂盒进行质检和定量。如果需要,将mRNA稀释至1.2-2.7 ng/μL,如果需要,将来自PCR2的抗体和样本标记库稀释至0.5-1.1 ng/μL。根据BD用户推荐的方案和列出的循环次数,从每个样品中添加3 μL到47 μL的PCR3试剂中,除了AbSeq,它有9个PCR循环,这是由之前的优化确定的。然后用AMPure XP珠子以0.7X的AbSeq和0.8X的样本标签清洗三个库。样品用200 μL 80%乙醇洗涤2次。cDNA用BD的洗脱缓冲液从珠子上洗脱。 Final QC and quantification was performed using TapeStation and Qubit kits and reagents.
测序
将样本集合并按照BD推荐的标称深度进行测序:n× 1000读取每个单元格,其中n是使用AbSeq的复杂度;mRNA:每细胞20,000个reads;示例标签:每个单元格600个读取。因此,在NovaSeq测序中,每个细胞总共需要60600个reads。对S1和S2 100周期试剂盒(Illumina)进行了优化,配置为67 × 8 × 50 bp,样品、池化和测序深度的规格以及加载到每个板上的细胞数量。一旦测序完成,BD生成一个FASTA文件,作为我们的AbSeq和我们用这些分析靶向的基因的参考。将NovaSeq生成的FASTA文件和FASTQ文件上传到Seven Bridges Genomics管道,在那里过滤数据并生成矩阵和csv文件。该分析生成了54,078个细胞(496个基因,40个抗体)的转录组草稿和表面表型。11个基因未表达,剩下485个基因待分析。
紧身上衣删除
基于每个板使用的4个样本标签,去除了8359个双重结构。剩余的45,719个细胞使用R (https://github.com/chris-mcginnis-ucsf/DoubletFinder),使用预设的双态形成率(7.5%)。这又除去了3322个双偶,剩下42,397个cell。最后,我们删除了所有小于128 (27)抗体分子测序。这去除了786个噪声细胞,得到了41611个细胞转录组。所有抗体数据均采用CLR(居中对数比)归一化并转换为对数2规模。所有转录本通过每个细胞中的UMIs总数归一化,并放大到1000。
阈值
初步实验表明,正如预期的那样,每种抗体都具有特异性和非特异性结合。为了去除非特异性信号,为每个表面标记的表达式获得一个分离噪声的阈值,如下所示(附加文件1:表S5)。主要细胞类型中每个表面标记的表达密度图(Ridgeline图)用于定义已知负细胞群中的信号,或通过重叠正态分布的反褶积(我们使用“normalmixEM”函数来反褶积R包“mixtools”中的重叠分布)。然后将两个高斯分布的交点设置为抗体的最小表达阈值,将低于阈值的表面表达值设置为零。在结合蛋白和转录板单细胞测序中,非特异性背景染色是由于不完整的Fc区块和寡核苷酸标记的抗体被困在纳米阱中[72]以及不正确的滴定。一些抗体,如大多数趋化因子受体抗体,有固有的背景。抗体浓度的调整改善了信号,降低了背景[8].每个主要细胞类型的阈值蛋白表达的山脊线图显示在附加文件中1:图S2A,其中显示了阈值如何对每个蛋白表达起作用。根据图S2A、CCR7 (CD197)抗体数据未纳入分析。
聚类
在基于抗体聚类数据之前,我们确保使用Harmony包对数据进行了批量校正。为了准备数据进行聚类,我们首先使用UMAP(均匀流形近似和投影)降低数据的维数[1]来可视化集群。UMAP是一种流形学习技术,它通过降低数据的维数来帮助在高维空间中找到数据所在的潜在空间。它是一种用于可视化的降维技术。我们使用鲁汶聚类[3.],以便对数据进行聚类。决定聚类质量的参数“分辨率”,B细胞设为0.8,CD4+ T细胞设为1.0,CD8+ T细胞设为1.3,经典单核细胞设为0.5,中间单核细胞设为0.4,非经典单核细胞设为0.4,NK细胞设为0.3。每个主要细胞类型的亚聚类是基于所有非阴性抗体(附加文件1:表S6)。门被覆盖并用于所有后续的UMAP图(附加文件中每个集群中的单元格号)1:表S7)。
集群的任务
聚类只用抗体来完成。在CD4+ T细胞中,根据CD11c、CD56、CD25、CD127、CXCR3和CCR2的表达进一步划分了4个初始聚类。CD8+ T细胞有两个簇,根据CD11c、CD16和CXCR3蛋白表达进行划分。分别从经典单核细胞和中间单核细胞中分别根据CD163和CD152的表达进一步划分一个簇。在非经典单核细胞中,一簇CD36和CD152表达差异,并分为两组。在B细胞中,有一簇细胞因CD25和CXCR3在簇内表达差异而分裂。最后,由于CD16、CD56和CD11c的表达,NK细胞中的两个簇被分裂。
比较不同类型参与者的基因表达
为了确定四种类型参与者之间的差异表达(DE),我们在Seurat包中运行了Wilcoxon秩和检验[73],没有超过avg_logFC的阈值,两个被比较群体所需的最小细胞分数,两组中表达某一特征的最小细胞数和最小细胞数。我们过滤了调整后的p与HIV−、HIV+CVD−、HIV+CVD+、HIV+CVD+CRT+比较< 0.05。从这些数据中,利用r的ggpubr包生成点图p-value (Bonferroni校正)< 0.05的阈值和pct.1(第一组检测到特征的细胞百分比)的值> 0.2。显著差异表达基因(确切p-values)为每个主要单元格类型显示在附加文件1:表S8。
比较细胞比例
为了发现比例的变化,我们确定了每个集群中每个参与者的单元格号(附加文件1:表S9)。细胞比例的统计差异由对数比值比计算,定义为p/(1−p),p为细胞比例,其次为四组间的方差分析和Tukey多元比较检验。为清晰起见,数据以单元格百分比表示。
相关分析
我们使用Spearman秩相关和显著性(R包)将每个抗体与其对应的基因进行关联。对于基因-抗体的每一种组合,我们丢弃了抗体值低于相应阈值的细胞以及基因计数为零的细胞。经过这种过滤,任何基因抗体组合,有10个或更少的细胞被认为是不重要的。最后,所有不显著的(p-value > 0.05)被指定一个标称值为零作为斯皮尔曼秩相关系数,我们只选择那些至少有一个相关系数≥0.25或系数≤- 0.25的基因或抗体。所有显著的非负相关均在附加文件中报告1:表S10。
随机森林分析
实施了机器学习(ML)方法来识别区分疾病组的基因。为了实现这一目标,随机森林(RF)模型[37,40]用每个条件随机选择的1000个细胞的归一化基因表达进行训练,并计算基因的不同重要度得分。这个过程重复了15次迭代,每次迭代的重要性得分被缩放到0-100。得分越高,对疾病组的分类能力越强。
结果
基于表面标记物表达的主要细胞类型的鉴定
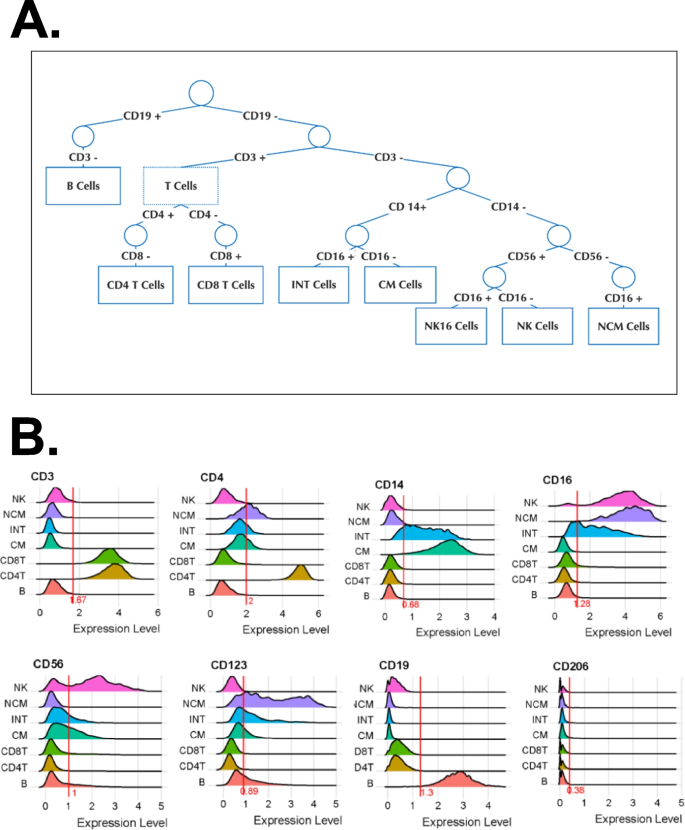
为了鉴定主要的已知细胞类型(图。1A),我们使用CD3, CD4, CD8, CD14, CD16, CD19, CD56, CD123和CD206的山脊线图。这种方法定义了(图。1B):
B细胞:CD19+ CD3−
T细胞:CD19−CD3+
CD4+ T细胞:CD4+ CD8−T细胞
CD8+ T细胞:CD8+ CD4−T细胞
单核细胞(M): CD19−CD3−CD56−
经典(CM): CD14+CD16−
中间(INT): CD14+CD16+
非经典(NCM): CD14−CD16+CD56−
NK细胞(NK): CD4−CD56+ CD14−CD20−CD123−CD206−
一个门控系统可以识别主要的免疫细胞类型B山脊线图来识别阈值,C主要细胞类型的基于抗体的UMAPDNK细胞和B细胞umap的年龄预测(高于和低于中位年龄,49岁)。对32名WIHS参与者的pbmc进行标签标记,并用40种寡核苷酸标记抗体进行染色。主要免疫细胞类型为umap - louvain -聚类,表面表达CD3、CD19、CD14、CD16、CD20、CD56、CD123和CD206。然后,每一种主要的已知细胞类型都被所有非阴性表面标记物分别聚成umap - louvain。经典单核细胞(CM)形成7个簇,中间单核细胞(INT) 3个簇,非经典单核细胞(NCM) 3个簇。CD4+ T细胞形成13个簇,CD8+ T细胞形成14个簇。NK细胞形成3个簇,B细胞形成7个簇。每个UMAP中表示集群的数量。绿色:中位数以上,红色:中位数以下
结果是2835个B细胞,11019个CD4+ T细胞,10865个CD8+ T细胞,5145个CM, 995个INT, 475个NCM和1801个NK细胞。然后,每种主要的细胞类型分别重新聚类,使用Seurat [73],利用Louvain聚类构建高维数据可视化的有效工具UMAPs(图。1C).与流式或大规模细胞术一样,我们仅在抗体染色上聚类。这“保存”了转录组,用于研究疾病和治疗相关的变化。使用这种方法,我们鉴定出13个CD4+ T细胞亚群、14个CD8+ T细胞亚群、7个CM亚群、3个NCM亚群、3个INT亚群、7个B细胞亚群和3个NK细胞亚群(图2)。1C).将每个参与者的年龄投影到主要细胞类型umap上,以研究该变量对结果的可能影响。在CD4+ T细胞、CD8+细胞、CM、INT和NCM中观察到类似的年龄分布(附加文件)1:图S2B)。在B细胞和NK umap的情况下,一些簇呈现不均匀的年龄分布,但这些簇在本研究中没有显示出任何显著的发现(图2)。1D)。
使用40个表面标记调用细胞子集
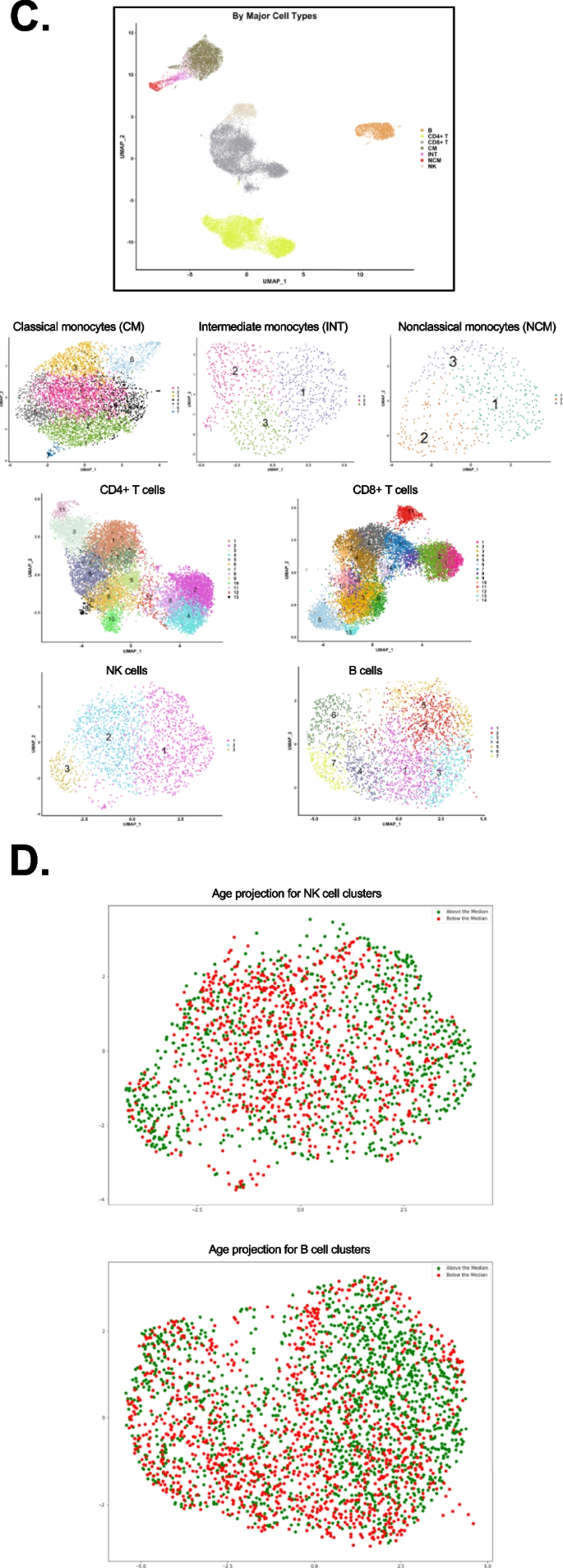
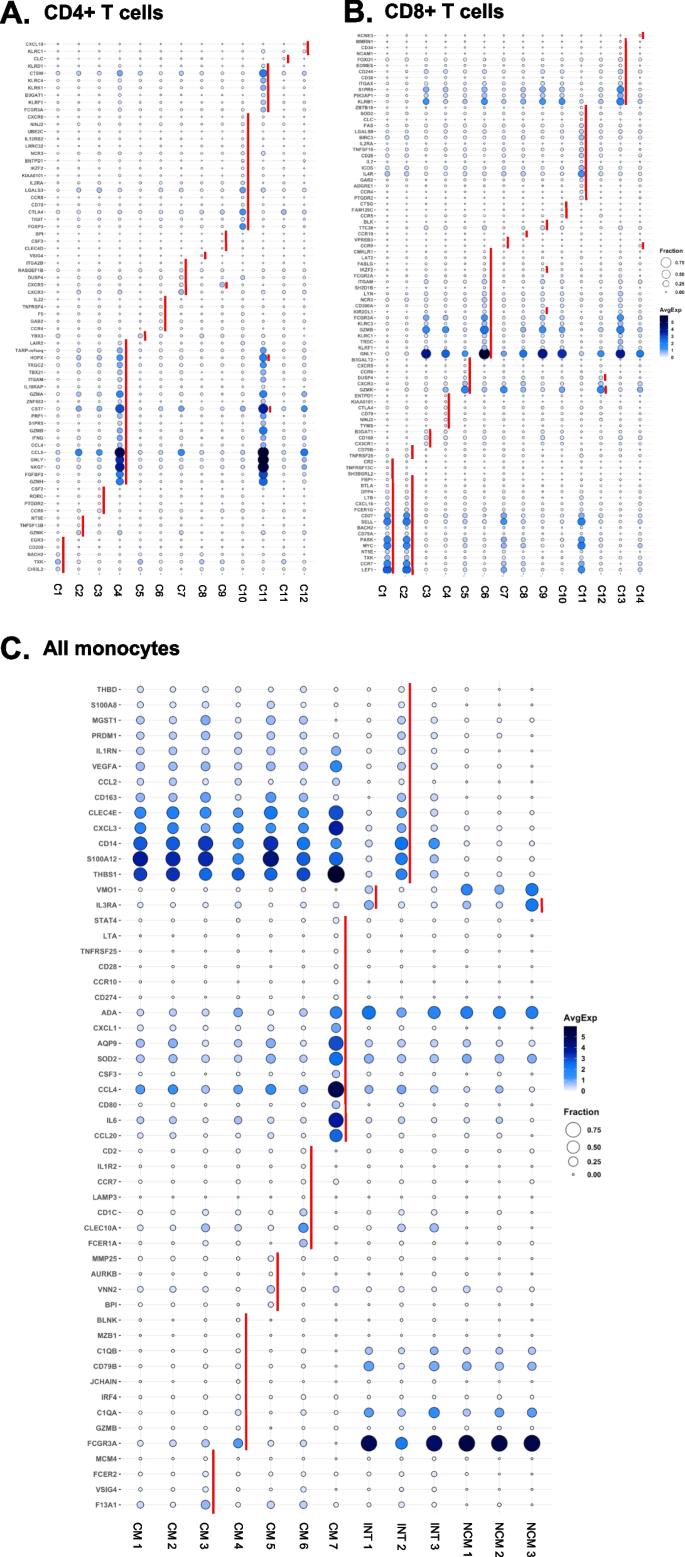
接下来,我们为那些至少在一个亚群中有显著差异表达且与细胞呼叫相关的抗体构建了热图(图2)。2).根据图S2A、CCR7 (CD197)抗体数据未纳入分析。这一信息使我们能够根据已发表的工作将所有CD4+ T和CD8+ T细胞亚群称为CD4+ T细胞。在CD4+ T细胞中,CD2几乎在所有细胞中都有表达。高亲和力IL2受体IL2RA (CD25)在大约三分之一的CD4+ T细胞中表达,在簇10中表达显著高,而在簇10中表达IL7受体(CD127)也很低,定义簇10为调节性T细胞(Tregs)。CD45RA和RO相互排斥,分离原始和抗原经历的CD4+ T细胞。CXCR3 (CD183)识别T-helper-1 (Th1)细胞,并在簇1中高表达。簇9表达CXCR5 (CD185)作为唯一的趋化因子受体,提示其可能含有滤泡辅助(Tfh) T细胞。簇9是唯一CD56高表达的簇,提示CD56+ CD4+ T细胞。根据蛋白质信息,所有CD4 T细胞簇被称为(图。2A).大多数CD8+ T细胞表达CD2。趋化因子受体(CD183, 184, 192, 194, 195, 197)在簇5,7和8的细胞上表达。簇6被鉴定为nk样(CD56+) T细胞,具有CD45RA+终分化记忆(Emra)表型(图4)。2B)。
每个主要细胞类型的表面标记物表达(log2刻度)的比例热图。一个CD4+ T细胞,BCD8+ T细胞,C单核细胞,DB细胞,以及ENK细胞。底部是免疫表型。Em,效应记忆;Emra,终分化效应子记忆;Treg,调节性T细胞;Tfh,滤泡辅助T细胞;CM,经典单核细胞;INT,中间单核细胞;NCM,非经典单核细胞;嗨,高; lo, low. To denote each of the clusters, the letter “C” is used in CD4+ T, CD8+ T, B, and NK cells followed by the cluster number. In the case of monocytes, clusters are represented as INT, CM, or NCM followed by the cluster number. Only expressed (non-negative) markers are shown
在单核细胞中,我们能够根据已发表的数据将所有经典单核细胞亚群称为[23,75],与海量细胞术描述的亚群有关[23].所有CM均为CD11b+(图;2C). CD9、CD69、CD184的表达有梯度。清道夫受体CD36和趋化因子受体CCR2 (CD192)在所有经典单核细胞中均有表达。在每个CM亚群中都有显著的标记。例如,CM簇7表达了高水平的CD142(组织因子),该因子此前已涉及艾滋病毒感染者[68],而簇5高表达CD137,簇3高表达CD163(血红蛋白触珠蛋白受体)。INT CD14+CD16+单核细胞被认为是促炎细胞,已知在HIV感染者中增加[24]和CVD [62,74].所有INT型单核细胞均高表达活化分子CD69、CD9和CD36(图2)。2C).由于INT子集之前没有描述过,我们提出了一个临时命名建议(图。2C)基于他们最显著的表达标记。NCM形成了3个簇。引人注目的是,CD9和CD36的表达仅限于聚类2,这表明该聚类对应于前面描述的CD9+CD36+ NCM [23].CD11c、CD86、CD141和CD152在所有ncm中均有表达。2C)。
使用从患有冠状动脉疾病的女性中获得的18种B细胞亚型表面抗体,B细胞被分为7个簇(图2)。2D) 3簇CD27+ B细胞和4簇CD27−B细胞。CD27是一种传统的记忆B细胞标记物[31].因此,簇4、6、7被归类为记忆B细胞群。聚类6和7显著高表达CD11c。CD11c+记忆B细胞已被证明是抗体分泌细胞的前体[22].簇4为CD25+, CD25+ B细胞被称为抗原提呈B细胞[5].簇1、2、3和5是CD27−B细胞,可能是naïve B细胞和移行B细胞的组合。
在NK细胞中,我们发现了3个簇。簇1含有HLADR+ CD56-CD16的成熟NK细胞高在慢性HIV感染中,NK细胞亚群的表达升高[29].NK细胞2簇成熟(CD56昏暗的/ CD16 +)。簇3包含未成熟(CD56 .明亮的CD16−)NK细胞(图;2E)。
PBMC亚群丰度随疾病或治疗的改变
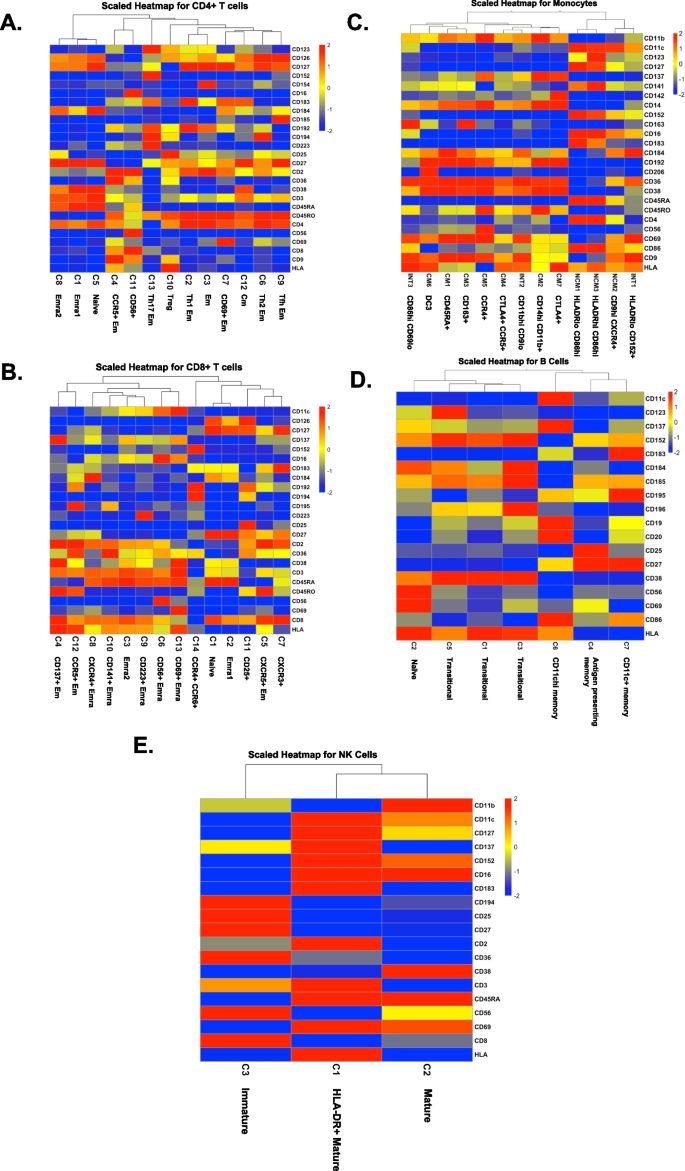
基于这些数据,有可能解决基于疾病或治疗的细胞比例变化:艾滋病毒效应,比较艾滋病毒−与艾滋病毒+;感染艾滋病毒的妇女心血管疾病的影响,比较HIV+与HIV+CVD+;以及降低胆固醇治疗的效果,比较HIV+ CVD+CRT -与HIV+ CVD+CRT +。我们发现细胞比例有显著差异(p)(按对数比值比计算,p/(1−p),然后进行方差分析和Tukey的多重比较检验),其中一个中间单核细胞亚群,一个非经典单核细胞亚群,一个CD8+ T细胞亚群和一个B细胞亚群(图。3.).在B细胞中,抗原提呈记忆B细胞(图;3.A)在所有携带HIV并伴有或不伴有亚临床CVD的WIHS参与者中显著降低。在CD8+ T细胞内,与未接受降胆固醇治疗的患者相比,接受CRT治疗的HIV和CVD患者中,第7簇(CXCR3+ CD8+ T细胞)减少。3.B).引人注目的是,两个单核细胞亚群显示出显著不同的丰度。簇2来自中间单核细胞(CD11bhi CD9lo)3.C)在HIV和群集3非经典单核细胞(CD9hi CXCR4+)患者中升高(图。3.D)在携带HIV并伴有亚临床CVD的WIHS参与者中显著升高。
感染艾滋病毒或心血管疾病的女性的细胞比例,两者都有,或两者都没有。从左到右依次为HIV - CVD -(绿色)、HIV+CVD -(黄色)、HIV+CVD+(蓝色)、HIV+CVD+ CRT+(红色)。除HIV+CVD+ 7例外,每组8例。每一簇中细胞的比例计算为母细胞类型的百分比,如每个面板的标题所示。一个B细胞簇4,BCD8+ T细胞簇7,CINT单核细胞簇2,和DNCM集群3。有显著差异的聚类(p-value)的细胞比例(由对数比值比(p/(1−p)),其次是方差分析(ANOVA)和Tukey的多重比较检验(multiple comparison test)),并以单个点以及均值和均值的标准误差(SEM)表示。INT,中间单核细胞;NCM,非经典单核细胞;CVD,心血管疾病;CRT,降胆固醇治疗
每个簇的差异基因表达
由于转录组信息未用于umap和聚类,如图所示。1C,我们可以将每个细胞亚群中的基因表达模式与同一细胞类型中的所有其他群集进行无偏置对比。我们筛选在至少一个亚群中显著差异表达的基因(图2)。4,附加文件1:表S8)。该分析揭示了大多数亚群的基因特征,并证实了CITE-seq鉴定的细胞簇的身份(图2)。2)和扩展的表型信息。簇4 CD36+效应记忆CD4+ T细胞过表达gn,GZMA,GZMH,NKG7,FGFBP2这些基因被称为效应记忆(Em)特征基因。簇10表达调节性T细胞(Treg)特征基因,包括FoxP3,TIGIT,CTLA4,LGALS3.簇9 Tfh Em CD4+ T细胞表达CXCR5, Tfh细胞的经典趋化因子受体特征[13].CD56+ CD4+ T细胞(簇11)表达NK特征,如HOPX,CTSW,KLRC4,KLRK(无花果。4A).在CD8+ T细胞内,簇2 (naïve)过表达CCR7,出售,或LEF1, naïve细胞的代表基因。nk样表型基因如gn,KLRF1,GZMB,FCGR3A在聚类6中表达(CD56+ EMRA)(图。4B). CTLA4+ CM(聚类7)表达CCL20,SOD2,或AQP9,经典单核细胞标记物(图;4C). B细胞与NK细胞无显著差异。
各组细胞基因表达差异显著。通过BD Rhapsody系统检测485转录本的表达。重要基因定义为调整基因p< 0.05和log2倍变化> 0。点图:表达每个基因的细胞在簇中的比例以圆圈的大小表示,表达水平以白色(=0)到深蓝色(=max, log2刻度)表示。红色条形图表明,在亲本细胞类型的所有其他簇中,某一簇的基因显著高于其他簇。在NK细胞和B细胞簇中均未检测到DEGs。一个CD4+ T细胞,BCD8+ T细胞和C单核细胞。CM,经典单核细胞;INT,中间单核细胞;NCM,非经典单核细胞。为了表示每一个簇,CD4+ T和CD8+ T使用字母“C”,后面跟着簇号。在单核细胞的情况下,簇表示为INT、CM或NCM,后面跟着簇号
转录组随着HIV、CVD和胆固醇控制而改变
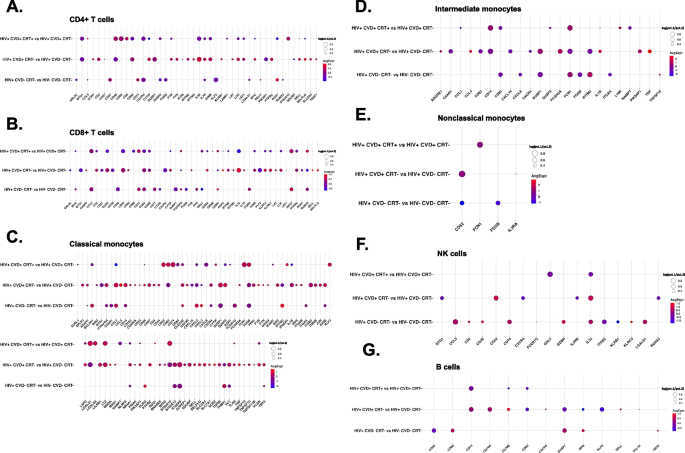
我们假设血液免疫细胞转录组随疾病状态而改变。为了验证这种可能性,我们为每种疾病状态构建了点状图,并将HIV -与HIV+、HIV+与HIV+与CVD、HIV+CVD+与HIV+CVD+与CRT治疗进行了比较(图2)。5,附加文件1:图S3,附加文件2:数据S1)。CD4+和CD8+ T细胞亚群中许多基因表现出显著差异。单核细胞亚群和NK细胞亚群中部分基因存在显著差异。在CD4+ T、CD8+ T和NK细胞中(图2)。5A, b, f),IL-32CVD显著增加,但在CVD+的CRT女性中没有显著增加。IL-32是一种炎性细胞因子,已知在CVD中很重要[14,34].转录因子JUNB还有淋巴细胞特异性蛋白酪氨酸激酶LCKCD4+ T和CD8+ T细胞均上调,而CRT存在时则降低。JUMB促进炎症Th17细胞的发育,并限制替代效应和调节程序的灵活性[9].LCK是激活TCR信号和T细胞的关键分子。几种杀手细胞凝集素受体(KLRC4而且KLRK1)在CVD中也显著上调,但在CD8+ T细胞中,CRT存在时下调。RUNX在CVD中减少,但在CRT中增加[35].
DUSP1在女性CVD的经典单核细胞中高度过表达(图2)。5C)。DUSP1氧化延长MAPK激活,最终导致炎症反应增强[30.].除了CCL3,亚兰,DUSP2,IL1B已知与动脉粥样硬化高度相关,在HIV+CVD+女性的CM中高度上调。TNFSF10(路),TNFSF13(4月),TNFSF13B(BAFF),重要的B细胞调节因子,在CVD女性的CM中上调。toll样受体TLR2,已知与动脉粥样硬化有关[15,49,55],经CVD上调。在中间单核细胞中(图;5D),亚兰,肿瘤坏死因子,IL1B,FCGR3A,PIK3AP1在未接受CRT的妇女中与心血管疾病有关,而FCN1与CRT患者相比,NCM增加(图;5E).在非经典单核细胞中,CD52与之前的一份报告一致[77].CD74在B细胞中的表达(图;5G)与CVD相比,在接受CRT治疗的CVD女性中略有下调。与HIV+CVD−相比,HIV+CVD+女性B细胞中的DUSP1下调。通过筛选过程的基因簇(p-value <0.05, avg.Log2FC>0或<0,pct.1 > 0.2)的主要细胞类型如图S所示3..
随机森林分析,以确定区分不同疾病组的基因
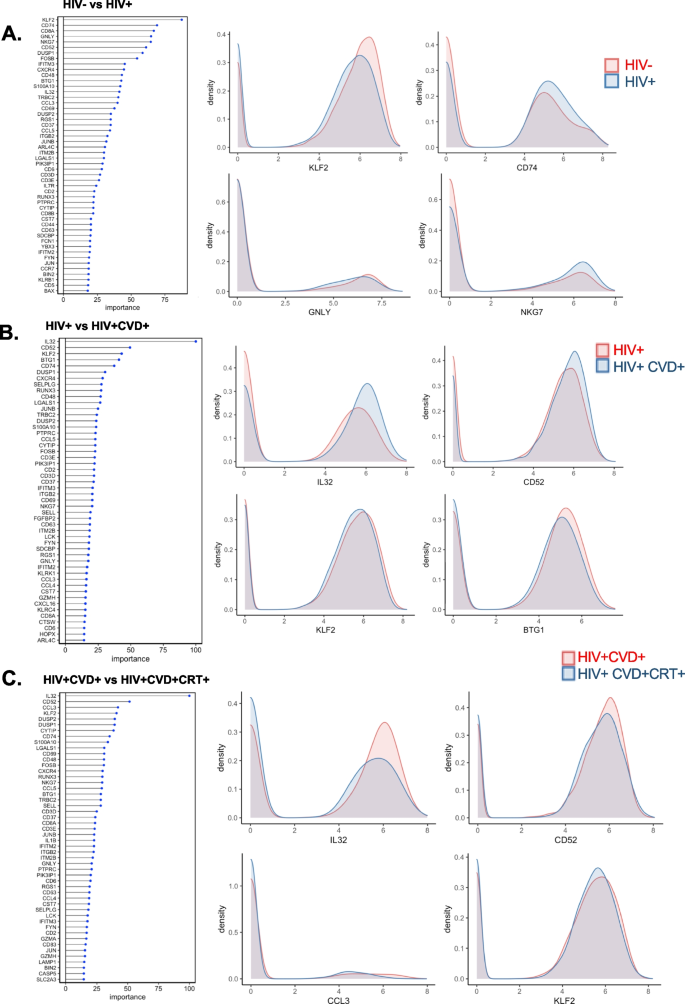
我们使用随机森林机器学习方法来识别具有最高能力区分疾病组的基因(附加文件)2:数据S2)。我们展示了排名前50位的基因来区分HIV和健康(图2)。6A), HIV vs HIV+CVD+(图。6B), HIV+CVD+ vs HIV+CVD+CRT+(图。6C),重要性在0 - 100之间。图中的直方图。6A-C为关键基因的重叠脊线图。KLF2是区分HIV和非HIV参与者的最重要的基因。在CVD和HIV的CVD+CRT+中,IL32,CD52排名较高(图;6有趣的是,这些基因在CVD中上调,而在CVD+CRT+中相反下调。许多基因在区分女性是否患有心血管疾病方面很重要,包括DUSP1,DUSP2,CCL5,LGALS1,由阴极射线管按相反方向调节。
讨论
在免疫学中,表面标记物被广泛用于定义和区分细胞类型[11,71,80].流式细胞术是免疫学的学科定义方法[60].与流式细胞术类似,在CyTOF中,单细胞悬液用抗体板染色以检测细胞抗原。与CyTOF不同,scRNA-seq允许检测单细胞转录组。由于免疫细胞中细胞表面蛋白与mRNA表达的相关性较弱[42],转录组提供了一个有价值的额外维度。没有表面表型信息的scRNA-seq导致了该领域的许多挫折,因为编码已知表面标记的许多基因的表达仍然没有在scRNA-seq中检测到[10,44,80].仅根据基因表达数据来判断细胞类型仍然很困难,这强调了除了转录组外,还需要细胞表面表型。在这里,我们将41对基因和蛋白质的基因表达与细胞表面表达相关联。CD74蛋白的表达与两种肿瘤的表达有良好的相关性CD74和HLA-DRA基因。CD4和CD16表面和基因表达在所有细胞类型中都有相当好的相关性。其他一些基因包括CD14,CD16, IL-3受体(CD123),CD27在某些细胞类型中与其蛋白的表面表达有一定的相关性。对于大多数标记,我们确认弱相关性(附加文件1:表S10) [42,67,69],这说明了scRNA-seq中监测细胞表面表型的价值。
pmcs可以在没有机械或酶解的情况下进行分析,已知机械或酶解可以改变细胞表面标记物和转录组[79.].pbmc对单细胞RNA测序(scRNA-seq)研究很有吸引力,因为它们可用于许多具有明确疾病和结果的特定人群的临床研究。本研究的样本参与者是WIHS内嵌套的子研究的一部分[25,28,32],提供了亚临床动脉粥样硬化的详细信息。参与者接受了高分辨率b型颈动脉超声,以成像右颈动脉的六个位置[28].虽然我们的研究不是决定性的,但它提示了心血管疾病受试者的细胞比例和转录组的显著变化。
scRNA-seq已应用于包括癌症在内的疾病中的人类pbmc [6,84,85,86]、炎症性肠病[48,76],以及自身免疫性疾病[36,57],以及动脉粥样硬化[18,19,81].10x Genomics drop-Seq方法的基础论文[87]证明了在pbmc上使用scRNA-seq的可行性。其他研究报告了结直肠癌中的scPBMC转录组[85], γδ T细胞[54]、肝癌[86],体外沙门氏菌感染(4]和记忆T细胞[45].两篇文章报道了结合来自动脉粥样硬化患者的单细胞转录组和蛋白质组学。费尔南德斯等人[19]只对一种人类斑块进行了抗体测序,但通过识别五种不同的巨噬细胞簇,揭示了它的力量。Wirka等人[81]揭示了体内平滑肌细胞表型调节的过程可以通过表达Tcf21这种基因与降低冠状动脉疾病的风险有因果关系。损失Tcf21结果病变部位的纤维肌细胞和保护性纤维帽减少[81].
在目前的研究中,四组参与者的细胞丰度有显著差异。其中一种是中间单核细胞亚群,这强调了这种细胞类型在慢性HIV感染中的非凡重要性[26,47].在非hiv外周动脉闭塞疾病患者中,中间单核细胞数量已被发现增加[78]并显著预测心血管事件[27,62,63].非经典单核细胞团簇在CVD中增加,此前有报道[20.,39].
CD8+ T细胞在人类动脉粥样硬化斑块中含量丰富[21]而且它们的数量比CD4+细胞要多[19,21,65].在人类晚期病变中,CD8+ T细胞主要存在于纤维帽区[52].在接受CRT治疗的女性中,CD8 + T细胞簇7 (CXCR3+)减少。症状性动脉粥样硬化患者CD8+ T细胞表达较高水平的CXCR3 [19].我们发现IL-32在心血管疾病的大多数T和NK细胞簇中高度表达。IL-32是在T细胞和单核细胞中表达的27-kDa细胞因子,在细胞凋亡后分泌[50].它是一种驱动IL-1β的炎症细胞因子,在CVD中具有重要临床意义[59, TNF, IL-6, IL-8的表达[14,34,50].IL-32激活白细胞表面蛋白酶PR3,进而触发g蛋白偶联受体PAR2 [50]并且在病毒感染中很重要[38,50,56,70].IL32在CVD患者中上调,在CVD患者中下调,降低胆固醇治疗。由于IL-32似乎是cvd特异性的,我们主张未来在更大的队列中进行前瞻性研究,以确定IL32 mRNA是否是一种有用的生物标志物。
KLF2是区分HIV和非HIV参与者的最重要的基因。以前的一些研究表明KLF2与HIV感染有关[12,58].这个基因和其他一些基因包括CD74而且CD52在HIV中区分CVD与非CVD, CVD+CRT+与CVD+也很重要,这表明这些基因可能与HIV和CVD有关。事实上,据报道,抗cd52抗体可能对抗逆转录病毒治疗的HIV患者有效[77]以及评估抗逆转录病毒有效性的潜在诊断价值[82].这里观察到的HIV和CVD之间的相互作用是新的。
我们的发现研究将鼓励前瞻性流行病学研究,以确定哪些PBMC亚群和转录组最适合作为冠状动脉或外周动脉疾病患者的风险分层和指导治疗的临床生物标志物。目前的发现有一些局限性。它们需要扩展到男性(目前的数据基于女性)和其他种族和民族(目前的数据主要基于非洲裔美国人和西班牙裔女性)。还需要对非吸烟者的心血管疾病进行研究(目前的数据基于吸烟者),年龄范围需要扩大。
结论
总之,我们证明了scRNA-seq在相同细胞中用于细胞表面表型评估的实用性。鉴定出50种不同的CD4+ T和CD8+ T细胞、B细胞、NK细胞和单核细胞簇有助于更深入地了解pmcs,这是一种丰富且易于获取的生物学和临床信息来源。中间单核细胞亚群的发现要求在模式生物中识别这些亚群,以测试它们在体内的功能。
数据和材料的可用性
所有数据均可在正文或补充材料中查阅。本研究中提供的数据集可以在在线存储库中找到。本文报道的数据的存储库名称和登录号为Gene Expression Omnibus (GEO), GSE205320 [88].
改变历史
2022年10月20日
缩写
- 加拿大广播公司:
-
血细胞计数器
- CITE-seq:
-
转录表位测序的细胞索引
- CLR:
-
集中log-ratio
- CM:
-
经典的单核细胞
- CRT:
-
降低胆固醇治疗
- 心血管疾病:
-
心血管病
- 德:
-
微分表达式
- ELISA:
-
酶联免疫吸附试验
- 新兴市场:
-
记忆效应
- Emra:
-
终分化记忆
- 的边后卫:
-
胎牛血清
- 鸡尾酒疗法:
-
高效抗逆转录病毒疗法
- INT(警官):
-
中间
- M:
-
单核细胞
- 马伯:
-
单克隆抗体
- ML:
-
机器学习
- 不合格品:
-
模单核细胞
- NK:
-
自然杀伤细胞
- PBMCs:
-
外周血单个核细胞
- PBS:
-
磷酸盐
- 质量控制:
-
质量控制
- 射频:
-
随机森林
- scRNA-seq:
-
单细胞RNA测序
- sCVD:
-
亚临床心血管疾病
- Tfh:
-
卵泡辅助T细胞
- 亚群:
-
调节性T细胞
- UMAP:
-
均匀流形近似和投影
- 这个程序:
-
妇女艾滋病病毒跨机构研究
参考文献
Amezquita RA, Lun ATL, Becht E, Carey VJ, Carpp LN, Geistlinger L,等。利用生物导体进行单细胞分析。自然科学进展。2020;17:137-45。https://doi.org/10.1038/s41592-019-0654-x.
张志刚,张志刚,张志刚,等。大规模细胞术识别不同的CD4+ T细胞簇,根据抗逆转录病毒治疗开始区分hiv -1感染患者。JCI Insight 2019;4:e125442。
布隆德尔,纪尧姆J-L,兰贝特R,列斐伏尔E.大型网络中社区的快速展开。统计机械理论,2008;P10008。https://doi.org/10.1088/1742-5468/2008/10/p10008.
张志强,张志强,张志强,等。利用人类免疫细胞的单细胞rna测序分析预测细菌感染结果。Nat Commun. 2019;10:3266。https://doi.org/10.1038/s41467-019-11257-y基因表达综合(GEO)https://identifiers.org/geo:GSE122084(2019)。
布里斯勒特M, Bokarewa M, Larsson P, Wing K, Collins LV, Tarkowski A.人CD25+ B细胞的表型和功能特征。免疫学。2006;117:548-57。https://doi.org/10.1111/j.1365-2567.2006.02331.x.
Brown CC, Gudjonson H, Pritykin Y, Deep D, Lavallée V-P, Mendoza A,等。小鼠和人类树突状细胞异质性的转录基础。细胞。2019;179:846 e24——863.。https://doi.org/10.1016/j.cell.2019.09.035基因表达综合(GEO)https://identifiers.org/geo:GSE137710(2019)和https://identifiers.org/geo:GSE130201(2019)。
Buttarello M, Plebani M.自动血细胞计数:最新技术。中华临床病理学杂志。2008;130:104-16。https://doi.org/10.1309/EK3C7CTDKNVPXVTN.
张志强,张志强,张志强,等。多模态单细胞分析中寡聚偶联抗体信号的改进。Elife。2021;10:e61973。https://doi.org/10.7554/eLife.61973Figshare 10.6084 / m9.figshare.c.5018987。v1, 2020。
Carr TM, Wheaton JD, Houtz GM, Ciofani M. JunB促进Th17细胞身份识别并抑制炎症期间CD4(+) t细胞的替代程序。Nat Commun. 2017;8:301。https://doi.org/10.1038/s41467-017-00380-3基因表达综合(GEO)https://identifiers.org/geo:GSE98414(2017)。
Cochain C, Vafadarnejad E, Arampatzi P, Pelisek J, Winkels H, Ley K,等。单细胞RNA-Seq揭示了小鼠动脉粥样硬化中主动脉巨噬细胞的转录格局和异质性。Circ res 2018; 122:1661-74。https://doi.org/10.1161/CIRCRESAHA.117.312509基因表达综合(GEO)https://identifiers.org/geo:GSE97310, 2018年。
Cole JE, Park I, Ahern DJ, Kassiteridi C, Danso Abeam D, Goddard ME,等。小鼠动脉粥样硬化中的免疫细胞普查:通过飞行时间的细胞计数揭示血管髓细胞多样性。心血管杂志2018;114:1360-71。https://doi.org/10.1093/cvr/cvy109.
Collins DR, Urbach JM, Racenet ZJ, Arshad U, Power KA, Newman RM,等。hiv特异性CD8(+) T细胞的功能损害先于病毒血症自发控制的流产。免疫力。2021;54:2372 - 2384. e7。https://doi.org/10.1016/j.immuni.2021.08.007基因表达综合(GEO) https://identifiers.org/geo:GSE168296(2021)。
Crotty s.t滤泡辅助细胞生物学:十年的发现和疾病。免疫力。2019;50:1132-48。https://doi.org/10.1016/j.immuni.2019.04.011.
Damen MSMA, Popa CD, Netea MG, Dinarello CA, Joosten LAB。慢性炎症条件下的白细胞介素32与心血管疾病的高风险相关。动脉粥样硬化。2017;264:83 - 91。https://doi.org/10.1016/j.atherosclerosis.2017.07.005.
李志强,李志强,李志强,等。人动脉粥样硬化病变中toll样受体的表达及其与斑块活化的关系。循环。2002;105:1158 - 61。https://doi.org/10.1161/01.CIR.0000012489.17433.31.
张晓东,刘志刚,张志刚,等。经典单核细胞转录组显示显著抗炎他汀类药物作用于慢性HIV妇女。心血管科学,2021;117:1166-77。https://doi.org/10.1093/cvr/cvaa188.
范浩昌,傅国科,福多SPA。表达分析。用于基因表达的单细胞组合标记。科学。2015;347年。https://doi.org/10.1126/science.1258367.
Fernandez DM, Giannarelli C.在动脉粥样硬化中的免疫细胞谱分析:在研究和精准医学中的作用。Nat Rev Cardiol, 2022; 19:43-58。https://doi.org/10.1038/s41569-021-00589-2.
范德德,马志强,李志强,等。人类动脉粥样硬化斑块的单细胞免疫图景。中国医学杂志2019;25:1576-88。https://doi.org/10.1038/s41591-019-0590-4.
Funderburg NT, Zidar DA, Shive C, Lioi A, Mudd J, Musselwhite LW,等。HIV-1感染和未感染急性冠状动脉综合征受试者共享单核细胞亚群表型血。2012;120:4599 - 608。https://doi.org/10.1182/blood-2012-05-433946.
Gewaltig J, Kummer M, Koella C, Cathomas G, Biedermann BC。CD8 t细胞迁移到人动脉管壁的要求。《悲怆》,2008;39:1756-62。https://doi.org/10.1016/j.humpath.2008.04.018.
Golinski M- l, Demeules M, Derambure C, Riou G, Maho-Vaillant M, Boyer O,等。CD11c(+) B细胞在健康供体中主要是记忆细胞,是抗体分泌细胞的前体。前免疫,2020;11:32。https://doi.org/10.3389/fimmu.2020.00032基因表达综合(GEO)https://identifiers.org/geo:GSE112515(2020)。
Hamers AAJ, Dinh HQ, Thomas GD, Marcovecchio P, Blatchley A, Nakao CS,等。高维海量细胞术显示的人单核细胞异质性。动脉血栓血管生物学2019;39:25-36。https://doi.org/10.1161/ATVBAHA.118.311022.
汉J,王B,汉族N,赵Y,歌C,冯X, et al。在慢性hiv感染患者中,CD14(高)CD16(+)单核细胞与疾病进展相关,而CD14(低)CD16(+)单核细胞与疾病进展相关。获得性免疫缺陷综合征2009;52:553-9。https://doi.org/10.1097/qai.0b013e3181c1d4fe.
Hanna DB, Post WS, Deal JA, Hodis HN, Jacobson LP, Mack WJ,等。HIV感染与亚临床颈动脉粥样硬化进展相关。临床感染杂志2015;61:640-50。https://doi.org/10.1093/cid/civ325.
赫普斯AC, Maisa A,程文杰,Angelovich TA, Lichtfuss GF, Palmer CS,等。艾滋病毒感染导致年轻男性单核细胞和先天免疫激活发生与年龄相关的变化,尽管联合抗逆转录病毒治疗仍持续存在。艾滋病。2012; 26:843-53。https://doi.org/10.1097/QAD.0b013e328351f756.
李文杰,李志强,李志强,等。CD14(++)CD16+单核细胞而不是总单核细胞数预测透析患者的心血管事件。肾脏杂志2008;73:622-9。https://doi.org/10.1038/sj.ki.5002744.
Hodis HN, Mack WJ, Lobo RA, Shoupe D, Sevanian A, Mahrer PR,等。雌激素对动脉粥样硬化的预防作用。随机、双盲、安慰剂对照试验。安实习医学2001;135:939-53。https://doi.org/10.7326/0003-4819-135-11-200112040-00005.
洪浩,Eberhard JM, Keudel P, Bollmann BA, Ahmad F, Ballmaier M,等。表型和功能上不同的亚群有助于CD56-/CD16+自然杀伤细胞在HIV感染中的扩增。艾滋病。2010; 24:1823-34。https://doi.org/10.1097/QAD.0b013e32833b556f.
Hoppstädter J, Ammit AJ。双特异性磷酸酶1在糖皮质激素驱动的抗炎反应中的作用。前沿免疫。2019;10:1446。https://doi.org/10.3389/fimmu.2019.01446.
张晓明,张晓明,张晓明,张晓明。B细胞表型分析的研究进展。《免疫前沿》2012;3:302。https://doi.org/10.3389/fimmu.2012.00302.
Kaplan RC, Kingsley LA, Gange SJ, Benning L, Jacobson LP, Lazar J,等。低CD4+ t细胞计数是艾滋病毒感染者动脉粥样硬化的主要危险因素。艾滋病。2008; 22:1615-24。https://doi.org/10.1097/QAD.0b013e328300581d.
张志刚,张志刚,张志刚,张志刚,等。超急性HIV-1感染期间多细胞免疫动力学的集成单细胞分析医学杂志2020;26:511-8。https://doi.org/10.1038/s41591-020-0799-2.
金秀华,韩秀英,李志强,尹德勇,等。白介素-32:一种细胞因子和诱导因子。免疫力。2005;22:131-42。https://doi.org/10.1016/j.immuni.2004.12.003.
Korinfskaya S, Parameswaran S, Weirauch MT, Barski A. Runx转录因子在T细胞中的作用——胸腺发育之外的是什么?前方免疫。2021;12:701924。https://doi.org/10.3389/fimmu.2021.701924.
Kotliarov Y, Sparks R, Martins AJ, Mule MP, Lu Y, Goswami M,等。广泛的免疫激活奠定了健康个体疫苗反应性和狼疮患者疾病活动性的共同设定点特征。《医学杂志》2020:618-29。https://doi.org/10.1038/s41591-020-0769-8.
Kuhn M.使用插入包在R中构建预测模型。中国统计杂志,2008;28:1-26。https://doi.org/10.18637/jss.v028.i05.
李伟,孙伟,刘林,杨峰,李勇,陈勇,等。IL-32:抗流感病毒复制的宿主促炎因子在流感病毒感染期间通过异常表观遗传修饰上调。中华免疫杂志2010;185:5056-65。https://doi.org/10.4049/jimmunol.0902667.
梁红,谢震,沈涛。HIV感染中单核细胞活化与心血管疾病的关系。细胞免疫杂志,2017;14:960-2。https://doi.org/10.1038/cmi.2017.109.
李国强,李国强。基于随机森林的分类与回归。R新闻,2002;2:18-22。
Liechti T, Roederer M. OMIP-060: 30参数流式细胞仪面板评估T细胞效应功能和调节性T细胞。Cytom A. 2019; 95:1129-34。https://doi.org/10.1002/cyto.a.23853.
刘勇,王志强,王志强,等。细胞蛋白水平对mRNA丰度的影响。细胞。2016;165:535-50。https://doi.org/10.1016/j.cell.2016.03.014.
Londino JD, Gulick DL, Lear TB, Suber TL, Weathington NM, Masa LS,等。翻译后修饰干扰素γ受体改变其稳定性和信号。生物化学杂志,2017;474:3543-57。https://doi.org/10.1042/BCJ20170548.
Lundberg E, Fagerberg L, Klevebring D, Matic I, Geiger T, Cox J,等。在三种功能不同的人类细胞系中定义转录组和蛋白质组。生物化学学报。2010;6:50 5。https://doi.org/10.1038/msb.2010.106.
Mair F, Erickson JR, Voillet V, Simoni Y, Bi T, Tyznik AJ,等。一种靶向多组学分析方法在单细胞水平上测量蛋白质表达和低丰度转录本。Cell rep 2020;31:10 499。https://doi.org/10.1016/j.celrep.2020.03.063.
Mair F, Prlic M. OMIP-044:人树突状细胞室28色免疫分型。Cytom A. 2018; 93:402-5。https://doi.org/10.1002/cyto.a.23331基因表达综合(GEO)https://identifiers.org/geo:GSE135325(2020)。
葛志伟,陈志伟,陈志伟,等。单核细胞和先天免疫激活标记物的年龄相关变化在感染艾滋病毒的妇女中发生得更快。科学通报。2013;8:e55279。https://doi.org/10.1371/journal.pone.0055279.
Martin JC, Chang C, Boschetti G, Ungaro R, Giri M, Grout JA,等。对克罗恩病病变的单细胞分析确定了与抗tnf治疗耐药性相关的致病细胞模块。细胞。2019;178:1493 - 1508. - e20。https://doi.org/10.1016/j.cell.2019.08.008基因表达综合(GEO)https://identifiers.org/geo:GSE134809(2019)。
Mullick AE, Soldau K, Kiosses WB, Bell TA 3rd, Tobias PS, Curtiss LK.血流紊乱部位内皮细胞toll样受体2表达增加加剧早期动脉粥样硬化事件。中华临床医学杂志。2008;205:373-83。https://doi.org/10.1084/jem.20071096.
中山M, Niki Y,川崎T,武田Y,池上H,富山Y,等。IL-32-PAR2轴是一种先天性免疫传感器,为LPS-TRIF轴提供替代信号。科学通报2013;3:2960。https://doi.org/10.1038/srep02960.
netey L, Giles AJ, Chattopadhyay PK. OMIP-050:一种28色/30参数荧光流式细胞仪面板,用于枚举和描述表达多种免疫检查点分子的细胞。Cytom A. 2018; 93:1094-6。https://doi.org/10.1002/cyto.a.23608.
Paul VSV, Paul CMP, Kuruvilla S.晚期动脉粥样硬化斑块中各种炎症细胞的定量。中国临床诊断杂志2016;10:EC35-8。https://doi.org/10.7860/JCDR/2016/19354.7879.
Peterson VM, Zhang KX, Kumar N, Wong J, Li L, Wilson DC,等。单细胞蛋白质和转录物的多重定量。生物工程学报。2017;35:936-9。https://doi.org/10.1038/nbt.3973基因表达综合(GEO)https://identifiers.org/geo:GSE100501(2017)。
Pizzolato G, Kaminski H, Tosolini M, Franchini D-M, Pont F, Martins F,等。单细胞RNA测序揭示了人类TCRVdelta1和TCRVdelta2 γ T淋巴细胞的共享和独特的细胞毒性特征。中国科学院学报(自然科学版)2019;116:11906-15。https://doi.org/10.1073/pnas.1818488116基因表达综合(GEO)https://identifiers.org/geo:GSE128223(2019)。
Quillard T, Araújo HA, Franck G, Shvartz E, Sukhova G, Libby P. TLR2和中性粒细胞增强内皮应激,凋亡和脱离:浅表侵蚀的意义。《欧洲心脏》杂志,2015;https://doi.org/10.1093/eurheartj/ehv044.
史瑞尔,唐辉,吴娟,李伟,穆赫塔尔,张娟,等。人体免疫缺陷病毒感染期间IL-32水平升高抑制HIV复制。免疫杂志2008;117:161-7。https://doi.org/10.1016/j.imlet.2008.01.007.
雷yes M, Vickers D, Billman K, Eisenhaure T, Hoover P, Browne EP,等。外周血细胞的多重富集和基因组分析揭示了亚群特异性免疫特征。科学通报2019;5:eaau9223。https://doi.org/10.1126/sciadv.aau9223基因表达综合(GEO) https://identifiers.org/geo:GSE120442(2019)。
理查德森MW, Jadlowsky J, Didigu CA, dom RW, Riley JL。克虏伯样因子2调节CCR5表达和HIV-1感染易感性中华免疫杂志,2012;https://doi.org/10.4049/jimmunol.1201431.
Ridker PM, Everett BM, Thuren T, MacFadyen JG, Chang WH, Ballantyne C,等。canakinumab抗炎治疗动脉粥样硬化性疾病。中华外科杂志,2017;https://doi.org/10.1056/NEJMoa1707914.
罗宾逊JP,罗德尔M.科学史。流式细胞仪发现了金矿。科学。2015;350:739-40。https://doi.org/10.1126/science.aad6770.
罗德里格斯L, Pekkarinen PT, Lakshmikanth T, Tan Z, Consiglio CR, Pou C,等。从重症COVID-19急性期到恢复期的系统级免疫监测。细胞代表医学2020;1:100078。https://doi.org/10.1016/j.xcrm.2020.100078.
罗加夫,李志强,李志强,等。CD14++CD16+单核细胞独立预测心血管事件:951例择期冠状动脉造影患者的队列研究《中华医学会心血管病杂志》2012;https://doi.org/10.1016/j.jacc.2012.07.019.
罗加瑟夫KS, Seiler S, Zawada AM, Reichart B, Herath E, Roth D,等。CD14++CD16+单核细胞与慢性肾病患者心血管结局《中国经济》杂志,2011;32(1):54 - 59。https://doi.org/10.1093/eurheartj/ehq371.
De Rosa SC, Brenchley JM, Roederer M.超越六种颜色:流式细胞仪的新时代。医学杂志,2003;9:112-7。https://doi.org/10.1038/nm0103-112.
Rossmann A, Henderson B, Heidecker B, Seiler R, Fraedrich G, Singh M,等。来自晚期动脉粥样硬化病变的t细胞识别hHSP60,并具有限制性的t细胞受体库。《科学》,2008;43(3):229 - 37。https://doi.org/10.1016/j.exger.2007.11.009.
沙希尔F,马特奥JM,施泰因霍夫M, Siveen KS。开发了43色面板,用于常规和非常规t细胞亚群、B细胞、NK细胞、单核细胞、树突状细胞和先天性淋巴样细胞的光谱流式细胞术表征。Cytom A. 2020。https://doi.org/10.1002/cyto.a.24288.
王志强,王志强,王志强。单细胞抗体测序在动脉粥样硬化研究中的应用。方法Mol生物学2022;2419:765-78。https://doi.org/10.1007/978-1-0716-1924-7_46.
Schechter ME, Andrade BB, He T, Richter GH, Tosh KW, Policicchio BB,等。表达组织因子的炎性单核细胞驱动SIV和HIV凝血病变。9.中国医学科学。2017;https://doi.org/10.1126/scitranslmed.aam5441.
Schwanhäusser B, Busse D, Li N, Dittmar G, Schuchhardt J, Wolf J,等。哺乳动物基因表达控制的全球定量研究。大自然。2011;473:337-42。https://doi.org/10.1038/nature10098.
王志强,王志强,王志强,王志强,等。HIV-1感染期间淋巴组织中IL-32的免疫抑制作用。中华免疫杂志2011;186:6576-84。https://doi.org/10.4049/jimmunol.1100277基因表达综合(GEO)https://identifiers.org/geo:GSE16363, 2009年。
斯皮策MH,诺兰GP。大规模细胞术:单细胞,多特征。细胞。2016;165:780 - 91。https://doi.org/10.1016/j.cell.2016.04.019.
Stoeckius M, Hafemeister C, Stephenson W, Houck-Loomis B, Chattopadhyay PK, Swerdlow H,等。单细胞中同时测定表位和转录组。2017; 14:865-8。https://doi.org/10.1038/nmeth.4380基因表达综合(GEO)https://identifiers.org/geo:GSE100866, 2017年。
Stuart T, Butler A, Hoffman P, Hafemeister C, Papalexi E, Mauck WM 3rd,等。单细胞数据的全面集成。细胞。2019;177:1888 e21——1902.。https://doi.org/10.1016/j.cell.2019.05.031基因表达综合(GEO)https://identifiers.org/geo:GSE128639(2019)。
塔普LD,珊西拉E,瑞格利BJ,帕慕克库B,利普GYH。st段抬高型心肌梗死患者CD14++CD16+单核细胞亚群与单核细胞-血小板相互作用中华血液学杂志,2012;10:431 - 424。https://doi.org/10.1111/j.1538-7836.2011.04603.x.
Thomas GD, Hamers AAJ, Nakao C, Marcovecchio P, Taylor AM, McSkimming C,等。人血单核细胞亚群:一种新的门控策略,使用细胞表面标记物通过大规模细胞术鉴定。动脉血栓血管生物学,2017;37:1548-58。https://doi.org/10.1161/ATVBAHA.117.309145.
Uniken Venema WT, Voskuil MD, Vila AV, van der Vries G, Jansen BH, Jabri B,等。克罗恩病患者血液和回肠T细胞的单细胞RNA测序揭示了组织特异性特征和药物靶点。胃肠病学。2019;156:812 e22——815.。https://doi.org/10.1053/j.gastro.2018.10.046.
傅德曼,贾德波,刘志强,张志强,等。简要报告:CD4+ T细胞在hiv阳性个体cART中的CD52表达。中国免疫缺陷综合征杂志,2018;https://doi.org/10.1097/QAI.0000000000001568.
Wildgruber M, Aschenbrenner T, Wendorff H, Czubba M, Glinzer A, Haller B,等。“中间”CD14(++)CD16(+)单核细胞亚群在人类严重外周动脉疾病中增加。科学通报2016;6:39483。https://doi.org/10.1038/srep39483.
Williams JW, Winkels H, Durant CP, Zaitsev K, Ghosheh Y, Ley K.单细胞RNA测序在动脉粥样硬化中的研究。第2020号;126:1112-26号。https://doi.org/10.1161/CIRCRESAHA.119.315940.
温克尔斯H, einger E, Vassallo M, Buscher K, Dinh HQ, Kobiyama K,等。通过单细胞rna测序和大规模细胞术确定的小鼠动脉粥样硬化免疫细胞图谱。Circ res 2018; 122:1675-88。https://doi.org/10.1161/CIRCRESAHA.117.312513.
王志强,王志强,王志强,等。单细胞分析显示平滑肌细胞表型调节和TCF21疾病基因的动脉粥样硬化保护作用。中国医学杂志2019;25:1280-9。https://doi.org/10.1038/s41591-019-0512-5基因表达综合(GEO)https://identifiers.org/geo:GSE131780(2019)。
吴建强,Dyer WB, Chrisp J, Belov L,王波,Saksena NK。来自HIV+个体的高活性抗逆转录病毒治疗的外周血单个核细胞表面抗原的纵向微阵列分析。Retrovirology。2008;24。https://doi.org/10.1186/1742-4690-5-24.
Zernecke A, Winkels H, Cochain C, Williams JW, Wolf D, Soehnlein O,等。动脉粥样硬化小鼠主动脉白细胞多样性的meta分析。Circ res 2020; 127:402-26。https://doi.org/10.1161/CIRCRESAHA.120.316903.
张磊,李志,Skrzypczynska KM,方强,张伟,O 'Brien SA,等。单细胞分析为结肠癌骨髓靶向治疗机制提供信息。细胞。2020;181:442 e29——459.。https://doi.org/10.1016/j.cell.2020.03.048基因表达综合(GEO)https://identifiers.org/geo:GSE146771(2020)。
张艳,郑玲,张玲,胡欣,任欣,张卓。治疗初治结直肠癌患者个体T细胞深度单细胞RNA测序数据。科学数据。2019;6:131。https://doi.org/10.1038/s41597-019-0131-5基因表达综合(GEO)https://identifiers.org/geo:GSE108989(2018)。
郑超,郑林,俞纪坤,郭华,张勇,郭旭,等。单细胞测序揭示肝癌浸润T细胞的格局。细胞。2017;169:1342 - 1356. e16天。https://doi.org/10.1016/j.cell.2017.05.035基因表达综合(GEO)https://identifiers.org/geo:GSE98638(2017)。
郑国祥,Terry JM, Belgrader P, Ryvkin P, Bent ZW, Wilson R,等。大规模并行数字单细胞转录谱分析。Nat Commun. 2017; 8:1-12。https://doi.org/10.1038/ncomms14049基因表达综合(GEO)https://identifiers.org/geo:GSE93421(2017)。
Ley K, Kaplan RC, Hedrick C, Lanier LL, McNamara C, La Jolla免疫研究所。人外周血单个核细胞蛋白和转录单细胞RNA组合测序NCBI地理, 02.8,GSE205320.(2022)。
确认
感谢Donna Foster和Greg Markby校对这篇文章。
资金
美国国立卫生研究院拨款R35-HL-145241, R01-HL-121697, R01-HL-148094 (K.L.)
美国国家卫生研究院拨款P01-HL-136275 (C.C.H.)
美国国家卫生研究院拨款R01-HL-134236 (C.C.H.)
国家卫生研究院拨款R01-HL-126543, 5R01-HL-126543-05, 5R01-HL-140976-02, R01-HL-148094-01, R01-HL-148094 (R.C.K.)
美国国立卫生研究院拨款K01-HL-137557 (D.B.H.)
美国国家卫生研究院拨款U01-AI-103408 (I.O.)
美国国家卫生研究院拨款U01-AI-103390 (a.a.a)
美国国家卫生研究院拨款U01-AI-034989 (P.C.T.)
癌症研究所(CRI)
国家卫生研究院授予NIAID, NICHD, NCI, NIDA, NIMH, NIDCR, NIAAA, NIDCD, UL1-TR-000004, P30-AI-050409, P30-AI-050410和P30-AI-027767
瑞典医学研究学会
本手稿中的数据由妇女跨机构艾滋病毒研究收集,现在是MACS/WIHS联合队列研究(MWCCS)。
作者信息
作者及隶属关系
贡献
研究设计:k.l., j.v., r.s., y.g., c.p.d., E.E.样本和数据的收集。a.l.l., r.p.t., j.m.l., w.j.m., k.m.w., a.a.a., H.N.H., p.c.t., i.o., s.l.h.和R.C.K.临床数据分析:D.B.H. B型超声子研究数据的设计和收集:H.N.H. scRNA-seq实验:C.P.D.和E.E.数据分析:j.v., r.s., r.g., s.s.a.s., a.a., Y.G., p.r., t.p., a.s., c.a.m., l.l.l., c.c.h.和K.L.生物信息学分析:r.g., s.s.a.s., v.s., c.a.m., l.l.l., c.c.h.和Y.G.作者阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
所有参与者都提供了知情同意,每个站点的机构审查委员会批准了这些研究。
发表同意书
所有列出的作者都审阅了手稿并同意其提交。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:
补充数字和表格。图S1。(相关图1).研究设计:研究参与者之间的比较。图S2。(相关图1).(一个)每个主要细胞类型的所有40个表面标记的无阈值表达的山脊线图。(B年龄投影(中位数上下)在CM、INT、NCM、CD4+ T细胞和CD8+ T细胞umap上。图S3。(相关图5).各亚群疾病类型的DEG点图。表S1。试剂。表S2。每个冷冻PBMC管的细胞活力。表S3。40份定量寡核苷酸标记单克隆抗体列表。表S4。自定义面板中所选基因的列表。表S5。每个抗体的阈值。表S6。不用于细胞聚集的抗体。表S7。每个集群中的单元格数。表S8。各细胞类型基因表达差异显著(A-E)。表S9。每个参与者的cell数。表S10。抗体与基因在各细胞类型中呈非负的Spearman相关性。
附加文件2:数据S1。
(单独的excel文件)。数据基础图5,疾病类型的deg点图。
附加文件3:数据S2。
(单独的excel文件)。数据基础图6,随机森林模型。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
巴列霍,J.,塞古萨,R.,古拉蒂,R.。et al。人外周血单个核细胞中蛋白质和转录单细胞RNA的组合测序。BMC医学杂志20., 193(2022)。https://doi.org/10.1186/s12915-022-01382-4
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12915-022-01382-4
关键字
- 化学汽相淀积
- 艾滋病毒
- scRNA-seq
- 转录组
- 抗体
- 人类