摘要
背景
凋亡蛋白是一种肿瘤特异性的促凋亡蛋白,具有重要的抗肿瘤作用,但其自噬激活机制以及自噬与凋亡的相互作用尚未被准确阐明。在此,我们研究了凋亡素诱导细胞凋亡和自噬的机制以及两者之间的相互作用。
方法
采用结晶紫染色和CCK-8法,在体外分析凋亡素对肝癌细胞的抑制作用,在体内建立裸鼠肿瘤模型,分析凋亡素对肝癌的抑制作用。流式细胞术和荧光染色分析凋亡素诱导的细胞凋亡和自噬的主要类型。随后,还分析了这两个事件之间的关系。采用流式细胞仪分析ROS对凋亡素介导的细胞凋亡和凋亡素介导的自噬的影响。分析了活性氧对两种现象的影响。最后,利用基因沉默分析了参与自噬的关键基因的作用。
结果
结果表明,apoptin可以显著增加肝癌细胞的凋亡和自噬,并通过增加NIX蛋白的表达引起自噬。凋亡素还能显著提高细胞ROS水平,参与凋亡素介导的肝癌细胞自噬和凋亡。ROS的变化可能是引起细胞凋亡和自噬的关键因素。
结论
上述结果表明,凋亡素处理肝癌细胞后ROS水平升高,导致线粒体跨膜潜能丧失,通过募集NIX导致内源性凋亡和线粒体自噬。因此,ROS可能是连接内源性凋亡与凋亡素诱导的肝癌细胞自噬的关键因素。
图形抽象

视频摘要
背景
肝癌是世界上癌症相关死亡的第三大原因。2020年2月,世界卫生组织国际癌症研究机构(IARC)报告称,全球新诊断的癌症病例为1930万例。这一数字比2018年报告的1810万例继续增加,癌症死亡人数达到100万大关,预计将达到1000万[1].在全球1930万例癌症新发病例中,中国有457万例癌症新发病例,占全球总数的23.7%。由于中国是世界上人口最多的国家,新发癌症病例数量远远超过世界其他国家。目前,手术切除仍是治疗本病最有效的方法之一。然而,目前传统的治疗方法,仍不能令人满意。
随着分子生物学、细胞生物学和病毒学的发展,基因治疗已成为一种新型的癌症治疗方法。溶瘤病毒具有病毒治疗和基因治疗的双重功能,显示出极大的优势,有望成为治疗肝细胞癌(HCC)的有效方法[2].鸡贫血病毒(CAV)基因组包含三个部分重叠的开放阅读框,产生一个编码三种不同蛋白质的多顺子非剪接RNA。其中VP3是CAV的功能蛋白,与病毒毒力有关。它是一种致病蛋白,可诱导靶细胞凋亡。VP3基因全长366 bp,编码Apoptin蛋白。Apoptin的活性依赖于其在肿瘤细胞核中的磷酸化和重新定位,而在正常细胞中是不存在的[3.].Apoptin的选择性凋亡作用既不依赖于p53蛋白介导,也不受Bcl-2过表达的抑制,因此被认为是一种新型的具有生物活性的抗肿瘤蛋白,有望改善肿瘤基因治疗[4,5,6,7].
细胞死亡是一个复杂的过程,受到严格的调控。细胞凋亡是目前公认的程序性细胞死亡(PCD)的第一种类型,其作用和调控网络已逐渐明确。然而,细胞凋亡并不是决定细胞死亡命运的唯一过程。自噬已被证实在调节细胞凋亡的同时调节细胞死亡。在某些情况下,自噬抑制细胞凋亡,但也可诱导细胞死亡,或与凋亡共同作用,在凋亡缺陷时作为诱导细胞死亡的备用机制。
大自噬(本课题中的自噬特指大自噬)是一种高容量的过程,起源于胞质双膜对目标蛋白的隔离,形成自噬小体,形成自噬溶酶体,最后降解内部不必要的物质和其他成分。这一过程由30多种蛋白质和调控因子组成[8,9].底物P62 (Sequestosome-1)是一种特异性的自噬底物,可以介导选择性自噬,如有丝分裂。自噬通量通过检测存在和不存在溶酶体抑制剂时p62、LC3-II和其他自噬底物蛋白水平的差异来测量[10].
选择性自噬可以特异性地识别和降解底物,这些底物可以是蛋白质复合物、受损的细胞器和入侵的微生物。线粒体自噬是细胞内自噬的一种形式,在多种病理生理条件下起着重要的促生存作用。线粒体通透性转变(MPT)的改变在线粒体有丝分裂过程中起着重要作用,线粒体去极化与线粒体通透性转变直接相关。在线粒体自噬过程中,去极化的线粒体首先被包裹在自噬体中,然后与溶酶体融合形成自溶酶体,从而降解线粒体[11].研究已经证明了线粒体自噬和帕金森病之间的联系。E3泛素连接酶、Parkin和线粒体激酶Pink1的突变导致帕金森病的常染色体隐性遗传。在Pink1蛋白的作用下,细胞质Parkin蛋白易位到去极化的线粒体表面,促进线粒体蛋白的泛素化,从而诱导线粒体自噬[12,13].除Parkin外,研究表明Nix、BNIP3、FUNDC1在选择性有丝分裂过程中也起重要作用[14].
在我们之前的研究中,构建了过表达Apoptin (Ad-apoptin)的重组5型腺病毒载体(图2)。1E).该传递系统已被证明在细胞中稳定有效地表达蛋白apoptin [15].事实上,使用转染试剂进行异位表达有一些缺点,包括(i)缺乏实验一致性;(ii)由于细胞毒性作用和/或试剂的效率低和不稳定而导致表达减少。在之前的研究中,我们对凋亡素诱导的凋亡和自噬进行了初步研究,发现凋亡素和凋亡的协同作用导致了肿瘤细胞的自噬。
本研究拟利用表达凋亡素蛋白重组病毒Ad-apoptin的人5型腺病毒载体感染肝癌细胞,探讨凋亡素对肝癌细胞是否具有凋亡和自噬作用。本研究还探讨了凋亡素诱导细胞凋亡与自噬的关系,为进一步研究开发基于凋亡素的肿瘤药物提供了新的理论基础。
材料与方法
人肝癌细胞系、重组腺病毒和动物
肝癌细胞株HepG-2和Huh-7由吉林省人畜共患病预防控制重点实验室冷冻保存。我们实验室构建并保存了两种重组腺病毒(Ad-mock和Ad-Apoptin) [15].
雌性BALB/c裸鼠(4 ~ 5周龄)购自北京vital River实验动物科技有限公司,动物实验方案经长春中医药大学机构动物护理与使用委员会(IACUC)批准(批准号:2020119)。所有手术都是在麻醉下进行的。实验结束后,腹腔注射三倍于麻醉剂量的戊巴比妥钠(150 mg/kg)安乐死2-3分钟。安乐死方法参照AVMA动物安乐死指南。
结晶紫染色
将细胞种在12孔板中培养24 h,然后加入重组腺病毒感染(100 MOI)。12、24和48小时后,丢弃细胞上清液,用PBS冲洗井三次。每孔加入600 μL 0.4%结晶紫染色液,室温下10 min,弃液,PBS洗孔3次,置于干燥环境中,拍照分析。
CCK-8化验
制备细胞悬液,加入96孔板培养。取96孔细胞培养板5个不同时间点(6、12、24、48、72 h),在每孔上清中弃去,加入CCK-8试剂,37℃5% CO孵育2在黑暗的地方放置2小时。振荡10 s后,用酶标仪在450nm处测量OD值。
体内肿瘤生长(异种移植)
HepG-2细胞(5 × 106)皮下接种于5周龄BALB/c裸鼠胸部,建立肿瘤模型。将移植小鼠随机分为3组:a 1 × 108PFU/100 μL Ad-apoptin处理组,a 1 × 108PFU/100 μL Ad-mock处理组,对照组。每周测量肿瘤大小,并观察生存率。经过42天的治疗后,动物被安乐死,每个肿瘤都用福尔马林固定。绘制生长曲线,计算肿瘤体积:
免疫化学(包含IHC)
组织切片脱蜡,再水化,在3% H中孵育2O2和甲醇15分钟,以消除内源性过氧化物酶活性。将载玻片置于0.01 M柠檬酸钠缓冲液(pH为6.0)中,在95°C下孵育20分钟,进行抗原提取。然后将载玻片与一抗在4℃下孵育过夜。二抗室温孵育1 h后,DAB进行免疫染色,切片用苏木精反染。这一步之后是IHC平均密度分析。
赫斯特染色法
将细胞种在12孔板中培养24 h,然后加入重组腺病毒感染(100 MOI)。12、24、48 h后收集细胞,加入100 μL Hoechst染色液。细胞在黑暗中染色15 min,取10 μl染色后的细胞混合物,荧光显微镜下分析。
Annexin V-FITC/PI染色
将细胞种在12孔板中培养24 h。孵育后,加入重组腺病毒感染(100 MOI)。然后用fitc偶联Annexin-V凋亡试剂盒处理细胞12、24、48 h,采用流式细胞仪检测细胞凋亡情况。
线粒体膜电位检测
将细胞种在12孔板中培养24 h。培养后,加入重组腺病毒感染(100 MOI)。收集细胞12、24、48 h后,加入100 μL JC-1染色液。细胞在黑暗中染色15 min,然后从染色的细胞混合物中提取10 μL,荧光显微镜下分析。
细胞在96孔板中制备,5% CO孵育237°C孵育24小时。然后将稀释的JC-1溶液加入每个孔,在37°C的黑暗中孵育15分钟。使用微板阅读器确定结果。
西方墨点法
用含蛋白酶抑制剂的RIPA细胞裂解液制备全细胞蛋白提取物。等量的蛋白质样本在10%的SDS聚丙烯酰胺凝胶上分离,并转移到PVDF膜上。用5%脱脂牛奶堵塞膜1-2小时,然后在4℃下与一抗孵育过夜。随后用二抗在室温下孵育2 h,最后用酶联化学发光(ECL)检测试剂盒检测。用化学发光和荧光成像系统对结果进行了定量分析。详细步骤执行如前所述[16].
免疫荧光分析
将细胞种在12孔板(含无菌细胞载玻片)中培养24 h。培养结束后,按组分别加入Ad-apoptin (100 MOI)和不同试剂。48 h后,孔内细胞用4%多聚甲醛固定15 min, 0.5% Triton X-100处理,1%牛血清白蛋白(BSA)堵塞2 h, 4℃一抗孵育过夜,PBS洗涤3次。用FITC或CY3标记的二抗孵育2小时,用蔡司共聚焦显微镜分析细胞。
LC3检测法
pEGFP-LC3转染细胞24 h后用重组腺病毒(100 MOI)感染细胞。12、24、48 h后固定细胞,荧光显微镜下观察。
溶酶体染色试验
将细胞种在12孔板中培养24 h。培养结束后,加入重组腺病毒(100 MOI)。12、24、48 h后收集细胞,加入100μL LTR (Lyso-Tracker Red)染色液。细胞在黑暗中染色15 min后,取10 μl染色细胞混合物,荧光显微镜下分析。
TMRM染色法
将细胞种在12孔板中培养24小时。培养结束后,加入重组腺病毒(100 MOI)。12、24、48 h后收集细胞,加入100μL TMRM和Hoechst染色液。细胞在黑暗中染色15 min,采集染色细胞混合物10 μl,荧光显微镜下分析。
溶酶体和线粒体共定位的观察
将细胞种在12孔板中培养24 h。培养结束后,加入重组腺病毒(100 MOI)。12、24、48 h后收集细胞,加入100μL MTG (Mito-Tracker Green)和LTR染色液。细胞在黑暗中染色15 min,采集染色细胞混合物10 μl,荧光显微镜下分析。
活性氧的检测
将细胞种在12孔板中培养24 h。培养结束后,加入重组腺病毒(100 MOI)。收集细胞12、24、48 h后,加入100 μL DHR染色液。细胞在黑暗中染色30 min,流式细胞术观察ROS水平的变化。
统计分析
使用至少三个独立实验的数据进行统计分析,并使用Pad Prism 8图进行数据处理。随机分析两组间的数据t以及。p < 0.05时差异有统计学意义。
结果
凋亡素对肝癌细胞生长的抑制作用
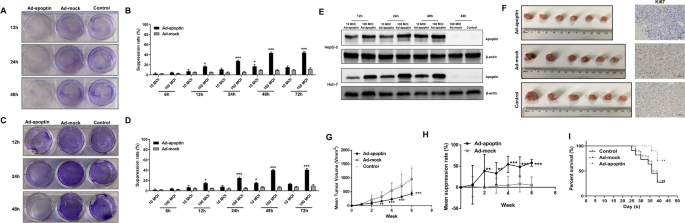
通过结晶紫染色和CCK-8检测,我们分析了apoptin对肝癌细胞的抑制作用(图。1模拟)。我们发现apoptin对肝癌细胞具有显著的细胞毒作用(p < 0.05),并呈剂量依赖性和时间依赖性。通过CCK-8实验,我们发现抑制率在48 h时达到峰值,72 h时的抑制率与48 h时相似(分别为45.02%和42.85%),没有显著差异。然后我们还发现,Ad-apoptin在100 MOI时的抑制作用明显高于10 MOI时。显然,抑制作用与剂量和时间有关。
凋亡素在体内的抗肿瘤作用
我们在裸鼠体内建立了HepG-2细胞皮下肿瘤模型。结果显示,与对照组相比,Ad-mock组肿瘤体积无明显变化,但注射Ad-apoptin后肿瘤体积明显减小,与对照组相比差异有统计学意义(p < 0.05)(图)。1G-H)。Ki67结果显示,注射Ad-apoptin后,肿瘤的增殖能力明显降低。我们还发现,注射Ad-apoptin可以延长小鼠的生存时间,提高存活率(图。1I).上述结果与体外.综上所述,这些结果表明apoptin具有显著的抑制作用体内而在体外,并且它可以显著提高小鼠的存活率。
凋亡素通过线粒体途径诱导细胞凋亡
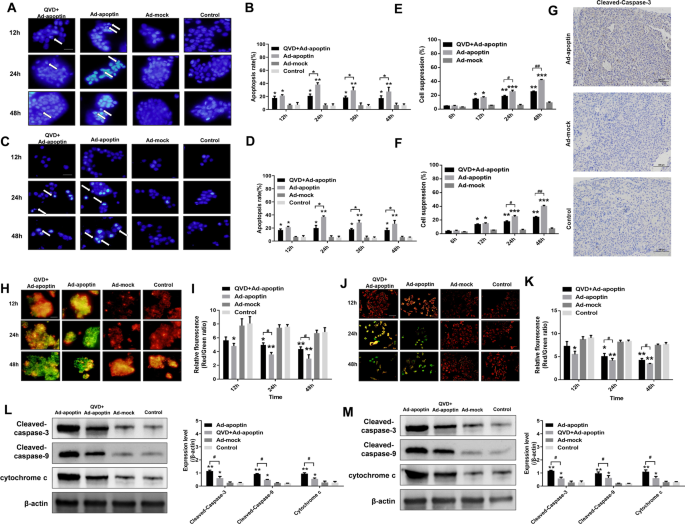
为了分析apoptin是否通过凋亡途径杀伤肝癌细胞,我们进行了Hoechst染色并检测了凋亡水平(图。2模拟)。Hoechst染色显示,在感染后24和48 h,有凋亡素的细胞在12 h开始死亡,观察到大规模的核碎裂和过度染色。模拟组和对照组均未见细胞凋亡。从凋亡水平检测结果来看,凋亡水平从12 h开始升高,24 h时达到峰值(HepG-2为32.13%,hu -7为26.74%)(补充文件)1:图S1A-B)。加入caspase抑制剂QVD后,凋亡素诱导的肝癌细胞凋亡和抑制率显著降低(图。2E, F).免疫组化结果也显示apoptin可显著提高caspase-3的表达水平(图。2G)。
凋亡素诱导肝癌细胞死亡的途径。HepG-2细胞凋亡(一个,B)和Huh-7 (C,D)采用Hoechst和Annexin V-FITC/PI染色检测。在Ad-apoptin感染的细胞中加入caspase抑制剂QVD (20 μM)后,HepG-2的抑制率(E)和Huh-7 (F)用CCK-8法检测。(G)免疫组化检测cleaved caspase-3在异种移植瘤组织中的表达。JC-1染色法分析HepG-2线粒体膜电位(MMP)变化H,我)和Huh-7 (J,K)细胞。(l,米) Western blot检测线粒体凋亡通路相关蛋白表达。比例尺等于100µm。数据代表三个独立的实验(n = 3)。未配对的学生t-test被使用。*p< 0.05, **p< 0.01, ***p< 0.001。(#p< 0.05,# #p与Ad-apoptin相比< 0.01)
为了确定apoptin是否通过线粒体凋亡途径杀伤肝癌细胞,我们首先进行了JC-1染色试验(图。2H-K)。凋亡素处理细胞后,线粒体膜电位逐渐降低。随着时间的推移,凋亡细胞数量逐渐增多,细胞呈大量去极化状态。同时使用Ad-apoptin和QVD处理的细胞线粒体膜电位均显著升高,红色荧光/绿色荧光比值显著高于Ad-apoptin组。此外,我们还分析了线粒体通路相关蛋白caspase-3、9和细胞色素c的表达水平,发现这些蛋白的表达明显升高。此外,QVD的加入抑制了这些蛋白的表达(图。2L, M)。上述结果表明,凋亡素可能通过激活线粒体凋亡通路诱导HCC细胞凋亡。
自噬活性的变化
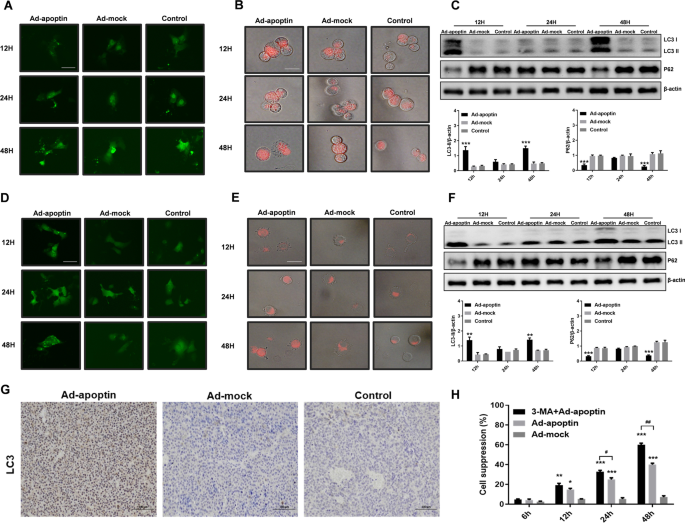
接下来,我们分析了apoptin治疗肝癌细胞后是否影响自噬水平。如图所示。3.A-E, Ad-apoptin组细胞12 h时LC3绿色荧光明显,24 h时保持不变,48 h时荧光明显增加。同样,溶酶体染色结果与LC3实验相似。红色荧光在12 h时增加,24 h时保持不变,48 h时达到最高,表明apoptin可以抑制肝癌细胞的生长,影响自噬。
自噬对凋亡素诱导的肝癌细胞凋亡影响的鉴定。HepG-2细胞LC3荧光变化分析(一个)和Huh-7 (D)细胞使用LC3-GFP质粒。HepG-2 LTR染色后(B)和Huh-7 (E)细胞,荧光显微镜观察溶酶体荧光强度的变化。Western blot分析HepG-2中自噬和凋亡相关蛋白的表达水平(C)和Huh-7 (F)细胞。G用免疫组化法检测肿瘤组织中裂解LC3的表达。H在Ad-apoptin感染的细胞中加入自噬抑制剂3-MA (2 mM)后,采用CCK-8法检测HepG-2和Huh-7细胞的抑制率。比例尺等于50µm。数据代表三个独立的实验(n = 3)。未配对的学生t-test被使用。*p< 0.05, **p< 0.01, ***p< 0.001。(#p< 0.05,# #p与Ad-apoptin相比< 0.01)
随后,分析自噬相关蛋白的水平(图。3.C, F, G)。添加Ad-apoptin后,LC3水平先升高后降低,再升高,而P62的趋势与LC3相反。上述结果表明,凋亡素可以影响肝癌细胞的自噬水平。
此外,我们还分析了自噬的增加是否影响凋亡素介导的肝癌细胞杀伤。结果表明,抑制自噬可显著提高凋亡素对肝癌细胞的杀伤效果,48 h时抑制率可达62.83%(图;3.H)。
凋亡素介导的细胞凋亡对自噬的影响
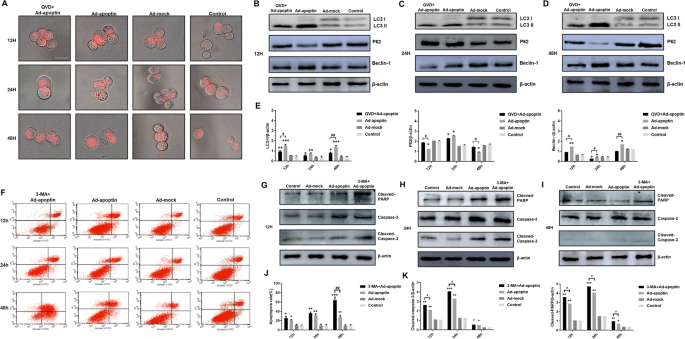
为了分析凋亡素诱导的凋亡是否影响自噬,首先用LTR染色肝癌细胞(图。4A).加入QVD后,溶酶体数量明显减少,说明抑制凋亡可显著降低自噬水平。
随后,检测到自噬相关蛋白(图;4抵扣)。在抑制细胞凋亡后,我们发现自噬相关蛋白LC3-II和Beclin-1的表达水平显著降低,而p62的表达水平显著升高(p < 0.05)。上述结果表明,减少凋亡可以减少凋亡素介导的自噬的增加,且凋亡水平越高,影响越大。
自噬对细胞凋亡的影响
接下来,为了分析自噬是否影响凋亡素诱导的凋亡,我们首先检测了凋亡水平(图。4F, J).抑制自噬后,我们发现凋亡素诱导的凋亡明显增加,并超过凋亡素单独组的凋亡水平(p < 0.05)。48 h时凋亡率最高,为63.54%。上述结果表明,抑制自噬可显著增加凋亡素介导的肝癌细胞凋亡。
检测细胞凋亡相关蛋白。加入3-MA后,我们发现PARP和Caspase-3的表达水平明显升高(图。4G-K)。从12 h开始,3-MA + Ad-apoptin组细胞凋亡相关蛋白水平持续高于Ad-apoptin组(p < 0.05)。以上结果再次表明,抑制自噬可显著提高凋亡素介导的细胞凋亡水平。
凋亡素可引起线粒体自噬
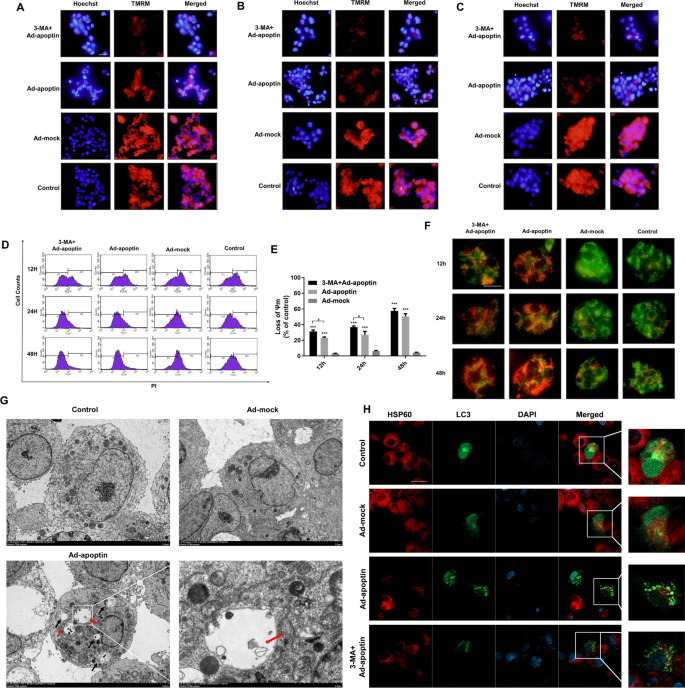
采用TMRM染色进一步分析自噬对线粒体的影响(图。5a e)。在12和24 h,自噬抑制显著降低线粒体膜电位,表明线粒体去极化加重(p < 0.05)(图。5D, E)。这表明线粒体去极化水平与凋亡素诱导的自噬有关。
接下来,使用MTG染色和LTR染色进一步分析线粒体与自噬的关系(图。5F). 12 h后,线粒体绿色荧光减弱,溶酶体红色荧光增强。24 h时,红色荧光减弱,绿色荧光继续减弱。48 h后,我们发现线粒体绿色荧光的减弱最为明显,溶酶体红色荧光的增强也最为显著。抑制自噬后,红色和绿色荧光均下降,绿色荧光迅速下降。有趣的是,在Ad-apoptin组中,红色荧光增加和绿色荧光减少的细胞区域在同一位置。
随后,电镜观察显示,在线粒体受损的Ad-apoptin组中存在大量自噬体(图。5然后,我们分析了线粒体表面蛋白和LC3的定位,发现在Ad-apoptin组中存在许多共定位,其中绿色荧光和红色荧光叠加产生橙色荧光。加入3-MA后,共定位现象明显减少(图。5H).上述结果表明,当apoptin抑制肝癌细胞增殖时,受损的线粒体通过自噬降解。
ROS调节肝癌细胞凋亡素的细胞毒作用
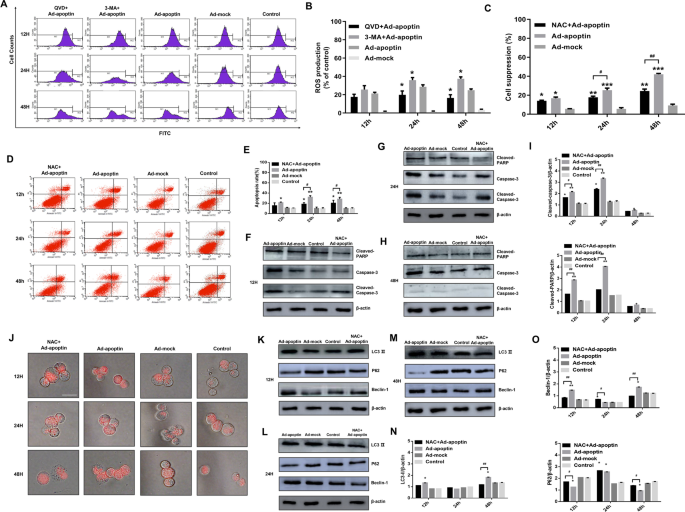
为了分析apoptin在抑制肝癌细胞增殖时是否影响ROS水平,我们分析了ROS水平(图2)。6A, B).从12 h开始,Ad-apoptin组的ROS水平逐渐升高,在24 h达到峰值。在抑制凋亡后,我们发现apoptin诱导的ROS水平有不同程度的降低。抑制自噬后,我们发现ROS水平明显提高(p < 0.05)。上述结果表明,apoptin可引起ROS水平的显著升高,且这种升高与凋亡和自噬密切相关。
ROS在凋亡素介导的自噬和凋亡中的作用。一个,BDHR染色定量分析ROS水平变化。C在Ad-apoptin感染的细胞中加入ROS抑制剂NAC (10 mM)后,采用CCK-8法检测HepG-2细胞的抑制率。D,EAnnexin-V FITC/PI法定量分析细胞凋亡变化。F,我.Western blot检测凋亡相关蛋白表达。JLTR染色后,荧光显微镜下观察溶酶体荧光强度的变化。K- - - - - -OWestern blot检测自噬相关蛋白表达。比例尺等于50µm。数据代表三个独立的实验(n = 3)。未配对的学生t-test被使用。*P< 0.05, **p< 0.01, ***p< 0.001。(#p< 0.05,# #p与Ad-apoptin相比< 0.01)
随后,通过CCK-8实验,我们发现在抑制ROS水平后,apoptin对肝癌细胞的抑制作用显著降低(图。6C).此结果与抑制细胞凋亡后的结果相似。提示凋亡素可能通过增加ROS水平诱导肝癌细胞死亡。
ROS调节细胞凋亡和自噬变化
为了分析ROS是否会影响细胞凋亡和自噬,我们对细胞自噬和细胞凋亡进行了定性和定量分析。首先,我们发现抑制ROS可以降低凋亡素介导的细胞凋亡水平(图。6D, E),然后分析细胞凋亡相关蛋白水平的变化(图。6外:我)。通过分析凋亡相关蛋白水平,我们发现抑制ROS后,可显著降低aved- parp和aved- caspase -3的表达水平(p < 0.05)。上述结果表明,ROS可影响凋亡素介导的肝癌细胞凋亡。
随后,我们进行溶酶体染色分析(图。6J)抑制ROS后。我们发现apoptin诱导的溶酶体红色荧光在48 h时逐渐下降,明显弱于Ad-apoptin组。然后我们分析了自噬相关蛋白的水平(图。6k o)。抑制ROS后,LC3-II和Beclin-1表达水平显著降低,p62表达水平显著升高(p < 0.05)。上述结果表明,ROS也能显著影响凋亡素介导的肝癌细胞自噬。
NIX是凋亡素诱导肝癌细胞有丝分裂的关键蛋白
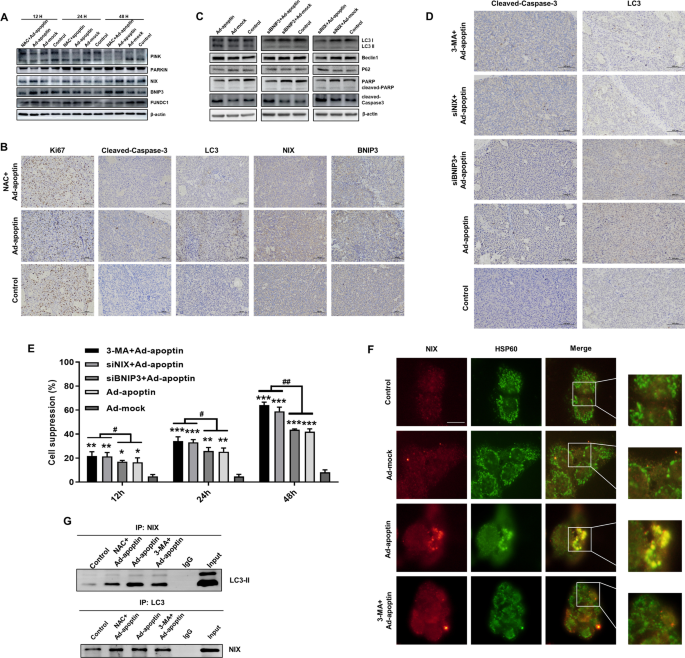
为了进一步分析有丝分裂是否被诱导,我们研究了有丝分裂相关蛋白的表达。结果显示,NIX和BNIP3表达的变化与自噬相关蛋白的变化相似,添加NAC后,NIX表达的下降更为明显(图。7A).在免疫组化实验中,我们也发现apoptin可以增加细胞凋亡和自噬水平,增加NIX和BNIP3的表达。抑制ROS可显著降低细胞凋亡和自噬水平,降低NIX的表达水平(图。7B).沉默NIX和BNIP3后,我们发现沉默NIX在增加cleave - parp、cleave -caspase-3和p62水平以及降低LC3 II和beclin1水平方面比沉默BNIP3显著有效(图2)。7C).免疫组化也得到类似结果(图;7D).为了分析NIX和BNIP3在凋亡素诱导的自噬中的作用,我们分析了沉默NIX和BNIP3抑制自噬后凋亡素对肝癌细胞的抑制作用。无论是添加3-MA,还是沉默NIX,都观察到类似的结果,但siBNIP3 + apoptin组与单独apoptin组的结果没有显著差异(图。7E)。
NIX蛋白对凋亡素诱导肝癌细胞有丝分裂的影响。一个在Ad-apoptin感染的细胞中加入ROS抑制剂NAC后,用Western blot法检测有丝分裂相关蛋白水平。B免疫组化检测LC3、cleaved caspase-3、NIX、BNIP3、Ki67在异种移植瘤组织中的表达。CWestern blot检测沉默NIX和BNIP3后MCF-7/ADR细胞凋亡和自噬相关蛋白表达水平的变化。D沉默NIX和BNIP3后,免疫组化检测LC3和cleaved caspase-3在异种移植瘤组织中的表达。E沉默NIX和BNIP3后,采用CCK-8法检测HepG-2细胞的抑制率。F免疫荧光染色分析NIX和HSP60共定位。G免疫共沉淀法分析LC3与NIX的相互作用。比例尺为20µm。数据以均值±SD (*p< 0.05, **p< 0.01, ***p与对照组相比< 0.001)
我们还用3-MA抑制自噬,并分析了NIX和线粒体膜蛋白的定位(图。7F).结果表明,这些蛋白在Ad-apoptin组共定位。抑制自噬后,这一事件显著减少。最后,我们进行了免疫沉淀实验,发现在Ad-apoptin组中,NIX与LC3之间存在相互作用,而抑制自噬和ROS后,NIX与LC3之间的相互作用明显降低(图。7以上结果表明,凋亡素可以介导肝癌细胞有丝分裂的发生,而NIX是凋亡素诱导有丝分裂的关键蛋白。
讨论
癌症是世界上最严重的疾病之一,其发病率和死亡率正在迅速上升,严重威胁着人类的健康。在所有癌症中,肝癌的发病率和死亡率也在逐年上升。肝细胞癌(HCC)是一种高度恶性肿瘤,具有隐蔽性强、侵袭性强、进展快等特点。目前,手术和化疗仍是肝癌的主要治疗手段。肝癌患者虽然采用化疗治疗,但由于化疗耐药,大多数患者会在短时间内复发。目前耐药机制尚不清楚,治疗患者在化疗过程中也会出现严重的毒性反应。虽然在精准医疗方面取得了一些成果,如分子靶向治疗、免疫治疗等,但由于研究样本量小、结果不一致等原因,这些研究大多仍处于二线以上临床阶段。
凋亡素是一种诱导肿瘤细胞特异性凋亡的蛋白,由于不受p53或Bcl-2过表达的抑制,被认为是一种新的抗肿瘤生物制剂。通过对凋亡素的研究,也有望解决癌症治疗中效率低、特异性差、耐药等问题。
在本研究中,我们首先通过多种研究方法分析了凋亡素对肝癌细胞的细胞毒作用体内而在体外实验。我们发现apoptin可以显著导致肝癌细胞死亡,之前在其他肿瘤细胞类型中也得到了类似的结果[4,7,15,17,18,19].此外,我们还发现apoptin对肝癌细胞的杀伤能力高于对其他肿瘤细胞的杀伤能力,这表明apoptin在肝癌的治疗中可能具有更高的潜在治疗效果。有趣的是,我们的体内实验表明,凋亡素不仅能抑制肿瘤的生长,还能延长小鼠的生存时间。因此,apoptin可显著杀伤肝癌细胞体内而在体外.
研究表明,凋亡素主要通过凋亡来杀伤多种肿瘤细胞[20.],例如通过激活人骨肉瘤细胞系(Saos-2)中的caspases来启动细胞凋亡[21].Apoptin也通过死亡受体独立途径杀死Jurkat T细胞[22].在本研究中,我们发现apoptin显著增加细胞凋亡水平,添加caspase抑制剂后,apoptin对肝癌细胞的杀伤作用显著降低。这一结果与其他研究结果相似,表明凋亡素主要通过凋亡来杀伤各种肿瘤细胞[20.].随后对线粒体膜变化的分析表明,凋亡素可显著损伤线粒体,导致细胞去极化。上述结果表明,凋亡素可通过内源性凋亡途径杀伤肝癌细胞。
自噬是指以细胞质中出现自噬体为标志的细胞自我消化过程。受损、变性或衰老的蛋白质和细胞器被运送到溶酶体,在那里它们被消化和降解。研究表明,肿瘤与自噬密切相关,临床许多调节自噬的药物在肿瘤治疗中发挥着重要作用。在这里,我们通过染色自噬相关蛋白和溶酶体来分析这一事件,以研究凋亡素如何杀死HCC细胞,同时也影响具有保护反应的自噬。
研究表明,外部因素刺激细胞可引起自噬,从而导致细胞凋亡[23].这两种细胞程序性死亡的关系可以分为以下几类:(i)自噬可以缓解环境对细胞的应激状态,从而维持细胞的正常功能[24];(ii)自噬可促进细胞凋亡。通过提供死亡或激活caspase活性所需的ATP [25,26,27,28];(iv)自噬可通过降解受损的细胞器,维持正常的细胞功能,如线粒体功能(即线粒体自噬),从而抑制细胞凋亡[29,30.,31].
在这里,我们研究了凋亡素诱导的凋亡与自噬的关系。我们发现抑制细胞凋亡可以降低凋亡素介导的肝癌细胞自噬水平。相反,抑制自噬可增加凋亡素介导的肝癌细胞凋亡水平。此外,我们分析了自噬对线粒体的影响,发现自噬可能对凋亡素诱导的线粒体膜电位(MMP)变化有一定的影响。然后,我们分析了线粒体与溶酶体之间的关系。我们首次发现线粒体和溶酶体共定位。随后,我们观察到LC3和HSP60的共定位,发现这两个蛋白在apoptin处理后具有很强的共定位。因此,我们初步判断,apoptin可能诱导自噬吞噬受损的线粒体。
ROS作为线粒体损伤的重要因素,在本研究中发挥了重要作用。我们发现apoptin可以增加肝癌细胞ROS的水平,ROS可以影响细胞凋亡和自噬的变化。同样,细胞凋亡和自噬也会影响ROS的水平。这说明凋亡素可以通过调节ROS水平来影响细胞凋亡和自噬。
接下来,为了进一步探讨凋亡素是否诱导有丝分裂,我们研究了有丝分裂相关蛋白的表达。结果表明,观察到的NIX表达变化趋势与凋亡素诱导肝癌细胞自噬变化趋势相似。我们还观察到,NIX表达的改变可能显著影响自噬水平。随后,抑制ROS也可以显著降低NIX的表达水平。最后,通过免疫沉淀实验,我们发现NIX与LC3之间存在明显的相互作用,而抑制自噬和ROS后,NIX与LC3之间的相互作用明显减少。以上结果表明,NIX是凋亡素诱导有丝分裂的关键蛋白。
结论
综上所述,apoptin可显著杀伤肝癌细胞,主要是通过内源性凋亡,对自噬有显著影响。当凋亡素通过诱导凋亡杀死肝癌细胞时,自噬起保护作用。通过多层次的研究,我们发现凋亡素诱导ROS水平升高导致肝癌细胞线粒体跨膜潜能丧失,导致细胞凋亡和线粒体自噬以及NIX蛋白的募集。这一过程中产生的自噬是一种抑制细胞凋亡的保护机制。因此,我们的研究表明ROS可能是连接凋亡素诱导的肝癌细胞凋亡和自噬的关键因素。
数据和材料的可用性
本研究中使用和分析的数据集可根据合理要求从通讯作者处获得。
缩写
- ROS:
-
活性氧
- 纤毛运动:
-
程序性细胞死亡
- 骑兵:
-
鸡贫血病毒
- DRs:
-
死亡受体
- FADD:
-
浮点加法
- Atg:
-
Autophagy-related基因
- 我:
-
多重感染
- QVD:
-
Q-VD-OPh
- DMEM:
-
杜尔贝科的改良鹰媒体
- 南京:
-
N乙酰半胱氨酸
- LTR:
-
Lyso-Tracker红
- MTG:
-
Mito-Tracker绿色
参考文献
Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, Bray F. 2020年全球癌症统计:全球185个国家36种癌症的发病率和死亡率。中华癌症杂志。2021;71:209-49。
顾东,Kelly TN,吴旭,陈杰,Samet JM,黄建峰,朱敏,陈建昌,陈晨晨,段欣,等。中国吸烟导致的死亡率。中华医学杂志,2009;36(1):59 - 61。
Backendorf C, notborn MHM。凋亡蛋白是一种安全有效的抗癌疗法。在:格林S,编辑。抗癌基因。伦敦:施普林格伦敦;2014.39-59页。
刘玲,吴伟,朱刚,刘玲,管刚,李霞,金宁,迟波。hTERT启动子驱动的表达凋亡蛋白的溶瘤腺病毒在胃癌中的治疗作用。中华药理学杂志,2012;30:457 - 457。
张敏,王娟,李超,胡楠,王凯,吉宏,何东,全春,李霞,金楠,李艳。表达凋亡素的双癌特异性溶瘤腺病毒对前列腺癌的强生长抑制作用。中华医学杂志,2013;
齐颖,郭辉,胡楠,何东,张松,楚莹,黄艳,李霞,孙玲,金楠。新型双癌特异性溶瘤腺病毒Ad-hTERT-E1a-Apoptin的临床前药理和毒理学研究。中国药理学杂志。2014;280:362-9。
杨刚,孟X,孙玲,胡楠,姜松,盛勇,陈震,周勇,陈冬,李霞,金楠。一种双癌特异性溶瘤腺病毒对结直肠癌的体内外抗肿瘤作用。Exp Ther Med. 2015; 9:327-34。
Levy JMM, Towers CG, Thorburn A.靶向自噬治疗癌症。癌症杂志。2017;17:528-42。
水岛N, Yoshimori T, Ohsumi Y. Atg蛋白在自噬体形成中的作用。细胞发育生物学,2011;27:7 7 - 32。
Klionsky DJ, Abdelmohsen K, Abe A, Abedin MJ, Abeliovich H, Acevedo Arozena A, Adachi H, Adams CM, Adams PD, Adeli K,等。用于监测自噬测定的使用和解释指南(第3版)。自噬。2016;十二1 - 222。
Youle RJ, Narendra DP。有丝分裂机制。中国生物医学工程学报。2011;12:9-14。
Youle RJ, Narendra DP。有丝分裂机制。中国生物医学工程学报。2010;12:9-14。
伦德拉D,田中A,孙东芳,有乐RJ。帕金被选择性地招募到受损的线粒体,并促进它们的自噬。中国生物医学工程学报(英文版)。2008;
Tolkovsky。Mitophagy。生物化学学报(英文版);2009;
李霞,刘勇,文志,李超,陆华,田明,金凯,孙林,高鹏,杨娥,等。在体外和体内表达凋亡素的双特异性溶瘤腺病毒的强抗肿瘤作用。摩尔癌症。2010;9:10。
李霞,金宁,米智,连红,孙玲,李霞,郑慧。表达Apoptin的重组鸡痘病毒的体内外抗肿瘤作用。国际癌症杂志。2006;119:2948-57。
金健,朱勇,孙峰,陈震,陈松,李勇,李伟,李敏,崔超,崔勇,等。双癌特异性溶瘤腺病毒与顺铂联合抗肺癌细胞的协同抗肿瘤作用。《科学通报》2018;16:6275-82。
陈松,李永强,尹晓珍,李世珍,朱永利,范友友,李文杰,崔永利,赵娟,李霞,等。表达凋亡素的重组腺病毒抑制MCF7乳腺癌细胞的生长并影响细胞自噬。Oncol代表2019;41:2818-32。
崔彩霞,李永强,孙玉军,朱永利,方剑杰,白波,李文杰,李世忠,马一智,李旭,等。双癌特异性溶瘤腺病毒对前列腺癌PC-3细胞的抗肿瘤作用Urol Oncol. 2019;37:352 e351-352 e318。
张超,周东。腺病毒载体对抗传染病和癌症的策略。Hum Vaccin Immunother. 2016; 12:2064-74。
Danen-van Oorschot AA, van Der Eb AJ, Noteborn MH.鸡贫血病毒来源的蛋白凋亡蛋白需要激活caspases来诱导人肿瘤细胞凋亡。中国病毒学杂志,2000;74:7072-8。
Maddika S, Booy EP, Johar D, Gibson SB, Ghavami S, Los M.凋亡素的癌症特异性毒性与死亡受体无关,但涉及线粒体膜电位的丧失和通过nur77依赖通路释放线粒体细胞死亡介质。中国生物医学工程学报,2005;
王晓明,王晓明。巯基嘌呤诱导的癌细胞凋亡与自噬通路的相互作用:活性氧的作用。Oncotarget。2016;7:75616-34。
Bcl-2凋亡开关在癌症发展和治疗中的作用。致癌基因。2007;26:1324-37。
陈建平,陈建平,陈建平,等。死亡相关蛋白激酶(DAPK)在细胞程序性死亡中的作用。Febs j . 2010; 277:58-65。
Espert L, Denizot M, Grimaldi M, Robert-Hebmann V, Gay B, Varbanov M, Codogno P, Biard-Piechaczyk M.自噬参与了HIV-1包膜蛋白与CXCR4结合后的T细胞死亡。中华临床医学杂志,2006;
Yu L, Alva A, Su H, Dutt P, Freundt E, Welsh S, Baehrecke EH, Lenardo MJ。caspase-8调控自噬细胞死亡的ATG7-beclin 1程序科学。2004;304:1500-2。
于磊,Lenardo MJ, Baehrecke EH。自噬和半胱天冬酶:一种新的细胞死亡程序。细胞周期。2004;3:11 124 - 6。
王志强,王志强,王志强。泛素介导的选择性自噬细胞识别及其研究进展。中国生物医学工程学报。2010;12:836-41。
Levine B, Klionsky DJ。自我消化发育:自噬的分子机制和生物学功能。开发细胞,2004;6:463-77。
Kirkin V, McEwan DG, Novak I, Dikic I.泛素在选择性自噬中的作用。生物化学学报。2009;34:359 - 69。
确认
作者在此向EditSprings (https://www.editsprings.cn)查阅所提供的专业语言服务。
资金
本工作由长春中医药大学青年科学家培养计划(批准号:)资助。吉林省教育厅科技研究计划项目(批准号:QNKXJ2-2021ZR13);JJKH20220873KJ)、吉林省重大疾病预防控制重大科技专项(批准号:20210303002SF)、吉林省重要病原生物疫苗研究计划(批准号:19SWAQ08)、吉林省青年科技人才支撑计划(批准号:20210303002SF);QT202111)。
作者信息
作者及隶属关系
贡献
构思设计实验:YL、XL、JF、YZ。进行实验:超尚、YZ、WL、SL、XL、ZL、GS、NJ。分析数据:YL, XL, LS和YZ。贡献试剂/材料/分析工具:YZ、CS、ZL、SL、JC、BB。撰写论文:YL和YZ。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
遵守了所有适用的国际、国家和/或机构的动物护理和使用指南。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1
.凋亡素处理肝癌细胞凋亡水平变化的流程图。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
李,杨,尚,C,刘,Z。et al。凋亡素通过调控肝细胞癌的ROS水平介导有丝分裂和内源性凋亡。小区公共信号20.134(2022)。https://doi.org/10.1186/s12964-022-00940-1
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12964-022-00940-1
关键字
- Apoptin
- 人类肝癌
- 细胞凋亡
- 自噬
- ROS