摘要
单核细胞表达多种受体,监测和感知环境变化。单核细胞具有高度的可塑性和异质性,并在环境刺激下改变其功能表型。来自小鼠和人类研究的证据表明,单核细胞增多症可以是各种炎症性疾病的一个指标。单核细胞可分化为炎症亚群或抗炎亚群。在组织损伤或感染时,单核细胞迅速被招募到组织中,在那里它们可以分化为组织巨噬细胞或树突状细胞。鉴于单核细胞在广谱炎症疾病中的研究进展迅速,有必要总结一下我们在单核细胞异质性及其在人类疾病中的影响方面的知识。在这篇综述中,我们描述了目前对人类和小鼠单核细胞异质性的认识,单核细胞不同亚群的功能,以及单核细胞分化的潜在机制。我们强调炎性单核细胞亚群是包括心血管疾病在内的炎性疾病的有价值的生物标志物。
简介
单核细胞的主要作用被认为是感知环境并补充巨噬细胞和树突状细胞池。免疫学研究的最新进展发现,单核细胞具有异质性,根据特定的表面标记可以分为三个亚群,每个亚群具有特定的功能。在稳态状态下,循环单核细胞的半衰期约为1 ~ 3天,并维持稳定的单核细胞亚群组成。
鉴定的单核细胞亚群表现出不同的病理生理作用。经典的炎症单核细胞配备了一组toll样受体(TLRs)和清道夫受体,识别病原体相关分子模式(PAMPs),并通过吞噬作用去除微生物、脂质和死亡细胞。它们产生细胞因子、髓过氧化物酶和超氧化物等效应分子,并引发炎症[1].
炎性单核细胞选择性地运输到炎症部位,产生炎性细胞因子,导致局部和全身炎症[2].它们具有高度浸润性,可分化为炎性巨噬细胞,清除PAMPs和细胞碎片。稳定状态下,巡逻抗炎单核细胞巡逻脉管系统监测PAMPs并成为组织常驻巨噬细胞。在炎症过程中,它们分化为抗炎巨噬细胞,修复受损组织[3.].
小鼠单核细胞亚群的分类及其功能测定一直是一致的,并被广泛接受[4].然而,与炎症或抗炎功能表型相关的人类单核细胞亚群的分类仍然部分未明确。在这里,我们打算回顾目前对单核细胞异质性的理解,并整合小鼠和人类单核细胞分类的知识。
单核细胞增多症和异质单核细胞
20世纪70年代首次报道,单核细胞增加骨髓(BM)的增殖活性以应对炎症刺激,导致单核细胞增多,[5反映循环单核细胞数量增加的临床状况。
新兴的临床分析显示,心血管疾病(CVD)中单核细胞增多症的患病率较高(表1).与稳定型冠状动脉疾病(CAD)患者相比,急性心肌梗死(AMI)患者单核细胞计数增加[6].外周单核细胞增多与左室功能障碍和左室动脉瘤有关,提示单核细胞可能在AMI再灌注后左室重塑的发展中发挥作用[7].在CAD患者中,单核细胞增多症也与高密度脂蛋白(HDL)水平降低和肾功能受损有关[8].已证明单核细胞计数是CVD的一个更好的独立危险因素,优于一些传统的危险因素,如c反应蛋白(CRP)、炎症细胞因子白细胞介素-6 (IL-6)、纤维蛋白原、高血压和吸烟[9].用普伐他汀(一种降胆固醇药物)治疗冠状动脉疾病患者6个月可减少斑块体积和单核细胞计数,这意味着单核细胞增多是冠状动脉粥样硬化消退的潜在靶点[10].
在定义单核细胞增多症后,类风湿关节炎和皮肤血管炎患者单核细胞吞噬能力降低[11].淋巴细胞减少症患者有抑制单核细胞,无法激活t细胞[12].这些发现提示存在异质单核细胞群。对这些群体不同功能特性的进一步研究发现,CD16 (Leu-11),一种Fc受体(FcR),因为它结合到抗体的Fc区(常数区),在单核细胞表面表达,并与患者的动脉粥样硬化和CVD以及培养的单核细胞和循环单核细胞的炎症表型相关[13].的CD16+单核细胞一直被认为是人类炎症性单核细胞亚群[14].
小鼠单核细胞亚群
小鼠单核细胞亚群首先通过趋化因子受体CCR2的差异表达被鉴定。CCR2+亚群迁移入渗能力高于CCR2-亚群,最初被认为是小鼠炎性单核细胞[15].随后,小鼠单核细胞亚群以炎症单核细胞标记物Ly6C (Gr1)的差异表达为特征。现在公认小鼠单核细胞亚群被归为Ly6C+(进一步分为Ly6C高+ Ly6C中间)和Ly6C-(也称为Ly6C低基于细胞表面Ly6C表达水平的单核细胞亚群2).Ly6C的表面标记和趋化因子受体+子集是CD11b+CD115+和CCR2高CX3CR1低.而Ly6C的表面标记物和趋化因子受体-单核细胞为CD11b+CD115+和CCR2低CX3CR1高[16].
小鼠单核细胞亚群的功能特性
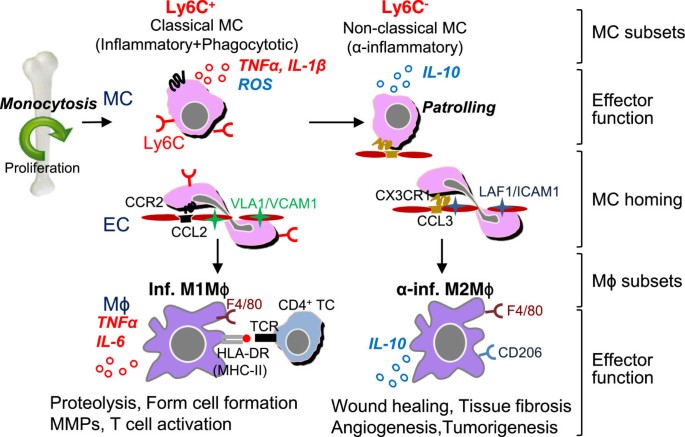
如图所示1,小鼠Ly6C+单核细胞在细菌感染时具有很强的吞噬能力、分泌ROS、TNFα、一氧化氮、IL-1β、少量IL-10等抗菌能力[17]和大量的1型干扰素(IFN)对病毒配体的反应[18].Ly6C中的CCR2-CCL2信号+单核细胞改变VCAM-1配体vra -4 (α4β1整合素)的构象变化,导致高亲和相互作用和单核细胞转运(图1).在血管炎症中,Ly6C+单核细胞通过趋化因子受体CCR2的相互作用优先被招募到炎症组织中[19],更有可能成熟为炎性M1巨噬细胞,其特征是促炎细胞因子、TNFα和IL-6的分泌,并有助于组织退化和T细胞激活。
老鼠MC和Mϕ分化,和不同的子集函数。鼠标Ly6C+MCs以cc -趋化因子受体2 (CCR2)依赖的方式离开骨髓。稳态是Ly6C+MCs分化为Ly6C-流通中的MCs。Ly6C-MCs通过互补对CX3CR1/CCL3的相互作用,通过LAF/ icam1依赖的方式被招募到正常组织中,并成为组织常驻Mϕ/DCs。Ly6C+MCs具有很强的抗微生物能力,因为它们具有强大的吞噬能力,并分泌ROS, TNFα和IL-1β,而Ly6C-MCs分泌抗炎细胞因子IL-10在活的有机体内细菌感染。在血管炎症中,Ly6C+MCs通过VLA-1/ vcam1依赖的方式通过相互作用互补对CCR2/CCL2(MPC-1)被栓住并入侵组织,然后成熟为炎性m1mφ。m1mφ通过促炎细胞因子、TNFα和IL-6的分泌来区分,并有助于组织退化和T细胞激活。Ly6C-MCs被招募到组织中并分化为m2mφ,分泌抗炎细胞因子,有助于组织修复。TC, T细胞;MC单核细胞;米ϕ,巨噬细胞;电子商务,内皮细胞;直流,树突细胞;正,炎症;α负无穷。抗炎;细胞受体, T细胞受体;HLA-DR,人白细胞抗原DR(主要组织相容性复合体II类(MHC-II))。
稳态时,Ly6C+单核细胞分化为Ly6C-循环中的单核细胞。该亚群巡逻于小血管内皮管腔侧,并通过趋化因子受体CX3CR1依赖于af -1/ icam1与内皮结合。单核细胞的巡逻行为可能是由于粘附分子的低水平表达。Ly6C-单核细胞分泌抗炎细胞因子IL-10在活的有机体内细菌感染。在血管炎症中,Ly6C-单核细胞被招募到组织中,更容易分化为M2巨噬细胞,分泌抗炎细胞因子,有助于组织修复(图1) [20.].
招募的单核/巨噬细胞可能从血管迁移并进入淋巴结,这与动脉粥样硬化病变的消退有关[21].值得注意的是,包括Ly6C在内的白细胞表达CD62L (l -选择素)+单核细胞,对通过高内皮小静脉(HEV)循环至淋巴结很重要[15].Ly6C选择性表达了参与淋巴结转运的趋化因子受体CCR7和CCR8中间单核细胞(22].
人类单核细胞亚群
由于CD14在人单核细胞和巨噬细胞表面大量表达,因此被用来标记人单核细胞。与CD14相比+CD16-(也被描述为CD14明亮的CD16-)单核细胞,人类CD14+CD16+(也被描述为CD14昏暗的CD16+)单核细胞亚群的吞噬能力降低,产生的活性氧(ROS)减少,并表达较低水平的CCR2(炎症期间介导单核细胞趋化的趋化因子受体)和较高水平的CX3CR1(介导驻留单核细胞聚集的趋化因子受体)[23].因为趋化因子表达模式暗示CD16+单核细胞具有抗炎功能,对人类单核细胞亚群的表征存在混淆[23].然而,CD14+CD16+单核细胞也表达CCR2,并与克罗恩病相关[24]和CVD [25].一些早期的临床研究使用了CD14+CD16+作为炎性单核细胞标准,并建立了CD14水平升高的相关性+CD16+单核细胞在人类炎症性疾病中的作用,包括类风湿关节炎、冠状动脉疾病、动脉粥样硬化、噬血细胞综合征和克罗恩病(表3.).此外,循环CD16+单核细胞水平与致动脉粥样硬化脂质水平呈正相关[26]及斑块易损性[27],而与AMI后左室射血分数等心功能呈负相关[28].CD16显著增加+单核细胞水平在肥胖的人类慢性病理中也有描述[29].在同一研究中,有几组报告了CD14的差异表达昏暗的和CD14高在CD16+单核细胞(26,30.],这与趋化因子受体表达模式的不同功能特性有关[31].单核细胞生物学领域的一个主要专家小组在2010年提出了人类单核细胞亚群的共识命名法,并将人类单核细胞亚群分类为经典单核细胞(CD14)++CD16-),中间单核细胞(CD14++CD16+)和非经典单核细胞(CD14+CD16++) [32].
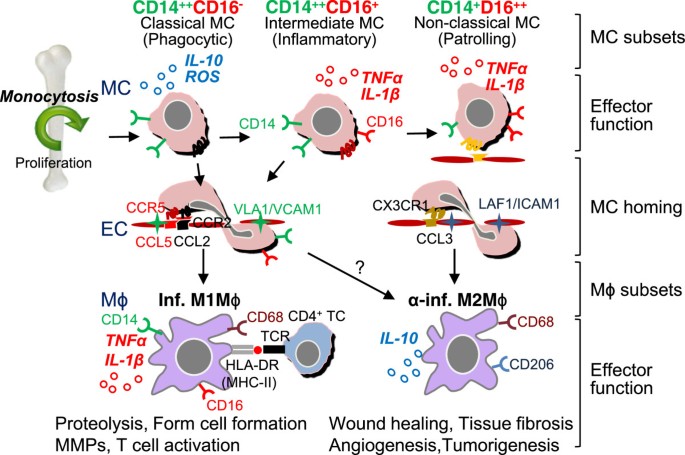
如表所示2, CD14++CD16+单核细胞表达CCR2和选择性CCR5,与巨噬细胞炎症蛋白-1α (mmp -1α)发生反应,mmp -1α是巨噬细胞和CCL5的趋化因子(称为活化调节,正常T细胞表达和分泌,RANTES)。CCR5被称为人类免疫缺陷病毒进入巨噬细胞的共受体,也与CVD有关[31,33].CD14++CD16-单核细胞表达最高水平的CCR2和CD14+CD16++单核细胞CX3CR1表达水平最高[31].
尽管更多的证据支持Ly6C+和CD14+CD16-经典单核细胞是促炎单核细胞,其CD62L的高表达暗示了淋巴结迁移的可能作用,并分化为多种巨噬细胞和树突状细胞亚型,可抑制免疫应答[34].了解亚群的功能为从各种炎症性疾病患者血液中发现的炎症性单核细胞增多症的临床研究中推断结果提供了见解。
人单核细胞亚群的功能特性
如图所示2,人CD14++CD16-经典单核细胞表达高水平的CCR2和CD62L (l -选择素),低水平的CX3CR1。它们的主要功能是吞噬。它们具有吞噬作用,表现出高过氧化物酶活性,并对LPS产生高水平的IL-10和低水平的TNF-α [23,35].基因表达谱分析表明,人经典单核细胞优先表达与血管生成、伤口愈合和凝血有关的基因[36].人类CD14++CD16+中间单核细胞显示炎症功能。该亚群具有较低的过氧化物酶活性,但具有较高的产生和释放IL-1β和TNFα的能力,以响应LPS [35].基因签名连接CD14++CD16+单核细胞抗原提呈和T细胞活化(图2) [36].在炎症过程中,经典单核细胞和中间单核细胞通过CCR2/CCL2(称为单核细胞趋化蛋白,MCP)或CCR5/CCL5互补对以极晚激活抗原-1 (VLA1)/VCAM1依赖方式相互作用并侵入组织。
人类MC和Mϕ分化,和不同的子集函数。人类CD14++CD16-经典MCs以cc趋化因子受体2 (CCR2)依赖的方式离开骨髓。在稳态下,经典MCs可以分化为中间MCs,然后分化为循环中的巡逻非经典MCs。经典MCs具有很强的吞噬能力,具有较高的抗菌能力,在LPS刺激下可分泌ROS和IL-10,而中度和非经典MCs在炎症刺激下可分泌炎症因子、TNFα和IL-1β。在炎症过程中,经典和中间MCs通过互补对CCR2/CCL2(MCP1)或/和CCR5/CCL5(RANTES)以VLA1/VCAM1依赖的方式相互作用并侵入组织。MCs在组织中成熟为m1mφ,并通过MHC-I/II向TCR呈递自我抗原,导致TC激活。非经典MCs通过CX3CR1/CCL3互补对通过LAF/ icam1依赖的相互作用在血管壁上巡逻和入侵。TC, T细胞;MC,单核细胞;Mϕ,巨噬细胞;EC,内皮细胞; inf., inflammatory; α-inf. Anti-inflammatory; TCR, T cell receptor; HLA-DR, human leukocyte antigen DR (a major histocompatibility complex class II (MHC-II)).
人类CD14+CD16++通过Leu-CAM家族整合素淋巴细胞功能抗原-1 (LFA-1)/ icam1依赖方式,CX3CR1/CCL3互补对相互作用,巡逻血管壁并入侵(图2).该亚群在DNA、RNA颗粒作用下释放IL-1β和TNFα,在类风湿性关节炎等自身免疫性疾病中发挥病理作用[35].
在人类CVD和炎症条件下,炎症中间体CD14++CD16+单核细胞增多(表3.&4).然而,CD14的变化+CD16++非经典单核细胞计数不一致;CD14+CD16++单核细胞计数在慢性肾脏病(CKD)、腹主动脉瘤(AAA)、败血症、乙型肝炎、人类免疫缺陷病毒(HIV)感染和结核病中升高,但在充血性心力衰竭、中风和败血症中下降。有人认为CD14++CD16-和CD14++CD16+单核细胞类似小鼠Ly6C+炎性单核细胞亚群,而CD14+CD16++单核细胞可能类似Ly6C-抗炎单核细胞及潜在的血管内皮巡逻作用[23].然而,一些研究强调CD14的炎症作用+CD16++因为细胞产生炎性细胞因子。然而,CD14的变化一直是人们关注的焦点++CD16+炎症性疾病患者中单核细胞计数。自从CD14++CD16+单核细胞计数的增加始终与人类炎症疾病相关(表3.&4),是慢性和急性炎症性疾病的充分生物标志物。
单核细胞分化
单核细胞由巨噬细胞dc前体(MDP)分化而来,主要存在于骨髓中,并分化为树突状细胞或巨噬细胞。它们由两个主要亚群组成:CX3CR1高CCR2低Ly6C-和CX3CR1低CCR2高Ly6C+.然而,目前尚不清楚Ly6C-单核细胞由CX3CR1分化而来低CCR2高Ly6C+或直接来自骨髓MDP。成熟后,Ly6C+单核细胞离开骨髓,通过CCR2介导的迁移进入血液[37].离开骨髓后,小鼠Ly6C+单核细胞分化为Ly6C-循环中的单核细胞[38].最近的一项单核细胞命运图谱研究强烈支持稳定状态下的Ly6C+单核细胞是Ly6C生成和寿命控制的必要前体-骨髓、外周血和脾脏中的单核细胞。在混合ccr2精通(CD45.1)和ccr2缺乏(CD45.2)的竞争环境中(Ly6C+据报道,单核细胞选择性减少)BM嵌合体CD45.1+WT Ly6C-单核细胞在竞争中击败了CD45.2突变体Ly6C-同行(39].在同一项研究中,Ly6C+单核细胞恢复Ly6C-半衰期和人口。
同样,在人类单核细胞分化中,人们普遍认为CD14++经典单核细胞离开骨髓分化为CD14++CD16+中间单核细胞,依次转化为CD14+CD16++外周血循环中的非经典单核细胞[40].
单核细胞向巨噬细胞分化
CCR2嗨Ly6C+炎症和CCR低Ly6C-在炎症早期,常驻单核细胞通常被认为优先分化为M1炎性巨噬细胞和M2抗炎巨噬细胞[20.].Ly6C+心肌梗死早期以单核细胞为主,具有吞噬、蛋白水解、炎症功能和消化受损组织的功能。另一方面,Ly6C-单核细胞,在炎症后期被招募,减弱炎症特性,向M2巨噬细胞分化,并有助于血管生成、成纤维细胞的生成和胶原沉积(图1).单核细胞和巨噬细胞可能具有高度的可塑性,可以交叉分化为不同的亚群,以响应环境的变化。几项研究揭示了单核细胞向巨噬细胞转变的“不寻常”级联:1)渗透Ly6C+炎症骨骼肌或脑组织中的单核细胞通过下调Ly6C的表达获得抗炎单核细胞的表型特征,从而表现出抗炎的M2巨噬细胞功能;[41,42]2) Ly6C中间单核细胞通过CCR7和CCR8向淋巴结转移并分化为树突状细胞;[22,43]3.)稳态时,Ly6C .+单核细胞被招募到健康的固有层并分化为组织常驻CX3CR1高巨噬细胞;[44]4M2巨噬细胞是由组织驻留巨噬细胞的选择性激活而产生的,而不是在感染时招募的单核细胞Litomosoides倍;[45),5)炎性单核细胞募集到过敏性皮肤对于缓解过敏性炎症至关重要,以便通过嗜碱性粒细胞来源的IL-4获得抗炎M2表型[46].这些发现证明了单核细胞分化为调节性或炎性成熟巨噬细胞/树突状细胞的多种能力。
CVD和卒中中的炎性单核细胞增多症
炎性单核细胞是动脉粥样硬化斑块的主要细胞成分[47].激活的免疫细胞,包括炎性单核细胞和巨噬细胞,以及T淋巴细胞在血管壁的聚集产生炎性细胞因子,促进血管炎症。
炎性单核细胞可能不仅通过产生炎性细胞因子,还通过cd40介导的T细胞激活参与血管炎症。据报道,T细胞共刺激受体-配体对CD40-CD40配体(CD40L)信号通路在动脉粥样硬化中起着至关重要的作用[48].T细胞在动脉粥样硬化中的作用类似于CD4+T辅助细胞1 (Th1)介导的超敏反应,可能利用ox-LDL作为一种可能的自体抗原刺激[49].在人类动脉粥样硬化病变中,CD40-CD40L与ox-LDL、清道夫受体A(泡沫细胞形成的中介物)和CD16的表位共定位[50].CD40是TNF受体超家族5成员,在单核细胞、巨噬细胞、树突状细胞中表达。CD40配体在CD4上发现+T细胞和血小板的分泌和膜结合形式。血小板CD40-CD40L表达增强血小板活化和血栓形成[51].CD40和CD40L均在内皮细胞和血管平滑肌细胞上表达。CD40或CD40L缺乏症ApoE-/-小鼠通过增加细胞外基质和促进M2巨噬细胞极化来消除动脉粥样硬化[52].
古典CD14+单核细胞对清除LDL至关重要,而CD16+包括中间和非经典单核细胞在内的单核细胞具有较高的主要组织相容性复合体II类(MHC-II)的表达水平和较高的摄取ox-LDL的能力[53].CD40信号通路诱导巨噬细胞和泡沫细胞形成中粘附分子、基质金属蛋白酶和促炎细胞因子的表达[54].据报道,抗CD40L单克隆抗体可减少动脉粥样硬化引起的血栓栓塞并发症[55].因此,拮抗CD40信号通路或抑制CD40表达可能是人类CVD未来的治疗方案。
同样,单核细胞是脑卒中缺血性脑的主要浸润免疫细胞。单核细胞浸润是脑卒中早期细胞反应之一。中风后4小时发生,7天内浸润达到最大程度[56].脑卒中伴发炎症在继发性缺血性损伤中起重要作用[57].浸润的炎症细胞可产生ROS、炎症因子和基质金属蛋白酶,通过诱导血脑屏障(BBB)破坏直接或间接引起神经元损伤,导致水肿、脑出血,骨髓细胞不断涌入恶性循环。然而,炎症对中风过程的影响可能是有害的,也可能是保护性的,这取决于免疫细胞的类型、数量和持续时间。最近发表的一篇论文间接支持单核细胞在中风中的有害作用[58].骨髓移植ApoE-/-CD36-/-(主要表达于单核细胞)供体小鼠ApoE-/-脑卒中后,受体小鼠减少了梗死体积和神经功能缺损。但不同单核细胞亚群在脑卒中发病机制中的作用尚不清楚。Ly6C+单核细胞已被证明与许多中枢神经系统疾病有关,如自身免疫性多发性硬化症[59]和西尼罗病毒引起的传染性脑炎[60].趋化因子受体CCR2缺乏,它是招募Ly6C的主要趋化因子受体+在短暂性大脑中动脉闭塞(tMCAO)卒中小鼠模型中,单核细胞减少,减少卒中后的梗死大小和神经功能缺损,同时显著减少单核细胞和中性粒细胞浸润[61].还有一份报告指出Ly6C-巨噬细胞由浸润性Ly6C分化+单核细胞在tMCAO和光血栓诱导的永久性卒中模型中都是预防出血性梗死转化的关键[62].然而,Ly6C+通过克隆膦酸脂质体或骨髓移植使单核细胞衰竭CCR2-/-供体小鼠与野生型受体小鼠相比,在不改变梗死体积和神经功能的情况下,出血发生率显著增加。同样缺乏CCR2的小鼠出现不同结果的原因尚不清楚,可能是由于小鼠育种方法不同,纯敲除小鼠几代杂交可能会导致基因改变,从而弥补指定的基因缺陷。为了确定不同单核细胞亚群在脑卒中发病机制中的作用,应在正常或合并高脂血症和高同型半胱氨酸血症等疾病背景下进行更多实验。
结论
迄今为止,许多研究已经证明了炎症和抗炎单核细胞在小鼠模型中应对炎症或稳态的关键作用。炎性单核细胞亚群是包括心血管疾病在内的人类炎性疾病的有价值的生物标志物。了解单核细胞分化机制可能为炎症性单核细胞增多症提供一个潜在的治疗靶点。
参考文献
Yasaka T, Mantich NM, Boxer LA, Baehner RL:逆流离心洗脱获得的人单核细胞和淋巴细胞亚群的功能:人单核细胞亚群的不同功能能力。J Immunol1981年,127:1515 - 1518。
栗原T, Warr G, Loy J, Bravo R:缺乏CCR2趋化因子受体的小鼠巨噬细胞募集和宿主防御的缺陷。J实验医学1997年,186:1757 - 1762。
Nahrendorf M,等.:愈合的心肌依次动员两个具有不同功能和互补功能的单核细胞亚群。J实验医学2007年,204:3037 - 3047。10.1084 / jem.20070885
英格索兰MA,普氏AM,波多S,兰道夫GJ:单核细胞在急性和慢性炎症中的转运。趋势Immunol2011年,32:470 - 477。10.1016 / j.it.2011.05.001
王志刚,王志刚,王志刚。人单核细胞生成动力学。血1974年,44:801 - 816。
Afiune Neto A, Mansur Ade P, Avakian SD, Gomes EP, Ramires JA:[单核细胞增多症是冠状动脉疾病的独立危险标志]。巴西心脏病学研究2006,86:240 - 244。s0066 - 782 x2006000300013
前川Y,等.:急性心肌梗死再灌注后外周单核细胞增多的预后意义:左室重塑的可能作用。J Am Coll Cardiol2002年,39:241 - 246。
干达人,等.:与低HDL胆固醇相关的轻度肾功能障碍和代谢物与单核细胞增多症和动脉粥样硬化相关。循环2013,127:988 - 996。10.1161 / CIRCULATIONAHA.112.000682
Chapman CM, Beilby JP, McQuillan BM, Thompson PL, Hung J:单核细胞计数,而不是c反应蛋白或白介素-6,是亚临床颈动脉粥样硬化的独立危险标志。中风2004年,35:1619 - 1624。10.1161/01. str.0000130857.19423.ad
塔尼语,等.:白细胞亚型计数与普伐他汀治疗后冠状动脉粥样硬化消退的关系。Am J Cardiol2009年,104:464 - 469。10.1016 / j.amjcard.2009.04.009
赫斯特NP,努基G:类风湿关节炎和皮肤血管炎患者单核细胞补体介导吞噬缺陷的证据。临床医学(临床医学)1981年,282:2081 - 2083。
谢克特GP,沃尔LM,奥本海姆JJ:人类疾病中的抑制单核细胞:综述。Adv Exp医学生物学1979年,121 b:283 - 298。
克拉克森SB, Ory PA:CD16。培养的人单核细胞上发育调节的IgG Fc受体。J实验医学1988年,167:408 - 420。
Passlick B, Flieger D, Ziegler-Heitbrock HW:人外周血中一种新型单核细胞亚群的鉴定与鉴定。血1989年,74:2527 - 2534。
Palframan RT,等.:HEV中的炎症趋化因子运输和呈现:炎症组织中单核细胞募集到淋巴结的远程控制机制。J实验医学2001年,194:1361 - 1373。
司毅,祖晓玲,克罗夫特,夏若:CCR2介导造血干细胞和祖细胞运输到小鼠炎症部位。J临床调查120:1192 - 1203。
Serbina NV, Jia T, Hohl TM, Pamer EG:单核细胞介导的对微生物病原体的防御。免疫年鉴2008年,26:421 - 452。10.1146 / annurev.immunol.26.021607.090326
Barbalat R, Lau L, Locksley RM, Barton总经理:炎性单核细胞上的toll样受体2诱导I型干扰素对病毒而非细菌配体作出反应。Nat Immunol2009年,10:1200 - 1207。10.1038 / ni.1792
Audoy-Remus J,等.:杆状单核细胞在促炎细胞因子和血管生成素-2的作用下巡逻脑血管,并产生血管周围巨噬细胞。J >2008年,28:10187 - 10199。10.1523 / jneurosci.3510 - 08.2008
Auffray C,等.:用具有巡逻行为的单核细胞群监测血管和组织。科学2007年,317:666 - 670。10.1126 / science.1142883
伦道夫GJ:在炎症消退和动脉粥样硬化失败过程中,单核细胞来源的细胞迁移到淋巴结。Curr Opin Lipidol2008年,19:462 - 468。10.1097 / MOL.0b013e32830d5f09
瞿C,等.:CCR8和其他趋化因子通路在单核细胞来源的树突状细胞向淋巴结迁移中的作用J实验医学2004年,200:1231 - 124。10.1084 / jem.20032152
Geissmann F, Jung S, Littman DR:血液单核细胞由两个具有不同迁移特性的主要亚群组成。免疫力2003年,19:71 - 82。
Grip O, Bredberg A, Lindgren S, Henriksson G:活动性克罗恩病患者CD16(+)和CD56(+)血单核细胞亚群增加。肠炎2007年,13:566 - 572。10.1002 / ibd.20025
Shantsila E,等.:人类单核细胞亚群的免疫表型特征:对心血管疾病病理生理学的可能影响。血栓凝血2011年,9:1056 - 1066。10.1111 / j.1538-7836.2011.04244.x
Rothe G,等.:外周血单核吞噬细胞亚群作为高胆固醇血症的细胞标志物。动脉血栓血管生物学1996年,16:1437 - 1447。
Kashiwagi M,等.:稳定型心绞痛患者中单核细胞亚群与冠状动脉斑块易损性特征的相关性(64层多层计算机断层扫描)动脉粥样硬化2010年,212:171 - 176。10.1016 / j.atherosclerosis.2010.05.004
Tsujioka H,等.:人外周血单核细胞亚群异质性对原发性急性心肌梗死患者心肌抢救的影响。J Am Coll Cardiol2009年,54:130 - 138。10.1016 / j.jacc.2009.04.021
Rogacev KS,等.:肥胖和亚临床动脉粥样硬化中的单核细胞异质性。Eur Heart J2010年,31日:369 - 376。10.1093 / eurheartj / ehp308
田中M,等.:外周血祖细胞白细胞采集CD16+单核细胞的表面表型分析。临床试验免疫1999年,116:57 - 61。
Ancuta P,等.:Fractalkine优先介导CD16+单核细胞的阻滞和迁移。J实验医学2003年,197:1701 - 1707。
Ziegler-Heitbrock L,等.:血液中单核细胞和树突状细胞的命名。血2010年,116:e74 - 80。10.1182 / - 2010 - 02 - 258558血
Jones KL, Maguire JJ,达文波特美联社:趋化因子受体CCR5:从艾滋病到动脉粥样硬化。Br J药膏2011年,162:1453 - 1469。10.1111 / j.1476-5381.2010.01147.x
许华,Manivannan A, Crane I, Dawson R, Liversidge J:CD62L和CD44在炎症期间在体内指导血液单核细胞运输的关键但不同的作用。血2008年,112:1166 - 1174。10.1182 / - 2007 - 06 - 098327血
横J,等.:人类CD14dim单核细胞通过TLR7和TLR8受体巡逻和感知核酸和病毒。免疫力2010年,33:375 - 386。10.1016 / j.immuni.2010.08.012
黄吉隆坡,等.:基因表达谱揭示了经典、中间和非经典人类单核细胞亚群的定义特征。血2011年,118:e16-e31。10.1182 /血液- 2010 - 12 - 326355
Sunderkotter C,等.:小鼠血液单核细胞亚群在成熟阶段和炎症反应上存在差异。J Immunol2004年,172:4410 - 4417。
赫里斯托夫M,韦伯C:单核细胞亚群在动脉粥样硬化中的差异作用。Thromb Haemost2011年,106:757 - 762。10.1160 / th11 - 07 - 0500
尤纳,等.:命运图谱揭示了内稳态下单核细胞和组织巨噬细胞的起源和动态。免疫力2013,38:79 - 91。
王彦华,等.:人心血管疾病中的单核细胞异质性。免疫生物学2012年,217:1273 - 1284。10.1016 / j.imbio.2012.07.001
阿诺德·L,等.:骨骼肌损伤后招募的炎性单核细胞转变为抗炎巨噬细胞以支持肌生成。J实验医学2007年,204:1057 - 1069。10.1084 / jem.20070075
Saederup N,等.:ccr2红色荧光蛋白敲入小鼠中枢神经系统髓系细胞对选择性趋化因子受体的使用。《公共科学图书馆•综合》2010年,5:e13693。
Zigmond E,等.:炎症结肠中的Ly6C hi单核细胞产生促炎效应细胞和迁移的抗原提呈细胞。免疫力2012年,37:1076 - 1090。10.1016 / j.immuni.2012.08.026
里沃利埃A,何j,科尔A,瓦拉塔斯V,凯尔萨尔BL:炎症使Ly6Chi单核细胞的分化程序在结肠中从抗炎巨噬细胞转变为炎性树突状细胞。J实验医学2012年,209:139 - 155。10.1084 / jem.20101387
詹金斯SJ,等.:局部巨噬细胞增殖,而不是从血液中招募,是TH2炎症的一个特征。科学2011年,332:1284 - 1288。10.1126 / science.1204351
Egawa M,等.:招募到过敏性皮肤的炎症单核细胞通过嗜碱性粒细胞来源的白介素-4获得抗炎M2表型。免疫力2013,38(3): 570 - 580。10.1016 / j.immuni.2012.11.014
张,等.:重度高同型半胱氨酸血症促进LDLr/ cbs缺陷小鼠骨髓来源和驻留炎性单核细胞分化和动脉粥样硬化。中国保监会Res2012年,111:37-49。10.1161 / CIRCRESAHA.112.269472
马赫F,舍恩贝克U,苏霍娃GK,阿特金森E,利比P:通过抑制CD40信号通路减少小鼠动脉粥样硬化。自然1998年,394:200 - 203。10.1038/28204
Tedgui A, Bernard C:细胞因子、免疫炎症反应和动脉粥样硬化。细胞因子网络1994年,5:263 - 270。
哈基宁T, Karkola K, Yla-Herttuala S:巨噬细胞、平滑肌细胞、内皮细胞和t细胞在脂肪条纹和更晚期的人类动脉粥样硬化病变中表达CD40和CD40L。与氧化低密度脂蛋白、清道夫受体和CD16 (Fc gammaRIII)表位共定位。菲尔绍档案2000,437:396 - 405。
列文D,等.:血小板CD40L在动脉粥样硬化中介导血栓形成和炎症过程。血2010年,116:4317 - 4327。10.1182 / - 2010 - 01 - 261206血
Lutgens E,等.:白细胞中缺乏CD40-TRAF6信号可以通过使免疫反应偏向抗炎特征来预防动脉粥样硬化。J实验医学2010年,207:391 - 404。10.1084 / jem.20091293
Mosig年代,等.:家族性高胆固醇血症中单核细胞亚群的不同功能:CD14+ CD16+单核细胞在氧化LDL解毒中的潜在功能美国实验生物学学会联合会J2009年,23:866 - 874。10.1096 / fj.08 - 118240
菲普斯总机:动脉粥样硬化:炎症和CD40-CD40配体系统的作用。美国国立自然科学研究院2000,97:6930 - 6932。
Kawai T, Andrews D, Colvin RB, Sachs DH, Cosimi AB:抗CD40配体单克隆抗体治疗后的血栓栓塞并发症。Nat地中海2000,6:114.10.1038/72162
Gelderblom M,等.:脑卒中患者脑免疫细胞积累的时空动态。中风2009年,40岁:1849 - 1857。
金锐,杨刚,李光:缺血性卒中的炎症机制:炎症细胞的作用。白细胞生物学2010年,87:779 - 789。
金E等.:高脂血症脑卒中损伤中外周CD36与脑协同作用的研究安神经2012年,71:753 - 764。
国王IL,狄更斯TL,西格尔BM:循环的Ly-6C +髓系前体迁移到中枢神经系统,在自身免疫性脱髓鞘疾病中发挥致病作用。血2009年,113:3190 - 3197。
Getts博士,等.:Ly6c +“炎性单核细胞”是在西尼罗河病毒脑炎中以致病方式招募的小胶质细胞前体。J实验医学2008年,205:2319 - 2337。
迪米特里耶维奇OB,斯塔马托维奇SM, Keep RF,安德耶尔科维奇AV:趋化因子受体CCR2缺失对小鼠脑缺血/再灌注损伤有保护作用。中风2007年,38:1345 - 1353。
Gliem M,等.:巨噬细胞在小鼠脑卒中模型中预防出血性梗死转化。安神经2012年,71:743 - 752。
确认
这项工作部分由NIH资助HL67033, HL77288, HL82774, HL110764和HL117654 (HW);HL9445、HL108910和HL116917 (XFY)。
作者信息
作者及隶属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
YJ生成图表并起草手稿。ZL对卒中的炎性单核细胞增多和部分单核细胞分化有贡献。YC在科学讨论和编辑科学写作和英语方面做出了贡献。X-FY参与了稿件设计和最终审稿。WH负责稿件设计和最终写作。所有作者都阅读并批准了最终的手稿。
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是原创作品的名称要注明出处。创作共用公共领域奉献弃权书(https://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
杨俊,张丽娟,于春。et al。单核细胞和巨噬细胞分化:循环炎性单核细胞作为炎症疾病的生物标志物。Biomark Res2, 1(2014)。https://doi.org/10.1186/2050-7771-2-1
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/2050-7771-2-1
关键字
- 单核细胞
- 炎性疾病