摘要
2型糖尿病(T2DM)、肥胖和动脉粥样硬化相关的胰岛素抵抗是一个全球性的健康问题。代谢和血管稳态异常的组合伴随2型糖尿病和肥胖,被认为共同导致加速动脉粥样硬化和过早死亡。疾病代谢变化的复杂性为充分理解促进这些疾病发展的分子途径提出了挑战。最近在这一领域出现的称为“代谢组学”的新技术可能有助于这些疾病的全面代谢分析。因此,代谢组学已广泛应用于2型糖尿病、肥胖和动脉粥样硬化的代谢产物,不仅用于评估疾病发展和预后,还用于发现疾病诊断的生物标志物。在此,我们总结了代谢组学技术和生成的数据集在这些疾病代谢分析中的最新应用,特别是这些技术在细胞、动物模型和人类疾病水平上的应用。此外,我们还广泛讨论了胰岛素抵抗、2型糖尿病、肥胖和动脉粥样硬化中代谢谱的关联机制,特别强调了活性氧(ROS)产生增加和线粒体功能障碍的潜在作用。
简介
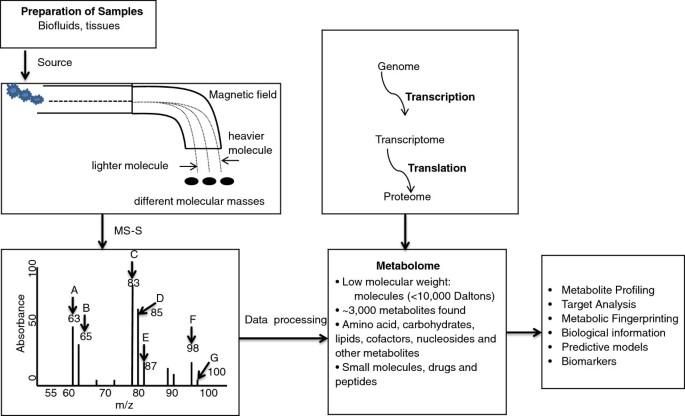
代谢组是基因组、转录组和蛋白质组下游的最终产物,由细胞、组织或生物中所有低分子量分子(代谢物)的总补体组成[1,2].代谢组学被准确地定义为一种旨在测量/描绘细胞、组织或生物体内代谢物变化以响应遗传改变或病理生理刺激的技术[3.,4].转录、转录后、翻译和翻译后过程的下游(图1),代谢物是身体/组织/细胞在疾病过程中发生变化的最接近的报告者。对动物模型中响应基因操作的与时间相关的代谢变化的测量可用于定义观察到的不同表型[5].一般来说,代谢组学方法分为两个不同的组:非靶向代谢组学,对样本中所有可测量的特征进行综合分析,包括化学未知;以及目标代谢组学,测量确定的组的化学特征和生物化学注释的代谢物。靶向代谢组学研究的结果在生理、病理、介入和流行病学研究中都证明了可行性和灵活性。除了在疾病过程中的代谢物的识别,代谢组学也有完善的网络数据库组可用。这些数据库将已确定的代谢物或化合物与特定的疾病和生理特征联系起来(表2)1,2),他们也有明确的生物学途径或基因组,转录组和蛋白质组,强调代谢物的变化(表3.,4).因此,代谢组学的新方法为在全球范围内研究这些相互作用提供了宝贵的工具,并为一些更简化的分子生物学方法提供了另一种研究手段。
用于确定内源性代谢物浓度和通量变化的分析方法包括但不限于:1H和13C核磁共振(1H - - -13C-NMR谱、气相色谱-质谱(GC-MS)、气相色谱-火焰离子化检测(GC-FID)、直接注入质谱(DI-MS)、液相色谱-质谱(LC-MS)。数字1显示了代谢组学技术(MS)如何工作,并在典型反应中根据不同的质量分离分子(图1).除了表中列出的其他代谢组学数据库外,光谱数据库几乎包括了代谢组学研究中应用的所有光谱(表2)5).然而,由于代谢物的广泛范围及其在细胞内浓度的动态性质,迄今为止,即使采用了一系列分析方法,也未能对代谢组进行完整的分析[6].此外,代谢组学已越来越多地应用于心血管疾病、糖尿病的生物标志物发现,以及通过代谢综合征患者的代谢分析发现肥胖代谢产物的早期变化[7- - - - - -9],基于ms的胰岛素抵抗动物模型中酰基肉碱的代谢分析[10],细胞脂质信号[11],以及分析肥胖个体的氨基酸和酰基肉碱[12].虽然使用了各种方法,但代谢物分析的核心方法主要有两种:核磁共振[13]和质谱,后者与包括GC和LC在内的一系列分离技术相结合。
代谢组学与基因组学、转录组学和蛋白质组学的结合在系统生物学研究中起着重要作用。在许多情况下,mRNA表达和蛋白质水平的相关性很低,在某些情况下,它们与表型的相关性甚至更低,而表型是遗传信息流的上游几个步骤。此外,转录组的研究可能是相当昂贵的,相比之下,蛋白质组的研究是相对耗时的。同时,将代谢组学应用于疾病小鼠模型可以快速分析一系列组织。这种分析将使我们能够了解一个基因突变如何影响血浆和多种组织的代谢,如白色脂肪组织、快收缩和慢收缩骨骼肌和心脏组织。因此,在活的有机体内模型可以建立在基因改造后整个生物体的系统代谢变化上[14],并不是所有这些转基因模型的发现都可以转化为人类疾病。特别是,最近的进展已经朝着理解疾病中代谢物谱变化的突出途径。在本文中,我们重点综述了代谢组学在动脉粥样硬化、代谢综合征和肥胖的病理生理学中的应用,以及代谢物的变化和特定通路。
代谢组学在动脉粥样硬化中的应用
代谢组学已被应用于分析动脉粥样硬化样本,以发现生物标志物和循环代谢物谱,这可能在疾病发展中发挥重要的调节信号作用。为了鉴别缺血和非缺血个体血浆代谢物的差异,Sabatineet al。[15]在研究中采用了基于ms的技术。结果表明,在运动应激试验后,患者和健康对照组中参与骨骼肌AMP分解代谢的乳酸及其代谢产物次黄嘌呤、肌苷和丙氨酸均增加。相比之下,缺血患者的多种代谢物调节明显不一致,表现为MET193和MET221升高,γ-氨基丁酸、MET288、草酰乙酸、瓜氨酸和精氨酸琥珀酸的血浆水平下降,这是由于保留柠檬酸循环中间产物以保护心肌ATP的产生造成的。这项代谢组学研究发现了急性心肌缺血的新型生物标志物。此外,模式识别技术也被应用于1人血清H-NMR谱。研究表明,CH代谢产物增加是严重动脉粥样硬化发展的最主要影响因素2链(化学位移ð1.26, ð1.3和ð1.34在600 MHz1HNMR谱)和CH3.组(化学位移ð86)由脂质中的脂肪酸侧链产生,特别是LDL和VLDL)。在本研究中,研究人员不仅可以正确诊断血管造影定义的冠心病的存在,而且还可以正确诊断其严重程度,特异性为>90% [16].在高收缩压(SBP)患者中显示了相似的血清代谢谱和化学转移模式,这表明血清代谢谱和血压之间存在关系,部分原因是由于样本之间的脂蛋白颗粒组成差异[17].综上所述,这些研究首次显示了一种能够提供准确、无创和快速诊断冠心病和高血压的技术,可用于临床人群筛查或有效的靶向治疗。然而,一些作者争论的预测能力和特异性1H-NMR方法在冠状动脉疾病(CAD)检测中的应用,指出分析主要依赖于光谱的主要脂质区域,包括性别和药物治疗在内的许多变量影响脂质组成,是潜在的混杂因素[18].
最近,研究人员将GC-MS指纹技术应用于急性冠状动脉综合征患者的血浆样本,并与模式识别技术用于疾病诊断的健康对照进行比较。有趣的是,结果显示急性冠脉综合征(ACS患者血浆柠檬酸、4-羟脯氨酸(4OH-Pro)、天冬氨酸和果糖降低;乳酸,尿素,葡萄糖和缬氨酸增加[19].尽管需要进一步研究这些变化对ACS的明确影响,但血浆4OH-Pro的降低尤其有趣,因为循环4OH-Pro被认为可以防止LDL与先前沉积在血管壁上的脂蛋白结合,以及从动脉粥样硬化病变中释放已经沉积的LDL。此外,4OH-Pro是胶原蛋白的组成部分,它也赋予血管中动脉粥样硬化斑块的稳定性。
在一项类似的研究中[20.],研究人员同时应用了GC-MS和1H-NMR用于研究稳定颈动脉粥样硬化患者的血浆与健康受试者的比较。结果表明,这些技术相辅相成,能够更清晰地解释生物样本的图像,不仅用于分类目的,而且更重要的是可以定义颈动脉粥样硬化患者的代谢状态。代谢组学资料显示,通过这种“非靶向”治疗,动脉粥样硬化患者组中至少有24种代谢物被显著改变。这些代谢物包括但不限于增加D-葡萄糖,降低D-果糖、丙酮酸(pyr)和肌肌醇(myo),它们与胰岛素敏感性受损、糖酵解和糖基因发生有关;增加的3- oh -丁酸盐(3HB),乙酰乙酸盐(AcAc),长链脂肪酸(如棕榈酸盐,硬脂酸盐,11-横贯癸酸盐和亚油酸盐),D-甘油(gol),减少中链脂肪酸(己酸和月桂酸)产生的脂肪分解增加和脂肪生成减少,脂肪酸β氧化和胰岛素信号缺乏。此外,本研究还发现2-羟基丁酸升高,认为是由于l -苏氨酸降低所致。由于大多数变化与胰岛素抵抗代谢特征的改变有关,颈动脉粥样硬化的代谢谱可能与代谢综合征密切相关。总之,这些研究强调了两点。首先,GC-MS和1H NMR指纹图谱可以为颈动脉粥样硬化患者代谢途径改变的识别提供补充信息。其次,两种技术的结果之间的相关性,而不是单一的研究,可以深入了解患者的状态。
许多实验室已经应用代谢组学来了解载脂蛋白E (ApoE)*3Leiden小鼠或致动脉粥样硬化的ApoE基因敲除(ApoE-/-)老鼠模型[21,22].在仅发生轻度I型和II型动脉粥样硬化病变的ApoE3-Leiden (APO*E3)转基因小鼠中,与对照组相比,肝型脂肪酸结合蛋白(L-FABP)、甘油三酯和选定的生物活性溶血磷脂酰胆碱显著增加,表明该模型可快速识别疾病病理的早期蛋白质和代代物标志物。对确定的基因、蛋白质和脂类的相关性分析被用来构建相互作用网络,尽管一些确定的变化需要“翻译”到人类疾病中。综上所述,这些结果表明,整合生物学是快速识别早期标志物和病理生理过程关键组成部分的强大工具,并构成了该方法在哺乳动物系统中的首次应用[21].此外,LC-MS/MS完成的代谢谱还显示,1-Cys过氧还蛋白(1-cyc prx)是一种新型抗氧化剂,具有抗氧化膜损伤的保护作用,主要以还原蛋白的形式存在于载脂蛋白E中+/+但在载脂蛋白E中被氧化-/-船(22],表明氧化应激增加在该模型中动脉粥样硬化的发展中起着重要作用。目的:探讨载脂蛋白e血管内蛋白质及代谢物的变化-/-使用蛋白质组学和代谢组学技术研究正常饮食的小鼠[22],研究人员使用二维凝胶电泳(2-DE)、基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)和LC-MS/MS分析并绘制了小鼠主动脉平滑肌细胞(SMC)中的蛋白质表达[23].本研究共鉴定出79种蛋白,其中在动脉粥样硬化形成的各个阶段表达水平均有升高。免疫球蛋白沉积、氧化还原失衡和能量代谢受损在ApoE中形成病变之前被发现-/-老鼠。与此同时,核磁共振显示10周龄ApoE血管中的丙氨酸下降和腺苷核苷酸库耗尽-/-老鼠。此外,病变形成的减弱与NADPH生成苹果酶的改变有关,苹果酶为脂质合成和谷胱甘肽循环提供还原等量物,并成功补充血管能量池[23].在一项转录组学和代谢组学的联合研究中,研究人员[24]使用全新的全基因组和高效液相色谱/质谱分析代谢组技术来研究动脉粥样硬化的促炎成分,这些成分来源于ApoE*3Leiden小鼠组的肝脏,喂食无胆固醇(对照组),低胆固醇(LC;0.25%),以及高胆固醇(HC;1%)饮食。结果表明,由于HC应激显著激活了特定的促炎途径,即血小板衍生生长因子(PDGF)、干扰素-γ (IFNγ)、白细胞介素-1 (IL-1)和肿瘤坏死因子-α (TNF-α)信号通路,导致动脉粥样硬化的诱导与饮食中胆固醇的摄入成正比。HC治疗激活这些促炎途径导致调控因子显著上调,如丝分裂原激活蛋白激酶(MAP激酶)、补体因子和急性期蛋白,如血清淀粉样蛋白a (SAA)。值得注意的是,其中一些调控因子同时控制脂质代谢和炎症,这表明高胆固醇饮食不仅诱导炎症,还改变脂质代谢,从而将血脂异常和炎症与动脉粥样硬化的早期病变形成与该动物模型联系起来。显然,该研究表明,转录组学和代谢组学的结合是一种新开发的功能系统生物学工具。这可以更好地定义与给定饮食干预相关的扰动,并确定新的调节途径和控制脂质代谢和炎症反应的转录调节因子。
代谢组学在病理研究中的有用性得到了进一步的巩固,其中,基于nmr的小鼠尿液代谢组学与传统的主动脉染色和成像结合使用,以表征疾病进展,即未处理和血管紧张素i转换酶抑制剂卡托普利处理的apoE中的斑块形成-/-老鼠(25].结果表明,黄嘌呤和抗坏血酸在未处理的小鼠体内升高。未处理组黄嘌呤水平升高被认为是apoE斑块形成的标志-/-老鼠。同时,未治疗组抗坏血酸升高与压力会导致产生更多抗坏血酸的发现是一致的,无论是对抗更大的ROS还是用于血管舒张。有趣的是,多变量分析的代谢组学方法能够区分卡托普利处理的小鼠和未处理的小鼠,与染色结果基本一致。代谢物被认为是疾病进展的指示物,因为它们在氧化应激中的作用。通过超快速液相色谱-离子捕获飞行时间(IT-TOF)质谱(UFLC/MS-IT-TOF)对动脉粥样硬化大鼠和对照大鼠的血浆和尿液样本进行了比较,大鼠血浆中的12种代谢物和尿液中的8种代谢物被鉴定为潜在的生物标志物。血浆中亮氨酸、苯丙氨酸、色氨酸、乙酰肉碱、丁酰肉碱、丙酰肉碱、精胺浓度及3- o -甲基多巴、乙基n2 -乙酰- l-精氨酸、亮氨酸脯氨酸、葡萄糖醛酸、t6A N6-(n -苏酰基羰基)-腺苷和甲基-马尿酸在动脉粥样硬化大鼠尿中减少。同时,动脉粥样硬化大鼠血浆中熊去氧胆酸、鹅去氧胆酸、溶血磷脂酰胆碱(lysoPC) C16:0、溶血磷脂C18:0、溶血磷脂C18:1、尿中马尿酸含量较高。改变后的代谢物表现为苯丙氨酸、色氨酸、胆汁酸和氨基酸代谢异常。该报告表明,代谢组学是一种很有前途的疾病研究工具[26].
代谢组学在糖尿病和肥胖症中的应用
2型糖尿病和肥胖的发生与高脂肪饮食的摄入高度相关。这些疾病导致许多代谢紊乱,包括关键器官和血浆中的糖代谢失衡和血脂异常。这些改变导致极低密度脂蛋白(VLDL)/低密度脂蛋白(LDL)与高密度脂蛋白(HDL)的比例发生变化,并诱发动脉粥样硬化。这些疾病相互作用产生了所谓的代谢综合征,其中许多动脉粥样硬化的独立危险因素相互作用,极大地放大了发生心血管疾病的风险。因此,代谢变化是这些疾病的核心,我们希望任何旨在测量整体代谢变化的过程都能很好地描述这些疾病的表型。因此,代谢组学已被用于识别糖尿病和肥胖的潜在新疾病标志物。在一项研究中,LC-MS结合多变量统计分析成功应用于T2DM患者血浆磷脂代谢谱分析。LC-MS在480 ~ 788 m/z范围内检测到的特定磷脂分子种类,如甘油磷酸乙醇胺(GPE)、二酰基磷脂酰乙醇胺和溶素磷脂酰胆碱(Lyso-PC C16:0和C18:0),被确定为将DM2患者与对照组区分的潜在生物标志物。使用这种方法,不仅可以将T2DM与对照组区分开来,还可以通过LC-MS/MS识别潜在的生物标志物。所提出的方法表明,LC-MS结合多元统计分析是NMR在代谢组学应用中的补充或替代方法[7].在胰岛素抵抗性动脉粥样硬化研究(IRAS)中,研究人员使用NMR测量脂蛋白颗粒,研究人员显示了糖尿病前期个体的一系列脂蛋白异常,包括HDL(减少)和VLDL(增加)的组成变化。这些发现扩展了先前的工作,表明健康、非糖尿病受试者在随后发展为糖尿病的情况下存在致动脉粥样硬化原状态[8],表明甘油和亮氨酸/异亮氨酸(分别是脂肪分解和蛋白质分解的标志物)的下降共同提供了胰岛素敏感性的预测因子[27,28].在一项针对1型糖尿病(T1D)人的临床研究中,MS显示胰岛素剥夺期间血浆氨基酸和氨基酸代谢物水平的显著扰动,以及蛋白质合成和分解、糖异生、酮生、氨基酸氧化、线粒体生物能学和氧化应激等几种代谢途径也受到扰动[29].一项超高性能LC四倍飞行质谱(UPLC-q-TOF-MS)驱动的非靶向代谢组学研究显示,糖尿病前期代谢产物指纹图谱发生了显著变化,包括脂肪酸- (FFAs C18:2, C16:1, C20:4和C22:4;饱和的FFA棕榈酸酯和FFA硬脂酸酯,不饱和的FFA油酸酯)和在糖鹅去氧胆酸;以及Lyso-PC-代谢、尿酸和三羧酸循环代谢(TCA循环)的降低[30.].在另一项使用血浆靶向LC-MS谱的临床研究中,研究人员旨在研究代谢物谱是否可以预测糖尿病的发展。结果显示,五种支链和芳香族氨基酸异亮氨酸、亮氨酸、缬氨酸、酪氨酸和苯丙氨酸的水平与未来糖尿病发病的概率有高度显著的相关性。三种氨基酸的组合可以预测未来的糖尿病(前四分之一的人患糖尿病的风险高出五倍多)。该结果后来在一个独立的前瞻性队列中得到了重复。这些发现强调了氨基酸代谢在糖尿病发病机制早期的关键作用,并表明氨基酸谱可以帮助糖尿病风险评估[31].此外,使用GC-MS检查血浆酯化脂肪酸(EFAs)和非酯化脂肪酸(NEFAs)代谢谱表明,大多数花生四烯酸(C20 FAs类)在病理进展中具有显著的区别特征。很可能是因为花生四烯酸参与了前列腺素的合成代谢,这些分子是炎症过程的重要调节剂。与对照组相比,DM患者血浆中大部分EFA浓度降低,NEFAs明显升高。EFA水平的波动可能与细胞自我修复机制和EFAs自我调节机制导致的NEFA变化有关。这些发现可能预示着监测糖尿病和糖尿病肾病(DN)进展的潜在生物标志物[32].
这种使用气相色谱-质谱联用的靶向方法也已应用于胰岛素抵抗研究在活的有机体内苯丙氨酸代谢物的增加与Hnf1α对苯丙氨酸羟化酶基因的已知调控相一致[33].基于ms的酰基肉碱物种代谢分析发现,过表达肝丙二酰辅酶a脱羧酶的小鼠肌肉中脂源性β-羟基丁酸浓度增加,并表现出改善的胰岛素抵抗[10].与此同时,在喂食高脂肪饮食的野生型小鼠中,肝脏中的代谢物发生了显著变化[34],包括尿素循环中间产物的增加,这与用于糖异生的氨基酸脱氨作用的增加一致,以及1,5-无水葡萄糖醇,这是先前确定的短期血糖控制的标志。在血浆中可识别的代谢物中,用高脂肪饮食喂养的野生型小鼠的血浆硬脂酸盐和两种嘧啶相关代谢物也有所增加。这些变化与用于糖异生作用的氨基酸脱氨作用的增加是一致的[34].这些发现也得到了一项对T2D大鼠和链霉素诱导的糖尿病大鼠(I型糖尿病模型)的研究的支持[35,36].PPARγ激活和PPARδ激活在调节脂肪组织代谢和胰岛素敏感性方面的代谢作用是明确的在活的有机体内在ob/ob小鼠的白色脂肪组织(小鼠纯合子的肥胖自发突变瘦素基因)和在体外在培养的3T3-L1脂肪细胞中1H NMR和MS代谢组学。受体的代谢效应很容易区分,PPARγ激活的特征是增加脂肪的储存、合成和延伸,而PPARδ激活导致脂肪酸β-氧化、三羧酸循环速率和细胞外支链氨基酸氧化的增加。刺激糖酵解和增加脂肪酸去饱和是激动剂的常见途径。PPARγ和PPARδ通过不同的机制恢复胰岛素敏感性。PPARδ激活增加了白色脂肪组织的总氧化代谢,传统上不认为该组织是氧化的。然而,支链氨基酸代谢的增加可能为肌肉萎缩提供了一种机制,这与该核受体的激活有关。PPARδ具有抗肥胖靶点和抗糖尿病靶点的作用,因此可能同时针对血脂异常的原因和后果[9].这些结果得到了最近一项综述的支持,该综述定义了PPARδ在调节脂肪组织中脂肪酸氧化的作用以及肝脏中衰老与PPARα之间的相互作用[37].有或没有T2D的肥胖个体的特征是脂肪酸和氨基酸代谢失调。最近的研究应用了全面的代谢组学分析,以获得对精瘦、肥胖和糖尿病个体之间代谢差异的广泛理解。一名研究人员使用靶向代谢组学证明了酰基肉碱(AcyCN)和氨基酸浓度的升高;特别是支链氨基酸和C3、C5、C6和C8:1酰基肉碱[12].此外,超重/肥胖男性在血清磷脂中硬脂酸的比例较高,而油酸的比例较低。此外,与健康对照组相比,超重/肥胖个体的脂肪摄入量更高,多不饱和脂肪酸与饱和脂肪酸的比例更低。3种溶血色素被确定为潜在的血浆标志物,该研究证实了超重/肥胖男性的8种已知代谢物,超重/肥胖受试者的溶血色素C14:0和溶血色素C18:0水平高于瘦受试者,而溶血色素C18:1水平低于瘦受试者。结果表明两种支链氨基酸(BCAA)、两种芳香族氨基酸以及脂肪酸的合成和氧化代谢异常[38,39].最近的研究表明,肥胖、前驱糖尿病和2型糖尿病患者的胰岛素信号通路受损与脂肪和氨基酸中间代谢的改变有关。选定的必需氨基酸及其衍生物,特别是BCAA和/或BCAA部分分解代谢衍生的肉碱酯、硫氨基酸、酪氨酸和苯丙氨酸,在肥胖和胰岛素抵抗中明显升高,通常在临床诊断为2型糖尿病发病之前[40].必需脂肪酸和多不饱和脂肪酸包括二十碳五烯酸(EPA)、二十二碳六烯酸(DHA)和花生四烯酸(AA)的代谢下降被认为在代谢综合征和糖尿病的病理生理中起着重要作用[41].一项针对早发性心血管疾病家族的血浆模式的代谢组学研究显示,亚油酸(LA)和AA作为生物标志物减少[42]因为ECs合成并释放足量的EPA、DHA、LA、AA可以阻止血小板在其表面聚集,降低粘附分子的表达和IL-1β、IL-2、IL-6、TNF-α等促炎细胞因子的产生,从而防止动脉粥样硬化的发生。值得注意的是,胆汁酸(BAs)现在被讨论为全身能量稳态的代谢积分器。事实上,它们是在口服葡萄糖耐量试验(OGTT)中显示出最显著变化的代谢物之一[27]以及在非靶向代谢组学研究中[43]尽管需要更好地理解它们在OGTT期间的特征双相改变(增加-减少-增加模式)。同样相关的是,BAs可以影响葡萄糖和脂质代谢[44FXR是配体激活核受体转录因子超家族的成员,通过一种可能涉及抑制肝固醇调节元件结合蛋白(SREBP)-1c表达和/或葡萄糖诱导的脂肪生成基因调节的机制,通过激活法尼苯X受体(FXR)降低血浆甘油三酯合成。FXR-/-小鼠表现出糖耐量受损和胰岛素敏感性下降,因此,研究结果表明FXR活性可能是代谢综合征和T2D发展和治疗的潜在生物标志物。
与动脉粥样硬化、糖尿病和肥胖相关的代谢物谱变化的潜在机制和信号通路
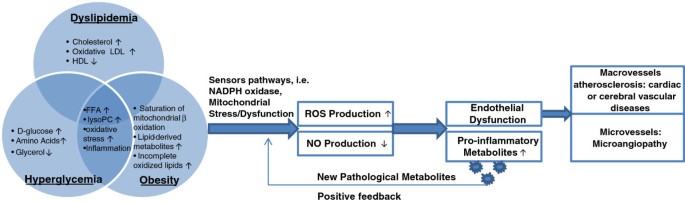
与胰岛素抵抗相关的疾病,如T2DM和肥胖,所见的动脉粥样硬化加速发展的相关机制仍在研究中,但人们认为一氧化氮(NO)生物利用度的下降和活性氧(ROS)的增加是最关键的因素。NO具有血管松弛剂的功能[45],消炎[46],抗增殖[47],抗氧化剂[48],以及抗血小板作用[49],证明了在预防内皮功能障碍方面的关键作用。NO生物利用度的下降是由于NO生物合成的减少和/或ROS降解的增加。一些证据表明,一氧化氮依赖性血管舒张受损可以预测未来的心脏事件和冠状动脉疾病的发展[50,51].一系列研究提供了令人信服的证据,支持肥胖、胰岛素抵抗和NO生物利用度之间的强烈关联[52- - - - - -59].此外,在饮食诱导的肥胖模型中,数据显示胰岛素介导的NO释放在肥胖的早期发展中减弱[60],这被认为与内皮细胞来源的ROS增加有关。这一发现得到了一项非肥胖全身胰岛素抵抗模型研究的支持,该研究证明了基础和胰岛素介导的NO释放减少[61],这是由于血管氧化应激导致内皮细胞烟酰胺腺嘌呤二核苷酸磷酸氧化酶(NADPH)衍生的ROS增加[62].氧化应激被认为在动脉粥样硬化的病理生理学中起着关键作用[63],以及胰岛素抵抗[64].一种流行的理论是,脂质向肌肉组织输送的增加饱和了线粒体ß-氧化的能力,导致生物活性脂质衍生代谢产物的积累,如二酰甘油和神经酰胺在额外的线粒体空间和应激/丝氨酸激酶的激活,干扰胰岛素的作用。最近的研究表明,高脂肪喂养实际上增加了肌肉组织中的脂肪酸氧化,但TCA循环活性没有相应的增加。这导致线粒体中不完全氧化脂质的积累和TCA循环中间产物的损耗,可能导致线粒体应激和胰岛素作用的干扰[65].
ROS被认为通过许多不同的机制促进动脉粥样硬化,包括增强脂蛋白氧化、激活促炎基因、改变血管平滑肌细胞表型,以及可能最重要的降低NO生物利用度。动脉壁中的ROS是由几种酶产生的,包括NADPH氧化酶[66],黄嘌呤脱氢酶;细胞色素p450基酶,线粒体电子转移链,以及浸润炎性细胞[66].此外,NADPH氧化酶衍生的ROS可以影响ROS的主要细胞来源线粒体,以增强该细胞器的超氧化物产生[67].由于ROS来源之间的这种复杂的相互作用,一个自我传播的循环可以随之而来,放大内皮细胞ROS的产生,降低NO的生物利用度,并产生一个越来越有利于动脉粥样硬化的环境。如上所述,线粒体电子传递是ROS的主要产生者之一。研究认为,血管平滑肌细胞中的解偶联蛋白1 (UCP-1)在ROS的产生和动脉粥样硬化中起重要作用。Semenkovich实验室的研究表明,UCP-1从血管平滑肌细胞产生ROS,导致ApoE缺乏小鼠的ROS升高,NO生物利用度降低,并加速动脉粥样硬化[68].相反,UCP-1在内皮细胞中过表达可抑制游离脂肪酸(FFAs)诱导的ROS产生,这表明UCP-1在内皮细胞中过表达可防止内皮细胞功能障碍。这一争议值得进一步研究。除了血管平滑肌细胞,在糖尿病和肥胖状态下,线粒体功能障碍和内皮细胞中ROS产生的作用已被广泛研究。研究认为,病理生理浓度下的游离脂肪酸通过增加NADPH氧化酶p47 (phox)和内皮氧化应激的表达,选择性代偿性上调抗氧化酶和ser1177 -磷酸化的内皮一氧化氮合酶(eNOS),增加大血管内皮细胞中ROS的产生[69].与人类的研究结果一致,NADPH氧化酶已被证明是肥胖小鼠脂肪组织中ROS的关键来源[70].值得注意的是,内皮细胞NADPH氧化酶被认为是胰岛素抵抗中NO生物利用度降低和显著血管氧化应激的主要来源[62,71].
最近,NADPH氧化酶已成为肥胖人群中超氧化物的主要来源[72]、代谢综合症患者[73], T2D患者[74],以及患有慢性心力衰竭的人[75].在肥胖成人中,内皮素-1和核因子- kappab蛋白的表达似乎也有所升高,这为肥胖与人类临床动脉粥样硬化疾病风险增加之间的分子机制提供了新的见解[69].
肥胖和T2DM与原动脉粥样硬化性血脂异常相关,其特征为血浆甘油三酯和FFAs增加,HDL减少,以及小的、易受影响的LDL颗粒的存在。动脉粥样硬化早期进展的一个重要事件是小LDL颗粒穿过内皮屏障的渗透及其随后在血管壁上的积聚[76].甘油三酯和FFAs处理中的离散步骤增加了ROS的产生,并激活了NADPH氧化酶和线粒体电子链以产生超氧化物。一个来源产生的过多ROS会导致另一个来源产生的ROS增加。低密度脂蛋白中所含的磷脂很容易被ROS氧化,从而产生氧化磷脂(OxPLs)。OxPLs的形成触发内皮细胞活化,促进单核细胞黏附并刺激炎症因子的表达[77].除此之外,升高的FFA本身也可能对NO生物合成产生直接影响[78- - - - - -80]和损害线粒体解耦[81].在胰岛素抵抗小鼠模型中,ffa诱导的ROS产生显著抑制了主动脉中的前列环素合成酶和eNOS活性[69].FFA对胰岛素抵抗和ROS的连锁作用可能导致脂毒性诱导的血管功能障碍的恶性循环。通过丝氨酸激酶抑制剂kappaB激酶B (IKKB)激活转录因子NF-kB信号通路和炎症介质toll样受体-4 (TLR4)信号通路可能通过抑制胰岛素受体底物1、Akt(蛋白激酶B)和eNOS磷酸化而破坏胰岛素信号通路。反过来,这会导致NO生成减少,可能会引发炎症和内皮功能障碍[82- - - - - -84].
结论
综上所述,代谢组学作为一种研究工具,已经成功应用于动脉粥样硬化、糖尿病、肥胖等疾病的研究。该技术已应用于新型生物标志物的鉴定,不仅用于疾病的诊断,而且还用于评估这些疾病的严重程度和提供预后信息。一套新兴的代谢组学工具,如MS、NMR和其他技术,能够监测这些疾病的生物样本的代谢物谱,这与基因组学、转录组学和蛋白质组学等其他“组学”技术相比,具有一定的优势。由于代谢组学测量的化学表型是基因组、转录组学和蛋白质组学变异性的净结果,因此代谢组学提供了生物状态的最完整的概况。然而,代谢组学仍然是一个处于初级阶段的领域,在其数据的解释上存在一些局限性和困难,甚至是困惑。相比之下,全基因组关联研究和微阵列分析mRNA分析是相对成熟的技术。尽管代谢组学技术仍在发展中,但它们补充了其他功能性“组学”方法,如高通量基因组测序、RNA表达分析和蛋白质组学。代谢组学有望在阐明系统生物学、发现疾病诊断的生物标志物和治疗评估方面发挥无价的作用。迄今为止,代谢组学研究已发现动脉粥样硬化、糖尿病、肥胖过程中血液、组织、尿液中的代谢产物相当多样化,其中大部分是特定脂类、脂肪酸、碳水化合物、氨基酸、胆汁酸、嘌呤、嘧啶、蛋白质等的中间产物。已确定的代谢产物及其来源和/或与动脉粥样硬化、糖尿病和肥胖相关的机制汇总在表格中6而且7.这些研究中代谢组学数据集的积累使我们发现了NO生物利用度降低、ROS生成增加和线粒体功能障碍在与这些疾病相关的代谢物生成中起关键作用的机制(图)2).这些发现可能会缩小未来代谢组学研究的重点,以了解动脉粥样硬化、糖尿病和肥胖的机制。
同意
本报告及任何附带图像的发表已获得患者的书面知情同意。
参考文献
Goodacre R:代谢剖析:发现途径。今日毒品发现2004年,9:260 - 261。10.1016 / s1359 - 6446 (04) 03027 - 2
Goodacre R, Vaidyanathan S, Dunn WB, Harrigan GG, Kell DB:数字代谢组学:获取和理解全球代谢物数据。生物科技趋势》2004年,22:245 - 252。10.1016 / j.tibtech.2004.03.007
Oliver SG, Winson MK, Kell DB, Baganz F:酵母基因组的系统功能分析。生物科技趋势》1998年,16:373 - 378。10.1016 / s0167 - 7799 (98) 01214 - 1
Scarfe GB, Wright B, Clayton E, Taylor S, Wilson ID, Lindon JC, Nicholson JK:19 F-NMR和直接耦合的HPLC-NMR-MS对大鼠2-溴-4-三氟甲基苯胺代谢的研究:不使用放射性标记的尿排泄平衡研究。Xenobiotica1998年,28日:373 - 388。10.1080 / 004982598239489
林登·JC,霍姆斯·E,尼克尔森JK:那么代谢组学是怎么回事呢?肛门化学2003年,75:384 - 391 a。
Roberts LD, Souza AL, Gerszten RE, Clish CB:有针对性的代谢组学。Curr Protoc Mol Biol2012年,第三十章:Unit 30 32 31-24
王超,孔辉,管勇,杨军,顾军,杨松,徐刚:基于高效液相色谱/电喷雾质谱和多元统计分析的2型糖尿病血浆磷脂代谢特征和生物标志物肛门化学2005年,77:4108 - 4116。10.1021 / ac0481001
Festa A, Williams K, Hanley AJ, Otvos JD, Goff DC, Wagenknecht LE, Haffner SM:胰岛素抵抗动脉粥样硬化研究中糖尿病前期受试者的核磁共振脂蛋白异常。循环2005年,111:3465 - 3472。10.1161 / CIRCULATIONAHA.104.512079
Roberts LD, Murray AJ, Menassa D, Ashmore T, Nicholls AW, Griffin JL:在白色脂肪组织中,PPARdelta和PPARgamma在调节脂肪氧化和储存之间的代谢切换中的对比作用。基因组医学杂志2011年,12(8): R75。10.1186 / gb - 2011 - 12 - 8 r75
An J, Muoio DM, Shiota M, Fujimoto Y, Cline GW, Shulman GI, Koves TR, Stevens R, Millington D, Newgard CB:肝脏表达丙二酰辅酶a脱羧酶可逆转肌肉、肝脏和全动物胰岛素抵抗。Nat地中海2004年,10:268 - 274。10.1038 / nm995
Wakelam MJ, Pettitt TR, Postle AD:信号通路的脂质组学分析。方法Enzymol2007年,432:233 - 246。
Newgard CB, An J, Bain JR, Muehlbauer MJ, Stevens RD, Lien LF, Haqq AM, Shah SH, Arlotto M, Slentz CA:一种支链氨基酸相关的代谢特征,用来区分肥胖和瘦人,并有助于胰岛素抵抗。细胞金属底座2009年,9:311 - 326。10.1016 / j.cmet.2009.02.002
psychgios N, Hau DD, Peng J, Guo AC, Mandal R, Bouatra S, Sinelnikov I, Krishnamurthy R, Eisner R, Gautam B:人体血清代谢组。《公共科学图书馆•综合》2011年,6:e16957。10.1371 / journal.pone.0016957
Atherton HJ, Bailey NJ, Zhang W, Taylor J, Major H, Shockcor J, Clarke K, Griffin JL:基于1H-NMR波谱和质谱的ppar - α零突变小鼠代谢组学研究定义了与代谢综合征相关的深刻的全身性代谢变化。杂志基因组学2006年,27日:178 - 186。10.1152 / physiolgenomics.00060.2006
Sabatine MS, Liu E, Morrow DA, Heller E, McCarroll R, Wiegand R, Berriz GF, Roth FP, Gerszten RE:心肌缺血新生物标志物的代谢组学鉴定。循环2005年,112:3868 - 3875。10.1161 / CIRCULATIONAHA.105.569137
Brindle JT, Antti H, Holmes E, Tranter G, Nicholson JK, Bethell HW, Clarke S, Schofield PM, McKilligin E, Mosedale DE, Grainger DJ:基于1h - nmr的代谢组学对冠心病的存在和严重程度的快速和无创诊断Nat地中海2002年,8:1439 - 1444。10.1038 / nm1202 - 802
Brindle JT, Nicholson JK, Schofield PM, Grainger DJ, Holmes E:应用化学计量学的1H NMR光谱数据来研究人类血清代谢谱和高血压之间的关系。分析师2003年,128:32-36。10.1039 / b209155k
Kirschenlohr HL, Griffin JL, Clarke SC, Rhydwen R, Grace AA, Schofield PM, Brindle KM, Metcalfe JC:血浆质子核磁共振分析是冠状动脉疾病的弱预测因子。Nat地中海2006年,12:705 - 710。10.1038 / nm1432
Martinez-Pinna R, Barbas C, Blanco-Colio LM, Tunon J, Ramos-Mozo P, Lopez JA, Meilhac O, Michel JB, Egido J, Martin-Ventura JL:动脉粥样硬化性血栓性血管疾病的蛋白质组学和代谢组学特征。Curr动脉粥样硬化协会2010,12:202 - 208。10.1007 / s11883 - 010 - 0102 - y
Teul J, Ruperez FJ, Garcia A, Vaysse J, Balayssac S, Gilard V, Malet-Martino M, Martin-Ventura JL, Blanco-Colio LM, Tunon J:通过GC-MS和1H NMR指纹图谱的关联和相关性提高稳定动脉粥样硬化患者的代谢物知识。J蛋白质组Res2009年,8:5580 - 5589。10.1021 / pr900668v
Clish CB, Davidov E, Oresic M, Plasterer TN, Lavine G, Londo T, Meys M, Snell P, Stochaj W, Adourian A:APOE*3-leiden转基因小鼠的综合生物学分析。组学2004年,8:3-13。10.1089 / 153623104773547453
Mayr M, Chung YL, Mayr U, Yin X, Ly L, Troy H, Fredericks S, Hu Y, Griffiths JR, Xu Q:来自载脂蛋白e缺陷小鼠的动脉粥样硬化血管的蛋白质组学和代谢组学分析揭示了炎症、氧化应激和能量代谢的改变。动脉血栓血管生物学2005年,25:2135 - 2142。10.1161/01. atv.0000183928.25844.f6
Mayr U, Mayr M, Yin X, Begum S, Tarelli E, Wait R, Xu Q:小鼠主动脉平滑肌细胞蛋白质组学数据集。蛋白质组学2005年,5:4546 - 4557。10.1002 / pmic.200402045
Kleemann R, Verschuren L, van Erk MJ, Nikolsky Y, Cnubben NH, Verheij ER, Smilde AK, Hendriks HF, Zadelaar S, Smith GJ:由膳食胆固醇摄入增加引起的动脉粥样硬化和肝脏炎症:转录组学和代谢组学的结合分析。基因组医学杂志2007年,8:R200。10.1186 / gb - 2007 - 8 - 9 - r200
Leo GC, Darrow AL:基于nmr的尿液代谢组学用于动脉粥样硬化小鼠模型,使用载脂蛋白e缺陷小鼠。麦格瑞森化学公司2009年,4716 (5): S20-25。
张峰,贾震,高鹏,孔辉,李鑫,陈娟,杨强,尹鹏,王娟,陆旭:超快速液相色谱-离子阱飞行时间质谱联用研究动脉粥样硬化大鼠代谢组学。Talanta2009年,79:836 - 844。10.1016 / j.talanta.2009.05.010
Shaham O, Wei R, Wang TJ, Ricciardi C, Lewis GD, Vasan RS, Carr SA, Thadhani R, Gerszten RE, Mootha VK:人体对葡萄糖挑战反应的代谢分析揭示了不同的胰岛素敏感性轴。Mol系统生物学2008年,4:214.
Lucio M, Fekete A, Weigert C, Wagele B, Zhao X, Chen J, Fritsche A, Haring HU, Schleicher ED, Xu G:胰岛素敏感性由特征代谢指纹反映-傅立叶变换质谱非靶向代谢组学方法。《公共科学图书馆•综合》2010,5:e13317。10.1371 / journal.pone.0013317
Lanza IR, Zhang S, Ward LE, Karakelides H, Raftery D, Nair KS:通过H-NMR和LC-MS/MS定量代谢组学证实了糖尿病代谢途径的改变。《公共科学图书馆•综合》2010,5:e10538。10.1371 / journal.pone.0010538
赵欣,Fritsche J,王杰,陈杰,Rittig K, Schmitt-Kopplin P, Fritsche A,胡haring, Schleicher ED,徐刚,Lehmann R:空腹血浆和斑点尿液的代谢指纹图谱揭示了人类糖尿病前期的代谢特征。代谢组学2010,6:362 - 374。10.1007 / s11306 - 010 - 0203 - 1
王tj, Larson MG, Vasan RS, Cheng S, Rhee EP, McCabe E, Lewis GD, Fox CS, Jacques PF, Fernandez C:代谢物特征和患糖尿病的风险。Nat地中海2011年,17:448 - 453。10.1038 / nm.2307
韩立德,夏建峰,梁清良,王勇,王亚明,胡萍,李萍,罗嘎:用气相色谱-质谱分析血浆酯化和非酯化脂肪酸代谢谱及其在糖尿病和糖尿病肾病研究中的应用。肛门化学学报2011年,689:85 - 91。10.1016 / j.aca.2011.01.034
Bonzo JA, Patterson AD, Krausz KW, Gonzalez FJ:代谢组学确定了体内新的hnf1依赖的生理途径。摩尔性2010,24:2343 - 2355。10.1210 / me.2010 - 0130
李洛,胡玉峰,王玲,Mitchell M, Berger A, Coleman RA:小鼠早期肝脏胰岛素抵抗:代谢组学分析。摩尔性2010,24:657 - 666。10.1210 / me.2009 - 0152
黄强,尹鹏,王娟,陈娟,孔辉,陆霞,徐刚:基于超高效液相色谱-质谱的2型糖尿病大鼠肝组织代谢谱研究方法及应用。色谱分析技术生物生命科学2011年,879:961 - 967。10.1016 / j.jchromb.2011.03.009
Ugarte M, Brown M, Hollywood KA, Cooper GJ, Bishop PN, Dunn WB:链脲霉素诱导糖尿病大鼠血清代谢组学分析及口服三乙烯四胺(TETA)治疗后。基因组医学2012年,4:35.10.1186 / gm334
阿蒙特Z,马苏迪M,格里芬JL:代谢组学在理解过氧化物酶体增殖物激活受体(ppar)在糖尿病、肥胖和癌症中的作用的应用。基因组医学2012年,4:32.10.1186 / gm331
金志勇,朴志勇,金oy, Ham BM, Kim HJ, Kwon DY, Jang Y, Lee JH:使用超高效液相色谱和Q-TOF质谱(UPLC-Q-TOF MS)对超重/肥胖和瘦男性的血浆代谢进行分析。J蛋白质组Res2010,9:4368 - 4375。10.1021 / pr100101p
Mihalik SJ, Michaliszyn SF, de las Heras J, Bacha F, Lee S, Chace DH, de Jesus VR, Vockley J, Arslanian SA:肥胖和2型糖尿病青年脂肪酸和氨基酸代谢的代谢组学分析:线粒体氧化增强的证据。糖尿病护理2012年,35:605 - 611。10.2337 / dc11 - 1577
亚当斯SH:肥胖和胰岛素抵抗状态中必需氨基酸代谢的新观点。阿德减轻2012年,2:445 - 456。
Das联合国:必需脂肪酸:生物化学,生理学和病理学。Biotechnol J2006年,1:420 - 439。10.1002 / biot.200600012
Shah SH, Hauser ER, Bain JR, Muehlbauer MJ, Haynes C, Stevens RD, Wenner BR, Dowdy ZE, Granger CB, Ginsburg GS:早期心血管疾病家庭代谢组谱的高遗传性Mol系统生物学2009年,5:258.
赵x, Peter A, Fritsche J, Elcnerova M, Fritsche A,胡haring, Schleicher ED, Xu G, Lehmann R:在口服葡萄糖耐量试验期间血浆代谢组的变化:是否有更多的葡萄糖要看?Am J Physiol Endocrinol Metab2009年,296:e384 - 393。
列斐伏尔P,卡里欧B,连文F,柯伊伯F, Staels B:胆汁酸和胆汁酸受体在代谢调节中的作用。杂志牧师2009年,89:147 - 191。10.1152 / physrev.00010.2008
Creager MA, Cooke JP, Mendelsohn ME, Gallagher SJ, Coleman SM, Loscalzo J, Dzau VJ:高胆固醇血症患者前臂抵抗血管的血管舒张受损。J临床投资1990年,86:228 - 234。10.1172 / JCI114688
Clapp BR, Hingorani AD, Kharbanda RK, mohammad - ali V, Stephens JW, Vallance P, MacAllister RJ:炎症诱导的内皮功能障碍包括一氧化氮生物利用度降低和氧化应激增加。Cardiovasc Res2004年,64:172 - 178。10.1016 / j.cardiores.2004.06.020
Tanner FC, Meier P, Greutert H, Champion C, Nabel EG, Luscher TF:一氧化氮调节细胞周期调节蛋白的表达:抑制人血管平滑肌细胞增殖的细胞静态策略。循环2000年,101:1982 - 1989。10.1161/01. cir.101.16.1982
Monastyrskaya E, Folarin N, Malyshev I, Green C, Andreeva L:一氧化氮供体SNAP应用于培养心肌细胞提供抗氧化应激的保护。一氧化氮2002年,7:127 - 131。10.1016 / s1089 - 8603 (02) 00107 - 6
Schafer A, Wiesmann F, Neubauer S, eigenaler M, Bauersachs J, Channon KM:一氧化氮在体内快速调节血小板活化。循环2004年,109:1819 - 1822。10.1161/01. cir.0000126837.88743.dd
Schachinger V, Britten MB, zeeiher AM:冠状动脉血管扩张剂功能障碍对冠心病不良长期预后的影响循环2000年,101:1899 - 1906。10.1161/01. cir.101.16.1899
Bugiardini R, Manfrini O, Pizzi C, Fontana F, Morgagni G:内皮功能预测冠状动脉疾病的未来发展:一项胸痛和正常冠状动脉造影女性的研究循环2004年,109:2518 - 2523。10.1161/01. cir.0000128208.22378.e3
Williams IL, Chowienczyk PJ, Wheatcroft SB, Patel AG, Sherwood RA, Momin A, Shah AM, Kearney MT:肥胖人群内皮功能与体重减轻。ob杂志2005年,15:1055 - 1060。10.1381 / 0960892054621134
Melikian N, Kearney MT, Thomas MR, De Bruyne B, Shah AM, mccarthy PA:一种评估人类冠状动脉内皮依赖性微血管功能的简单热稀释技术:与冠状动脉流量储备的验证和比较。Eur Heart J2007年,28日:2188 - 2194。10.1093 / eurheartj / ehm269
Momin A, Melikian N, Wheatcroft SB, Grieve D, John LC, El Gamel A, Marrinan MT, Desai JB, Driver C, Sherwood R:冠状动脉搭桥手术患者隐静脉内皮功能、全身炎症和他汀类药物治疗之间的关系。胸心外科杂志2007年,134:335 - 341。10.1016 / j.jtcvs.2006.12.064
Steinberg HO, Chaker H, leming R, Johnson A, Brechtel G, Baron AD:肥胖/胰岛素抵抗与内皮功能障碍相关。胰岛素抵抗综合征的意义。J临床投资1996年,97:2601 - 2610。10.1172 / JCI118709
Laine H, Yki-Jarvinen H, Kirvela O, Tolvanen T, Raitakari M, Solin O, Haaparanta M, Knuuti J, Nuutila P:肥胖患者骨骼肌葡萄糖摄取的胰岛素抵抗不能通过增加内皮依赖性血流量来改善。J临床投资1998年,101:1156 - 1162。10.1172 / JCI1065
Tack CJ, Ong MK, Lutterman JA, Smits P:肥胖/胰岛素抵抗中胰岛素诱导的血管舒张和内皮功能曲格列酮的作用。Diabetologia1998年,41:569 - 576。10.1007 / s001250050948
Westerbacka J, Vehkavaara S, Bergholm R, Wilkinson I, Cockcroft J, Yki-Jarvinen H:胰岛素降低动脉硬化能力的显著抵抗是人类肥胖的特征。糖尿病1999年,48:821 - 827。10.2337 / diabetes.48.4.821
Williams IL, Wheatcroft SB, Shah AM, Kearney MT:肥胖、动脉粥样硬化和血管内皮:肥胖人群一氧化氮生物利用度降低的机制。Int J Obes相关Metab紊乱2002年,26日:754 - 764。
Noronha BT, Li JM, Wheatcroft SB, Shah AM, Kearney MT:诱导型一氧化氮合酶对肥胖患者血管和代谢功能有不同程度的影响。糖尿病2005年,54:1082 - 1089。10.2337 / diabetes.54.4.1082
Wheatcroft SB, Shah AM, Li JM, Duncan E, Noronha BT, Crossey PA, Kearney MT:在敲除胰岛素受体的小鼠杂合子中,保留了胰岛素的血糖调节,但减少了胰岛素的血管作用。糖尿病2004年,53:2645 - 2652。10.2337 / diabetes.53.10.2645
Duncan ER, Walker SJ, Ezzat VA, Wheatcroft SB, Li JM, Shah AM, Kearney MT:轻度糖尿病前期胰岛素抵抗中内皮功能障碍加速:活性氧的早期作用。Am J Physiol Endocrinol Metab2007年,293:e1311 - 1319。10.1152 / ajpendo.00299.2007
蔡宏,董建华:心血管疾病中的内皮功能障碍:氧化应激的作用。中国保监会Res2000年,87:840 - 844。10.1161/01. res.87.10.840
Houstis N, Rosen ED, Lander ES:活性氧在多种形式的胰岛素抵抗中起着因果作用。自然2006年,440:944 - 948。10.1038 / nature04634
Bain JR, Stevens RD, Wenner BR, Ilkayeva O, Muoio DM, Newgard CB:代谢组学在糖尿病研究中的应用:从信息到知识。糖尿病2009年,58:2429 - 2443。10.2337 / db09 - 0580
Cave AC, Brewer AC, Narayanapanicker A, Ray R, Grieve DJ, Walker S, Shah AM:NADPH氧化酶在心血管健康和疾病中的作用抗氧化还原信号2006年,8:691 - 728。10.1089 / ars.2006.8.691
Zorov DB, Filburn CR, Klotz LO, Zweier JL, Sollott SJ:活性氧(ROS)诱导的ROS释放:心肌细胞线粒体通透性转变诱导的一种新现象。J实验医学2000年,192:1001 - 1014。10.1084 / jem.192.7.1001
Bernal-Mizrachi C, Gates AC, wess, Imamura T, Knutsen RH, DeSantis P, Coleman T, Townsend RR, Muglia LJ, Semenkovich CF:血管呼吸解耦会增加血压和动脉粥样硬化。自然2005年,435:502 - 506。10.1038 / nature03527
Silver AE, Beske SD, Christou DD, Donato AJ, Moreau KL, Eskurza I, Gates PE, Seals DR:超重和肥胖人群显示血管内皮NAD(P)H氧化酶p47(phox)表达增加和内皮氧化应激的证据。循环2007年,115:627 - 637。10.1161 / CIRCULATIONAHA.106.657486
何steinberg, Baron AD:血管功能,胰岛素抵抗和脂肪酸。Diabetologia2002年,45:623 - 634。10.1007 / s00125 - 002 - 0800 - 2
Duncan ER, Crossey PA, Walker S, Anilkumar N, Poston L, Douglas G, Ezzat VA, Wheatcroft SB, Shah AM, Kearney MT:体内内皮特异性胰岛素抵抗对内皮功能的影响。糖尿病2008年,57:3307 - 3314。10.2337 / db07 - 1111
福尔图诺A,圣何塞G,莫雷诺MU,贝洛基O,迪耶斯J,扎尔巴G:吞噬性NADPH氧化酶过度活性是代谢综合征中氧化应激的基础。糖尿病2006年,55岁:209 - 215。10.2337 / diabetes.55.01.06.db05 - 0751
Guzik TJ, Mussa S, Gastaldi D, Sadowski J, Ratnatunga C, Pillai R, Channon KM:人糖尿病血管超氧化物生成增加的机制:NAD(P)H氧化酶和内皮型一氧化氮合酶的作用。循环2002年,105:1656 - 1662。10.1161/01. cir.0000012748.58444.08
Dworakowski R, Walker S, Momin A, Desai J, El-Gamel A, Wendler O, Kearney MT, Shah AM:人心衰中烟酰胺腺嘌呤二核苷酸磷酸氧化酶衍生的超氧化物与血管内皮功能障碍。J Am Coll Cardiol2008年,51:1349 - 1356。10.1016 / j.jacc.2007.12.033
古川S,藤田T,岛三郎M,磐木M,山田Y,中岛Y,中山O,牧岛M,松田M,下村I:肥胖中的氧化应激增加及其对代谢综合征的影响。J临床投资2004年,114:1752 - 1761。
付鹏,比鲁科夫KG:氧化磷脂在控制炎症和内皮屏障中的作用。Transl Res2009年,153:166 - 176。10.1016 / j.trsl.2008.12.005
Schonfeld P, Wojtczak L:脂肪酸作为细胞产生活性氧的调节剂。自由基生物医学2008年,45:231 - 241。10.1016 / j.freeradbiomed.2008.04.029
Symons JD, McMillin SL, Riehle C, Tanner J, Palionyte M, Hillas E, Jones D, Cooksey RC, Birnbaum MJ, McClain DA:胰岛素和Akt1信号通路对内皮型一氧化氮合酶在内皮功能和血压调节中的作用中国保监会Res2009年,104:1085 - 1094。10.1161 / CIRCRESAHA.108.189316
Karman RJ, Gupta议员,Garcia JG, Hart CM:外源性脂肪酸调节培养肺动脉内皮细胞对氧化应激的功能和细胞毒性反应。实验室临床医学1997年,129:548 - 556。10.1016 / s0022 - 2143 (97) 90009 - 3
Chinen I, Shimabukuro M, Yamakawa K, Higa N, Matsuzaki T, Noguchi K, Ueda S, Sakanashi M, Takasu N:血管脂毒性:肥胖zucker糖尿病脂肪大鼠通过脂肪酸诱导活性氧过量产生内皮功能障碍。内分泌学2007年,148:160 - 165。
杜X, Edelstein D, Obici S, Higham N,邹MH, Brownlee M:胰岛素抵抗通过增加内皮脂肪酸氧化降低动脉前列环素合成酶和eNOS活性。J临床投资2006年,116:1071 - 1080。10.1172 / JCI23354
Kim F, Tysseling KA, Rice J, Pham M, Haji L, Gallis BM, Baas AS, Paramsothy P, Giachelli CM, Corson MA, Raines EW:游离脂肪酸对内皮细胞一氧化氮生成的影响由IKKbeta介导。动脉血栓血管生物学2005年,25:989 - 994。10.1161/01. atv.0000160549.60980.a8
Maloney E, Sweet IR, Hockenbery DM, Pham M, Rizzo NO, tatateya S, Handa P, Schwartz MW, Kim F:内皮细胞中棕榈酸盐对NF-kappaB的激活:NADPH氧化酶衍生的超氧化物在TLR4激活中的关键作用。动脉血栓血管生物学2009年,29日:1370 - 1375。10.1161 / ATVBAHA.109.188813
Kim F, Pham M, Luttrell I, Bannerman DD, Tupper J, Thaler J, Hawn TR, Raines EW, Schwartz MW:toll样受体-4在饮食性肥胖中介导血管炎症和胰岛素抵抗。中国保监会Res2007年,100:1589 - 1596。10.1161 / CIRCRESAHA.106.142851
确认
这项工作得到了美国国立卫生研究院HL094451和HL108910 (XFY), HL67033, HL82774和HL77288 (HW)的部分支持。
作者信息
作者及隶属关系
相应的作者
额外的信息
相互竞争的利益
作者声明他们没有相互竞争的利益。
作者的贡献
FYD:已起草稿件。AV:曾参与稿件起草。HW:参与了稿件的起草和修改。XFY:参与了稿件的起草和修改,并最终批准了即将出版的版本。所有作者都阅读并批准了最终的手稿。
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
杜,F,德,A,王,H。et al。动脉粥样硬化、糖尿病和肥胖的代谢组学分析。Biomark Res1, 17(2013)。https://doi.org/10.1186/2050-7771-1-17
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/2050-7771-1-17
关键字
- 代谢组学分析
- 动脉粥样硬化
- 糖尿病
- 肥胖
- 代谢物