摘要
背景
迷走神经刺激(VNS)在许多正在进行的临床试验中显示出治疗各种不同疾病的潜力。VNS在减少脑缺血损伤中的作用有待进一步评估。心脏骤停(CA)引起全身缺血,导致重要器官,特别是大脑的损伤。在本研究中,我们研究了自定义阈值调节VNS (customize threshold-adjusted VNS, tVNS)在CA和复苏大鼠模型中的保护作用。
方法
sd大鼠进行12 min窒息- ca复苏。大鼠分别接受复苏后2小时的tVNS或不接受tVNS(对照组)。采用电极放置于左颈迷走神经的方法应用tVNS。为了优化阈值,我们使用动物的心率,并确定从基线水平下降15-20%作为每个动物的有效生理阈值。主要终点为72 h生存期;次要终点包括神经功能恢复、脑细胞损伤减少(组织病理学)、心脏和肾脏损伤参数(肌钙蛋白I和肌酐水平分别)。
结果
与对照组相比,tVNS组显著提高了CA作用12分钟后72 h的生存时间和脑功能恢复。与对照组相比,tVNS组明显减少了大脑CA1海马区受损神经元的数量。与对照组相比,tVNS组血浆肌钙蛋白I和肌酐水平有下降趋势。
结论
我们的研究结果表明,CA 12分钟后使用tVNS 2小时可减轻缺血神经元细胞死亡、心脏和肾脏损伤,并提高72小时生存时间和神经恢复。
背景
迷走神经刺激(VNS)对神经恢复的治疗效果(Kim等,2019;太阳等。2018),调节代谢稳态,调节免疫功能(Borovikova et al.,2000)、线粒体功能(Xue et al.,2017)、败血症(Borovikova et al.,2000;特蕾西,2007)、类风湿性关节炎(Koopman et al.,2016)和失血性休克(Levy et al.,2013)已经在多项研究中得到证实。VNS也在1997年被食品和药物管理局批准用于临床,目前被认为是一种安全有效的治疗癫痫病、抑郁症和中风的方法(Nemeroff et al.,2006;古永锵et al .,2001;道森et al .,2021)。此外,最近报道了心脏骤停后vns介导的生存改善、神经保护和心肌功能改善(Kim et al.,2019;太阳等。2018;邵et al .,2021)。
心脏骤停(CA)是由于心脏泵送无效或缺失而导致全身自发循环的停止。尽管复苏成功,许多幸存者仍然遭受严重的神经损伤(Choudhary等人,2021)。CA不仅会引起缺血性脑损伤,还会对其他重要器官造成损伤。由于大脑内禀代谢需求高,内禀抗氧化活性较低,因此特别容易发生缺血性损伤(Kristián,2004;Adibhatla &孵卵器,2010)。人们提出了各种导致ca和复苏后细胞损伤的机制,包括由脑血流损伤引起的细胞损伤(Kim等,2019;Iordanova et al .,2017),自主神经系统失衡导致迷走神经活动改变(Chen et al.,2009),在缺氧期间缺乏能量生产(Kalogeris等,2012),复苏后可能存在活性氧(ROS)释放引起的再灌注损伤(Granger & kvieys,2015;Shoaib et al .,2021)和炎症细胞因子(Jou et al.,2020;年et al .,2004)。到目前为止,在开发可用于预防神经损伤的治疗方法方面取得了有限的成功,可用于预防CA的即时治疗和处理再灌注损伤的后果,特别是注意到最近的失败,在靶向低温组和正常组之间6个月没有观察到有益的生存结果(Dankiewicz等人,2021)。
各种研究使用不同的电设置来刺激左或右颈迷走神经来滴定益处。然而,VNS的最佳剂量仍不确定。例如,Kim等人使用0.05 mA 1 Hz电流强度持续3小时刺激大鼠左颈迷走神经,以证明在大鼠窒息性CA和ROSC后24小时大脑灌注和神经结局改善(Kim等人,2019)。相比之下,Sun等人通过刺激大鼠右侧迷走神经,将HR降低10%作为优化阈值,结果显示心肌和大脑功能改善,生存时间更长(Sun等人,2018)。Shao等人最近使用脉冲宽度为1.2 ms,频率为4 Hz,强度为6 V的脉冲刺激大鼠的左右迷走神经(Shao等人,2021)产生生存和神经保护作用。薛等人使用2 - 4v的电电压脉冲来减轻大鼠异丙肾上腺素诱导的心脏损伤,从而获得基础心率降低10%的效果(薛等人,2017),而Inoue等人则采用了电刺激(方波;50μ强度;频率、5赫兹;在小鼠缺血再灌注损伤后,VNS可减轻肾脏损伤(Inoue等,2016)。所有这些研究都表明,VNS根据不同的刺激参数提供不同的器官保护。因此,刺激强度、刺激持续时间、刺激时间和刺激电极放置对VNS和缺血-再灌注损伤后的功能预后均有重要影响。虽然已有研究表明了VNS的好处,但在CA和复苏的情况下实时调节VNS阈值的作用还没有得到很好的研究。目前的研究旨在评估在窒息性心脏骤停和复苏的情况下,对大脑、心脏和肾脏的迷走神经进行阈值调节刺激的总体生存率、认知表现和保护作用。
材料和方法
窒息-心脏骤停动物实验方案
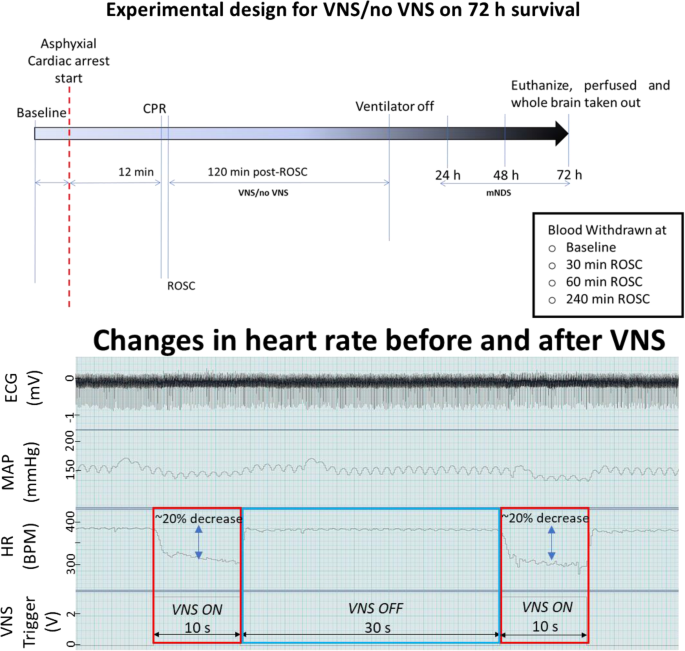
所有实验均根据范斯坦医学研究所动物护理和使用机构委员会(IACUC)指南进行(2016-009)。雄性sd大鼠(450-550 g;查尔斯河实验室,威尔明顿,麻州)在实验前被放置在一个12小时的光/暗循环中,免费获得水和食物。诱导窒息的程序之前已经发表过(Han等人,2010;Shinozaki K等人,2018)。简单地说,用4%异氟醚麻醉大鼠(异感觉,Butler-Schein AHS),然后用14号塑料导管插管(Surflo, Terumo Medical Corporation, NJ, USA),并用2%异氟醚进行机械通气。左股动脉和左股静脉分别置入聚乙烯导管(PE50, BD Intramedic, USA)测量动脉血压和药物灌注。在颈部切开1 ~ 2 cm,露出左颈迷走神经(cVN)。暴露后,在cVN周围放置一个袖口电极。在手术准备和肝素注射(300 IU)后观察动物,直到平均动脉压(MAP)正常化。使用PowerLab和LabChart (ADInstruments, USA)对平均动脉压、心率、潮末CO2 (ETCO2)进行基线记录,在CA期间持续记录,并在自发循环(ROSC)恢复2小时后继续记录。CA开始注射维库溴铵(2 mg/Kg体重;Hospira, USA)通过左股静脉间隔4分钟缓慢给药。维库溴铵注射3分钟后,通过关闭呼吸机和随后停用异氟醚诱导窒息- ca。 Mean arterial pressure below 20 mmHg was defined as CA (Han et al.,2010)。未经治疗的窒息- ca 12分钟后,开始复苏,恢复100%氧气通气,胸部按压,20 μg/Kg肾上腺素(国际药物系统,有限公司,美国)注射,以达到ROSC定义为平均动脉压(MAP)大于60 mmHg。大鼠在-ROSC后监测通气2 h。食道温度通过提供外热维持在37±0.5。在ROSC后2小时,大鼠脱离呼吸机,取出所有导管,闭合伤口。然后,将大鼠送回动物收容设施,并根据批准的方案提供日常护理。观察动物存活72 h。然后,动物被实施安乐死,整个大脑被采集用于组织学分析。为了与非ca动物进行比较,假手术动物根据各自实验的方案进行深度麻醉和安乐死以收集组织。在基线、ROSC、ROSC后30分钟、60分钟和120分钟从股动脉采集血液,测定葡萄糖和乳酸。 A schematic of the experimental protocol is shown in Fig.1.
阈值调节迷走神经刺激的实验方案
将大鼠随机分为对照组(迷走神经上放置手术电极但无VNS)和VNS组。在股动脉和股静脉上放置导管后,使用颈部1-2 cm的中线切口放置颈电极。分离唾液腺,收缩肌肉以观察左侧颈动脉束。左侧迷走神经小心地从颈动脉束中分离出来。然后将一个灵活的三极电极放置在左颈迷走神经(cVN)上,就像以前的研究中使用的那样(Ahmed et al.,2020;艾哈迈德·等。2021)。在电极上放置硅酮弹性体,以防止增产过程中电流分流(Kwiksil, WPI)。仅在对照组中,电极放置在cVN上,但不进行刺激。tVNS组在CA和ROSC 12 min后立即给药。对于定制的tVNS,刺激参数由对称的双相矩形波形组成,起始电流强度为200 μA,脉冲宽度为500 μs,频率为30 Hz。
在一个周期内给药10秒。我们的tVNS处理的占空比为25%,这意味着VNS在25%的时间内处于开启状态,但在75%的时间内处于关闭状态。一次VNS治疗完成一个开关周期的时间为40秒。因此,每个周期给予动物30秒的非vns时间。这个循环一直持续到实验完成。我们校准每个tVNS的强度,并根据动物在休息时间的心率确定刺激阈值。计算关闭时间最后10秒内的平均心率,电流强度逐渐增加20 μA,直到观察到心率(HR)比平均值下降15-20%,即大约10分钟才能达到的阈值。对每只动物进行检测,所有8只动物阈值的平均值为360 μA±45 (Mean±SEM)。以阴极为中心极性的三极刺激在阈值水平下进行2小时(10 s ON, 30 s OFF)。使用STG4008刺激器传输多通道系统(多通道系统)。 A schematic of the tVNS and example of the changes in HR is shown in Fig.1.
复苏后24、48、72 h记录神经功能缺损评分
在12 min CA后成功实现ROSC的大鼠监测72 h生存(n= VNS组和对照组各8例)。为了测量神经功能恢复,采用盲法进行改良神经功能缺损评分评估(mNDS)的记录,使用之前建立的方法的改良版本(Neumar等,1995)。在ROSC后24、48和72 h监测mNDS值(mNDS, 0-500;0,脑死亡;500年,正常)。包括mNDS来评估一般意识(100 =意识;50 =抑郁;0 =无反应),呼吸模式(100 =正常;50 =温和;0 =异常),脑神经(100 =正常),运动功能(50 =正常),感觉(50 =正常),协调模式(100 =正常)。
组织学和染色
ROSC后72 h,存活的动物置于终末麻醉下,经心灌注冷磷酸盐缓冲盐水(PBS, 1X, pH = 7.4;Biorad美国)。假手术动物为非ca大鼠,灌注PBS后深度麻醉安乐死。取假手术组和实验组的全脑,立即用4%多聚甲醛(PFA)固定于4°C。在30%蔗糖溶液中PBS中冷冻保存后,在低温恒温器(CM1900, Leica)上切割含有氨角海马体1 (CA1)区域的连续冠状切片(14 μm),收集在明胶载玻片上。使用之前建立的方法对神经损伤进行nisl染色(Cresyl Violet, Acros Organics, USA)和NeuN染色(Thermofisher Scientific, USA)2008;拉娜et al .,2014),其中末端脱氧核苷基转移酶dUTP切口末端标记(TUNEL)染色(Abcam,英国)按照制造商的说明进行,以观察凋亡细胞。为了进行神经元核蛋白(NeuN)染色,首先用0.25% Triton X孵育载玻片20分钟(1X TBST),然后用2%正常驴血清(NDS;VWR,美国)在1X, TBST室温。切片用2% NDS制备的小鼠抗大鼠NeuN(1:500)抗体在1X TBST中孵育。玻片在4℃下孵育过夜,轻微搅动。双免疫染色时,载片用1X TBS洗涤3次,与NeuN二抗(Green, AlexaFluor 488,驴抗小鼠,1:400)室温孵育1 h。孵育后,载玻片用1X TBS冲洗三次,然后用水冲洗,并使用带有DAPI (Sigma, USA)的氟屏蔽安装介质安装。
染色后,使用BX-X800明亮视野显微镜(Keyence, USA)在40倍放大的双侧成像。对于nisl, TUNEL和NeuN染色,我们使用每组三个连续冠状面切片(n= 3,假,控制和tVNS)。用图像J半量化CA1海马和皮质区损伤细胞数(nisl染色)和凋亡细胞数。对于NeuN,使用BX-X800荧光显微镜(Keyence, USA)对左右皮层区成像,使用图像j从两个半球取平均值。
复苏后肌钙蛋白1和血浆肌酐水平的生化分析
分别用血浆肌钙蛋白1和肌酐评估心脏和肾脏损伤。比较对照组和tVNS组在基线和rosc后2小时的血浆。取出血样,在1000 x g离心10分钟,分离血浆,收集的血浆立即冷冻,保存在−80°C,用于进一步的生化分析。使用血浆测量肌钙蛋白1 (Abcam, USA)和肌酐(Abcam, USA)的水平,按照制造商的协议。
统计分析
连续变量的数据以均数±均数标准误差(SEM)表示。血液动力学参数分析、血糖、乳酸测定、肌钙蛋白、肌酐测定采用重复测量双向方差分析(ANOVA),事后比较采用Sidak校正,比较组间差异。采用Log-Rank检验评价大鼠存活至72 h的比例,比较两组间存活曲线。从假手术组和对照组和vns治疗组的存活动物中分离出的大脑的组织学比较,采用单因素方差分析和Tukey多重比较检验来比较组间的差异。对于其他分析,使用未配对的双尾Student 's t检验进行连续变量比较。统计显著性设定为p< 0.05。GraphPad Prism 9.1 (GraphPad Software Inc., La Jolla, CA, USA)用于统计分析。
结果
迷走神经刺激不改变血流动力学,血浆葡萄糖或乳酸水平12分钟后的CA和复苏
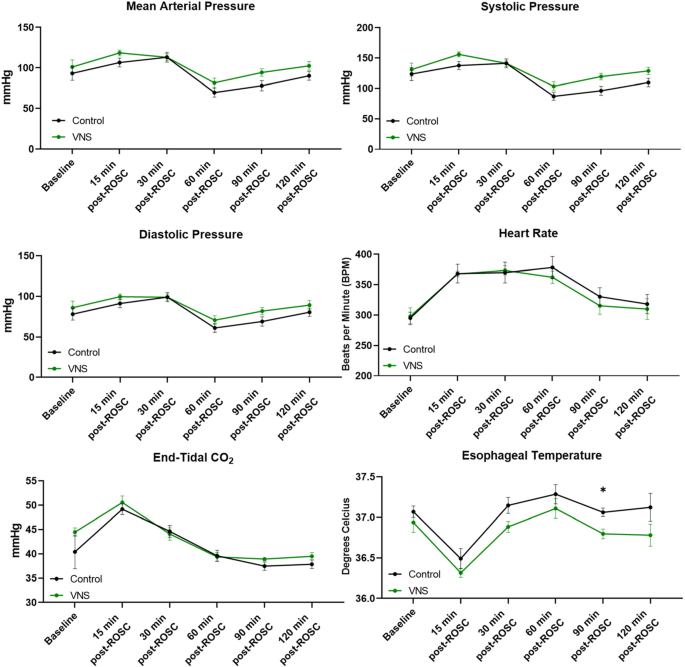
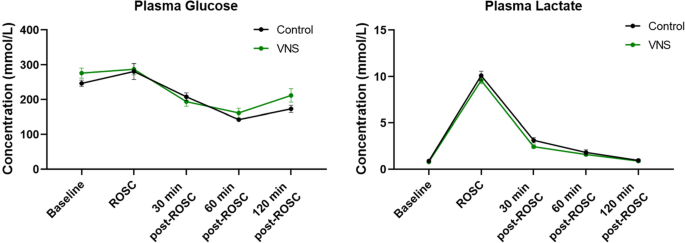
基线特征(体重),达到CA的时间,或达到ROSC的时间在对照组和tns治疗大鼠之间没有显著差异(表2)1)。在CA和复苏后,我们使用HR降低15-20%作为刺激左侧cVN的阈值。因此,每只动物都根据tVNS电流的强度接受了不同程度的刺激。然而,所有经tns治疗的大鼠的波形和刺激持续时间是相似的。我们没有观察到与对照组大鼠相比,经tns治疗的大鼠在12分钟CA和复苏后血流动力学参数的变化,如MAP、收缩压、舒张压或心率(图1)。2)。尽管乳酸水平在rosc后最初如预期的一样增加,但我们观察到两组中乳酸水平都有时间依赖性,呈向基线下降的趋势。在rosc后60分钟内,两组患者的葡萄糖水平均呈下降趋势,然后呈上升趋势。3.)。ca后两组的葡萄糖和乳酸水平几乎相同。综上所述,CA术后的tVNS治疗似乎对血流动力学、葡萄糖和乳酸水平没有任何不良影响。
迷走神经刺激可改善存活结果,并可减轻12 min后的神经功能障碍
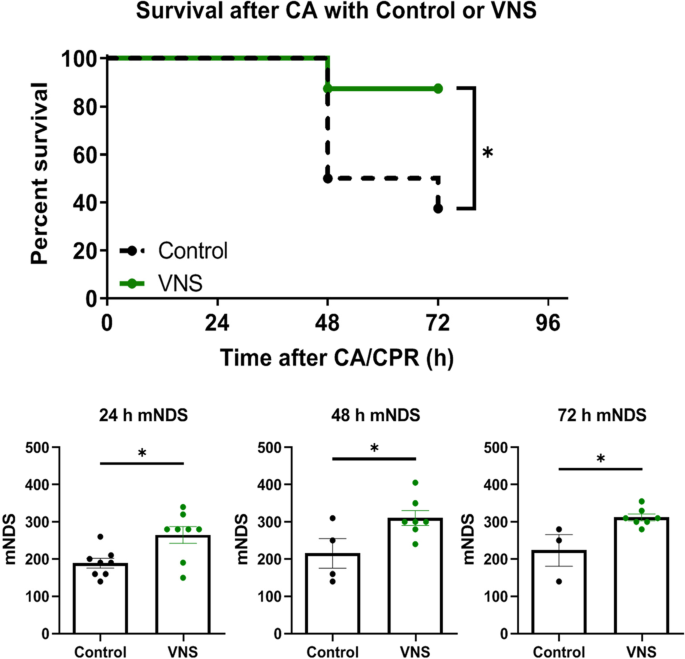
与对照组大鼠相比,tVNS动物表现出明显改善的72小时生存效益(87.5% v 37.5%;P< 0.05;无花果。4)。此外,为了评估神经功能,我们计算了ROSC后24、48和72小时的mNDS。mNDS的评价包括一般意识、呼吸模式、脑神经、运动、感觉和协调模式。结果显示,在存活的大鼠中,tns治疗的大鼠神经功能明显改善(P24、48和72 h < 0.05)。
VNS治疗可改善脑形态特征,减少缺血12 min及复苏后的神经损伤
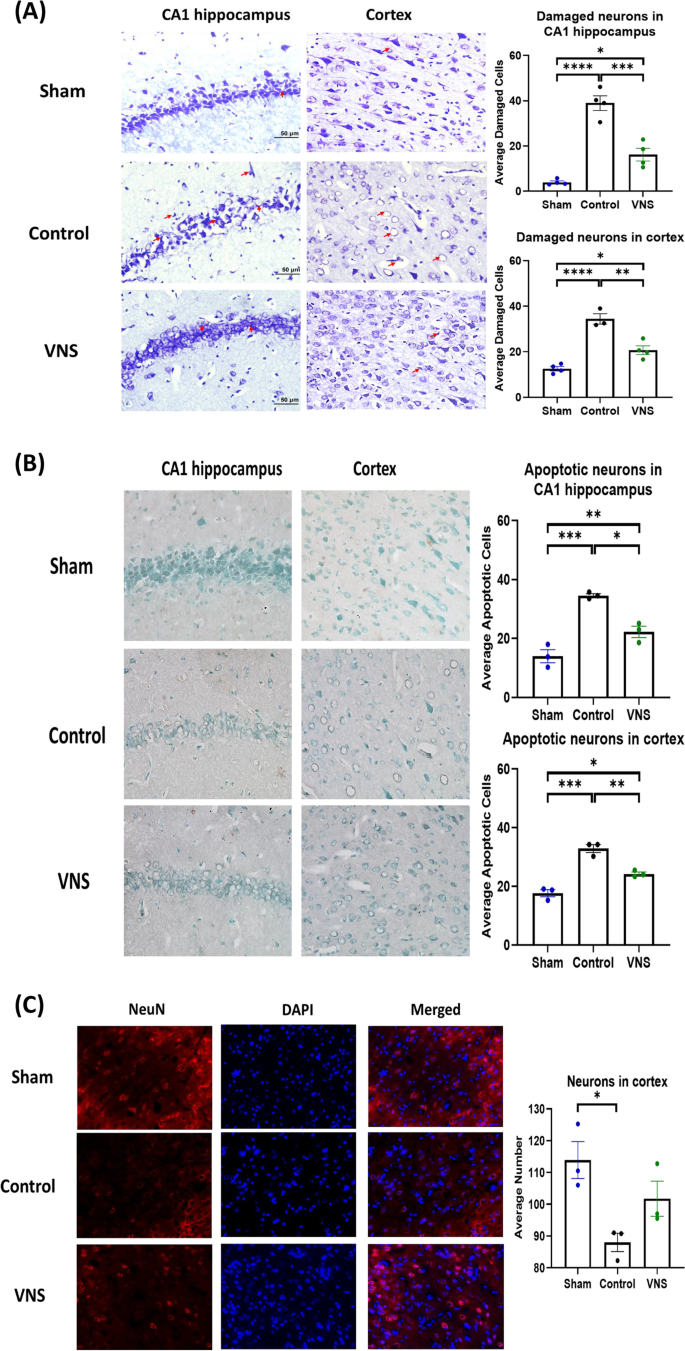
用nisl和TUNEL染色对CA1海马区和皮质区进行组织学分析,发现损伤细胞和凋亡细胞的存在,证明了tVNS的治疗效果。CA1组损伤神经元的平均数目显著增加。P< 0.0001)和皮层区(P< 0.0001)与假手术动物相比。虽然与假手术组相比,tVNS组CA1和皮层区受损神经元增加。P< 0.05),与对照组相比,tns处理后CA1的平均损伤神经元数量显著减少(P< 0.001)和皮层(P< 0.01)的区域(图。5一个)。
迷走神经刺激可减少12分钟后的神经死亡和复苏。对于nisl, TUNEL和NeuN染色,我们从每组中使用三个连续的冠状切片(n= 3,假,控制和tVNS)。红色箭头指示海马CA1区和大脑皮层区受损神经元的尼氏染色。与假手术大鼠相比,CA大鼠海马和皮层CA1区损伤神经元的平均数目显著增加(P< 0.0001)。CA后给予tVNS可显著减少海马CA1区受损神经元的数量(P< 0.001)和皮层(P< 0.01),与对照组相比(一个)。TUNEL染色显示大脑海马区和皮层区CA1细胞凋亡。与假手术大鼠相比,CA大鼠海马CA1区平均凋亡细胞数量显著增加(P< 0.001)。CA后给予VNS后,海马CA1区凋亡细胞数量显著减少(P< 0.01)和皮层(P< 0.001)与对照组相比(B)。NeuN染色显示神经元的功能状态。与假手术大鼠相比,CA大鼠大脑皮层区域的平均神经元数量明显减少(P< 0.05),但假手术组与VNS组之间无显著差异(C)。比例尺50μm。数据以平均值±SEM表示。*P< 0.05,* *P< 0.01,* * *P< 0.001, ****P< 0.0001。迷走神经刺激
CA1细胞中凋亡神经元的平均数目显著增加。P< 0.001)和皮层区(P< 0.001)。虽然tVNS组CA1细胞凋亡神经元增加(P< 0.01)和皮层(P< 0.05)区与假手术区比较,tns处理后CA1 (P< 0.05)和皮层(P< 0.01)的区域(图。5B)。
通过皮层区NeuN染色进一步评价神经元的功能状态。在大脑皮层区域,平均神经元数量显著减少(P对照组与假手术动物比较< 0.05),而对照组与tVNS组之间未见明显变化。
rosc后72 h的脑细胞特征评估显示,脑缺血-再灌注损伤明显,损伤神经元数量增加,与对照动物相比,tns治疗可减轻损伤程度。
VNS治疗可减少心脏和肾脏损伤12分钟的CA和复苏
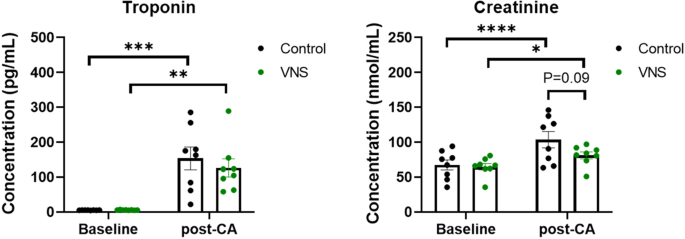
为了评估tns处理大鼠和对照组大鼠在12分钟CA和复苏后的心脏和肾脏损伤,我们分别评估了基线和rosc后2小时的血浆肌钙蛋白I和肌酐水平。与各自的基线水平相比,CA后对照组和tVNS组血浆肌钙蛋白I水平均显著升高(P< 0.001和P< 0.01;无花果。6)。然而,与对照组相比,tVNS治疗后心脏损伤的增加不太严重,提示心脏损伤的改善。此外,与各自的基线水平相比,CA后对照组和tVNS组血浆肌酐水平均显著升高(P< 0.0001和P< 0.05)。tVNS后肌酐的升高不太严重,表明与对照组相比,肾损伤减轻(P= 0.09)。这些结果表明,CA和复苏后的vns治疗可减少心脏和肾脏损伤。
讨论
在本研究中,我们发现在CA 12分钟后立即开始tVNS,复苏可改善72小时的生存和复苏后24、48和72小时的神经预后。tVNS还可减轻海马CA1和皮质区神经元损伤,减少神经元凋亡,维持神经元功能状态,减轻CA和复苏后的心肾损伤。
我们的结果清楚地表明,定制的左颈椎tVNS在12分钟CA和复苏后立即2小时可提高72小时的生存时间。这一结果与Sun等人,2017年的一项研究一致,该研究表明,在大鼠心室颤动(VF) CA 8分钟后,右颈VNS在胸压开始时启动4小时,HR降低10%,大脑功能改善,72小时存活(Sun et al.,2018)。尽管治疗前的研究存在一系列困难,但Shao等人证明,在诱导大鼠VF前,对左或右颈迷走神经进行30min的VNS可显著提高72小时的存活率(Shao等人,2021),表明刺激任何一种颈迷走神经都可产生保护作用。因此,为了激活颈部迷走神经纤维阵列(传入和传出)并达到最佳效果(Ahmed et al.),2021;Chang et al .,2020),我们在CA和复苏12分钟后应用电性tVNS,观察到与对照组相比有显著的生存获益(分别为87.5% v 37.5%;P< 0.05;无花果。4)。
从我们的结果来看,与目前的实验相一致,我们已经注意到可能有临床意义。具体来说,我们的结果表明,定制的tVNS改善了24、48和72小时的神经缺损评分,因此,在该模型中,tVNS似乎具有高度的神经保护作用。临床评分进一步得到组织学结果的支持,组织学结果显示,tVNS治疗组海马CA1和皮层区神经元损伤损失和凋亡减少,并保持神经元的功能状态。这一结果也与之前的结果一致,即VNS通过增加脑血流量减少了rosc后24小时的细胞死亡(Kim et al.,2019),而VNS介导的抗炎和抗凋亡作用也在癫痫中得到证实(Bie et al.,2021)。我们进一步观察到一个有趣的现象,在8只接受tVNS的大鼠中,有5只在rosc后25 - 30分钟出现觉醒状态,有3只接受tVNS的大鼠能够自己进食,提示tVNS的治疗方法。
随着大脑功能的改善,我们观察到tVNS对心脏和肾脏也有治疗效益。我们的研究结果显示,ca和ROSC后,tVNS给药后血浆肌钙蛋白1和肌酐水平分别降低,这是心脏和肾脏损伤的标志。6)。我们的结果与之前的一项研究一致,即在胸压开始时通过VNS电刺激增强副交感神经活动,可通过VF 8分钟后增加心排血量来改善血流动力学(Sun et al.,2018)。在异丙肾上腺素(ISO)诱导的大鼠心肌缺血中,VNS减少心肌梗死,改善心肌细胞凋亡和心功能障碍(Xue et al.,2017)。最近,在狗身上,没有HR变化的轻微左侧VNS已被证明可以减少室性心律失常并改善左心室功能。这可能与多种潜在机制有关,包括心脏神经元萌发减少、过度交感神经萌发抑制和促炎反应减少(Zhao et al.,2021)。我们观察到的血管ns ca后肌酐水平的下降与之前的研究一致,该研究表明,血管ns通过激活α7nAChR+和降低促炎标志物,对缺血-再灌注损伤诱导的肾脏损伤具有保护作用(Inoue等,2016)。对迷走神经的光基因刺激也被证明可以保护小鼠肾脏免受缺血-再灌注损伤(Tanaka et al.,2021)。总的来说,我们的研究结果表明,在心脏骤停的情况下,tVNS也降低了心脏和肾脏损伤的风险。
tVNS的治疗效果可能是通过多因素的,但在猪复苏模型中有一个潜在的病理生理保留机制的重要特征。例如,VNS部分或完全阻止了高动力循环、细胞心肌抑制、高乳酸血症、交感迷走神经平衡向交感支配的转移、心脏线粒体功能障碍的发生,并减少了激活单核细胞的数量(Kohoutova et al.,2019)。同样在啮齿动物心肌缺血实验中,VNS通过调节Drp1、fis1、OPA1和Mfn1/2恢复线粒体动力学;ATP含量增加,线粒体膜电位升高;降低MPTP开口,改善线粒体超微结构和尺寸,提示VNS在减少心肌梗死、改善心肌细胞凋亡和调节心功能障碍方面具有治疗作用(Xue et al.,2017)。在伴有房颤的缺血性卒中患者中,血清肌钙蛋白1水平升高与神经系统预后不良相关(Nam et al.,2020然而,在CA患者中观察到急性肾损伤和血清肌酐水平升高导致不良神经结局(Hasper et al.,2009)。缺血性中风后肌钙蛋白1水平升高激活交感肾上腺系统(Barber等,2007),交感肾上腺系统激活与人类患者心脏骤停后内皮损伤和生存率差相关(Johansson et al.,2015)。此外,急性肾损伤引起的炎症升高和脑功能改变也在小鼠中有报道(Liu et al.,2008)。这些实验可能对我们的结果有影响,因为我们也观察到心脏和肾脏损伤减少,这可能有助于生存。然而,仍有明确的机会进一步探索和滴定治疗方式的CA和缺血/再灌注。
为了使我们的发现能够更直接的临床翻译,我们选择在我们的研究中刺激左侧迷走神经。左迷走神经刺激(VNS)是fda批准的一种治疗癫痫和抑郁症等疾病的临床干预方法(Nemeroff et al.,2006;古永锵et al .,2001)。有效左颈VNS的阈值为刺激最大颈迷走神经纤维(传入和传出)的基础HR降低15-20%,并获得最佳效果(Ahmed et al.,2021;Chang et al .,2020)。各种研究使用不同的环境来刺激右侧或左侧颈迷走神经以获得生存和神经保护(Kim等人,2019;太阳等。2018;邵et al .,2021),预防心脏损伤(Xue等,2017)和保护肾损伤(Inoue等,2016)。这些研究表明,不同的刺激参数可能会产生不同的效果。在我们的实验设置中,我们分别定制不同的电流强度和阈值水平,以实现HR降低15-20%,因此定制VNS参数可能是实现最佳结果的关键考虑因素。
我们的研究并非没有局限性。在我们的外科解剖和放置电极的过程中,我们可能无意中产生了迷走神经的直接刺激(Kim等人,2019)。虽然我们试图通过实施完整的手术和电极放置来控制这一情况,但我们无法辨别电极放置是否单独影响两组。此外,我们不知道我们所给VNS的剂量是否是一个真正的最佳剂量。我们应用了VNS的阈值水平,该阈值已在许多先前的研究中成功使用;然而,我们不能确定这是达到最大保护的最佳剂量或最佳持续时间。此外,我们的研究只使用了雄性大鼠,未来的研究将包括两种性别。最后,我们注意到,这是一项初步研究,并不是为了确定可能负责授予保护的具体机制途径。已经报道的VNS改变的介质、代谢物和途径的列表正在增加,对VNS机制的综合研究超出了当前的研究范围;然而,这将是未来研究的关键领域。
结论
在本研究中,我们发现HR降低15-20%作为在12分钟CA和复苏2小时后立即诱导迷走神经刺激的阈值,可显著改善72小时生存率。tVNS还能改善24、48和72小时的神经预后。tVNS还可减轻海马CA1区神经元损伤,并在CA和复苏后减少对心脏和肾脏的损伤。
数据和材料的可用性
在本研究过程中产生或分析的所有数据均可根据合理要求从通讯作者处获得。
缩写
- α7乙酰胆:
-
- 7尼古丁乙酰胆碱受体
- CA:
-
心脏骤停
- cVN:
-
颈迷走神经
- GFAP:
-
胶质纤维酸性蛋白
- 人力资源:
-
心率
- 地图:
-
平均动脉压
- 国防部:
-
改良神经缺损评分
- MPTP:
-
线粒体通透性过渡孔
- NeuN:
-
神经核内蛋白
- PBS:
-
磷酸缓冲盐
- PFA:
-
多聚甲醛
- ROS:
-
活性氧
- ROSC:
-
自发循环的恢复
- TBST:
-
(tris缓冲盐水,0.1%吐温20)
- TUNEL:
-
末端脱氧核苷酸转移酶dUTP切口末端标记
- 一家电视台tvn:
-
Threshold-adjusted VNS(一家电视台tvn)
- 迷走神经刺激法:
-
迷走神经刺激
- VF:
-
心室纤维性颤动
参考文献
Adibhatla RM, Hatcher JF。脂质氧化和过氧化在中枢神经系统健康和疾病中的作用:从分子机制到治疗机会。抗氧化氧化还原信号。2010;12(1):125-69。
Ahmed U, Chang YC, Cracchiolo M, Lopez MF, Tomaio JN, Datta-Chaudhuri T,等。阳极阻滞允许定向迷走神经刺激。Sci众议员2020;10(1):9221。
Ahmed U, Chang YC, Lopez MF, Wong J, Datta-Chaudhuri T, Rieth L,等。移植物和麻醉相关因素影响迷走神经刺激的心肺阈值强度。神经工程学报,2021;18(4)。
Barber M, Morton JJ, Macfarlane PW, Barlow N, Roditi G, Stott DJ。急性缺血性卒中肌钙蛋白水平升高与交感肾上腺激活相关。Cerebrovasc说。2007;23(4):260 - 6。
别斌,王铮,陈勇,盛磊,李辉,尤辉,等。迷走神经刺激通过调控miR-210影响癫痫大鼠模型的炎症反应和抗凋亡反应。Neuroreport。2021;32(9):783 - 91。
Borovikova LV, Ivanova S, Zhang M, Yang H, Botchkina GI, Watkins LR,等。迷走神经刺激可减弱对内毒素的全身炎症反应。自然。2000;405(6785):458 - 62。
Chang YC, Cracchiolo M, Ahmed U, Mughrabi I, Gabalski A, Daytz A,等。利用生理标记物对迷走神经刺激神经纤维接合的定量估计。大脑Stimul。2020;13(6):1617 - 30。
陈世龙,蔡天生,黄成昌,陈建华,郭昌昌。心率变化率预测院外心脏骤停复苏成功患者的短期预后。复苏。2009;80(10):1114 - 8。
Choudhary RC, Shoaib M, Sohnen S, Rolston DM, Jafari D, Miyara SJ,等。心脏骤停后神经保护的药理学方法——对当前治疗方法和未来神经保护鸡尾酒疗法的述评。前面地中海(洛桑)。2021; 8:636651。
Dankiewicz J, Cronberg T, Lilja G, Jakobsen JC, Levin H, Ullen S,等。院外心脏骤停后体温过低vs体温过低中华医学杂志2019;38(4):394 - 394。
Dawson J, Liu CY, Francisco GE, Cramer SC, Wolf SL, Dixit A,等。迷走神经刺激配合缺血卒中后上肢运动功能康复(VNS-REHAB):一项随机、盲法、关键的装置试验。柳叶刀》。2021;397(10284):1545 - 53年。
再灌注损伤与活性氧:一个概念的演变。氧化还原杂志。2015;6:524-51。
韩飞,Boller M,郭伟,Merchant RM, Lampe JW, Smith TM,等。不同温度下窒息性心脏骤停后紧急体外循环复苏的鼠模型。复苏。2010;81(1):93 - 9。
哈斯珀D,冯·海林S,斯托姆C,乔瑞斯A,舍福尔德JC。心脏骤停后24小时内血清肌酐的变化提示预后:一项观察队列研究。暴击治疗。2009;13 (5):R168。
Inoue T, Abe C, Sung SS, Moscalu S, Jankowski J,黄磊,等。迷走神经刺激通过α 7nachr +脾细胞介导肾缺血再灌注损伤的保护作用。中华临床杂志。2016;126(5):1939-52。
Iordanova B, Li L, Clark RSB, Manole MD.心脏骤停复苏后脑血流的改变。Pediatr前面。2017;5:174。
贾鑫,Koenig MA, Shin HC, Zhen G, Pardo CA, Hanley DF,等。改善大鼠心脏骤停后神经系统的预后:立即降低体温和定量脑电图监测。复苏。2008;76(3):431 - 42。
Johansson PI, Bro-Jeppesen J, Kjaergaard J, Wanscher M, Hassager C, Ostrowski SR.交感肾上腺活化和内皮损伤是相互相关的,并预测院外心脏骤停复苏患者的死亡率增加。ttm试验患者的事后亚研究。《公共科学图书馆•综合》。2015;10 (3):e0120914。
Jou C, Shah R, Figueroa A, Patel JK。炎症细胞因子在心脏骤停中的作用。重症监护医学杂志。2020;35(3):219-24。
卡洛盖里斯·T,贝恩斯CP,克伦兹·M,科尔修斯RJ。缺血/再灌注损伤的细胞生物学。国际Rev细胞分子生物学杂志2012;298:229-317。
金B,朴毅,李志华,金S,李梅梅,赵英华。迷走神经电刺激对窒息性心脏骤停模型大鼠脑血流及神经转归的影响。Neurocrit护理。2019;30(3):572 - 80。
柯胡托娃M, Horak J, Jarkovska D, Martinkova V, Tegl V, Nalos L,等。迷走神经刺激减轻复苏的猪进行性脓毒症的多器官功能障碍。危重护理医学2019;47(6):e461-e9。
古斌,哈姆斯德,苏德,塔弗乙。迷走神经电生理学:迷走神经刺激参数指南。中华临床神经物理杂志2001;18(5):429-33。
Koopman FA, Chavan SS, Miljko S, Grazio S, Sokolovic S, Schuurman PR,等。迷走神经刺激抑制细胞因子的产生,减轻类风湿关节炎的疾病严重程度。中国生物医学工程学报,2016;29(5):561 - 561。
Kristián T.缺氧/缺血性脑损伤中的代谢阶段、线粒体和钙。细胞钙。2004;36(3 - 4):221 - 33所示。
Lana D, Melani A, Pugliese AM, Cipriani S, Nosi D, Pedata F,等。慢性脑灌注不足大鼠模型中的神经元-星形胶质细胞-小胶质细胞三位一体:双嘧达莫的保护作用。老年神经科学。2014;6:322。
Levy G, Fishman JE, Xu D, Chandler BT, Feketova E, Dong W,等。经由迷走神经的副交感神经刺激可消除创伤和失血性休克中的肠道损伤和淋巴毒性,从而预防全身器官功能障碍。冲击。2013;39(1):39-44。
刘明,梁Y, Chigurupati S, Lathia JD, Pletnikov M,孙Z,等。急性肾损伤会导致炎症和大脑功能的改变。中华医学杂志2008;19(7):1360-70。
Nam KW, Kim CK, Yu S, Chung JW, Bang OY, Kim GM,等。肌钙蛋白水平升高与房颤缺血性中风早期神经系统恶化有关。Sci众议员2020;10(1):12626。
Nemeroff CB, Mayberg HS, Krahl SE, McNamara J, Frazer A, Henry TR,等。VNS治疗难治性抑郁症:临床证据和推定的神经生物学机制。神经精神药理学。2006;30(7):1345 - 55。
聂志华,吴伯彻,沈克明,肖峰,张志强,李志强,等。肾上腺素和碳酸氢钠在大鼠窒息性心脏骤停后心肺复苏中的作用。复苏。1995;29(3):249 - 63。
年敏,李萍,Khaper N,刘萍。炎症因子与心肌梗死后重构。中国保监会研究》2004;94(12):1543 - 53。
邵文杰,舒婷婷,徐松,梁丽丽,Grange JML,周昱,等。左侧迷走神经刺激与右侧迷走神经刺激对大鼠心肺复苏效果相同。世界新兴医学杂志。2021;12(4):309-16。
辛崎强,王晓燕,王晓燕,王晓燕,等。心脏骤停后大鼠的游离氧消耗和二氧化碳产生:一种新的代谢表型。美国心脏学会2018;7(13)。
Shoaib M, Kim N, Choudhary RC, Yin T, Shinozaki K, Becker LB,等。在心脏骤停后复苏早期,促氧化和抗氧化之间的血浆不平衡增加与氧化应激终产物水平的增加有关。摩尔医学。2021;27(1):135。
孙鹏,王杰,赵松,杨铮,唐铮,Ravindra N,等。迷走神经刺激对大鼠心肺复苏效果的改善及其可能机制。冲击。2018;49(6):698 - 703。
田中淳,阿部C, Abbott SBG,郑S, Yamaoka Y, Lipsey JE,等。迷走神经刺激激活两种不同的神经免疫回路汇聚在脾脏,以保护小鼠免受肾脏损伤。中国生物医学工程学报2021;118(12)。
特蕾西KJ。胆碱能抗炎途径的生理学和免疫学。中华临床医学杂志。2007;29(2):369 - 369。
薛荣强,孙磊,余晓军,李德龙,臧文杰。迷走神经刺激通过M3受体/CaMKKbeta/AMPK途径改善异丙肾上腺素诱导心肌缺血的线粒体动力学。中华细胞与分子医学杂志2017;21(1):58-71。
赵年代,戴Y, Ning X,唐米,赵Y, Z, et al。急性心肌梗死早期迷走神经刺激可预防室性心律失常和心脏重构。心血管医学前沿。2021;8:648910。
确认
我们感谢尹泰博士的技术援助。
资金
这项工作得到了ZOLL基金会、联合治疗公司和北岸大学医院急诊科的支持。
作者信息
作者和联系
贡献
R.C.C, U.A, m.s.s.z和L.B.B构思和设计了实验;rcc和u.a完成了所有的实验;R.C.C, U.A, m.s.和E.A.撰写了手稿的初稿;j.k和K.S.编辑了手稿;s.c., S.Z, K.J.T和L.B.B.监督了这项研究;所有作者对数据进行了分析和讨论,并通过了定稿。
相应的作者
道德声明
伦理批准和同意参与
作者证实,该研究获得了范斯坦医学研究所动物实验伦理委员会的批准(协议号:2016-009)。
同意出版
不适用。
相互竞争的利益
KJT和SC在VNS方面拥有多项专利。LBB获得了Philips Healthcare、NIH、Nihon Kohden Corp、Zoll Medical Corp、PCORI、BrainCool和United Therapeutics的拨款/研究支持;LBB拥有多个已发布和正在申请的专利,涉及医用浆液作为人体冷却剂的使用、制造浆液的设备、再灌注鸡尾酒和呼吸商测量。所有其他作者声明无竞争利益。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.
关于这篇文章
引用这篇文章
乔杜里,r.c.,艾哈迈德,U.,绍伊布,M。et al。窒息性心脏骤停后,阈值调整迷走神经刺激可保护神经并提高生存率。Bioelectron地中海810(2022)。https://doi.org/10.1186/s42234-022-00092-0
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s42234-022-00092-0
关键字
- 心脏骤停
- 迷走神经刺激
- 缺血再灌注损伤
- 神经保护