- 研究论文gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
新生转录组组装揭示了花性别决定的特征gydF4y2BaExcoecaria agallochagydF4y2Ba
林业科学年鉴gydF4y2Ba体积gydF4y2Ba79gydF4y2Ba文章编号:gydF4y2Ba36gydF4y2Ba(gydF4y2Ba2022gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
关键信息gydF4y2Ba
MADS-box基因家族可能在花性决定中起重要作用gydF4y2BaExcoecaria agallochagydF4y2Ba.共鉴定出73个MADS-box基因gydF4y2Ba大肠agallochagydF4y2Ba.De novo转录组组装分析表明gydF4y2BaAP1 /富尔语gydF4y2Ba,gydF4y2BaAP3 /πgydF4y2Ba,gydF4y2BaAGL104gydF4y2Ba,gydF4y2BaSOC1gydF4y2Ba扮演着潜在的角色gydF4y2Ba大肠agallochagydF4y2Ba花性别决定。gydF4y2Ba
上下文gydF4y2Ba
Excoecaria agallochagydF4y2Ba是一种雌雄同株的物种,包含雄性和雌性个体,产生单性花。这些物种中调节花序分化的潜在机制尚不清楚。gydF4y2Ba
目标gydF4y2Ba
花的发育影响植物的繁殖和育种gydF4y2BaE.agallochagydF4y2Ba,这有助于潮间带的生态恢复。gydF4y2Ba
方法gydF4y2Ba
我们用从头转录组组装的方法分析了植物的雌雄花和叶gydF4y2Ba大肠agallochagydF4y2Ba.gydF4y2Ba
结果gydF4y2Ba
我们共鉴定出73个MADS-box基因gydF4y2Ba大肠agallochagydF4y2Ba我们将其分为五个不同的类别(MIKCgydF4y2BacgydF4y2Ba, Mα, Mβ, Mγ, MIKC*)gydF4y2Baj . curcasgydF4y2Ba同源染色体。我们分析了表达谱并提出建议gydF4y2BaAP1 /富尔语gydF4y2Ba,gydF4y2BaAP3 /πgydF4y2Ba,gydF4y2BaAGL104gydF4y2Ba,gydF4y2BaSOC1gydF4y2Ba作为性别决定的候选监管者。此外,一些gydF4y2BaEaMADSgydF4y2Ba与叶片相比,花中基因表达明显上调。gydF4y2Ba
结论gydF4y2Ba
我们的研究首次详细、全面地评价了与性别决定相关的MADS-box基因调控gydF4y2Ba大肠agallochagydF4y2Ba.收集的转录组谱增加了该物种的遗传信息,对花序基因的功能研究做出了重要贡献。反过来,这将有助于探索潜在的分子机制的进化gydF4y2Ba大肠agallochagydF4y2Ba.gydF4y2Ba
简介gydF4y2Ba
大戟科是一个具有重要医学和经济意义的植物科,包含约7500种,属于300属和5个不同亚科(WebstergydF4y2Ba1994gydF4y2Ba).属gydF4y2BaExcoecariagydF4y2Ba由分布在旧世界红树林地区的近40个物种组成,包括雌雄异株植物,其果实具有3瓣分果皮(WebstergydF4y2Ba1994gydF4y2Ba;Mondal et al。gydF4y2Ba2016gydF4y2Ba).gydF4y2BaExcoecaria agallochagydF4y2BaL.,通常被称为“牛奶红树林”,具有相关的药用特性,属于少数非胎生的红树林物种,分布在东非、印度、锡兰到中国和琉球群岛(TomlinsongydF4y2Ba2016gydF4y2Ba).这种植物可以在红树林地区发现,偶尔在内陆。与大多数红树林物种不同,gydF4y2Ba大肠agallochagydF4y2Ba没有特殊的气根延伸到土壤表面以上,以确保向地下的根提供氧气(蒙达尔等。gydF4y2Ba2016gydF4y2Ba;汤姆林森gydF4y2Ba2016gydF4y2Ba).这种雌雄异株的红树林物种有较长的雄性花序和较短的雌性花序(杜克gydF4y2Ba2006gydF4y2Ba).之前的研究在gydF4y2Ba大肠agallochagydF4y2Ba主要研究了这种植物的遗传模式、药用特性和对新环境的生态适应(Chen和YegydF4y2Ba2014gydF4y2Ba;Mondal et al。gydF4y2Ba2016gydF4y2Ba;刘等人。gydF4y2Ba2021gydF4y2Ba).因此,这种雌雄异株红树林物种分子进化背后的几个方面仍然是未知的。gydF4y2Ba
在开花植物中,性别决定是一种通过促进异体繁殖来提高适应性和生存的发育过程。在单性花的情况下,性别的确定是通过选择性流产或停止生殖器官(雄性或雌性)来实现的(Hernández-Cruz等。gydF4y2Ba2019gydF4y2Ba).最近,一些研究通过在木本植物物种中使用全基因组表达分析来识别和表征mads结构域蛋白,包括gydF4y2Ba麻风树gydF4y2Ba(唐et al。gydF4y2Ba2020gydF4y2Ba),gydF4y2BaQuercus木栓gydF4y2Ba(Rocheta et al。gydF4y2Ba2014gydF4y2Ba),gydF4y2Ba茶树gydF4y2Ba(Pan等。gydF4y2Ba2018gydF4y2Ba),gydF4y2Ba马吕斯gydF4y2Ba×gydF4y2Ba有明显gydF4y2Ba(莫泽et al。gydF4y2Ba2020gydF4y2Ba),gydF4y2Ba杨树trichocarpagydF4y2Ba(Leseberg et al。gydF4y2Ba2006gydF4y2Ba),gydF4y2Ba枇杷gydF4y2Ba(徐et al。gydF4y2Ba2021gydF4y2Ba).专注于过表达分析和突变植物的研究表明MADS-box基因对花器官的规范是必不可少的(Krizek和FletchergydF4y2Ba2005gydF4y2Ba;凯特等。gydF4y2Ba2006gydF4y2Ba).重要的是,MADS-box转录因子在其n端区域包括一个保守的dna结合基序(称为MADS结构域)(Bai等人。gydF4y2Ba2019gydF4y2Ba).该结构域大约有58-60个氨基酸长,能够结合CArG box (CC[A/T]6GG) (Wei等。gydF4y2Ba2015gydF4y2Ba).祖先的MADS-box基因复制事件分离了两个主要谱系,I型和II型(Svensson等。gydF4y2Ba2000gydF4y2Ba).根据MADS结构域的遗传序列和其他基序的存在,前者可以进一步细分为三个不同的组,分别是Mα, Mβ, Mγ (Zhang et al.)。gydF4y2Ba2021gydF4y2Ba).属于II型植物的蛋白质被命名为MIKC,根据I域的序列发散,可分为两个不同的亚群MIKCgydF4y2BacgydF4y2Ba和MIKC*(林等。gydF4y2Ba2016gydF4y2Ba).I型基因的数量在开花植物中是高度可变的。gydF4y2Ba2016gydF4y2Ba).mikc型基因大多是基因组复制的结果,而I型MADS-box基因大多是通过片段复制产生的。后者在雌配子体的形成和种子的早期发育中起着至关重要的作用(Masiero et al。gydF4y2Ba2011gydF4y2Ba).gydF4y2Ba
MIKCgydF4y2BacgydF4y2Ba型已被鉴定为花基因(Rounsley et al。gydF4y2Ba1995gydF4y2Ba)它们也参与了花的器官发生。这些基因可以被分为五个不同的类别:A、B、C、D和E。每一类基因都起着不同的作用,特别是决定萼片(A + E)、花瓣(A + B + E)、雄蕊(B + C + E)、心皮(C + E)和胚珠(D + E)的身份gydF4y2Ba拟南芥gydF4y2Ba,这些功能类包括基因,如gydF4y2BaAPETALA1gydF4y2Ba(gydF4y2BaAP1gydF4y2Ba)在A班,gydF4y2BaPISTILATAgydF4y2Ba(gydF4y2BaπgydF4y2Ba),gydF4y2BaAPETALA3gydF4y2Ba(gydF4y2BaAP3gydF4y2Ba)在B班,gydF4y2Ba无性生殖的gydF4y2Ba(gydF4y2BaAG)gydF4y2Ba)在C班(徐gydF4y2Ba2002gydF4y2Ba),gydF4y2BaSEEDSTICKgydF4y2Ba/gydF4y2BaAGAMOUS-LIKE 1gydF4y2Ba(gydF4y2BaSTKgydF4y2Ba/gydF4y2BaAGL11gydF4y2Ba),gydF4y2Ba防碎的gydF4y2Ba(gydF4y2Ba轴马力gydF4y2BaD类(Mendes et al。gydF4y2Ba2013gydF4y2Ba),gydF4y2BaSEPALLATAgydF4y2Ba(gydF4y2BaSEP1gydF4y2Ba,gydF4y2BaSEP2gydF4y2Ba,gydF4y2BaSEP3gydF4y2Ba,gydF4y2BaSEP4gydF4y2Ba)在E类(孙等。gydF4y2Ba2014gydF4y2Ba).几个MIKCgydF4y2BacgydF4y2Ba基因的gydF4y2BaAG)gydF4y2Ba而且gydF4y2BaAPETALA1gydF4y2Ba/gydF4y2BaFRUITFULLgydF4y2Ba(gydF4y2BaAP1gydF4y2Ba/gydF4y2Ba富尔语gydF4y2Ba)亚科进一步参与果实和种子的发育(孟等。gydF4y2Ba2019gydF4y2Ba),而其他的似乎与控制开花时间和启动的调节网络有关。具体来说,基因gydF4y2Ba开花轨迹CgydF4y2Ba(gydF4y2Ba方法gydF4y2Ba),gydF4y2Ba常数过表达的抑制因子1gydF4y2Ba(gydF4y2BaSOC1gydF4y2Ba),gydF4y2Ba营养期短gydF4y2Ba(gydF4y2Ba高级副总裁gydF4y2Ba)整合不同花期调控通路信号,调控花期转变(Yuan et al.)。gydF4y2Ba2009gydF4y2Ba;Zhang et al。gydF4y2Ba2020年,一个gydF4y2Ba;赢得了et al。gydF4y2Ba2021gydF4y2Ba).这些基因可能是阳性的(gydF4y2BaSOC1gydF4y2Ba,gydF4y2BaAGL24gydF4y2Ba)或负调压器(gydF4y2Ba方法gydF4y2Ba,gydF4y2Ba高级副总裁gydF4y2Ba)调控花分生组织特性的基因(Wang等。gydF4y2Ba2015gydF4y2Ba;先令et al。gydF4y2Ba2020gydF4y2Ba).gydF4y2Ba
我们提供了一个参考转录组数据集gydF4y2Ba大肠agallochagydF4y2Ba这可以用于未来的研究。据我们所知,我们对与花发育或性别决定相关的MADS-box基因进行了前所未有的详细转录组学分析gydF4y2Ba大肠agallochagydF4y2Ba.本数据集扩展了可用的遗传资源gydF4y2Ba大肠agallochagydF4y2Ba并开启了未来功能研究的大门,试图探索分子进化背后的机制gydF4y2Ba大肠agallochagydF4y2Ba.gydF4y2Ba
材料和方法gydF4y2Ba
植物材料gydF4y2Ba
我们抽样gydF4y2Ba大肠agallochagydF4y2Ba广东湛江金沙湾(21.2771°N, 110.3899°E)标本。2020年7月20日上午9时,分别采集一株雄树和一株雌树的叶子和花朵。然后将采样的材料用于转录组学分析。此外,我们还收集了同一株雄树和雌树的叶子和花朵,以及同一株雌树的果实进行实时PCR分析(图5)。gydF4y2Ba1gydF4y2Ba).植物材料浸泡在液氮中,并在- 80°C保存,然后进行下游分析。每个样品进行3次生物重复。gydF4y2Ba
RNA提取gydF4y2Ba
我们使用TRIzol®试剂(植物RNA纯化试剂)按照制造商的说明(美国CA卡尔斯巴德Invitrogen公司)从叶子和花组织中提取总RNA。使用DNase I (TaKara Bio, Inc., USA)去除基因组DNA。使用2100生物分析仪(Agilent Technologies, Inc., Santa Clara CA, USA)测量RNA的完整性和纯度。RNA定量使用ND-2000 (NanoDrop Thermo Scientific, Wilmington, DE, USA)。只使用高质量的RNA样本(OD260/280 = 1.8 ~ 2.2, OD260/230≥2.0,RIN≥8.0,28S:18S≥1.0,> 1 μg)构建测序文库。每个样品进行三次生物重复。gydF4y2Ba
文库准备和Illumina NovaSeq 6000测序gydF4y2Ba
我们在上海马约比奥生物制药生物技术有限公司(中国上海)进行RNA纯化、反转录、文库构建和测序实验。这些分析都遵循制造商的说明(Illumina, San Diego, CA)。RNA-seq转录组文库(即Ea_ff1, Ea_ff2, Ea_ff3, Ea_fL1, Ea_fL2, Ea_fL3, Ea_mf1, Ea_mf2, Ea_mf3, Ea_mL1, Ea_mL2和Ea_mL3)使用Illumina样品制备试剂盒TruSeqTM RNA (Illumina, San Diego, CA)制备。每个样品进行三次生物重复。我们使用寡聚dt连接磁珠和碎片缓冲液获得了纯化的聚(A) mRNA。然后我们用这些短片段作为模板,用SuperScript双链cDNA合成试剂盒(Invitrogen, CA)和随机六聚体引物(Illumina)合成双链cDNA。我们对合成的cDNA进行末端修复,然后根据Illumina的文库构建协议进行磷酸化和添加' A '碱基。我们选择了200-300 bp的cDNA靶片段文库,使用2% Low Range Ultra琼脂糖和Phusion DNA聚合酶(New England Biolabs, Boston, MA) PCR扩增(15个循环)。在TBS380定量后,我们在Illumina NovaSeq 6000测序仪(Illumina, San Diego, CA)上对12个RNAseq文库进行测序,使用1通道和2 × 150 bp对端读取。通过相关检验验证重复实验的可靠性。 The raw reads generated in this study were deposited in the NCBI database under accession number PRJNA760657. See also Table S7 in dataset Zhou et al.2022gydF4y2Ba.gydF4y2Ba
从头组装和注释gydF4y2Ba
使用SeqPrep (gydF4y2Bahttps://github.com/jstjohn/SeqPrepgydF4y2Ba)及镰刀(gydF4y2Bahttps://github.com/najoshi/sicklegydF4y2Ba)和默认参数。我们使用Trinity (http://trinityrnaseq。gydF4y2Basourceforge.netgydF4y2Ba/)对清洁数据(Ea_ff1、Ea_ff2、Ea_ff3、Ea_fL1、Ea_fL2、Ea_fL3、Ea_mf1、Ea_mf2、Ea_mf3、Ea_mL1、Ea_mL2和Ea_mL3)进行从头组装(Grabherr等人。gydF4y2Ba2011gydF4y2Ba)组装的转录本对NCBI蛋白非冗余(NR)、NCBI核苷酸序列数据库(NT)、SwissProt、Pfam和真核完整基因组(KOG)数据库的同源组簇进行功能注释gydF4y2BaEgydF4y2Ba-value cut-off 1.0 × 10gydF4y2Ba−5gydF4y2Ba.此外,BLAST2GO (gydF4y2Bahttp://www.blast2go.com/b2ghomegydF4y2Ba(Conesa et al。gydF4y2Ba2005gydF4y2Ba)程序获得唯一组装的转录本的GO注释,以描述相关的生物过程、分子功能和细胞成分。代谢途径分析采用KEGG (gydF4y2Bahttp://www.genome.jp/kegg/gydF4y2Ba(绪方等。gydF4y2Ba1999gydF4y2Ba).gydF4y2Ba
差异表达分析和功能富集gydF4y2Ba
将每个样本的干净数据映射到组装的参考转录组gydF4y2Ba麻风树gydF4y2BaL. (Seesangboon等。gydF4y2Ba2018gydF4y2Ba).基因丰度计算采用RSEM (gydF4y2Bahttp://deweylab.biostat.wisc.edu/rsem/gydF4y2Ba李和杜威gydF4y2Ba2011gydF4y2Ba),并使用每百万次读取的转录本(TPM)方法进行规范化(表S8数据集Zhou等。gydF4y2Ba2022gydF4y2Ba).差异表达分析使用EdgeR (Robinson et al。gydF4y2Ba2010gydF4y2Ba|log2FC|>1和gydF4y2Ba问gydF4y2Ba值< = 0.05为显著差异表达(DEGs)。利用Goatools对DEGs进行GO和KEGG富集分析,以确定相关通路和功能(gydF4y2Bahttps://github.com/tanghaibao/GoatoolsgydF4y2Ba)和KOBAS (gydF4y2Bahttp://kobas.cbi.pku.edu.cn/home.dogydF4y2Ba),分别为(Xie等。gydF4y2Ba2011gydF4y2Ba).gydF4y2Ba
系统发育分析gydF4y2Ba
识别MADS-boxgydF4y2Ba大肠agallochagydF4y2Ba在转录组中,我们从植物转录因子数据库(PlantTFDB 4.0;gydF4y2Bahttp://planttfdb.gao-lab.org/gydF4y2Ba).我们下载了属于的MADS蛋白序列gydF4y2Ba麻风树gydF4y2Ba从PlantTFDB 4.0。序列比对使用ClustalX(1.83)进行。系统发育树比较gydF4y2Ba大肠agallochagydF4y2Ba而且gydF4y2Baj . curcasgydF4y2BaMADS-box蛋白是根据基于IQ-TREE的全长氨基酸序列之间的相似性的最大似然方法构建的(Nguyen et al。gydF4y2Ba2015gydF4y2Ba).gydF4y2Ba
实时定量PCR分析gydF4y2Ba
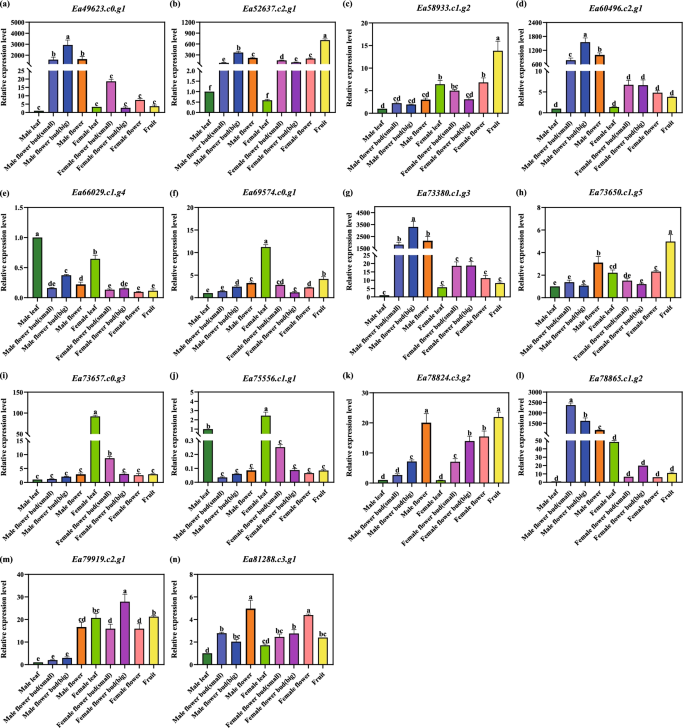
我们选取Ea_ff vs Ea_fL、Ea_ff vs Ea_mf、Ea_fL vs Ea_mL、Ea_mf vs Ea_mL共14个DEGs (MADS-box基因家族)进行实时定量PCR (qRT-PCR),方法包括雄花、雄花芽(小)、雄花芽(大)、雄花、雌花芽(小)、雌花芽(大)、雌花和果实。这样做是为了验证转录组的结果。根据本研究中确定的表达和功能变化随机选择基因(表S1数据集Zhou et al。gydF4y2Ba2022gydF4y2Ba).对每个器官和基因分别进行了三次生物和技术重复(图。gydF4y2Ba1gydF4y2Ba).我们使用PrimeScript®II第一链cDNA合成试剂盒(TaKaRa,日本)进行cDNA合成。引物采用Primer Premier 5.0软件设计。扩增的PCR产物长度在80到300 bp之间变化(表S2数据集Zhou et al。gydF4y2Ba2022gydF4y2Ba).qRT-PCR采用CFX96Touch实时PCR检测系统(Bio-Rad,美国)和SYBR Premix Ex Taq™II (TaKaRa,日本)进行。我们用了2gydF4y2Ba−ΔΔCtgydF4y2Ba估计基因在不同样本中的相对表达量的方法。数据分析采用SPSS 13.0版本(SPSS Inc., Chicago, IL, USA)进行单因素方差分析(ANOVA)和事后多重比较。我们以雄性叶片为对照,计算与MADS-box相关的DEGs的相对表达量。差异被认为是显著的gydF4y2BaPgydF4y2Ba< 0.05。这些数据是用GraphPad Prism 8完成的。gydF4y2Ba
结果gydF4y2Ba
转录组测序和从头组装gydF4y2BaE.agallochagydF4y2Ba
我们从雄叶(mL)、雄花(mf)、雌叶(fL)和雌花(ff)中分离总RNA,构建其转录组gydF4y2Ba大肠agallochagydF4y2Ba.在进行适配器修剪和过滤低质量碱基后,我们从12个cDNA文库中获得了6.91-11.79 Gb的测序数据(表S3数据集Zhou et al.)。gydF4y2Ba2022gydF4y2Ba).RNA-seq的估计错误率为~ 0.02%。Q30值均高于90.45%,GC含量均超过42%。我们获得了427,506个转录本(平均序列长度584 bp)gydF4y2Ba大肠agallochagydF4y2Ba转录组(图S1a数据集Zhou et al。gydF4y2Ba2022gydF4y2Ba).我们选择每个基因中最长的转录本作为候选unigene,得到了一个总共由152,412个unigenes组成的集合(图S1b数据集Zhou et al.)。gydF4y2Ba2022gydF4y2Ba).单基因长度为201 ~ 16447 bp(平均575 bp, N50 = 738 bp)。样本之间基因表达水平的相关性表明样本之间的表达模式高度相似(图S2数据集Zhou et al。gydF4y2Ba2022gydF4y2Ba).我们从转录组中共识别出66,975个简单序列重复(SSRs)gydF4y2Ba大肠agallochagydF4y2Ba使用MISA软件(图S3和表S4数据集Zhou et al。gydF4y2Ba2022gydF4y2Ba).这些结果表明遗传变异高gydF4y2Ba大肠agallochagydF4y2Ba.gydF4y2Ba
基因功能注释gydF4y2Ba
组装完成后,我们对NR、NT、SwissProt、KO、Pfam、GO和KOG等7个公共数据库进行了unigenes解析。这使得我们能够识别基因功能和相关途径(图S4数据集Zhou et al。gydF4y2Ba2022gydF4y2Ba;表格gydF4y2Ba1gydF4y2Ba).NR (102,678;41.40%),其次是Pfam(66309人;26.73%)和KOG (24,375;9.82%)。的gydF4y2BaEgydF4y2BaBLASTX命中数与NR数据库的-value分布显示,25.5%的映射序列具有较高的同源性(< 1e−45)。相比之下,gydF4y2BaEgydF4y2Ba- 73.80%的同源序列的值在1e−5和1e−45之间(图S3a数据集Zhou et al。gydF4y2Ba2022gydF4y2Ba).此外,41.10%的映射序列相似度高于80%,16.20%的映射序列相似度低于60%(图S4b)。此外,NR BLASTX匹配结果显示,排在前两名的物种均为gydF4y2Baj . curcasgydF4y2Ba(26.90%)和gydF4y2Bar .普通的gydF4y2Ba(21.60%)(图S4d数据集Zhou et al.;gydF4y2Ba2022gydF4y2Ba).上述结果突出了我们研究中获得的最高同源性。gydF4y2Ba
我们进一步使用55个基因本体(GO)术语注释了71565个(28.85%)unigenes。这包括分别与生物过程、细胞成分和分子功能相关的25、20、10和GO项(图S5数据集Zhou等人)。gydF4y2Ba2022gydF4y2Ba).主要的氧化石墨烯术语存在于以下三类中:细胞过程(GO: 0009987)和代谢过程(GO: 0008152);单元(GO: 0005623)和单元部分(GO: 0044464);结合(GO: 0005488)和催化活性(GO: 0003824)。为了进一步描述unigenes之间的生物学功能和相互作用,这些组被KEGG分为不同的代谢途径(表S5数据集Zhou et al.)。gydF4y2Ba2022gydF4y2Ba).我们总共将34,874个unigenes(14.06%)分配给19个类别,分为5个集群,包括细胞过程、环境信息处理、遗传信息处理、代谢和有机体系统(图S6数据集Zhou et al.)。gydF4y2Ba2022gydF4y2Ba).前5个KEGG通路分别是翻译(3719个unigenes)、碳水化合物代谢(3475个unigenes)、折叠和降解(2749个unigenes)、概述(2622个unigenes)和氨基酸代谢(2199个unigenes)(表S5数据集Zhou et al.)。gydF4y2Ba2022gydF4y2Ba).这些观察结果表明这些样品具有活跃的细胞发育和分化的特征。gydF4y2Ba
雌性和雄性之间的性特异性基因gydF4y2Ba大肠agallochagydF4y2Ba
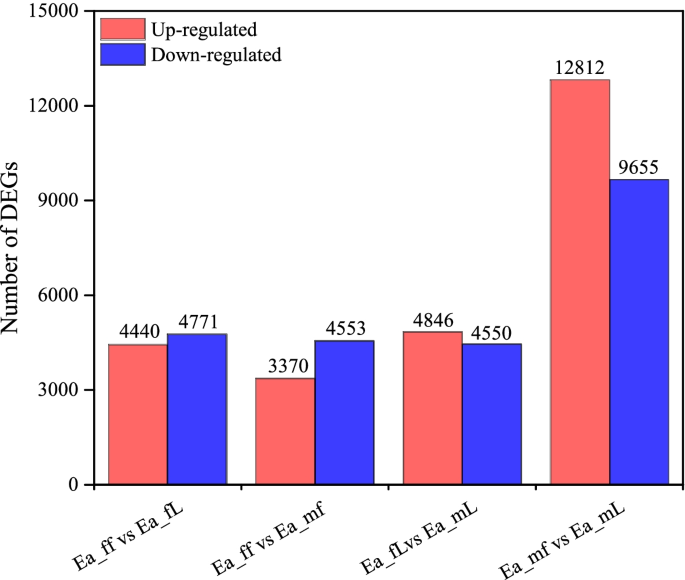
我们在女性和男性中发现了特定的deggydF4y2Ba大肠agallochagydF4y2Ba植物的性别特异性unigenes存在于叶和花的样本(gydF4y2BapgydF4y2Ba值< 0.05,|log2(倍数变化)| > 5),结果如图所示。gydF4y2Ba2gydF4y2Ba.我们发现在Ea_ff vs Ea_fL和Ea_mf vs Ea_mL组中分别有4440和12,812个DEGs上调;而在同一组中,分别有4471和9655个DEGs下调。在雌花与雄花间共发现7923个DEGs,其中Ea_ff组上调3370个,下调4553个。雌、雄叶间存在9396个DEGs,其中Ea_fL组上调4846个,下调4550个。gydF4y2Ba
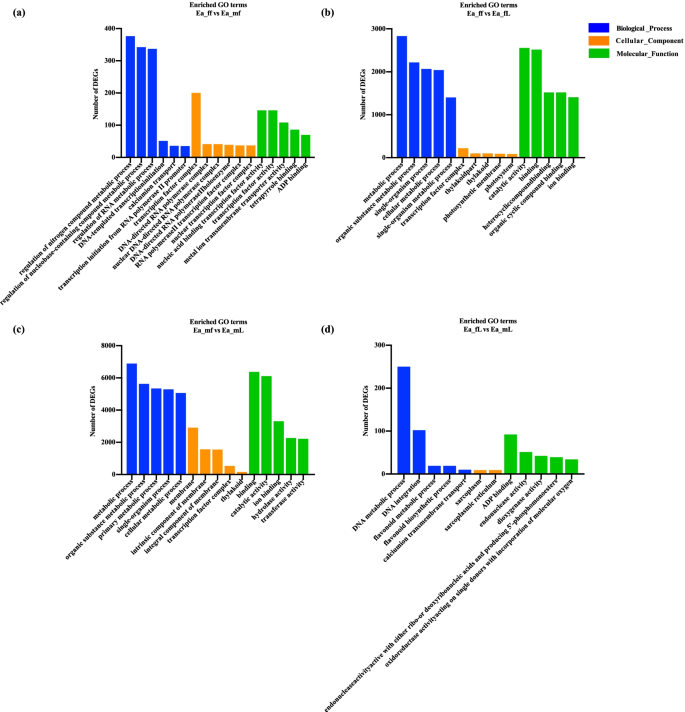
我们对函数进行了注释gydF4y2Ba大肠agallochagydF4y2Ba通过对DEGs进行GO分析,获得女性和男性的转录组。我们的结果(图gydF4y2Ba3.gydF4y2Ba结果表明,在生物过程、细胞成分和分子功能分类中,最显著的富集项与花氮化合物代谢过程(GO:0051171)、转录因子复合体(GO:0005667)和核/ dna导向RNA聚合酶复合体(GO:0055029/GO:0000428)的调控相关(Ea_ff vs Ea_mf组);雌性代谢过程(GO: 0008152)、转录因子复合体(GO:0005667)和催化活性(GO: 0003824) (Ea_ff vs Ea_fL组);雄性(Ea_mf vs Ea_mL组)的代谢过程(GO: 0008152)、膜(GO:0016020)和催化活性(GO: 0003824);叶片中的DNA代谢过程(GO:0006259)、肌浆和肌浆网(GO:0016528和GO:0016529)和ADP结合(GO:0043531) (Ea_fL vs Ea_mL组)。gydF4y2Ba
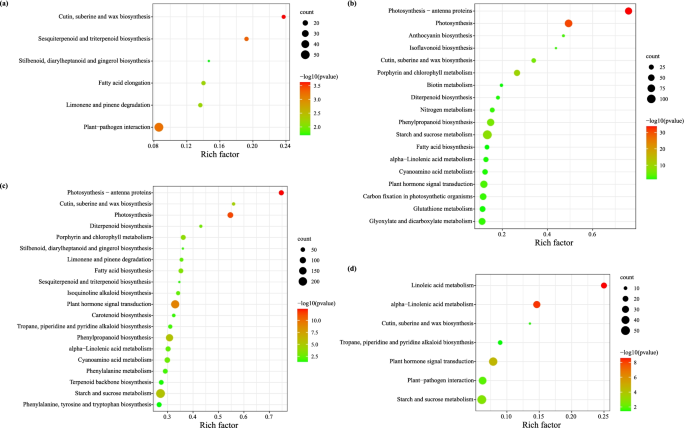
为了识别哪些unigenes与代谢或信号转导通路显著相关,我们使用DEGs查询KEGG数据库,并将结果与全转录组数据进行比较。该通路富集分析显示,这些unigenes在Ea_ff vs Ea_mf、Ea_ff vs Ea_fL、Ea_mf vs Ea_mL和Ea_fLvs Ea_mL组中分别与116、115、124和119条通路相关(表S6数据集Zhou et al.)。gydF4y2Ba2022gydF4y2Ba).估计的前3个显著途径是花中的“植物-病原相互作用”(ko04626)、“脂肪酸延伸”(ko00062)和“倍半萜和三萜生物合成”(ko00909) (Ea_ff vs Ea_mf组)(图)。gydF4y2Ba4gydF4y2Ba一个);雌性的“淀粉和蔗糖代谢”(ko00500)、“光合作用”(ko00195)和“苯丙烷生物合成”(ko00940) (Ea_ff vs Ea_fL组)(图2)。gydF4y2Ba4gydF4y2Bab);雄性植株(Ea_mf vs Ea_mL组)的“淀粉和蔗糖代谢”(ko00500)、“植物激素信号转导”(ko04075)和“苯丙烷类生物合成”(ko00940)(图4)。gydF4y2Ba4gydF4y2Bac);叶片中的“淀粉和蔗糖代谢”(ko00500)、“植物激素信号转导”(ko04075)和“植物-病原体相互作用”(ko04626) (Ea_fLvs Ea_mL组)。gydF4y2Ba4gydF4y2Bad)。gydF4y2Ba
MADS-box转录因子gydF4y2Ba大肠agallochagydF4y2Ba
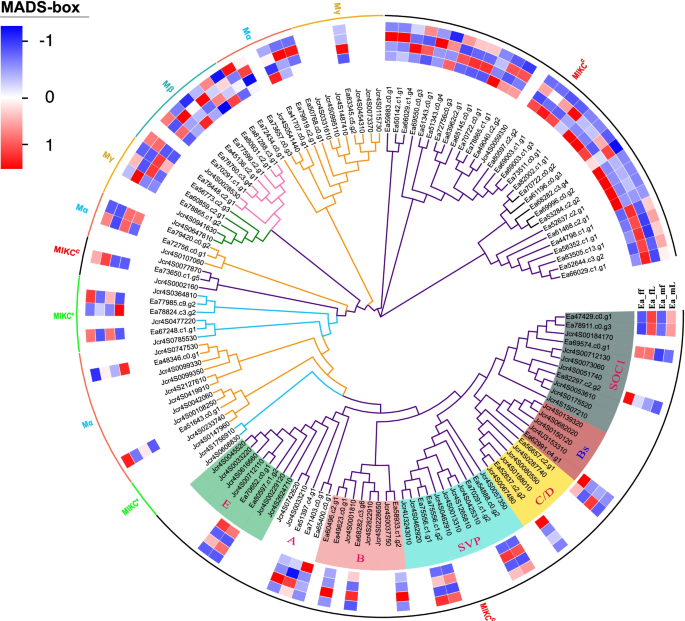
使用上述方法,我们获得了73个独特的MADS-box基因gydF4y2Ba大肠agallochagydF4y2Ba并将这些基因分成几个分支(图。gydF4y2Ba5gydF4y2Ba).同时,我们比较了MADS-box蛋白结构域的结果gydF4y2Ba大肠agallochagydF4y2Ba而且gydF4y2Baj . curcasgydF4y2Ba并进行了系统发育分析。EaMADS-box分类基于之前的一项研究(Tang等。gydF4y2Ba2020gydF4y2Ba).具体来说,我们共鉴定了9、7、4和3个带有Mα、Mβ、Mγ和Mδ MIKC*型基因的基因。其余50个MADS-box蛋白属于MIKCgydF4y2BacgydF4y2Ba子群(无花果。gydF4y2Ba5gydF4y2Ba).值得注意的是,我们推出了7个MIKCgydF4y2BacgydF4y2Ba演化支在gydF4y2Ba大肠agallochagydF4y2Ba属于MIKCgydF4y2BacgydF4y2Ba子群类gydF4y2Baj . curcasgydF4y2Ba.这七个MIKCgydF4y2BacgydF4y2Ba演化支包括B、SVP和SOC1演化支,有4个EaMADS-box序列;A支包括3个EaMADS-box序列;E和C/D分支包括2个EaMADS-box序列;B支包含单个EaMADS-box序列。我们分别在Ea_ff vs Ea_mf、Ea_ff vs Ea_fL、Ea_mf vs Ea_mL和Ea_fL vs Ea_mL组中鉴定出17、38、61和11个MADS-box相关的DEGs。gydF4y2Ba6gydF4y2Ba;表S1数据集Zhou等。gydF4y2Ba2022gydF4y2Ba).在花中(Ea_ff vs Ea_mf组),共发现3个与Mα、1个与Mγ、1个与MIKC*、11个与MIKC结合的DEGsgydF4y2BacgydF4y2Ba子群。在雌性(Ea_ff vs Ea_fL组)中,我们鉴定出3个与Mα有关的基因,2个与Mβ有关的基因,1个与Mγ有关的基因,2个与MIKC*有关的基因,33个与MIKC有关的基因gydF4y2BacgydF4y2Ba子群。在雄性(Ea_mf vs Ea_mL组)中,我们发现了6个与Mα、6个与Mβ、2个与Mγ、3个与MIKC*、39个与MIKC有关的基因gydF4y2BacgydF4y2Ba子群。结果发现3个基因与Mα有关,1个与Mβ有关,1个与Mγ有关,6个与MIKC有关gydF4y2BacgydF4y2Ba叶中(Ea_fL vs Ea_mL组)。因此,系统发育和DEGs分析表明,不同种类的雌性和雄性gydF4y2Ba大肠agallochagydF4y2Ba器官在每个假定的官能团中都含有MADS蛋白。然而,这些预测基因的功能相关性还有待进一步确定。gydF4y2Ba
采用qRT-PCR方法分析MADS-box基因的表达谱gydF4y2Ba大肠agallochagydF4y2Ba.gydF4y2Ba一个gydF4y2BaEa49623.c0.g1gydF4y2Ba.gydF4y2BabgydF4y2BaEa52637.c2.g1gydF4y2Ba.gydF4y2BacgydF4y2BaEa58933.c1.g2gydF4y2Ba.gydF4y2BadgydF4y2BaEa60496.c2.g1gydF4y2Ba.gydF4y2BaegydF4y2BaEa66029.c1.g4gydF4y2Ba.gydF4y2BafgydF4y2BaEa69574.c0.g1gydF4y2Ba.gydF4y2BaggydF4y2BaEa73380.c1.g3gydF4y2Ba.gydF4y2BahgydF4y2BaEa73650.c1.g5gydF4y2Ba.gydF4y2Ba我gydF4y2BaEa73657.c0.g3gydF4y2Ba.gydF4y2BajgydF4y2BaEa75556.c1.g1gydF4y2Ba.gydF4y2BakgydF4y2BaEa78824.c3.g2gydF4y2Ba.gydF4y2BalgydF4y2BaEa78865.c1.g2gydF4y2Ba.gydF4y2Ba米gydF4y2BaEa79919.c2.g1gydF4y2Ba.gydF4y2BangydF4y2BaEa81288.c3.g1gydF4y2Ba.注:内控基因为肌动蛋白基因,用于基因表达分析gydF4y2Ba
基因MADS-box的性别特异性表达模式gydF4y2Ba大肠agallochagydF4y2Ba
因为之前没有发现MADS-box转录因子gydF4y2Ba大肠agallochagydF4y2Ba,我们选择了14个属于每个MADS-box亚组的EaMADS-box基因,并评估了这些基因的表达模式(图。gydF4y2Ba5gydF4y2Ba).我们的结果显示14个MADS-box基因的差异表达gydF4y2Ba大肠agallochagydF4y2Ba(无花果。gydF4y2Ba6gydF4y2Ba;图S7数据集Zhou et al。gydF4y2Ba2022gydF4y2Ba).RNA-seq和qRT-PCR的模式几乎相同,特别是在比较叶子和花的时候(图S7数据集Zhou et al。gydF4y2Ba2022gydF4y2Ba).这表明4个EaMADS-box基因在雄花和花芽组织中均有高表达。这些包括gydF4y2BaEa49623.c0。g1gydF4y2Ba,gydF4y2BaEa60496.c2.g1gydF4y2Ba,gydF4y2BaEa73380.c1.g3gydF4y2Ba而且gydF4y2BaEa78865.c1.g2gydF4y2Ba.重要的是,gydF4y2BaEa69574.c0.g1gydF4y2Ba,gydF4y2BaEa73657.c0.g3gydF4y2Ba,gydF4y2BaEa75556.c1.g1gydF4y2Ba在雌叶中也有高表达,gydF4y2BaEa52637.c2.g1gydF4y2Ba,gydF4y2BaEa58933.c1.g2gydF4y2Ba,gydF4y2BaEa73650.c1.g5gydF4y2Ba在水果,gydF4y2BaEa78824.c3.g2gydF4y2Ba在雄花中,和gydF4y2BaEa66029.c1.g4gydF4y2Ba在男性的树叶。EaMADS-box基因的花表达谱为研究植物花发育提供了相关信息gydF4y2Ba大肠agallochagydF4y2Ba.综上所述,这些结果表明,转录组数据与大多数观察到的表达模式一致gydF4y2Ba大肠agallochagydF4y2Ba基因。gydF4y2Ba
讨论gydF4y2Ba
本研究首次提供了雌雄异株红树林花发育的转录组从头组装。使用7个公共数据库对未发现的unigenes进行了功能注释。揭示了NR BLASTx匹配的物种分布gydF4y2Ba大肠agallochagydF4y2Ba与…密切相关gydF4y2Baj . curcasgydF4y2Ba物种。事实上,这两个gydF4y2Baj . curcasgydF4y2Ba而且gydF4y2Ba大肠agallochagydF4y2Ba属大戟科(Satyan et al。gydF4y2Ba2009gydF4y2Ba;阿卜杜勒加迪尔和范·斯塔登gydF4y2Ba2013gydF4y2Ba).gydF4y2Ba
我们发现了大量与发育和其他生物过程显著相关的性别特异性unigenes。GO分析显示,与各种转录因子复合体相关的基因在雌性中大量富集,而“膜”在雄性中显著富集,影响其性别决定gydF4y2Ba大肠agallochagydF4y2Ba.KEGG通路分析表明,许多鉴定的DEGs参与植物花和叶组织中淀粉和蔗糖的代谢gydF4y2Ba大肠agallochagydF4y2Ba.我们发现在影响雄花的核糖体和植物激素信号转导途径中有较多的DEGs参与。植物激素可以调节植物从营养发育到生殖发育的第一个花序阶段的过渡(Xing et al。gydF4y2Ba2015gydF4y2Ba).此外,植物激素在性别决定中起着至关重要的作用,MADS-box基因的组成性表达导致了早熟花的分化gydF4y2Ba答:芥gydF4y2Ba(TanurdzicgydF4y2Ba2004gydF4y2Ba;AmasinogydF4y2Ba2010gydF4y2Ba).在此基础上,本研究筛选了与雌雄花性别决定相关的附加DEGsgydF4y2Ba大肠agallochagydF4y2Ba.该方法识别出73个属于MADS-box基因家族的DEGs,并证明该家族是植物发育的关键调控因子gydF4y2Ba大肠agallochagydF4y2Ba.9个收获的样品允许进一步鉴定花和果实发育期间的表达谱。共筛选出14个候选基因进行qRT-PCR分析,结果表明这些候选基因在不同器官中具有不同的表达谱。gydF4y2Ba
我们通过寻找与花发育相关的同源基因来分析MADS-box蛋白家族的系统发育gydF4y2Ba大肠agallochagydF4y2Ba.这使我们能够验证这些基因的不同亚家族的身份。我们对MADS-box蛋白序列进行了系统发育分析gydF4y2Baj . curcasgydF4y2Ba.MADS-box蛋白调节花的器官发生,对花的发育和性别决定至关重要(De Bodt等。gydF4y2Ba2003gydF4y2Ba;锅等。gydF4y2Ba2018gydF4y2Ba;bar - lev et al。gydF4y2Ba2021gydF4y2Ba).这些蛋白质可以细分为两个谱系,m型(I型)和MIKC (II型),前者可以根据它们mmas -box区域的序列相似性进一步分为Mα, Mβ和Mγ亚群(Pan等人)。gydF4y2Ba2018gydF4y2Ba).我们注释了73个抄本gydF4y2Ba大肠agallochagydF4y2Ba与MADS-box家族一致和/或包含MADS结构域的转录组。我们的系统发育分析确定了几个同源基因之间gydF4y2Ba大肠agallochagydF4y2Ba而且gydF4y2BaJ.curcasgydF4y2Ba在几乎所有的MADS-box蛋白枝中(图。gydF4y2Ba5gydF4y2Ba;表S1数据集Zhou等。gydF4y2Ba2022gydF4y2Ba).和其他植物一样,gydF4y2Ba大肠agallochagydF4y2Ba含有较多的Mα和MIKCgydF4y2BacgydF4y2Ba与Mγ或MIKC*基因相比(图5)gydF4y2Ba5gydF4y2Ba;表S1数据集Zhou等。gydF4y2Ba2022gydF4y2Ba).MADS-box亚家族基因的分布gydF4y2Ba大肠agallochagydF4y2Ba与大多数植物中观察到的基因相似,表明该基因家族在进化上是保守的(Tian et al。gydF4y2Ba2015gydF4y2Ba;魏et al。gydF4y2Ba2015gydF4y2Ba;马等。gydF4y2Ba2017gydF4y2Ba).几项研究表明MIKCgydF4y2BacgydF4y2Ba基因家族在花发育和花期调控中起着重要作用(Yuan et al.)。gydF4y2Ba2009gydF4y2Ba;王等。gydF4y2Ba2015gydF4y2Ba;Zhang et al。gydF4y2Ba2020 bgydF4y2Ba).有趣的是,我们发现了50个MIKCgydF4y2BacgydF4y2Ba在gydF4y2Ba大肠agallochagydF4y2Ba(无花果。gydF4y2Ba5gydF4y2Ba;表S1数据集Zhou等。gydF4y2Ba2022gydF4y2Ba).这可能表明可能有一个复杂的调节机制的开花gydF4y2Ba大肠agallochagydF4y2Ba.此外,包括Mβ、Mγ和MIKC*在内的亚家族数量的减少表明,其中一些家族可能在进化过程中逐渐消失。gydF4y2Ba
在MIKCgydF4y2BacgydF4y2Ba组中发现A、B、C、D、E类基因gydF4y2Ba大肠agallochagydF4y2Ba.其中,在雄花或雌花中显著上调的基因在花与叶间表达无显著差异。a级的基因,gydF4y2BaAP1 /富尔语gydF4y2Ba(gydF4y2BaEa51397.c4.g1gydF4y2Ba,gydF4y2BaEa65400.c0.g1gydF4y2Ba,gydF4y2BaEa71403.c0.g1gydF4y2Ba)在雄花中表达上调。此外,还有b类基因gydF4y2BaAP3 /πgydF4y2Ba(gydF4y2BaEa49623.c0.g1gydF4y2Ba而且gydF4y2BaEa60496.c2.g1gydF4y2Ba)也在雄花中上调,并可能影响雄性器官的发育。中提出了类似的结果gydF4y2BaQuercus木栓gydF4y2Ba(Rocheta et al。gydF4y2Ba2014gydF4y2Ba)gydF4y2Ba.gydF4y2Ba据挪威云杉的研究报告,b型MADS-box基因活跃于雄性器官原基(Sundstrom and EngstromgydF4y2Ba2002gydF4y2Ba).C和d类基因在植株雌雄花中表达显著上调gydF4y2Ba大肠agallochagydF4y2Ba.gydF4y2BaSTKgydF4y2Ba(gydF4y2BaEa56657.c2.g1gydF4y2Ba)只在花器官中表达,很可能参与花器官的鉴定(SoltisgydF4y2Ba2002gydF4y2Ba).gydF4y2BaAGL104gydF4y2Ba(gydF4y2BaEa52637.c2.g2gydF4y2Ba)在雌花中表达高于雄花。在gydF4y2Ba拟南芥gydF4y2Ba,gydF4y2BaAGL104gydF4y2Ba参与花粉成熟和花粉管生长(Adamczyk和FernandezgydF4y2Ba2009gydF4y2Ba).e级的基因,gydF4y2BaSEP2 / AGL4gydF4y2Ba(gydF4y2BaEa80597.c1.g2gydF4y2Ba而且gydF4y2BaEa70652.c0.g1gydF4y2Ba)在雌花和雄花中显著上调。gydF4y2BaSEP2 / AGL4gydF4y2Ba是花器官规范所必需的(Wang et al。gydF4y2Ba2016gydF4y2Ba).然而,这些基因在雌雄花的表达上没有显著差异。因此,我们假设e类基因可能不是性别决定所必需的。在苹果中,SOC1 (supsor OF CONSTANS 1)调控花芽的诱导。gydF4y2Ba2015gydF4y2Ba).gydF4y2BaSOC1gydF4y2Ba(gydF4y2BaEa47429.c0.g1gydF4y2Ba,gydF4y2BaEa78911.c0.g3gydF4y2Ba,gydF4y2BaEa69574.c0.g1gydF4y2Ba而且gydF4y2BaEa82297.c2.g2gydF4y2Ba)在花器官中表达较叶片显著下调,但在花蕾中表达较显著。的gydF4y2Ba高级副总裁gydF4y2Ba基因抑制花的转变gydF4y2Bab . junceagydF4y2Ba(李等。gydF4y2Ba2019gydF4y2Ba),在植物的雄性和雌性叶片中均有高表达gydF4y2Ba大肠agallochagydF4y2Ba.这将是非常有趣的评估这个基因是否可能被类似的抑制gydF4y2Ba大肠agallochagydF4y2Ba,限制了叶片的发育。我们建议gydF4y2BaAP1gydF4y2Ba/gydF4y2Ba富尔语gydF4y2Ba,gydF4y2BaAP3 /πgydF4y2Ba,gydF4y2BaAGL104gydF4y2Ba,gydF4y2BaSOC1gydF4y2Ba是否应考虑性别决定的候选调节器gydF4y2Ba大肠agallochagydF4y2Ba.gydF4y2Ba
结论gydF4y2Ba
我们报告的转录组gydF4y2BaEgydF4y2Ba.gydF4y2BaagallochagydF4y2Ba.这些数据为了解红树林的进化历史提供了重要的信息。大量的转录本序列可用于发现新的基因,特别是与花发育有关的基因gydF4y2BaEgydF4y2Ba.gydF4y2BaagallochagydF4y2Ba.雌花与雄花间共鉴定出7923个DEGs,其中73个为MADS-box基因(50个属于MIKC基因)gydF4y2BacgydF4y2Ba子群)。我们的结果表明gydF4y2BaAP1gydF4y2Ba/gydF4y2Ba富尔语gydF4y2Ba,gydF4y2BaAP3gydF4y2Ba/gydF4y2BaπgydF4y2Ba,gydF4y2BaAGL104gydF4y2Ba,gydF4y2BaSOC1gydF4y2Ba基因在植物花器官的形成过程中起着重要作用gydF4y2BaEgydF4y2Ba.gydF4y2BaagallochagydF4y2Ba.gydF4y2Ba
数据和材料的可用性gydF4y2Ba
在当前研究中生成的数据集可在NCBI数据库中获得:gydF4y2Bahttps://www.ncbi.nlm.nih.gov/bioproject/PRJNA760657gydF4y2Ba.补充数据集亦可于以下网址下载:gydF4y2Bahttps://doi.org/10.6084/m9.figshare.20362563.v5gydF4y2Ba
参考文献gydF4y2Ba
Abdelgadir HA, Van Staden J(2013)麻疯树(大戟科)的民族植物学、民族药理学和毒性研究进展。南J Bot 88:204-218。gydF4y2Bahttps://doi.org/10.1016/j.sajb.2013.07.021gydF4y2Ba
Adamczyk BJ, Fernandez DE (2009) MIKC* MADS结构域异二聚体是拟南芥花粉成熟和管束生长所必需的。植物杂志149:1713 - 1723。gydF4y2Bahttps://doi.org/10.1104/pp.109.135806gydF4y2Ba
Amasino R(2010)开花的季节和发育时间。植物J 61:1001 - 1013。gydF4y2Bahttps://doi.org/10.1111/j.1365-313X.2010.04148.xgydF4y2Ba
白刚,杨德华,曹培军等(2019)MADS-box基因家族的全基因组鉴定、基因结构和表达分析及其在烟草发育中的功能(gydF4y2Ba烟草gydF4y2Bal .)。国际分子生物学杂志20:5043。gydF4y2Bahttps://doi.org/10.3390/ijms20205043gydF4y2Ba
Bar-Lev Y, Senden E, Pasmanik-Chor M, Sapir Y(2021)皇家虹膜(Royal Iris)的转录组特征和MADS-box和系统发育分析gydF4y2BaR2R3-MYBgydF4y2Ba基因家族。Sci代表11:16246。gydF4y2Bahttps://doi.org/10.1038/s41598-021-95085-5gydF4y2Ba
[陈燕,叶燕(2014)盐度和营养物添加对红树林的影响。gydF4y2BaExcoecaria agallochagydF4y2Ba.《公共科学图书馆•综合》9:e93337。gydF4y2Bahttps://doi.org/10.1371/journal.pone.0093337gydF4y2Ba
coesa A, Gotz S, Garcia-Gomez JM等人(2005)Blast2GO:功能基因组学研究中用于注释、可视化和分析的通用工具。生物信息学21:3674 - 3676。gydF4y2Bahttps://doi.org/10.1093/bioinformatics/bti610gydF4y2Ba
De Bodt S, Raes J, Florquin K等(2003)植物I型MADS-box基因全基因组结构注释和进化分析。J Mol evl 56:573-586。gydF4y2Bahttps://doi.org/10.1007/s00239-002-2426-xgydF4y2Ba
杜克NC(2006)澳大利亚的红树林:澳大利亚红树林植物的权威指南。昆士兰大学圣卢西亚分校gydF4y2Ba
Grabherr MG, Haas BJ, Yassour M等人(2011)没有参考基因组的RNA-Seq数据的全长转录组组装。生物科技Nat》29:644 - 652。gydF4y2Bahttps://doi.org/10.1038/nbt.1883gydF4y2Ba
Grimplet J, Martínez-Zapater JM, Carmona MJ(2016)葡萄MADS-box转录因子家族的结构和功能注释。BMC基因组17:80。gydF4y2Bahttps://doi.org/10.1186/s12864-016-2398-7gydF4y2Ba
Hernández-Cruz R, Silva-Martínez J, García-Campusano F,等(2019)雄异株仙人掌Opuntia robusta雄蕊花和雌蕊花的比较发育。植物天线转换开关32:257 - 273。gydF4y2Bahttps://doi.org/10.1007/s00497-019-00365-wgydF4y2Ba
徐宏福(2002)兰(Oncidium Gower Ramsey) AP3-like MADS基因调控花的形成和启动。植物细胞物理43:1198-1209。gydF4y2Bahttps://doi.org/10.1093/pcp/pcf143gydF4y2Ba
Kater MM, Dreni L, Colombo L(2006)控制水稻和拟南芥花器官识别的MADS-box因子的功能守恒。J Exp Bot 57:34 - 3444。gydF4y2Bahttps://doi.org/10.1093/jxb/erl097gydF4y2Ba
Krizek BA, Fletcher JC(2005)花发育的分子机制:扶手椅指南。Nat Rev Genet:688 - 698。gydF4y2Bahttps://doi.org/10.1038/nrg1675gydF4y2Ba
Leseberg CH, Li A, Kang H et al . (2006) trichocarpa胡杨MADS-box基因家族的全基因组分析。基因378:84 - 94。gydF4y2Bahttps://doi.org/10.1016/j.gene.2006.05.022gydF4y2Ba
Li B, Dewey CN (2011) RSEM:从有或没有参考基因组的RNA-Seq数据中精确的转录本定量。BMC生物信息学12:323。gydF4y2Bahttps://doi.org/10.1186/1471-2105-12-323gydF4y2Ba
李松,李智,张杰等(2019)开花信号积分器AGL24与AGL18的K域相互作用gydF4y2Ba芸苔属植物junceagydF4y2Ba.生物化学生物物理学杂志518:148-153。gydF4y2Bahttps://doi.org/10.1016/j.bbrc.2019.08.023gydF4y2Ba
林C-S,许C-T,廖D-C等(2016)兰花MADS-box基因家族的转录组分析gydF4y2BaErycina pusillagydF4y2Ba.植物工程学报(英文版)gydF4y2Bahttps://doi.org/10.1111/pbi.12383gydF4y2Ba
刘刚,张铮,王赟,李旭(2021)高氧的戊二烷和异多酚二萜gydF4y2BaExcoecaria agallochagydF4y2Ba.Nat Prod Res 1-7。gydF4y2Bahttps://doi.org/10.1080/14786419.2021.1900177gydF4y2Ba
马杰,杨勇,罗伟等(2017)面包小麦MADS-box基因家族全基因组鉴定与分析(gydF4y2Ba小麦gydF4y2Bal .)。《公共科学图书馆•综合》12:e0181443。gydF4y2Bahttps://doi.org/10.1371/journal.pone.0181443gydF4y2Ba
Masiero S, Colombo L, Grini PE等(2011)I型MADS盒子转录因子在植物繁殖中的重要性。植物细胞23:865 - 872。gydF4y2Bahttps://doi.org/10.1105/tpc.110.081737gydF4y2Ba
Mendes MA, Guerra RF, Berns MC等(2013)MADS结构域转录因子介导短程DNA环,对拟南芥靶基因表达至关重要。植物细胞25:2560 - 2572。gydF4y2Bahttps://doi.org/10.1105/tpc.112.108688gydF4y2Ba
D,曹勇,陈涛等(2019)梨MADS-box基因的进化与功能分化。Sci代表9:1266。gydF4y2Bahttps://doi.org/10.1038/s41598-018-37897-6gydF4y2Ba
蒙达尔,高希D,罗摩克里希纳K(2016)盲眼红树林的完整概况gydF4y2BaExcoecaria agallochagydF4y2Bal . (gydF4y2Ba大戟科gydF4y2Ba):民族植物学、植物化学和药理学方面。Pharmacogn牧师10(123)。gydF4y2Bahttps://doi.org/10.4103/0973-7847.194049gydF4y2Ba
Moser M, Asquini E, Miolli GV等(2020)MADS-box基因gydF4y2BaMdDAM1gydF4y2Ba控制苹果生长停止和芽休眠。前沿植物科学:1003。gydF4y2Bahttps://doi.org/10.3389/fpls.2020.01003gydF4y2Ba
Nguyen L-T, Schmidt HA, von Haeseler A, Minh BQ (2015) IQ-TREE:一种快速有效的估计最大似然系统发育的随机算法。分子生物学杂志32:38 - 274。gydF4y2Bahttps://doi.org/10.1093/molbev/msu300gydF4y2Ba
Ogata H, Goto S, Sato K et al (1999) KEGG:京都基因和基因组百科全书。核酸Res 27:29-34。gydF4y2Bahttps://doi.org/10.1093/nar/27.1.29gydF4y2Ba
潘健,常平,叶霞等(2018)山茶中参与铝和氟同化的MADS-box家族基因转录组全范围分析。生物科技植物》35:313 - 324。gydF4y2Bahttps://doi.org/10.5511/plantbiotechnology.18.0621agydF4y2Ba
Rocheta M, Sobral R et al .(2014)雌雄同株植物雄花和雌花的比较转录组学分析gydF4y2BaQuercus木栓gydF4y2Ba.植物科学gydF4y2Bahttps://doi.org/10.3389/fpls.2014.00599gydF4y2Ba
Robinson MD, McCarthy DJ, Smyth GK (2010) EdgeR:用于数字基因表达数据差异表达分析的生物导体包。生物信息学26:139 - 140。gydF4y2Bahttps://doi.org/10.1093/bioinformatics/btp616gydF4y2Ba
Rounsley SD, Ditta GS, Yanofsky MF (1995) MADS盒基因在拟南芥发育中的不同作用。植物细胞7:1259 - 1269。gydF4y2Bahttps://doi.org/10.1105/tpc.7.8.1259gydF4y2Ba
Satyan R, Aveek N, Eganathan P, Parida A(2009)植物次生代谢物在种子培养和体外繁殖的比较组织化学定位gydF4y2BaExcoecaria agallochagydF4y2Ba林恩。(gydF4y2Ba大戟科gydF4y2Ba),即具有历史意义的乳白色红树。生物技术Histochem: 1 - 9。gydF4y2Bahttps://doi.org/10.1080/10520290903202478gydF4y2Ba
Schilling S, Kennedy A, Pan S等(2020)小麦MIKC型MADS -box基因的全基因组分析:普遍复制、功能守恒和假定的新功能化。新植醇225:511 - 529。gydF4y2Bahttps://doi.org/10.1111/nph.16122gydF4y2Ba
Seesangboon A, Gruneck L, Pokawattana T等(2018)gydF4y2Ba麻风树gydF4y2BaL.花蕾对多效唑处理有反应。植物物理与生物化学127:276-286。gydF4y2Bahttps://doi.org/10.1016/j.plaphy.2018.03.035gydF4y2Ba
缺失的环节:花的遗传结构和花的多样化。植物科学进展7:22-31。gydF4y2Bahttps://doi.org/10.1016/s1360 - 1385 (01) 02098 - 2gydF4y2Ba
孙伟,黄伟,李铮等(2014)gydF4y2BaAP1gydF4y2Ba/gydF4y2Ba9月gydF4y2Ba/gydF4y2BaAGL6gydF4y2Ba基部淫羊藿MADS-box基因的超分支。安机器人113:653 - 668。gydF4y2Bahttps://doi.org/10.1093/aob/mct301gydF4y2Ba
Sundstrom J, Engstrom P(2002)针叶树生殖发育涉及b型MADS-box基因,它们在雄性器官原基中具有不同的和不同的活性。植物J 31:161 - 169。gydF4y2Bahttps://doi.org/10.1046/j.1365-313X.2002.01343.xgydF4y2Ba
史文松,刘文松,Engström P (2000)gydF4y2BaLAMB1gydF4y2Ba青苔的吉恩,gydF4y2Ba石松属植物annotinumgydF4y2Ba,是一个发散的MADS-box基因,专门表达在产孢结构中。基因253:31-43。gydF4y2Bahttps://doi.org/10.1016/s0378 - 1119 (00) 00243 - 2gydF4y2Ba
唐勇,王杰,包雪等(2020)麻疯树MADS-box基因家族全基因组分析及功能表征gydF4y2BaJcMADS40gydF4y2Ba转基因水稻中的基因。BMC基因组21:325。gydF4y2Bahttps://doi.org/10.1186/s12864-020-6741-7gydF4y2Ba
Tanurdzic M(2004)陆地植物的性别决定机制。植物细胞在线16:61-71。gydF4y2Bahttps://doi.org/10.1105/tpc.016667gydF4y2Ba
田勇,董强,季智等(2015)苹果MADS-box基因家族的全基因组鉴定与分析。基因555:277 - 290。gydF4y2Bahttps://doi.org/10.1016/j.gene.2014.11.018gydF4y2Ba
Tomlinson PB(2016)《红树林植物学》,第二版。剑桥大学出版社,剑桥gydF4y2Ba
王东,陈旭,张铮等(2015)MADS-box基因gydF4y2BaNtSVPgydF4y2Ba通过直接抑制KNAT1样KNOX基因调控花梗伸长gydF4y2BaNtBPLgydF4y2Ba在烟草(gydF4y2Ba烟草gydF4y2Bal .)。J Exp Bot 66:6233-6244。gydF4y2Bahttps://doi.org/10.1093/jxb/erv332gydF4y2Ba
王欣,高东,孙杰等(2016)sepallata样基因外显子跳变与黄瓜花和果实发育紊乱相关:gydF4y2BaCsSEP2gydF4y2Ba发展和黄瓜。植物生物学杂志(英文版):766 - 771。gydF4y2Bahttps://doi.org/10.1111/jipb.12472gydF4y2Ba
韦伯斯特GL(1994)大戟科分类。安莫波特加德81:3。gydF4y2Bahttps://doi.org/10.2307/2399908gydF4y2Ba
魏晓,王磊,余杰等(2015)芝麻MADS-box基因家族的全基因组鉴定与分析。基因569:66 - 76。gydF4y2Bahttps://doi.org/10.1016/j.gene.2015.05.018gydF4y2Ba
袁永春,郑j - a, Kim JS(2021)小麦小麦MADS-box基因家族的全基因组分析gydF4y2Ba菊花gydF4y2Ba.编译Biol Chem 90:107424。gydF4y2Bahttps://doi.org/10.1016/j.compbiolchem.2020.107424gydF4y2Ba
谢超,毛旭,黄杰等(2011)KOBAS 2.0:用于富集途径和疾病注释和识别的web服务器。核酸Res 39:316-322。gydF4y2Bahttps://doi.org/10.1093/nar/gkr483gydF4y2Ba
邢丽波,张东,李艳梅等(2015)转录谱揭示了介导苹果花诱导的糖和激素信号通路(gydF4y2Ba马吕斯有明显gydF4y2BaBorkh)。植物细胞物理56:2052-2068。gydF4y2Bahttps://doi.org/10.1093/pcp/pcv124gydF4y2Ba
徐红,陈涛,祁梅等(2021)枇杷中的山梨醇通过MADS-box转录因子EjCAL促进早期花芽分化。bioRxiv 2021.08.17.456699。gydF4y2Bahttps://doi.org/10.1101/2021.08.17.456699gydF4y2Ba
袁艳霞,吴杰,孙瑞峰等(2009)gydF4y2Ba芸苔属植物拉伯FLC1gydF4y2Ba基因与开花时间的变化有关。J Exp Bot 60:1299-1308。gydF4y2Bahttps://doi.org/10.1093/jxb/erp010gydF4y2Ba
张欣,Fatima M,周鹏等(2020a)通过对MADS-box基因的分析,发现了菠萝开花基因网络的修饰及其日表达。BMC基因组21:8。gydF4y2Bahttps://doi.org/10.1186/s12864-019-6421-7gydF4y2Ba
周艳,郝丽,黄丽,唐旭,卓德,王丽丽,张艳(2022)植物花性决定的转录组重组特征gydF4y2BaExcoecaria agallochagydF4y2Ba.(数据集)。Figshare库V5。gydF4y2Bahttps://doi.org/10.6084/m9.figshare.20362563.v5gydF4y2Ba
张燕,陈燕,周燕等(2020b)比较转录组揭示了基因对herkogamy的适应gydF4y2BaLumnitzera littoreagydF4y2Ba(杰克)沃伊特。獛11:584817前面。gydF4y2Bahttps://doi.org/10.3389/fgene.2020.584817gydF4y2Ba
张志斌,金永杰,万红华等(2021)山茶MADS-box转录因子家族的全基因组鉴定与表达分析。J应用科学学报62:249-264。gydF4y2Bahttps://doi.org/10.1007/s13353-021-00621-8gydF4y2Ba
代码的可用性gydF4y2Ba
不适用gydF4y2Ba
资金gydF4y2Ba
本研究得到国家自然科学基金项目(No. 41776148、31360173)、广东省基础及应用基础研究基金项目(No. 2019A1515110138)、岭南师范大学校级人才计划项目(No. 2019A1515110138)资助。ZL2003也没有。ZL2032)。gydF4y2Ba
作者信息gydF4y2Ba
作者和联系gydF4y2Ba
贡献gydF4y2Ba
概念化:张颖、周燕;方法:郝璐璐、黄乐祥;形式分析与调查:唐晓明、周丹婷;写作-初稿准备:晏洲;撰稿、编辑:周燕、王丽云;资金获取:张颖、王丽云;资源:应张;监督:Liyun王。所有作者阅读并批准了最终稿件。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用gydF4y2Ba
同意出版gydF4y2Ba
所有作者都对本出版物及其内容给予了知情同意。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明他们没有竞争利益。gydF4y2Ba
额外的信息gydF4y2Ba
处理编辑:Véronique Jorge。gydF4y2Ba
出版商的注意gydF4y2Ba
伟德体育在线施普林格自然对出版的地图和机构附属的管辖权要求保持中立。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
周燕,郝丽丽,黄丽丽。gydF4y2Baet al。gydF4y2Ba新生转录组组装揭示了花性别决定的特征gydF4y2BaExcoecaria agallochagydF4y2Ba.gydF4y2Ba林业科学年鉴gydF4y2Ba79gydF4y2Ba36(2022)。https://doi.org/10.1186/s13595-022-01156-6gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s13595-022-01156-6gydF4y2Ba
关键字gydF4y2Ba
- 大肠agallochagydF4y2Ba
- MADS-boxgydF4y2Ba
- 性别决定gydF4y2Ba