摘要
背景
牛呼吸系统疾病(BRD)是由宿主、环境和病原体相互作用引起的。对患BRD的牛进行死前病原鉴定的一种标准方法是深度防护鼻咽拭子,这一方法具有挑战性,成本高,并产生废物。目的是比较恢复能力Mannheimia haemolytica使用29.5英寸(74.9厘米)深防护鼻咽拭子、16英寸(40.6厘米)无防护直肠拭子和6英寸(15.2厘米)无防护鼻拭子进行微生物群落结构的比较,并采用培养、实时定量pcr和16S rRNA基因测序进行鉴定。在到达饲养场2周后,从牛的上呼吸道收集好氧培养、qPCR和16S rRNA基因测序样本。
结果
所有拭子类型的培养和qPCR结果高度一致(分别有77%和81%的样本动物完全通过所有3种拭子类型的培养和qPCR结果)。微生物群落在不同拭子类型采集的样本中高度相似,与BRD治疗方法相关的差异也相似。qPCR结果阳性m . haemolytica是高度一致的(81%完全同意),但用深防护棉签收集的样品有较低的MhDNA鉴定(Kruskal-Wallis秩方差分析,P< 0.05;与Benjamini-Hochberg校正进行两两比较的dunn检验,P< 0.05),阳性频率低于鼻拭子和直肠拭子(McNemar’s卡方检验,P< 0.05)。
结论
虽然从单个牛采集的不同类型拭子之间存在差异,但鼻拭子和直肠拭子在鉴定和特征方面与深防护鼻咽拭子具有相当的结果m . haemolytica通过培养,16S rRNA基因测序和qPCR。
背景
牛呼吸系统疾病(BRD)是牛发病和死亡的主要原因之一,导致饲养场经营的重大经济损失[1].BRD是一种复杂的疾病,涉及环境因素、宿主免疫和微生物病原体之间的相互作用[2,3.].尽管BRD是一种多因素疾病,但细菌病原体的参与导致抗菌素成为疑似BRD的主要治疗方法,并用于疾病控制和预防[4,5].广泛使用抗微生物药物治疗和控制BRD已导致人们对BRD病原体分离株中抗微生物药物耐药性患病率增加的担忧[6,7].
历史上,最常见的细菌病原体通过培养方法分离的北美饲养场牛BRD是Mannheimia haemolytica(Mh) [8],而且它仍然经常与BRD有关[9].虽然Mh可在健康动物体内发现[10),隔离Mh在受BRD影响的动物群体中,从上呼吸道分离的Mh在肺部[11].虽然有氧培养是主要的诊断程序用于检测Mh这使得可以通过体外药敏试验和全基因组测序进行鉴定,使用培养无关的分子技术有助于帮助减少诊断时间,并加强对通过培养确认身份耗时的病原体的检测[12].Real-time qPCR已被报道Mh[12],这允许识别和量化Mh在不需要培养的样本中。此外,通过16S rRNA基因测序,在整个微生物群落的背景下研究病原体变得越来越重要[13,14,15].
也许,BRD病原体生前检测最常见的技术之一是使用长(29.5英寸;74.9 cm)双防护棉签[16,17,18,19最初设计用于母马的子宫培养。使用这些棉签的一个明显优势是能够在鼻咽深处采样,由于它们的保护结构,从鼻孔和吻侧气道污染的可能性更小。从理论上讲,与使用短(6英寸)无防护鼻拭子相比,使用这些拭子可以更准确地定位重要呼吸道细菌的解剖来源,后者通常用于对牛的呼吸道病毒病原体进行取样。在一项研究中,在受BRD影响的犊牛中,鼻咽培养与低气道采样的一致性高于鼻通道培养[11].然而,其他研究表明鼻咽部和鼻咽部的培养高度一致Mh与急性疾病乳牛和肉牛的下气道培养相比[20.,21].在评价健康牛的上呼吸道微生物组时,鼻咽部细菌群落和肺群落之间的一致性高于鼻道和肺之间的一致性[15].然而,使用双防护棉签进行鼻咽深度采样比使用鼻拭子进行采样需要更多的技术技能和解剖学知识,并且经常需要对头部进行严格的约束。这些取样技术的一个可能的替代方案是长(16英寸;40.6厘米)大尖拭子,用于人体直肠取样。这种棉签足够长,可以到达鼻咽,但比双防护棉签更灵活,可能更容易通过上呼吸道。与长双防护拭子和短拭子的小拭子(5毫米直径× 15毫米长)相比,直肠拭子上更大的拭子头(14毫米直径× 35毫米长)也有可能收集更多的呼吸分泌物。15.2 cm)拭子通常用于微生物样本的收集(附加文件3.:无花果。S1, S2)。16英寸直肠拭子($363/500计数)[22或6英寸鼻拭子($23/100次)[23]相对于29.5英寸双防护棉签($108/25计数)更容易使用,也更便宜[24],这些直肠拭子的结果与其他取样技术的一致程度尚未报道。
本研究的目的是比较使用长双防护鼻咽拭子、短鼻道拭子和长鼻道鼻咽直肠拭子的恢复和表征Mh使用分离和药敏试验培养物以及非培养物方法(qPCR、16S rRNA基因测序)进行评估。重要的是,本研究探讨了这些样本和测试策略的特性Mh在健康动物和BRD患者身上
方法
研究人群和抽样
两组分别由60头牛型阉牛和公牛组成,分别从德克萨斯州中部的一个牲畜拍卖市场购买,于2020年5月14日和5月21日运往西德克萨斯农工大学研究饲养场,在那里它们被纳入本研究(n = 120)。在到达饲养场后,牛会收到带有个人识别号码的耳朵标签,并按照许多饲养场的标准做法进行处理。简单地说,为治疗BRD过敏反应,给每只动物皮下注射长效大环内酯替地吡松(Zuprevo, Intervet Inc., Summit, NJ) 4 mg/kg。动物接种梭状芽胞杆菌(Calvary 9, Merck Animal Health, Omaha, NE)和呼吸道细菌病原体(Once PMH, Merck Animal Health, Omaha, NE)的疫苗,给予zeranol生长植入物(Ralgro, Merck Animal Health, Summit, NJ),并给予阿苯达唑(Valbazen, Zoetis, Kalamazoo, MI)和伊维菌素与corsulon (ivermectin Plus, Durvet, Inc., Blue Springs, MO)驱虫治疗。动物也通过抗原捕获ELISA检测,以确定任何持续感染牛病毒性腹泻病毒(BVD-PI)的动物,并将所有BVD-PI动物从研究中移除。在过敏反应、疫苗和给药后的第二天,阉割公牛并口服1.1 mg/kg的美洛昔康(补充文件)4:表S1)。
训练有素的饲养场人员每天对围栏进行监测,以识别患有BRD的动物,并根据疾病的视觉体征为动物分配0-4的BRD临床评分(附加文件)4:表S2) [25].临床评分≥2的牛将被移出围栏。直肠温度≥40°C和/或临床评分≥3分的动物被分类为BRD阳性。根据饲料场规程,用抗菌素对动物进行BRD治疗(附加文件4:表S2)。第1组和第2组分别饲喂213天和255天。
第14天到达后,当发病率较高m . haemolytica预期会脱落[17,牛通过一个斜槽加工,在那里称重并限制取样。如前所述,获得6个不同的鼻咽样本(左起3个,右起3个)[11].简单地说,用纸巾清洁外鼻孔以去除表面分泌物和污垢,然后用6英寸(15.2厘米)粘胶纤维鼻拭子(NS)擦拭内鼻腔通道(SP130D, Starplex科学公司,圣路易斯,密苏里州);拭子插入鼻道约2 - 3英寸处取样。收集鼻拭子后,使用16英寸(40.6厘米)粘胶纤维直肠拭子(PS) (816-100, Puritan, Guilford, ME)或29.5英寸(74.9厘米)棉纤维深防护拭子(DG) (E9-5200, Continental Plastic, Delavan, WI)通过将拭子传到鼻咽尾端腭咽弓水平处对左右鼻咽通道进行采样;收集直肠检查和深度保护棉签的顺序是随机的。通过左鼻孔收集的所有拭子被放置在改良的Amies运输培养基(Starplex Scientific Corporation, St. Louis, MO)中,用于好氧细菌培养、鉴定和抗菌药敏测试。所有通过右鼻孔采集的棉签置于100%乙醇中以稳定微生物群落结构,并用于DNA提取和随后的16S rRNA基因测序和qPCR分析。所有样本都保存在冰上,收集后立即运往实验室进行处理。
登记的两只动物的唯一动物ID记录错误,导致无法提取有关动物体重和健康记录的相应数据。此外,三个用于DNA分析的拭子样本(两个深防护拭子样本和一个直肠拭子样本)和一个用于培养的深防护拭子样本在运输到实验室的过程中损坏,无法进行分析。从一个深保护棉签样本中提取DNA也失败了。因此,这些数据在结果中缺失。
培养,微生物鉴定和药敏试验
从改良的Amies培养基中收集的棉签直接划痕到含有5%羊血(Remel, Lenexa, KS)的胰蛋白酶大豆琼脂(TSA)培养皿的一个四分之一,用一次性无菌环(Remel, Lenexa, KS)划痕培养皿的其余部分用于细菌分离。培养皿在37°C和5% CO中培养2.在孵育24和48小时时,监测板的生长是否与Mh(2-3毫米,圆形,隆起,浅灰色,光滑,有光泽的菌落,有微弱的β-溶血)。如果菌落与这种生长一致,进行过氧化氢酶、氧化酶和吲哚试验。如果初步生化测试结果与Mh(过氧化氢酶阳性、氧化酶阳性和吲哚阴性),随机选择单个菌落Mh -类似菌落在培养基板底部随机位置做标记,继代培养到新的血琼脂板上,在上述条件下返回培养箱。24 h后,继代培养进行菌落表型和生化检测Mh.如果存在,随机选择5-7菌落,使用无菌一次性循环,悬浮到1.5 mL脑心灌注汤(B-D,富兰克林湖,新泽西州)和30%甘油(Thermofisher,沃尔瑟姆,MA)。然后用同样的循环标记另一个血琼脂板的一半,然后按照上述方法孵育24小时,然后冷藏运到内布拉斯加-林肯大学兽医诊断中心(UNL-VDC),以确认鉴别和进行抗菌敏感性测试。没有可疑的主板Mh48 h的生长被认为是负的m . haemolytica。
在UNL-VDC,从装运的培养皿中取一个菌落在血琼脂上传代培养一夜,以确保纯生长,然后用于确认Mh鉴定和抗菌药敏试验。用基质辅助激光解吸电离飞行时间质谱(MALDI-TOF)进行了验证Mh识别以及基于MALDI-TOF生物标志物的基因分型Mh隔离(26].
在UNL-VDC中,通过敏化系统(ThermoFisher, Waltham, MA)和含有甘霉素和替地二哌松素的牛/猪面板(BOPO7F兽医AST板,ThermoFisher, Waltham, MA)使用半自动肉汤微量稀释法进行抗菌药敏试验。的断点解释结果Mh在BRD的临床和实验室标准协会[27].如果分离株对≥3类抗菌药物不敏感,则被定性为耐多药(MDR) [28].由于BOPO7平板上氨苄西林的浓度范围不包括CLSI断点,因此只记录了最低抑菌浓度(MIC),而氨苄西林耐药分类不包括在作为多药耐药的分离株的测定中。
DNA提取
根据制造商说明,使用QIAamp PowerFecal DNA试剂盒(Qiagen, Hilden, Germany)从拭子样本中分离DNA。分离后,使用量子位Flex荧光计(ThermoFisher, Waltham, MA)对DNA进行定量(ng/uL)。
qPCR样品制备及反应条件
从提取的DNA中,两个400 ng的DNA等分体被送到密西西比州立大学进行qPCR。其中一个样品在Low-Tris TE缓冲液中稀释至估计最终浓度为8 ng/μL。最终浓度在Qubit 4荧光计(Thermofisher, Waltham, MA)上测定,样品DNA模板的平均浓度为6.73±2.00 ng/μL。用8、10倍的稀释度(最高= 1.8 ng/μL,最低= 1.8 × 10)绘制DNA定量标准曲线−7从植物的纯培养物中提取的DNA (ng/μL)Mh由Sensititre GNID (Thermofisher, Waltham, MA)确认。使用QuantStudio 3 Real-Time PCR仪(Thermofisher, Waltham, MA)对每个标准进行9次重复,并使用以下反应混合物:7 μL的MhDNA标准品,10 μL PerfeCTa SYBR Green FastMix Low ROX (Quantabio, Beverly, MA),正向(F)和反向(R)引物各1 μLMh白细胞毒素D基因(lktD)(F-CTGCAACAAAGCCGATATCTTT R-TACGACTGCTGAAACCTTGAT) (12],分子级H2O达到20 μL的最终体积。扩增发生在以下条件下:95°C 5分钟,然后45个循环95°C 15秒,60°C 45秒。QuantStudio Design and Analysis Software v. 1.5.1默认设置(Thermofisher, Waltham, MA)用于确定量化周期(C问)重复阈值、融化曲线分析和其他质量控制检查,并将结果导出到使用Excel for Mac Version 16.5 (Microsoft)进行分析的电子表格中。C的标准曲线问诉日志10(ng of DNA)用于计算的质量MhDNA。含有SD C的DNA质量最低问以≤0.5为检测限。
对于样品板,使用QuantStudio 3 Real-Time PCR仪(Thermofisher, Waltham, MA)和以下反应混合物进行三次重复反应:40 ng(平均= 41.5 ng, SD = 4.7 ng)样品DNA, 10 μL PerfeCTa SYBR Green FastMix Low ROX (Quantabio, Beverly, MA), F和R底物各1 μLMh lktD基因(12],分子级H2O达到20 μL的最终体积。一个更小的校准曲线使用稀释5倍,10倍的DNA提取纯生长Mh通过Sensititre GNID (Thermofisher, Waltham, MA)确认,包括在每个96孔微安板(4316,813,Thermofisher, Waltham, MA)上,确认反应效率在90-110%之间。对反应效率小于90%或大于110%的平板进行重新运行。每个板上还包括阴性对照,由分子等级为H的反应混合物组成2O取代模板DNA。此外,未添加底漆的对照和未添加主配合比对照也包括在内。放大是在上述相同条件下发生的。
C问使用QuantStudio实验设计与分析软件v. 1.5.1进行确定,然后手动审核。熔体曲线用于检查反应的特异性。样品与未测定C问与C问SD大于0.5,熔体曲线显示非特异性结合,和/或计算出的DNA质量小于整体标准曲线确定的检测限,认为没有扩增。的质量Mh根据标准曲线计算DNA,并对其进行对数变换,进行几何平均值的统计分析。对于没有放大的样品,质量MhDNA记录为1 × 104Ng,在量化极限以下的非零数。日志10(Mh记录反应中每ng DNA的DNA),并作为结果变量进行统计分析。
16S rRNA文库的制备和测序
根据前面的描述(Illumina, 2013),对16S rRNA V3-V4区测序的文库进行了准备。使用341F (5 ' - cctacgggnggcwgcap -3 ')和805R (5 ' -GACTACHVGGGTATCTAATCC-3 ')引物对(Integrated DNA Technologies, Inc, Coralville, IA)扩增16S rRNA基因的V3-V4区,并使用Nextera IDT试剂盒(Illumina, San Diego, CA)制备测序文库[29].在科罗拉多大学安舒茨医学院基因组学和微阵列核心的Illumina NovaSeq仪器上使用对端化学(2 × 250 bp)对所得的扩增文库进行测序。
生物信息学和统计学
在QIIME2版本2020.11中导入16S rRNA基因测序产生的解复用对端reads [30.].扩增子序列变异(ASVs)使用DADA2 [31],它也被用于过滤读取的质量,删除嵌合序列,并合并重叠的对端读取。正向和反向读取分别在248 bp和250 bp处被截断。分类使用在Greengenes版本13_8 99% OTUs数据库上训练的Naïve贝叶斯分类器分配[32],其中序列被修剪,只包括V3-V4区域的碱基对与341F/805R引物对结合。使用' filter-seqs '和' filter-table '函数从代表性序列和ASV表中过滤到叶绿体和线粒体序列的Reads,并使用默认设置的' q2-phylogeny '管道生成中点根系统发育树,用于计算基于系统发育的多样性指标。然后将数据和元数据导入phyloseq [33]使用' import_biom '和' import_qiime_sample_data '函数合并到一个phyloseq对象。映射到每个分类级别的读取的比例可以在附加文件中找到4:表S3。然后使用累积和缩放法将每个样本的ASV计数归一化[34],使用广义UniFrac距离矩阵分析贝塔多样性[35,36].从这些距离出发,进行了主坐标分析(PCoA)并绘制了图,并使用置换多变量方差分析(PERMANOVA)来测试使用纯素[37和成对的阿多尼斯[38)包。为了确保显著差异不是组间变异性的不平等分散的结果,使用纯素包对所有显著的PERMANOVA结果进行了分散排列分析(PERMDISP)。此外,每个样品中asv的相对丰度用系统序列进行计算和绘制。在R版本3.6.0中,使用一对Wilcoxon秩和检验和Benjamini-Hochberg校正进行多次比较,以检验相对丰度的差异。
使用R版本4.0.3计算到达体重、接受BRD治疗的动物总数和采样时接受BRD治疗的动物数量,以及第一次接受BRD治疗前的饲养天数(DOF)的汇总统计数据[39].对连续结局变量(第一次治疗前的到达体重和自由度)采用Wilcoxon秩和检验,对二元响应变量(喂养期间的BRD治疗和采样时的BRD治疗)采用卡方检验,对R [39,40].用Cochran’s Q检验比较分离度Mh使用SAS软件v 9.4 (SAS Institute, Cary, NC)。如果使用Cochran’s Q检验发现差异,则使用McNemar’s卡方检验对rstatix包进行两两比较[40].
比较的日志10(ngMhDNA)在棉签类型中每毫微克DNA的含量Mh利用rstatix、stats和diplyr软件包,通过Kruskal-Wallis秩方差分析评估文化状态[39,40,41].如果发现差异,用Dunn检验和Benjamini-Hochberg校正进行两两比较。使用SAS软件v 9.4 (SAS Institute, Cary, NC)中的Cochran’s Q检验检测不同拭子类型之间qPCR扩增率(是或否)的差异,并使用rstatix中的两两McNemar’s Chi-square检验后续比较。
结果
牛的数量
采样时(14自由度),所有动物的平均体重为261.2 kg (SD = 12.2 kg)。36%(43/118)犊牛在饲养期间至少接受一次BRD治疗(附加资料)2).第一组接受BRD治疗的犊牛数量多于第二组,分别为50.0%(30/60)和22.4% (13/58)1;卡方检验,P= 0.003)。所有样本犊牛首次治疗前的中位天数为10天,组间无统计学上可检测的差异(Wilcoxon秩和检验,P= 0.188)。只有一头小牛在第40天后接受了第一次抗BRD药物治疗3.:无花果。S3-S5)。
培养结果和分离鉴定
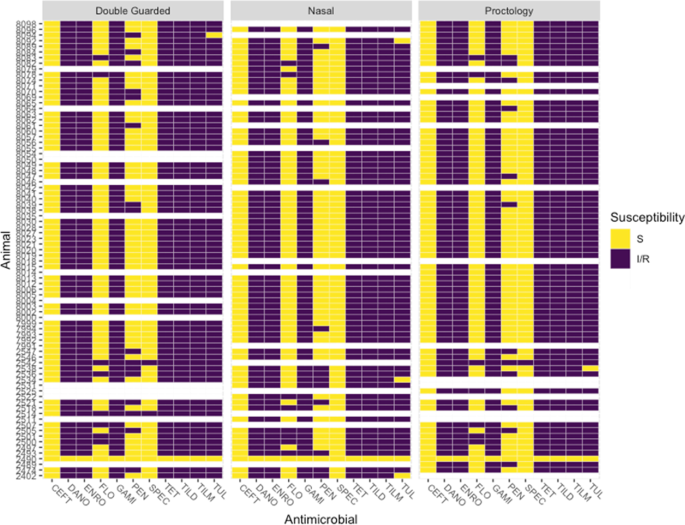
总的来说,Mh从67.5%(81/120)的牛中分离得到:55.0%(67/119)的DG、56.3%(66/120)的NS和56.7%(68/120)的PS,其中Mh在每种拭子类型中,组1的隔离率高于组2(附加文件4:表S4;卡方检验,P< 0.05)。所有201Mh分离株基因型均为2型,且几乎全部为MDR (98.5%, 198/201;额外的文件2,无花果。1).三个菌株是泛敏感的,这些菌株来自同一动物的不同棉签(动物2490,图。1).AMR与Mh从同一种动物身上收集的(图。1),尽管从同一种动物分离出的棉签在青霉素耐药性方面有轻微差异。的频率Mh不同拭子类型的分离在统计学上无差异(附加文件4:表S3;科克伦的问测试,P= 0.86)。77%(92/119)的牛,3种采样方法的培养结果完全一致;在11%的牛中发现了两个一致阳性和一个不一致阴性结果(13/119),在其余12%的牛中发现了一个不一致阳性结果(14/119)(表2).
qPCR
标准曲线
C问标准的SD包含在附加文件中1.最低浓度标准的9个重复中有6个没有扩增,第二低浓度的C很高问SD(0.770),认为检测限为1.26 × 10−4ng。C的斜率和y截距问与日志(MhDNA)分别为−3.3998和17.3361。有效率为96.8%,R2为0.9981(附加文件1).
qPCR样本
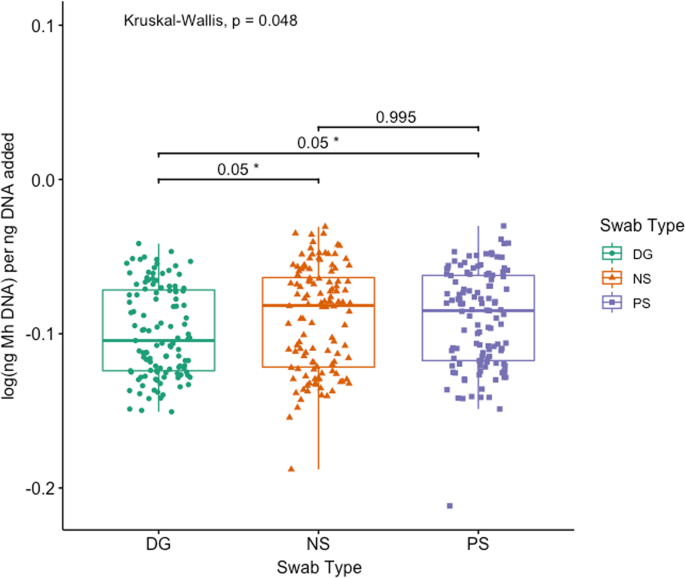
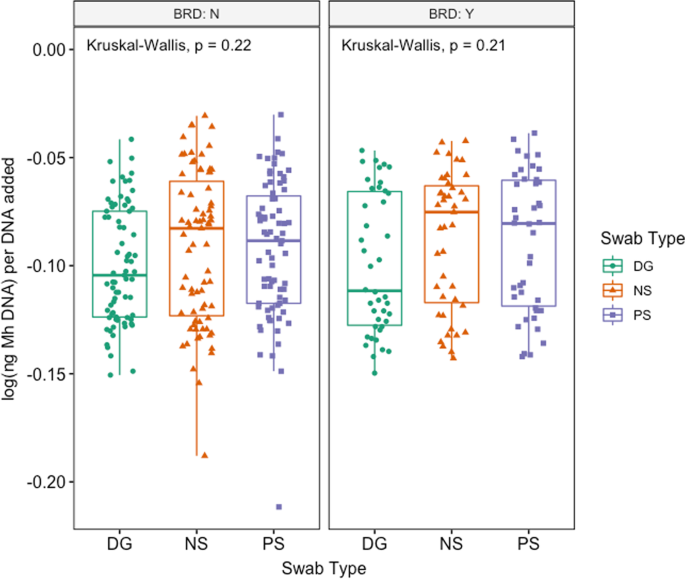
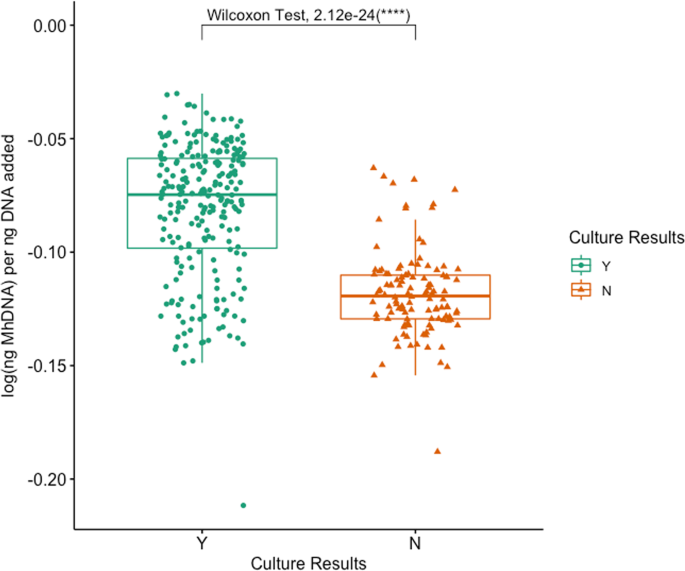
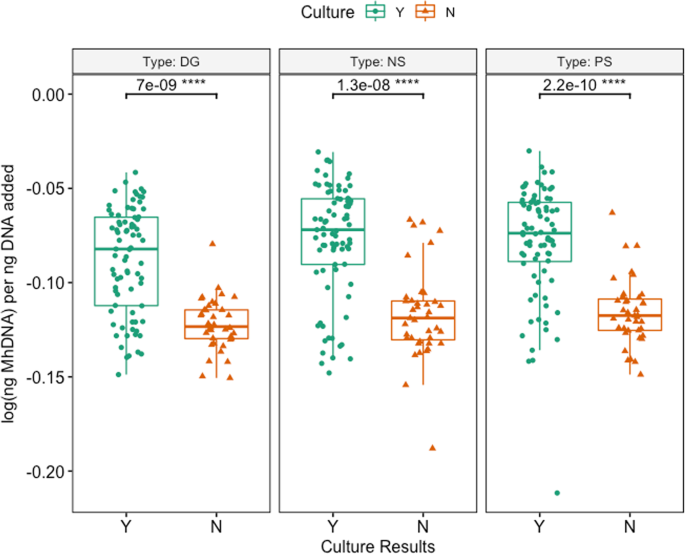
Mh在所有牛中,65.0%(78/120)的qPCR检测到:DG 50.4% (59/117), NS 61.7% (74/120), PS 58.0%(69/119)(附加文件4:表S5)。Mh与NS和PS组1和组2相比,DG拭子收集的样本明显较少,其中组2的动物明显较少Mh每个拭子均比第1组阳性(附加文件4:表S4;McNemar检验法卡方检验,P< 0.05)。同样,日志(Mh每添加的每ng DNA在棉签类型之间有显著差异(图。2;克鲁斯卡尔-沃利斯检验,P= 0.048),中位数对数(Mh与NS和PS相比,DG每ng添加的DNA显著降低(附加文件2和无花果。2;Benjamini-Hochberg校正对Dunn检验,P= 0.05,P分别为= 0.05)。81.9%(95/116)棉签间qPCR完全一致;12.1%的动物(14/116)发现2个一致阳性和1个不一致阴性结果,其余6.0%的动物(7/116)发现1个不一致阳性结果和2个一致阴性结果(表6)2).当评估棉签识别能力时Mh通过qPCR对治疗或未治疗BRD的动物进行检测,两组动物拭子类型之间没有差异(图5)。3.;克鲁斯卡尔-沃利斯,P> 0.05)。在评估效果时Mh文化上的辨别能力Mh通过qPCR,来自培养阳性动物的棉签有明显更高的log(ng)Mh与培养阴性的动物相比,每ng加入到反应的DNA中,这对所有拭子类型都是正确的(图。4,5;Wilcoxon rank-sum测试,P< 0.05)。
16S rRNA基因测序
微生物群落组成的整体差异
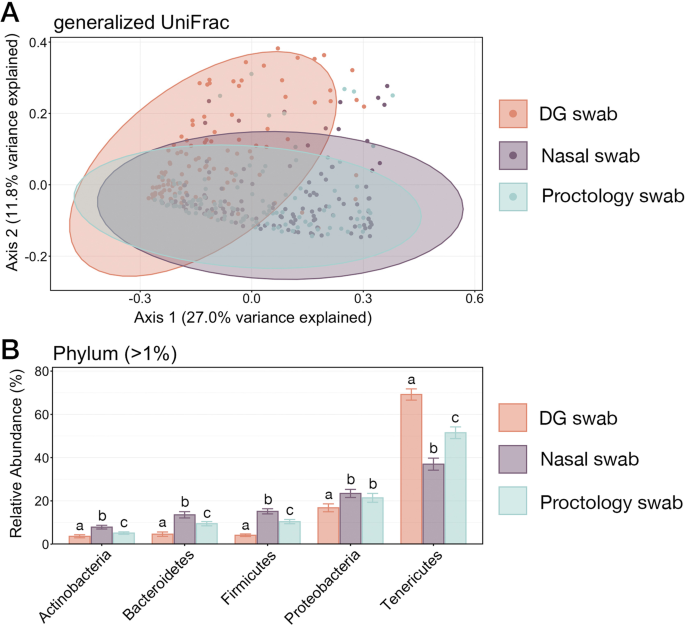
采用PERMANOVA和主坐标分析(Principal coordinate Analysis)分析样品采集方法(DG、NS或PS)对微生物群落组成的影响。基于广义UniFrac值,微生物群落结构在每种拭子类型收集的样品之间存在显著差异(附加文件4:表S6;配对PERMANOVA与Benjamini-Hochberg校正;Padj。< 0.05)。然而,PCoA表明,用DG拭子收集的样品具有最独特的群落结构,而用NS和PS收集的样品解释的变异量非常小(< 2%),这些群落非常相似(图2)。6).
一个广义UniFrac值的主坐标分析(PcoA),说明每种拭子类型收集的样品之间微生物群落组成的差异。PCoA显示了用DG拭子、NS或PS收集的微生物群落中ASVs的聚类。阴影区域代表每种拭子类型的95%置信椭圆。每种群落类型之间的微生物群落组成差异显著(对PERMANOVA与Benajmin-Hochberg校正,P< 0.005)。B图中显示了六个门的相对丰度,占整个群落的1%以上,说明了所有样品中微生物群落结构的变化。柱状图上的误差柱展示了使用DG拭子、NS或PS采样时,六个门中每一个门的平均相对丰度的标准误差。用不同的字母表示每种拭子类型收集到的相对丰度之间的显著差异(双Wilcoxon秩和检验,benjami - hochberg校正,P< 0.05)
为了进一步比较三种采样方法产生的微生物群落差异,我们比较了所有样本中占总群落1%以上的门的相对丰度。在使用NS和PS采集的样品中,除了变形菌门的相对丰度外,所有6个门的相对丰度在不同的样品类型中都存在显著差异(图1)。6;带有Benjamini-Hochberg修正的成对Wilcoxon秩和检验,P< 0.05)。然而,这六个门的流行率在所有三种拭子类型中遵循相同的顺序,Tenericutes是最丰富的门,其次是变形菌门、厚壁菌门、拟杆菌门和放线菌门。
描述与临床BRD相关的微生物转移
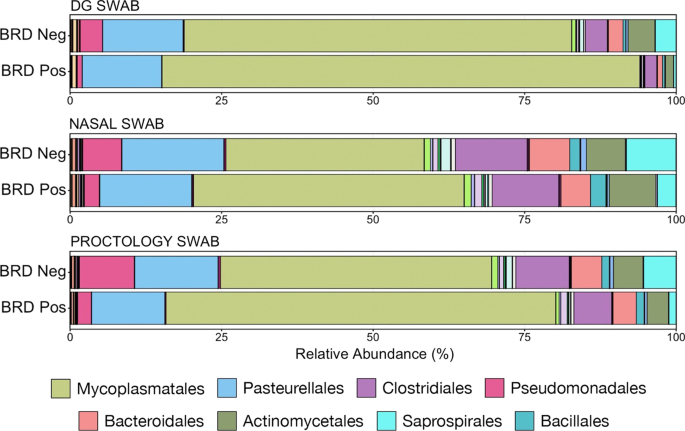
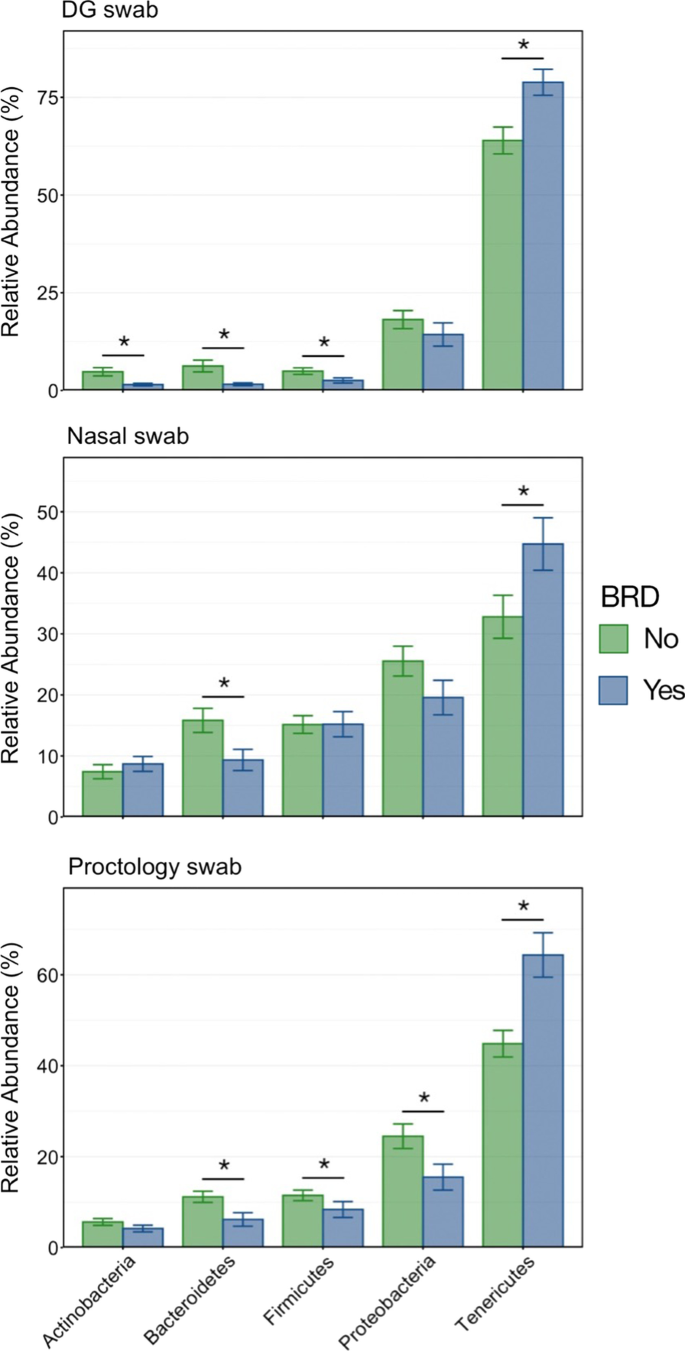
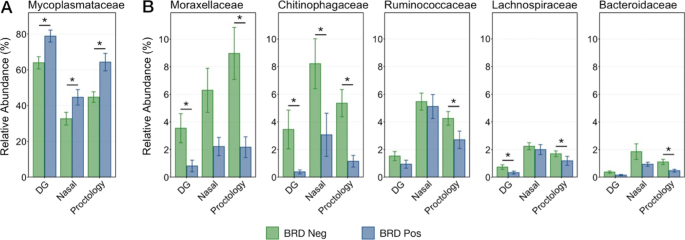
微生物组成的差异与BRD的发生有关,根据单个样本内asv的归一化比例,在分类顺序水平上可视化了微生物组成的差异(图1)。7).每种拭子类型在brd阴性和brd阳性动物之间都表现出类似的变化:支原体目相对丰度增加,而假单胞菌属、梭状芽胞菌属和拟杆菌属的相对丰度降低。在占整个微生物群落1%以上的6个门中,使用DG拭子采样时,brd阴性和-阳性动物之间有4个门的丰度存在显著差异。当使用NS采集样本时,只有两个门差异,而使用PS采集样本时,有四个门差异显著(图2)。8;Kruskal-Wallis秩方差分析,P< 0.05)。三种采集方法均显示出在Tenericutes上的显著差异,它是所有样品中数量最多的门,几乎全部由支原体目组成。然而,与DG拭子或PS收集的样品相比,使用NS收集的样品在描述丰度较低的门的变化方面效果较差。
为了说明不同样本类型之间潜在的重要差异,我们进一步研究了6个科(支原体科、莫拉菌科、瘤胃球菌科、螺纹菌科、几丁菌科和拟杆菌科)和3个属(Mannheimia,巴斯德菌,Histophilus),在brd阴性和阳性动物中差异丰富,或具有特定的临床兴趣。一般来说,在所有三种拭子类型收集的样本中观察到这些类群中的相同趋势。当使用所有三种拭子类型采样时,brd阳性动物中支原体科家族的丰度显著更高(图2)。9一个;Kruskal-Wallis秩方差分析P< 0.05)。在科水平上,支原体科也是数量最多的ASV,在所有样本类型中占总微生物种群的50%以上,几乎占所有Tenericutes的100%。此外,本研究中检测到的支原体科两属的相对丰度在brd阳性和brd阴性动物中进行了比较。支原体组成了支原体科的绝大多数(> 97%),其相对丰度显著高于用任何拭子类型收集的BRD阳性动物样本(附加文件)3.:图S6;Kruskal-Wallis秩方差分析P< 0.05)。相对丰富的Ureaplasma在用DG拭子收集的样本中,这种影响最大,但在BRD阳性动物中确实减少了(附加文件3.:图S6)。然而,由于其丰度低(约1%)和个体间的较大差异,任何拭子类型的差异都不显著(Kruskal-Wallis对等级的方差分析;P> 0.05)。
莫拉菌科的科(几乎完全由属组成)莫拉克斯氏菌属和未分类的莫拉菌科)和几丁菌科在brd阳性动物中表现出了最大的类群相对丰度下降(图5)。9B). Moraxellaceae的减少只在使用DG拭子和PS采样时显著,而几丁菌科的减少则在使用所有三种拭子类型采样时显著(图4)。9B;Kruskal-Wallis秩方差分析P< 0.05)。brd阳性动物中Ruminoccaceae、Bacteroidaceae和Lachnospiraceae家族的数量也减少了,尽管差异较小,而且只有在使用PS收集样本时才显著(图5)。9B;Kruskal-Wallis秩方差分析P< 0.05)。由于其临床相关性,该属的相对丰度巴斯德菌,Mannheimia Histophilus在brd阴性和阳性动物之间也比较了它们的家族巴斯德氏杆菌科,但在任何采样方法之间都没有丰度差异(补充文件3.:图S7;Kruskal-Wallis秩方差分析P> 0.05)。
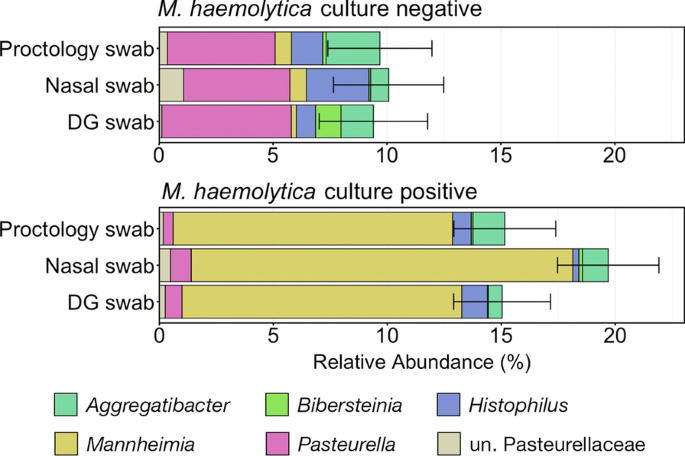
微生物变化的m . haemolytica培养阳性动物
作为Mh被广泛认为是牛最重要的呼吸系统病原体之一,不同的采样方法比较了捕获微生物丰度差异的能力Mh培养阳性和培养阴性动物。与属相关的asvMannheimia平均仅占样品总菌群的0.56%±0.19% (SEM)Mh但在培养阳性动物中显著增加到平均丰度为13.7%±1.22% (SEM)(图5)。10;Kruskal-Wallis秩方差分析P< 0.05)。而Mannheimia增加了,巴斯德菌而且Histophilus内的丰度显著下降Mh所有样本类型的培养阳性动物(图。10;Kruskal-Wallis秩方差分析P< 0.05)。然而,样本采集方法(DG拭子,NS或PS)不影响巴氏杆菌科或的丰度Mannheimia,因为同一动物之间没有差异Mh文化状态(图。10;带有Benjamini-Hochberg修正的成对Wilcoxon秩和检验,P> 0.05)。
讨论
这项独特的研究比较了三种样本采集方法(深度防护鼻咽拭子、无防护的16英寸直肠拭子和无防护的6英寸鼻拭子)来进行识别Mh并结合培养依赖性和培养依赖性(16S rRNA基因测序和qPCR)来表征牛呼吸系统疾病背景下微生物群落结构的变化。比较DG、NS或PS收集的样品与检测的结果基本相同Mh或者微生物群落组成的特征。这对研究活牛上呼吸道微生物群落的研究人员具有重要意义,因为在商业牛生产条件下,样本收集存在重大的后勤问题。虽然不同类型的样本在结果的统计显著性上存在差异,但在趋势上Mh检测和表征Mh/ brd相关的微生物群落变化与样品采集方法无关。由于BRD是牛发病和死亡的主要原因之一,也是使用抗菌药物治疗的最常见原因之一[1],改进在整个微生物群落背景下调查BRD病原体的方法对于进一步加深我们对这种疾病的了解以及有效开展相关监测至关重要。本文的研究结果为研究人员选择一种更简单的采样方法来表征牛呼吸道微生物群落和在BRD中发挥重要作用的病原体提供了依据;然而,值得注意的是,抽样方法之间的一致性并不完美。因此,根据感兴趣的临床或研究问题,研究人员可能选择使用不同的抽样策略。鼓励在不同的生产类别或管理系统中进行类似的研究,以确定这些更简单的采样方法是否适用于其他情况(牲畜、乳制品或小牛作业;没有metaphylaxis;等等)。这些棉签在分离与BRD有关的其他细菌方面的可比性的调查,如巴斯德菌multocida,Histophilus somni,或支原体宝也应该考虑。
居住在牛呼吸道不同部位(如鼻咽或支气管肺泡)的微生物群落结构的变化以前已作过描述[18].DG拭子已被研究人员用于鼻咽的特异性采样,而不受吻侧鼻道的污染,但使用DG拭子在后勤方面更具挑战性,而且比本研究中使用的其他拭子更昂贵。在本研究中使用的短鼻鼻窦更容易使用,但只采样鼻道的最前端几英寸。PS拭子对鼻道和鼻咽进行采样,对上呼吸道的一个区域进行采样,该区域实际上是DG和NS采样区域的组合。DG样品显示出最独特的微生物群落结构(图。6a),但这些群落结构的差异很大程度上归因于共享类群的丰度差异,而不是不同类群的存在,所有拭子类型中最丰富类群的排名是相同的(图1)。6b).有趣的是,当将NS、PS和DG样品进行比较时,常见微生物分类群丰度的相对差异表明,在牛呼吸道内可能存在一个生态梯度,因为NS拭子只采集吻侧鼻腔,DG样本只采集鼻咽,而PS收集的是一个“复合”样本。生态梯度(即pH值、盐度、温度)是环境微生物中微生物群落结构的既定驱动因素[42,43,44],但这一概念在很大程度上尚未在呼吸道的背景下得到探讨。本研究关于培养和分子检测的结果Mh与之前的研究一致,即在BRD的急性病例中,上呼吸道的恢复与下呼吸道的培养是一致的,且在群体水平上[11,20.,21,45].但由于本研究仅探讨了上呼吸道样本之间的差异,我们无法评价DG、PS、NS与下呼吸道采样方法的结果是否一致。
重要的是,brd阳性或brd阴性动物中感兴趣的微生物类群的趋势对于每种拭子类型基本上是相同的(图1)。7).支原体宝而且Mannheimia haemolytica是与BRD最常相关的细菌病原体[9,46,47,48和在这项研究中支原体无论样本类型如何,brd阳性动物的相对丰度都显著更高,这与之前一篇关于最近断奶的肉牛的报告一致[49].有趣的是,它们的相对丰度没有差异Mannheimia或任何其他巴氏杆菌属被认为在呼吸道这一水平的BRD中很重要,这与死于BRD的牛的下呼吸道组织中的病原体检测模式形成对比[8,50].造成这些差异的一个潜在原因是,在目前的研究中,一些牛在疾病治疗之前,甚至在某些情况下出现疾病迹象之前,就进行了采样;然而,先前的研究表明,与那些保持健康的动物相比,患有BRD的动物体内的微生物群落是不同的Mannheimia患病动物的相对丰度没有增加[19].
还需要注意的是,替地吡松素过敏反应可能影响鼻咽微生物群。犊牛使用图拉霉素(另一种大环内酯)治疗后的鼻咽微生物群已显示在用药后第12天恢复[51].关于tildipirosin政府将影响鼻咽菌群持续时间的信息很少;然而,我们有理由推测,由于tildipirosin在肺组织中的半衰期长达10天,其对微生物组的影响可能比图拉霉素持续时间更长[52相比之下,图拉霉素(Draxxin产品标签,Zoetis)需要8.75天。Holman等人也证实,给药后2-5天内对鼻咽微生物群有很大影响[14],这意味着与其他研究相比,在14度前不久的BRD治疗可能对本研究中观察到的鼻咽微生物组有一些影响。
由于这些分类单元通常不被认为是呼吸植物区系的重要成员,因此相对于BRD地位的其他分类目的差异是不太值得期待的。9B)。然而,肠道相关类群如瘤胃球菌科、几丁菌科、拟杆菌科和未分类的梭状芽孢杆菌属的丰度下降可能是反刍反应减少的结果,导致BRD动物向上呼吸道的转移减少,这些动物通常食欲下降[3.].
抗微生物药物耐药性的高流行率Mh分离株与之前的研究一致,在使用长效大环内酯类抗生素治疗后约14天对肉牛进行上呼吸道培养[17,53].这种多药耐药分离的高频率与MALDI基因分型一致,因为基因型2通常与抗微生物药物耐药基因的存在有关[54].Clawson等人还指出,基因2型中的这些耐药基因通常与整合结合元件(ICE)相关。ice是可移动的遗传元件(MGE),可以通过结合转移转移到naïve细胞,但也可以整合到细菌宿主的基因组[55].MGE上存在能够跨种和属间转移的抗微生物药物耐药基因[56]可以解释多药耐药分离样品类型之间的相似性Mh,并强调了研究抗微生物药物耐药性的重要性Mh和其他BRD病原体在整个微生物群落和其他BRD病原体的背景下。
培养和qPCR仅靶向Mh但使用16S rRNA测序是一种非常有用和协同的研究方法,因为它可以对呼吸道微生物组的组成进行集中和广泛的研究。然而,它在研究影响BRD发生的微生物方面仍然有限,因为它不允许研究被认为在这种多因子疾病的发生中非常重要的病毒因子。结合更多的分子诊断方法,除了影响BRD发生的宿主因素外,还可以对呼吸道的所有微生物(细菌、原菌、病毒)进行更广泛的宏基因组研究[57,58,59].
结论
本研究的结果表明,三种抽样方法评价提供了高度可比性的结果评价m . haemolytica通过培养、qPCR检测和16S rRNA基因测序鉴定微生物群落结构。研究结果支持了上述结论m . haemolytica可以选择培养或qPCR、NS或PS而不是DG,以更少的费用和更容易的采样提供类似的结果.此外,与BRD状态相关的微生物群落结构的相对差异在所有三种样本类型中都得到了相似的反映。相反,某些类群(如属)的丰度变化支原体),这表明DG拭子可能最适合用于研究这些生物体的特征,特别是如果有兴趣将结果与以前使用DG拭子的研究进行比较。未来的工作应该对来自不同生产部门的犊牛或牛进行这些采样技术的比较,并将PS上呼吸道采样的结果与气管清洗和/或支气管肺泡灌洗等下呼吸道采样方法的结果进行比较。
数据和材料的可用性
本研究期间产生或分析的所有数据均包含在本文及其附加信息文件中。
缩写
- ASV:
-
扩增子序列变异
- BRD:
-
牛呼吸道疾病
- DG:
-
Deep-guarded拭子
- Mh:
-
Mannheimia haemolytica
- NS:
-
鼻拭子
- PS:
-
直肠拭子
- qPCR:
-
定量聚合酶链反应
参考文献
与肉牛呼吸道疾病相关的经济影响。兽医临床食品兽医实践。1997;13(3):367-77。https://doi.org/10.1016/s0749 - 0720 (15) 30302 - 9.
泰勒JD,富尔顿RW,莱亨鲍尔TW,台阶DL, Confer AW。牛呼吸道疾病的流行病学:诱发因素的证据是什么?中华医学杂志。2010;32(5):559 - 561。
Griffin D, Chengappa MM, Kuszak J, McVey DS。牛呼吸道疾病复合体的细菌病原体。兽医临床营养学2010;26(2):381-94。https://doi.org/10.1016/j.cvfa.2010.04.004.
USDA-APHIS。美国饲养场对来料牛的处理方法。国家动物健康监测系统,饲养场2011信息表。2012。
艾夫斯SE,理查森JT。使用抗微生物过敏反应控制高危牛的呼吸系统疾病。兽医临床营养学2015;31(3):341-50。https://doi.org/10.1016/j.cvfa.2015.05.008.
Lubbers BV, Hanzlicek GA。从牛呼吸道疾病病例分离出的溶血性曼海氏菌的抗微生物多药耐药和共耐药模式——为期三年(2009-2011年)的回顾性分析中华兽医杂志。2013;25(3):413-7。https://doi.org/10.1177/1040638713485227.
Stanford K, Zaheer R, Klima C, McAllister T, Peters D, Niu YD, Ralston B.从使用或不使用抗菌素管理的死亡牛的肺组织中分离出的牛细菌性呼吸疾病复复体成员的抗菌素耐药性微生物。2020;8(2):288。https://doi.org/10.3390/microorganisms8020288.
Klima CL, Rahat Z, Cook SR, Booker CW, Hendrick S, Alexander TW, McAllister TA, Onderdonk AB.北美饲养场牛呼吸道疾病病原体通过结合结合元素引起多药耐药。临床微生物学杂志。2014;52(2):438-48。https://doi.org/10.1128/JCM.02485-13.
Anholt RM, Klima C, Allan N, Matheson-Bird H, Schatz C, Ajitkumar P, Otto SJG,等。加拿大艾伯塔省引起牛呼吸疾病复合物的细菌的抗菌敏感性。前沿兽医科学2017。https://doi.org/10.3389/fvets.2017.00207.
哦。BRD细菌发病机制的最新进展。Anim卫生Res rev 2009;10(2): 145-8。https://doi.org/10.1017/S1466252309990193.
戈迪尼奥KS,萨拉索拉P,雷诺E, Tilt N,基恩S,温莎GD,罗文TG,桑德兰SJ。使用深鼻咽拭子作为小牛自然呼吸道感染的预测诊断方法。兽医Rec。2007;160(1):三巨头。https://doi.org/10.1136/vr.160.1.22.
Loy JD, Leger L, Workman AM, Clawson ML, Bulut E, Wang B.利用两种热循环平台检测临床样本中与牛呼吸道疾病复合体相关的主要细菌病原体的多重实时PCR方法的建立。中华兽医杂志。2018;30(6):837-47。https://doi.org/10.1177/1040638718800170.
Holman DB, McAllister TA, Topp E, Wright ADG, Alexander TW。发生牛呼吸道疾病的饲养场牛鼻咽菌群。兽医Microbiol。2015;180(1):90 - 5。https://doi.org/10.1016/j.vetmic.2015.07.031.
霍尔曼DB,蒂姆西特E,布克CW,亚历山大TW。商业性饲养牛的注射抗菌素及其对鼻咽菌群和抗菌素耐药性的影响。兽医Microbiol。2018;214:140-7。https://doi.org/10.1016/j.vetmic.2017.12.015.
McMullen C, Alexander TW, Léguillette R, Workentine M, Timsit E.牛呼吸道细菌菌群的地貌学研究。微生物。2020;8(1):91。https://doi.org/10.1186/s40168-020-00869-y.
柴杰,Capik SF, Kegley B, Richeson JT, Powell JG,赵杰。养牛场牛呼吸道菌群及其与疾病的关系。兽医杂志2022;53(1):4。https://doi.org/10.1186/s13567-021-01020-x.
Woolums AR, Karisch BB, Frye JG, Epperson W, Smith DR, Blanton J, Austin F,等。耐多药溶血性曼海姆菌分离自高危肉牛在抗微生物过敏反应和牛呼吸疾病治疗后。兽医Microbiol。2018;221(6):143 - 52。https://doi.org/10.1016/j.vetmic.2018.06.005.
Zeineldin MM, Lowe JF, Grimmer ED, Godoy MRC, Ghanem MM, Abd El-Raof YM, Aldridge BM。临床健康饲养场牛鼻咽和支气管肺泡微生物群落的关系。BMC Microbiol。2017;17(1):138。https://doi.org/10.1186/s12866-017-1042-2.
Zeineldin M, Lowe J, de Godoy M, Maradiaga N, Ramirez C, Ghanem M, Abd El-Raof Y, Aldridge B.健康牛在饲料、入口加工和呼吸系统疾病期间鼻咽菌群的差异。兽医Microbiol。2017;208:30-7。https://doi.org/10.1016/j.vetmic.2017.07.006.
Doyle D, Credille B, Lehenbauer TW, Berghaus R, Aly SS, Champagne J, Blanchard P, Crossley B, Berghaus L, Cochran A.急性牛呼吸系统疾病乳牛呼吸道病原体4种采样方法的一致性。J Vet Intern Med. 2017; 31:954-9。https://doi.org/10.1111/jvim.14683.
DeRosa DC, Mechor GD, Staats JJ, Chengappa MM, Shryock TR的比较巴斯德菌同时从有牛呼吸道疾病临床症状的牛的鼻拭子和气管拭子中分离出该菌。中华临床微生物学杂志2000;38(1):327-32。https://doi.org/10.1128/JCM.38.1.327-332.2000.
VWR。采购产品清教超大的人造棉签,直肠镜涂抹器,聚丙烯处理,清教医疗产品。VWR目录编号:82005-438。https://us.vwr.com/store/product/7446353/puritan-oversized-rayon-swab-proctoscopic-applicator-polypropylene-handle-puritan-medical-products.2022年4月26日访问。
VWR。采购产品清教棉签,人造纤维尖端棉签,聚苯乙烯处理,清教医疗产品。VWR目录编号:10808-146。https://us.vwr.com/store/product/7446367/puritan-swab-rayon-tipped-swabs-polystyrene-handle-puritan-medical-products.2022年4月26日访问。
Jorvet。双保护性培养拭子。产品编号:J0273。https://jorvet.com/product/double-guarded-culture-swab/.2022年4月26日访问。
Perino LJ, Apley MD。饲养场的临床试验设计。兽医临床食品兽医实践1998;114(2):343-65。https://doi.org/10.1016/s0749 - 0720 (15) 30258 - 9.
Loy JD, Clawson ML. MALDI-TOF质谱法快速分型溶血曼海姆菌主要基因型1和2。微生物学杂志,2017;136:30-3。https://doi.org/10.1016/j.mimet.2017.03.002.
临床和实验室标准研究所。CLSI VET08-ED4:2018动物分离细菌抗菌片和稀释药敏试验性能标准,第4版。CLSI VET08补充。韦恩。2018。
Sweeney MT, Lubbers BV, Schwarz S, Watts JL。应用多药耐药、广泛耐药和广泛耐药的定义对临床显著的家畜和伴随动物细菌病原体。中国抗菌化学杂志,2018;73(6):1460-3。https://doi.org/10.1093/jac/dky043.
Illumina. 16S宏基因组测序文库的制备。Illumina公司支持。2013。
Bolyen E, Rideout JR, Dillon MR,等。利用QIIME 2可复制、交互式、可扩展和可扩展的微生物组数据科学。生物科技Nat》。2019;37:852-7。
Callahan BJ, McMurdie PJ, Rosen MJ, Han AW, Johnson AJ, Holmes SP. DADA2:来自Illumina放大器数据的高分辨率样本推断。Nat方法。2016;13:581-3。
DeSantis TZ, Hugenholtz P, Larsen N, Rojas M, Brodie EL, Keller K, Huber T, Dalevi D, Hu P, Andersen GL. Greengenes,嵌合检查16S rRNA基因数据库和与ARB兼容的工作台。应用环境微生物学,2006;72:5069-72。
McMurdie PJ, Holmes S. phyloseq:微生物组普查数据的可重复交互分析和图形R包。PLoS ONE。2013; 8: e61217。
Paulson JN, Stine OC, Bravo HC, Pop M.微生物标记基因调查的差异丰度分析。Nat方法。2013;10:1200-2。
Lozupone C, Lladser ME, Knights D, Stombaugh J, Knight R. UniFrac:微生物群落比较的有效距离度量。ISME j . 2011; 5:169 - 72。
陈娟,Bittinger K, Charlson ES, Hoffmann C, Lewis J, Wu GD, Collman RG, Bushman FD,李浩。基于广义UniFrac距离的微生物组组成与环境协变量的关联。生物信息学。2012;28:2106-13。
Oksanen J, Blanchet FG, Friendly M,等。素食:社区生态包。2019.https://CRAN.R-project.org/package=vegan.
Arbizu点。pairwiseAdonis:用adonis进行两两的多层次比较。2017.https://github.com/pmartinezarbizu/pairwiseAdonis.
R核心团队。R:用于统计计算的语言和环境。R统计计算基金会,奥地利维也纳,2020。https://www.R-project.org/.
Kassambara . Rstatix:用于基本统计测试的管道友好框架。R包版本0.7.0。2021.https://CRAN.R-project.org/package=rstatix.
维克汉姆·H, François R,亨利·L, Müller K. dplyr:数据操作的语法。2022.https://dplyr.tidyverse.org,https://github.com/tidyverse/dplyr.
Rousk J, Bååth E, Brookes PC, Lauber CL, Lozupone C, Caporaso JG, Knight R, Fierer N.耕地土壤PH梯度土壤细菌和真菌群落。ISME j . 2010; 4(10): 1340 - 51。https://doi.org/10.1038/ismej.2010.58.
克伦普BC,霍普金森CS,索金ML,霍比JE。沿河口盐度梯度的微生物生物地理:细菌生长和停留时间的综合影响。应用环境微生物学,2004;70(3):1494-505。https://doi.org/10.1128/AEM.70.3.1494-1505.2004.
邓勇,宁东,秦勇,薛凯,吴亮,何铮,尹浩,等。森林土壤微生物群落在温度梯度上的空间标度。环境Microbiol。2018;20(10):3504 - 13所示。https://doi.org/10.1111/1462-2920.14303.
Allen JW, Viel L, Bateman KG, Rosendal S, Shewen PE, Physick-Sheard P.饲用犊牛呼吸道微生物区系:鼻咽和支气管肺泡灌洗培养的相关性。《兽医学报》1991;55(4):341-6。
阿卡吉奥利马,Duet A,梅耶G, Dernburg A, Bézille P, Poumarat F, Le Grand d牛支原体在犊牛饲养场牛呼吸道疾病暴发中的作用。兽医j . 2008; 177(1): 89 - 93。https://doi.org/10.1016/j.tvjl.2007.03.008.
罗森达尔,马丁。养牛场犊牛支原体感染的血清学证据与呼吸道疾病之间的关系。《兽医学报》1986;50(2):179-83。
Autio T, Pohjanvirta T, Holopainen R, Rikula U, Pentikäinen J, Huovilainen A, Rusanen H, Soveri T, Sihvonen L, Pelkonen s饲养牛群中未接种疫苗和未用药的小牛呼吸道疾病的病因学。兽医Microbiol。2007;119(2):256 - 65。https://doi.org/10.1016/j.vetmic.2006.10.001.
McDaneld TG, Kuehn LA, Keele JW。对患有牛呼吸疾病复合物(BRDC)的牛鼻腔两个采样点的微生物组进行了评价。动物科学学报2018;96(4):1281-7。https://doi.org/10.1093/jas/sky032.
Booker CW, Abutarbush SM, Morley PS, Jim GK, Pittman TJ, Schunicht OC, Perrett T, Wildman BK, Guichon PT, Janzen ED.加拿大西部饲养场牛致命呼吸道疾病病例的微生物学和组织病理学发现。兽医学报。2008;49:473-81。
霍尔曼,杨伟,亚历山大TW。抗生素在饲养牛:土霉素和图拉霉素对粪便和鼻咽菌群影响的纵向研究。微生物。2019;7(1):86。https://doi.org/10.1186/s40168-019-0696-4.
Menge M, Rose M, Bohland C, Zschiesche E, Kilp S, Metz W, Allan M, Röpke R, Nürnberger M. tildipirosin在牛血浆、肺组织和支气管液(来自活体、非麻醉牛)中的药代动力学。中华兽医杂志2012;35:550-9。
Snyder E, Credille B, Berghaus R, Giguère s从到达时和加工后两周从高风险的牲畜中分离出的溶血性曼海姆氏菌对多种药物的耐药性的流行情况。动物科学杂志2017;95(3):1124-31。https://doi.org/10.2527/jas.2016.1110.
Clawson ML, Murray RW, Sweeney MT, Apley MD, DeDonder KD, Capik SF, Larson RL,等。与牛肺有关的溶血性曼海姆菌的基因组特征与呼吸疾病、结合因子和抗生素耐药基因BMC基因组学。2016;17(1):982。https://doi.org/10.1186/s12864-016-3316-8.
约翰逊CM,格罗斯曼广告公司。整合和结合元素:它们的作用和作用方式。2015.https://doi.org/10.1146/annurev-genet-112414-055018.
Michael GB, Kadlec K, Sweeney MT, Brzuszkiewicz E, Liesegang H, Daniel R, Murray RW, jeff Watts JL, Schwarz s,多杀性巴氏杆菌整合共轭因子(ICE) Pmu1:结构与转移,no。2011年10月,第91-100页。2012.https://doi.org/10.1093/jac/dkr411.
Scott MA, Woolums AR, Swiderski CE, Perkins AD, Nanduri B, Smith DR, Karisch BB, Epperson WB, Blanton JR JR .到达时的肉牛全血转录组分析确定了潜在的预测分子和机制,表明动物能够自然抵抗牛呼吸疾病。PLoS ONE。2020; 15 (1): e0227507。https://doi.org/10.1371/journal.pone.0227507.
Scott MA, Woolums AR, Swiderski CE, Perkins AD, Nanduri B, Smith DR, Karisch BB, Epperson WB, Blanton JR.对断奶后肉牛的综合到达时转录组分析揭示了与牛呼吸疾病死亡率相关的I型干扰素和抗病毒机制。PLoS ONE。2021; 16 (4): e0250758。https://doi.org/10.1371/journal.pone.0250758.
张明,Hill JE, Alexander TW,黄勇。加拿大西部饲养场到达牛鼻病毒及其与牛呼吸道疾病发展的关系。跨界新兴医学杂志2021;68(4):2209-18。https://doi.org/10.1111/tbed.13873.
确认
作者要感谢西德克萨斯农工大学研究饲养场人员在采样和牛的日常管理期间提供的帮助,西德克萨斯农工大学的Nakita Padilla在样本收集和处理期间提供的帮助,以及UNL-VDC的Laura Leger处理细菌分离物、分离物鉴定和抗微生物药敏测试。
资金
这项研究由德州农工大学资助。
作者信息
作者和联系
贡献
PSM和ARW共同拥有高级作者身份,负责研究的所有方面,包括概念化、实验设计、样本收集、实验室和数据分析以及报告准备。WBC进行了样品采集、细菌分离和qPCR,是稿件的主要作者。LJP对测序数据进行了生物信息和统计分析,撰写了相关内容的文本并准备了图表。JTR负责采购和管理参与研究的牛的所有方面。CW和JK负责DNA的提取和扩增子测序文库的制备。JDL监督确认m . haemolytica培养鉴定和药敏试验。SPG和SFC参与了实验设计。KSS咨询了qPCR方法和分析。所有作者阅读并批准了最终稿件。
相应的作者
道德声明
伦理批准和同意参与
本研究中使用的协议由西德克萨斯农工大学机构动物护理和使用委员会(协议# 2020.04.003)审查和批准。
同意出版
不适用。
相互竞争的利益
作者声明他们没有竞争利益。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.
关于这篇文章
引用这篇文章
克罗斯比,w.b.,平内尔,l.j.,理查森,J.T.et al。棉签类型重要吗?比较的方法Mannheimia haemolytica养牛场牛上呼吸道微生物群的恢复和特征。动物微生物4现年49岁(2022)。https://doi.org/10.1186/s42523-022-00197-6
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s42523-022-00197-6
关键字
- 牛呼吸道疾病
- 16S rRNA基因测序
- 抗菌素耐药性
- 宏基因组
- 文化
- qPCR
- 疾病监测