猪gydF4y2Ba
从中西部研究猪公司(Glencoe, MN)获得4周大的混合品种和性别的猪,并运输到堪萨斯州立大学的大型动物研究设施(Manhattan, KS)。动物被允许适应研究设施3天,然后被纳入实验。分别使用血凝抑制(HI)试验和RT-qPCR证实猪的H1/H3抗体和病毒脱落呈血清阴性(Kitikoon et al.)。gydF4y2Ba2014gydF4y2Ba;Sponseller等。gydF4y2Ba2010gydF4y2Ba).gydF4y2Ba
病毒和疫苗制备gydF4y2Ba
LAIV疫苗最初是由H3N2 A/Swine/Texas/4199-2/1998 (TX98)流感病毒反向遗传产生的,如前面所述(Solórzano等。gydF4y2Ba2005gydF4y2Ba).简单地说,LAIV编码一个截断的NS1蛋白,在126个读密码子后引入4个终止密码子,导致野生型NS1蛋白从219个氨基酸截断到126个氨基酸。剩余的野生型TX98遗传物质用于编码PB2、PB1、PA、HA、NP、NA、M1、M2和NS2。使用TranslT®-LT1转染试剂(Mirus Bio LLC, Madison, WI)转染编码每个基因片段的质粒,转染表达SV40大T抗原温度敏感突变体的HEK 293T人胚胎肾细胞。HEK 293T细胞随后与Madin-Darby犬肾(MDCK)细胞共培养,然后从培养上清中回收的病毒颗粒进一步通过MDCK细胞繁殖。在目前的研究中,LAIV疫苗和挑战病毒是通过内部储存的MDCK细胞繁殖的。挑战病毒包括包含完整NS1基因的野生型TX98, H3N2 A/Swine/Colorado/23619/1999 (CO99)和H1N1大流行病毒A/California/04/2009 (CA04)。病毒亚型经Sanger测序确认。gydF4y2Ba
病毒滴定gydF4y2Ba
鼻拭子和BALF收集于DMEM (Corning, Corning, NY)中添加抗生素-抗真菌剂(Gibco Life Technologies, Carlsbad, CA),使用0.45 μm注射器过滤器过滤,并保存于-80°C。气管、支气管和肺在DMEM中机械分离,DMEM中添加0.3%牛血清白蛋白(BSA, Sigma-Aldrich,圣路易斯,密苏里州),1gydF4y2Ba⨯gydF4y2BaMEM维生素(Gibco)和1gydF4y2Ba⨯gydF4y2Ba抗生素-抗真菌(Gibco)使用TissueLyser II (Qiagen, Germantown, MD)和不锈钢珠。得到的组织匀浆经0.45 μm细胞过滤器过滤,在-80°C保存,直到进一步加工。gydF4y2Ba
病毒滴度由组织培养感染剂量(TCID)的中位数(50%)确定gydF4y2Ba50gydF4y2Ba),表示为TCID的对数变换值gydF4y2Ba50gydF4y2Ba/mL或TCIDgydF4y2Ba50gydF4y2Ba/g,视情况而定。简单地说,TCIDgydF4y2Ba50gydF4y2Ba通过在96孔微量滴度板中连续稀释病毒感染MDCK细胞来确定这些值。样品在37°C和5% CO中孵育gydF4y2Ba2gydF4y2Ba在感染培养基(DMEM + 0.3% BSA + MEM维生素+抗生素-抗真菌药)中添加1 μg/mL L-(tosylamdo -2-苯基)乙基氯甲基酮(TPCK)处理的胰蛋白酶(Worthington生化公司,Lakewood, NJ)。对于组织匀浆样品,在3小时后将一系列稀释培养基改为含有tpck处理过的胰蛋白酶的新鲜感染培养基。含鼻拭子和BALF样本的平板在-20°C下用乙醇固定10分钟,并使用抗甲型流感核蛋白(NP)单克隆抗体(HB65杂交瘤ATCC, Manassas, Virginia)染色,随后用结合了根过氧化物酶(HRP)的兔抗小鼠免疫球蛋白二抗(Dako, Glostrup, Denmark)和3-氨基-9-乙基卡唑底物(AEC)孵育(电子显微镜科学,Hatfield, PA)。用同样的方法处理组织匀质样品,除了使用Alexa Fluor 488标记的多克隆山羊抗小鼠IgG (Invitrogen, Carlsbad, CA)作为二抗,以便通过间接免疫荧光来阅读样品。TCIDgydF4y2Ba50gydF4y2Ba用Reed and Muench方法(Reed and MuenchgydF4y2Ba1938gydF4y2Ba).gydF4y2Ba
实验设计gydF4y2Ba
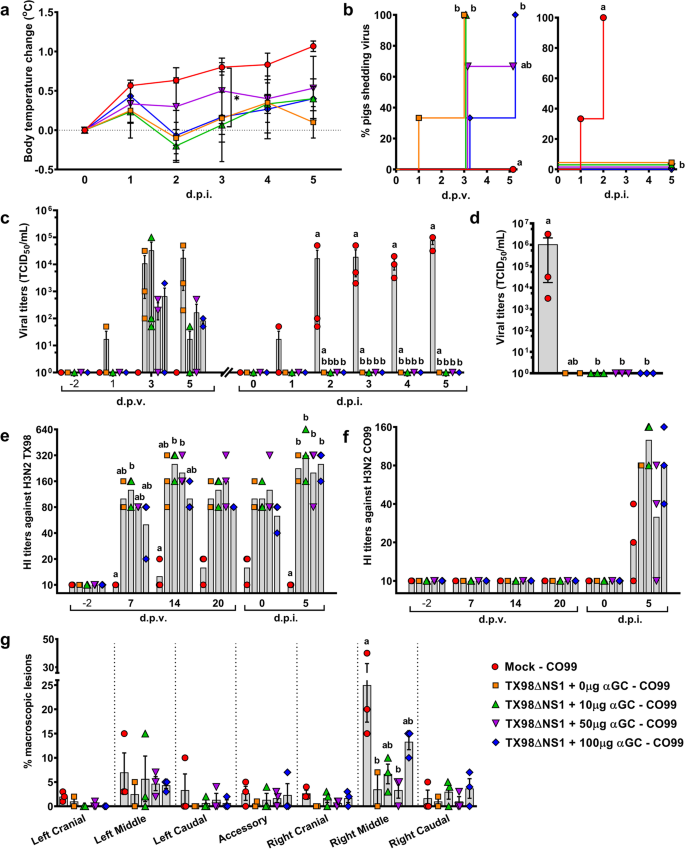
试验1,15头猪分为5个处理组,每组3头猪(表1)gydF4y2Ba1gydF4y2Ba和附加图。gydF4y2Ba1gydF4y2Baa).第0天,2-5组猪鼻内注射2 mL DMEM(每个鼻孔1 mL),含10gydF4y2Ba6gydF4y2BaTCIDgydF4y2Ba50gydF4y2BaTX98ΔNS1,与0(仅为载液)、10、50或100 μg/kg α-GalCer联合使用(Diagnocine LLC Hackensack, NJ)。α-GalCer原液(2 mg/mL)溶解在DMSO中,如前所述(Artiaga et al。gydF4y2Ba2014gydF4y2Ba).1组用溶解在2 mL DMEM中的DMSO(溶解100 μg/kg α-GalCer的DMSO体积)假性接种猪。接种28天后,猪用肌肉注射tiletamine-zolazepam (Telazol®;4.4 mg/kg体重)和xylazine (2.2 mg/kg)gydF4y2Ba6gydF4y2BaTCIDgydF4y2Ba50gydF4y2BaCO99在2毫升DMEM中。在整个挑战期,分别在- 2,0,1,3,5,7,14,20 d.p.v和每天评估体温和临床体征。在- 2,20和33 d.p.v.时采集外周血,用流式细胞术分析免疫细胞群。在第2、7、14、20、28和33天采集血清,用HI法检测病毒特异性抗体。在挑战期间,在- 2,1,3,5d.p.v.和每天收集鼻拭子,以评估鼻分泌物中的病毒脱落。在5d.p.i (33 d.p.v)时,用噻他明-唑西泮和甲苯嗪麻醉猪,并以致死剂量戊巴比妥钠静脉注射(150 mg/kg体重)安乐死。用50 mL DMEM灌洗肺收集细支气管肺泡灌洗液。将肺组织和TBLN收集到DMEM中,流式细胞术分析免疫细胞。取右肺中叶加入福尔马林进行组织病理分析。第2组的一头猪在感染时死于麻醉并发症,并从分析中移除。gydF4y2Ba
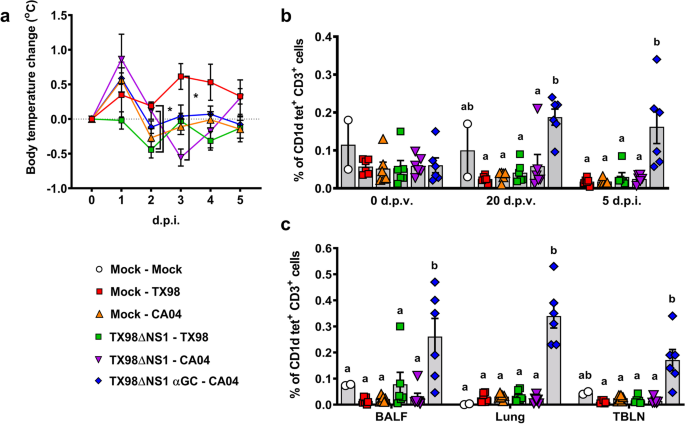
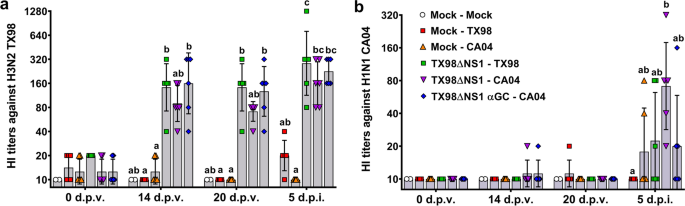
在实验2中,将4窝的32头猪分为6个处理组,使每组每窝猪数量相近(表2)gydF4y2Ba2gydF4y2Ba;额外的无花果。gydF4y2Ba1gydF4y2Bab).第0天,使用与实验1相同的方案鼻内接种猪。1、2、3组为假免疫组。第4组和第5组收到10份gydF4y2Ba6gydF4y2BaTCIDgydF4y2Ba50gydF4y2BaTX98ΔNS1。6组接种相同剂量LAIV疫苗联合50 μg/kg α-GalCer。接种后3周(21个d.p.v), 2组和4组感染野生型10gydF4y2Ba6gydF4y2BaTCIDgydF4y2Ba50gydF4y2Ba2 mL DMEM感染TX98, 3、5、6组感染相同剂量的CA04。同一天,第1组按照实验1所述进行安乐死和尸解。其余各组在5d.p.i. (26d.p.v.)时进行尸解。除了收集气管、支气管和肺叶的病毒滴度外,实验1的体温、临床体征、病毒滴度、组织病理学、免疫学分析和血清学分析与实验1相同。gydF4y2Ba
用于单细胞分离的组织加工gydF4y2Ba
如前所述,从外周血、BALF、肺组织和TBLN中分离出单细胞,并准备用于流式细胞术和ELISPOT检测(Artiaga et al.。gydF4y2Ba2014gydF4y2Ba;Artiaga等人。gydF4y2Ba2016年,一个gydF4y2Ba).简单地说,血液样本通过静脉穿刺从颈内静脉收集到包有EDTA或肝素的真空管中(BD Biosciences, San Jose, CA),组织样本收集到DMEM中。用氯化铵为基础的裂解缓冲液处理外周血以去除红细胞(RBC)。采用Ficoll-Paque™PREMIUM (GE Healthcare BioSciences Corp., Uppsala,瑞典)密度梯度离心分离外周血单个核细胞(Artiaga et al.)。gydF4y2Ba2014gydF4y2Ba).然后将细胞重悬在冷冻介质中[45% RPMI 1640 (ATCC), 45%胎牛血清(FBS;Atlanta Biologicals, Flowery Branch, GA)和10% DMSO (Sigma-Aldrich),并与异丙醇在-80°C的冷冻容器中缓慢冷冻24小时,然后转移到液氮中。将BALF样品离心,收集细胞球和上清液,分别分析免疫细胞和病毒滴度。取大约2克取自颅、中、尾叶的肺组织样本,用5 μg/mL的Liberase TL (Roche Diagnostics Deutschland GmbH, Mannheim, Germany)在DMEM中37°C消化45分钟,通过100 μm细胞过滤器(Fisher Scientific),用上述RBC裂解缓冲液处理。使用一次性组织研磨机(Fisher Scientific, Pittsburgh, PA)将TBLN均质成单细胞悬液,使用100 μm细胞过滤器过滤,并用RBC裂解缓冲液处理。单细胞在PBS中重悬,用0.4%台锥蓝染色,使用伯爵夫人™II自动细胞计数器(Life Technologies)计数细胞总数和活力。gydF4y2Ba
流式细胞仪和抗体gydF4y2Ba
细胞悬液用活性染料(LIVE/DEAD™Fixable Near-IR DEAD Cell Stain Kit, Invitrogen)孵育以排除死细胞,Fc用1mg /mL大鼠IgG (Sigma-Aldrich)溶液阻断,并在4°C下用指示的单克隆抗体(Abs)染色。使用CD3ε特异性抗体(BB23-8E6-8C8;BD生物科学),CD4 (74-12-4;南方生物技术,伯明翰,AL), CD8α (76-2-11;, CD8β (PPT23;Bio-Rad, Hercules, CA), TCRδ (PGBL22A;WSU单克隆抗体中心(Pullman WA), CD16 (G7;BD Biosciences)和CD11b (M1/70;BioLegend)。NKT细胞是使用pbs57负载的小鼠CD1d四聚体和来自美国国立卫生研究院四聚体核心设施的卸载CD1d对照四聚体进行鉴定的。 Monocytes, macrophages, and granulocytes were characterized using Abs specific for CD14 (MIL2; Bio-Rad), CD16, CD163 (2A10/11; Bio-Rad), CD172a (74-22-15A; BD Biosciences), CD11b, and MHC class II (H42A; WSU Monoclonal Antibody Center) (Additional Table1gydF4y2Ba及附加图gydF4y2Ba2gydF4y2Ba).染色细胞用PBS清洗一次,使用BD Cytofix/Cytoperm试剂盒(BD Biosciences)固定,再用PBS清洗一次,然后使用BD LSRFortessa™X-20流式细胞仪和FACSDiva软件(8.0.1版本,BD Biosciences)获取。荧光- 1对照用于确定阳性和阴性群体。所有数据均使用FlowJo软件(版本10.7.0,Treestar, Palo Alto, CA)进行分析。gydF4y2Ba
ELISPOT试验gydF4y2Ba
将冷冻的PBMC在37℃水浴中解冻,用解冻介质(RPMI 1640和20% FBS)洗涤两次,重悬在培养基中[RPMI 1640, 10% FBS, 1%抗菌素-抗真菌剂,55 μM 2-巯基乙醇(Gibco)],静置2小时。肺消化后分离的单细胞没有冷冻保存,而是立即使用。PBMC或肺细胞在96孔MultiScreen HTS板(Millipore, Billerica, MA)中以每孔0.5或100万个活细胞被镀,预涂有抗ifn -γ (P2G10, BD Biosciences)。然后细胞在37°C下以5 x 10孵育48小时gydF4y2Ba5gydF4y2BaTCIDgydF4y2Ba50gydF4y2Bauv灭活的TX98或CA04病毒颗粒或无病毒uv处理的MDCK上清液。随后,根据制造商说明,使用生物素偶联的抗ifn -γ单抗(P2C11, BD Biosciences)、链霉亲和素- hrp (BD Biosciences)和AEC底物(BD Biosciences)来开发板。使用ImmunoSpot S6 Micro Analyzer ELISPOT阅读器和ImmunoCapture 6.4软件(Cellular Technology Ltd., Shaker Heights, OH)读取每个孔中的斑点数量。数据以每10个点的数量表示gydF4y2Ba6gydF4y2Ba在用脱毒MDCK上清培养的孔中,减去平均斑点数后的PBMC或肺细胞。gydF4y2Ba
嗨化验gydF4y2Ba
用受体破坏酶II (Denka Seiken, Tokyo, Japan)在37°C下处理过夜的血清样本进行血凝抑制试验,在56°C下热灭活60分钟,并与0.5%洗涤过的鸡RBC (Colorado serum Company, Denver, CO)在4°C下孵育60分钟,以去除非特异性凝集剂。这种处理导致样品从原始样品稀释为1:10,然后用PBS以1:2连续稀释。HI检测使用TX98、CO99或CA04病毒的4 HA单位作为抗原,如前所述,使用0.5%洗涤过的鸡红细胞(Kitikoon等。gydF4y2Ba2014gydF4y2Ba).最高样品稀释,抑制病毒诱导的红细胞血凝被提出。gydF4y2Ba
病理学和组织病理学gydF4y2Ba
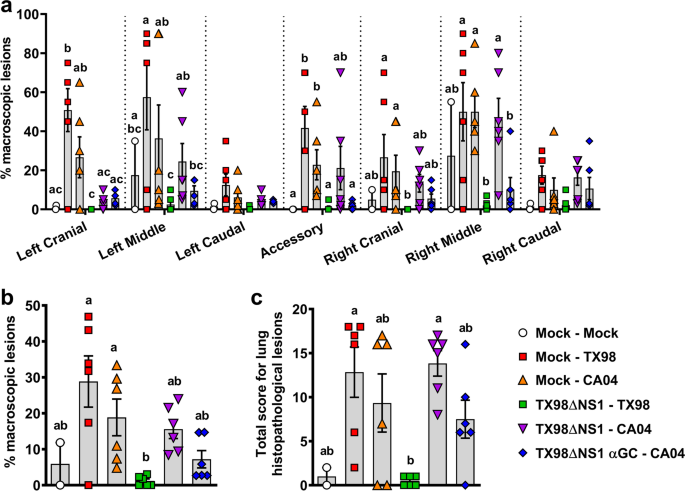
在尸检时,将肺从胸腔中取出,评估红色和凹陷区域(肺不张)影响的表面积百分比,这是ivv诱导的肺炎的特征。目视估计每个肺叶受肺炎影响的百分比,然后根据每个肺叶占总肺的相对比例计算每头猪的总分:左右脑叶和中叶各分配10%,副叶分配5%,左右尾叶各分配27.5%,共100% (Halbur et al.)。gydF4y2Ba1995gydF4y2Ba).收集病变评分最高的右肺中叶,用10%中性磷酸缓冲福尔马林固定,石蜡包埋,苏木精和伊红染色。对两段肺进行组织病理病变盲目评分。根据猪IAV感染通常相关的6个独立标准,使用先前描述的标准对每个肺切片从0到3进行评分:(i)上皮坏死、衰减或破坏;(ii)气道渗出坏死/炎症;(iii)呼吸道发生炎症的百分比;(iv)细支气管周围和血管周围淋巴细胞炎症;(v)肺泡渗出;(vi)肺泡间隔炎症(Khurana等。gydF4y2Ba2013gydF4y2Ba).计算每头猪的总分。gydF4y2Ba
统计分析gydF4y2Ba
使用GraphPad Prism版本9.3.1 (GraphPad Software, San Diego, CA)对数据进行绘图和分析。采用Shapiro-Wilk检验评估数据的正态性。体温变化、NKT细胞频率和每叶宏观肺损害评分数据正态分布,并采用单向或双向方差分析(ANOVA)进行评估。当确定主效应或相互作用项显著时,使用土耳其的多重比较检验分离均值(gydF4y2BaPgydF4y2Ba< 0.05)。HI滴度、IFN-γ ELISPOT检测、病毒滴度、全肺宏观病变评分和组织病理学病变评分的数据不是正态分布,因此使用非参数Kruskal-Wallis检验和Dunn’s多重比较检验进行分析。采用Mantel-Cox log-rank检验分析生存曲线。gydF4y2Ba