摘要
猪圆环病毒2型(PCV2)是猪圆环病毒相关疾病的主要病原体,对全球养猪业造成严重损失,可使感染PCV2的猪免疫反应失调,引起免疫抑制。与PCV2相似,猪圆环病毒3型(PCV3)是一种新发现的猪圆环病毒,它可能与猪皮炎、肾病综合征、生殖障碍和多系统炎症反应密切相关,也会干扰宿主的免疫防御。宿主免疫系统和pcv之间的相互作用被认为是猪致病性的一个关键决定因素。本文就猪圆环病毒2型和/或3型与宿主免疫细胞的相互作用和免疫应答的研究现状进行简要综述,以更好地描述病毒的免疫调节能力、致病机制以及宿主对PCV2和PCV3感染的免疫应答的未来研究方向。
背景
猪圆环病毒(PCV)是一种具有单链环状DNA基因组的小型非包膜病毒即圆环家庭(埃利斯2014).猪圆环病毒1型(PCV1)对猪无致病性;然而,猪圆环病毒2型(PCV2)是断奶后多系统消瘦综合征(PMWS)的主要病原体(Ellis等)。1998;哈丁等人。1998),现在被称为pcv2相关疾病(PCVAD) (Segalés等。2005;Opriessnig等人。2007).PCVAD与进行性体重减轻、先天性震颤、呼吸和肠道疾病、皮炎、肾病、生殖失败等相关。目前,PCVAD是世界上所有养猪国家和地区的一种重要疾病,正威胁着全球养猪业的健康发展。
PCVAD的临床症状包括体重减轻、贫血、黄疸、淋巴结肿大、腹泻和呼吸困难(Ramamoorthy和孟2009).PCV2对淋巴组织的趋向性最强。淋巴样减少和淋巴样组织中的组织细胞浸润被确定为PCVAD的标志性病理病变(Chae2004;Opriessnig等人。2007;Ramamoorthy和孟2009;孟2013).尽管PCV2已被确认为PCVAD的主要病因,但仅通过PCV2感染在灵生猪中繁殖该疾病的尝试失败了。2000,2001,2008).此外,在现场病例中,只有一部分受感染的猪最终出现典型症状(孟2013).这些发现表明PCV2是触发PCVAD的必要条件,但不足以触发PCVAD。与猪繁殖和呼吸综合征病毒(PRRSV)、猪伪狂犬病病毒(PRV)、猪细小病毒(PPV)、脓毒杆菌、支原体肺炎,或由特定疫苗或佐剂诱导的免疫刺激等病原体的合并感染被证明是PCVAD的额外触发因素(Pallares等人)。2002;孟2013;Dorr等人。2007;奥普里斯尼格和哈尔伯2012).实验模型表明,PCV2的复制可以通过与其他病毒或细菌的联合感染而增强,但确切的机制尚不清楚。据推测,共同病原体感染诱导的宿主细胞有丝分裂的启动促进了新的细胞DNA合成,这是PCV2复制的唯一前提条件(Opriessnig和Halbur2012).也有人认为,PCV2与其他病原体同时感染会干扰细胞因子的反应,从而影响PCV2的清除,从而有利于病毒的持久性(Opriessnig和Halbur2012).在并发/继发感染病例中,PCV2/其他病原体与宿主反应的相互作用在发病机制中起着重要作用,值得进一步研究。受pcvad感染的猪已被确认为免疫功能低下。PCV2可在淋巴组织中感染和复制,如淋巴结、胸腺、扁桃体和脾脏,从而破坏淋巴滤泡结构,导致白细胞减少和免疫抑制(Darwich et al。2002;Ramamoorthy和孟2009;达维奇和马图2012;孟2013).PCV2感染中免疫细胞和免疫反应的参与对PCVAD的发展至关重要。
2015年,在美国首次在pcv2阴性的母猪中发现了猪圆环病毒3型(PCV3),临床表现为猪皮炎和肾病综合征(PDNS)、繁殖失败和急性死亡(Palinski et al.)。2016).病理病变和病毒抗原在多个组织和器官,包括肺、肝、脾、肾、心、淋巴结和肠(Jiang et al。2019年,一个).有趣的是,研究表明PCV3也可在粪便样本中检测到,这表明它是一种粪-口传播方式(Zhai等。2017).迄今为止,PCV3已被报道在世界范围内具有广泛的地理分布(Fan et al。2016;Shen等人。2017;翟等人。2017).PCV3基因组比PCV2大,两种病毒Cap蛋白的氨基酸序列只有36-37%的相似性(Morozov et al。1998;Palinski等人。2016).先前的研究表明,一些糖胺聚糖作为PCV2的细胞表面受体(Misinzo et al。2006);然而,受体识别的特定基序不存在于PCV3的帽(Shi et al。2021).
PCV3抗原被证实与典型的PDNS组织病理学病变共定位。根据Palinski等人进行的回顾性研究,在具有PDNS特征的pcv2阴性病例中,PCV3感染阳性率为93.8% (Palinski等人)。2016).研究还报告了在没有PCV2、PRRSV或PRV的情况下,在生产失败的猪中PCV3感染的异常高的阳性率(85.7%)。2016).与PCV2 (Allan et al。1999;艾伦等人。2000;哈等人。2008;Krakowka等。2008),尝试用单独的PCV3在实验上复制PDNS是成功的(Jiang等。2019年,一个).由于这些发现,PDNS的病因作用被认为是PCV3。免疫组织损伤在感染PCV3的猪中也明显可见。这些损伤主要表现为淋巴细胞坏死和耗损,组织细胞和多核巨细胞替换,有趣的是嗜酸性粒细胞浸润(Palinski等。2016;Jiang等。2019年,一个).目前,PCV3已在许多国家被检测到,并已成为全球养猪业的潜在致病威胁(Chung等。2021;托切托等人。2020),因此强调揭示PCV3感染的发病机制的必要性。本文就PCV2和PCV3与宿主免疫系统的相互作用进行综述,有助于我们更好地了解它们的病毒免疫调节能力和致病机制。
由PCV2感染引起的淋巴衰竭
淋巴样减少后的组织细胞替代被认为是PCVAD最显著的病理特征(Chae2004;Opriessnig等人。2007;Ramamoorthy和孟2009;孟2013).淋巴样衰竭的发展与感染组织中的病毒抗原水平呈正相关(Darwich和Mateu2012;孟2013).PCV2感染引起的淋巴细胞减少主要表现为T和B淋巴细胞、树突状细胞(dc)和自然杀伤细胞的减少(Darwich et al.)。2002;尼尔森等人。2003;Grierson等人。2007;达维奇和马图2012).此外,在病变状态下中性粒细胞和单核细胞的比例增加(Darwich et al。2003 b;Sipos等人。2004).
直接病毒感染和复制引起的淋巴样细胞坏死和溶解被认为在PCVAD(孟)的淋巴样衰竭机制中发挥重要作用2013).无控制的炎症和组织细胞外渗到炎症部位在很大程度上导致淋巴组织损伤。2000).细胞凋亡和淋巴细胞增殖失败也可能是PCV2感染引起的免疫损伤的原因。PCV ORF3编码的蛋白可以通过激活PK15细胞中的caspase-3和caspase-8信号通路诱导细胞凋亡(Liu et al.)。2005).此外,已经确定了由PCV2介导的凋亡引起的B淋巴细胞耗损以及由PCV2感染引起的巨噬细胞凋亡(Shibahara等。2000).在感染pcv2的小鼠中也观察到淋巴组织生发中心的组织细胞凋亡(Kiupel等。2001).然而,一些已发表的研究认为,pcv2介导的细胞凋亡在淋巴样衰竭或淋巴结病中的主要作用,表明细胞凋亡率与组织中的病毒载量呈负相关(Resendes et al。2004).由于淋巴细胞从血液中增殖和募集归因于淋巴组织中细胞团块的维持,细胞增殖的减少而不是凋亡被认为是自发PCV2感染中观察到的淋巴细胞耗损的原因。
PCV2感染可激活自噬,随后通过PK15细胞中的AMPK/ERK/TSC2/mTOR信号通路增强病毒增殖(Zhu等。2012;Ren等人。2016).然而,自噬是发生在免疫细胞内还是参与宿主淋巴细胞耗竭仍未解决。免疫抑制主要与pcv2感染猪的淋巴细胞耗竭有关,淋巴细胞耗竭的确切决定因素和机制尚待阐明,值得进一步研究。
PCV2与树突状细胞的相互作用
PMWS以前被确定为PCVAD最严重的疾病类型。PMWS感染5至12周龄猪,在哺乳和育肥猪中有很高的死亡率。它的特征是体重减轻,呼吸困难和广泛性淋巴结肿大(Chae2004).根据显微镜分析,PMWS的典型特征是淋巴样减少,组织细胞浸润和淋巴样器官肉芽肿性炎症。在pmws感染猪的组织细胞中观察到PCV2包涵体,包括损伤器官中的巨噬细胞(Rosell等。1999;得知崔2004).具有“树突状细胞”形态的PCV2抗原阳性细胞也已被鉴定出来(Rosell等。1999;文森特等人。2003).
树突状细胞(dendritic cells, dc)是一种初级免疫细胞,也是宿主免疫系统中重要的抗原递呈细胞之一,在调节先天免疫反应、启动适应性免疫反应、协调两者的串扰、维持自我耐受等方面发挥着重要作用。作为哨兵,存在于皮肤和粘膜内的树突状细胞参与形成抵御病毒入侵的第一道免疫防线(Mellman和Steinman)2001;Geissmann等人。2010).大多数dc(80-90%)可以与PCV2相互作用,单核细胞来源的dc (modc)和骨髓来源的dc (BMDCs)都对PCV2敏感在体外.发现PCV2的感染性在细胞中保存至少5天,没有检测到病毒复制或降解(Vincent等。2003).此外,携带pcv2的MoDCs与同基因T淋巴细胞共培养不会诱导病毒传播到淋巴细胞或损害其细胞活力(Vincent et al.)。2003,2005),提示淋巴组织损伤可能不是由于感染树突状细胞与淋巴细胞的直接相互作用。PCV2内化到dc既不刺激也不抑制细胞分化。树突状细胞处理和呈递抗原(如超级抗原、葡萄球菌肠毒素B)的能力没有受到PCV2感染的损害。2003).因此,PCV2进入dc是一个活跃的过程通过PCV2在树突状细胞内的吞噬或内吞作用,而不是被动感染过程。树突状细胞中看似流产和沉默的PCV2感染不仅使病毒免受宿主免疫攻击,而且使细胞成为病毒传播的理想“特洛伊木马”通过树突状细胞在宿主体内的迁移活动。
虽然树突状细胞不支持明显的PCV2复制,但PCV2感染在许多方面显著影响树突状细胞的功能和关联的宿主免疫防御。树突状细胞的共刺激分子在T淋巴细胞活化中起重要作用。在体外PCV2持续感染未明显改变dc细胞MHC I、MHC II、CD80/86、CD25、CD16或CD14的表达水平(Gilpin et al。2003;文森特等人。2003,2005);然而,在活的有机体内,PCV2感染被证明下调了表面共刺激分子的表达,包括CD40、CD86和CD137 (Wang等。2017).此外,pcv2感染的猪髂动脉内皮细胞降低了MoDC的粘附和迁移能力,从而阻碍了MoDC的成熟,抑制了其抗原呈递能力(Liu等。2019).单核细胞趋化蛋白-1 (MCP-1)在宿主免疫反应中负责单核细胞和记忆T细胞的募集。在pcv2感染小鼠的脾脏CD11c + dc中观察到MCP-1的缺失(Wang等。2017).此外,携带pcv2的dc与外周血单个核细胞(PBMCs)共培养在体外已被观察到显著诱导CD4 + CD25 + FoxP3 +调节性T细胞,这是已知的介导宿主免疫应答中的免疫耐受(Cecere等。2012).
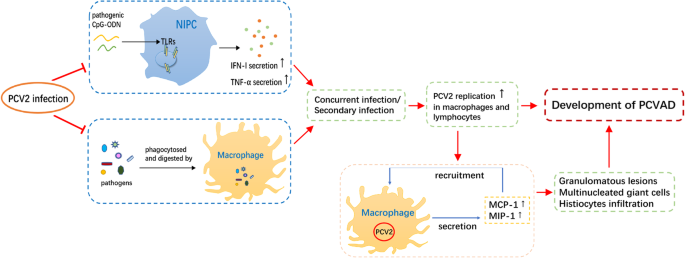
浆细胞样dc (Plasmacytoid dc, pDCs)是产生干扰素(IFN) i型的主要细胞,因此也被称为天然干扰素产生细胞(natural interferon production cells, NIPCs)。NIPC的内质体TLR9可与细菌和病毒的胞嘧啶-磷硫代-鸟嘌呤-寡脱氧核苷酸(CpG-ODN)基序相互作用,导致IFN-α和TNF-α的分泌。IFN-α是先天和适应性免疫应答的重要中介因子,通过诱导其受体细胞的抗病毒状态以及调节和激活免疫细胞。此外,IFN-α和TNF-α的混合物被证明可以促进髓样dc的自分泌和旁分泌成熟(Vincent等。2005;Ramamoorthy和孟2009).因此,NIPCs在触发宿主对病原体的免疫防御中起着至关重要的作用。然而,PCV2 DNA被证明可以干扰NIPCs对致病性CpG-ODNs的反应,从而抑制IFN-α和TNF-α的细胞因子产生(Vincent等。2006).PCV2 DNA还被发现损害NIPCs对TLR7激动剂和其他猪病毒病原体的反应,包括猪伪狂犬病病毒、经典猪瘟病毒和传染性胃肠炎病毒(Vincent et al。2006).此外,PCV2 DNA被证明影响pDCs的细胞骨架重排和内吞过程,这与细胞免疫调节能力相关(Balmelli等。2015).这些结果表明,PCV2 DNA是一种重要的免疫调节因子,可通过调节细胞因子的释放抑制NIPC功能,同时影响先天免疫和适应性免疫,从而有利于并发或继发感染,可能在PCV2感染猪的免疫功能障碍机制中发挥重要作用,有助于PCVAD的发展(图1)。1).
推测自然干扰素产生细胞(NIPCs)和单核/巨噬细胞参与了PCV2和其他病原体合并感染引起的PCVAD的发病机制。PCV2 DNA已被报道干扰NIPCs对致病性胞嘧啶-磷硫代-鸟嘌呤-寡脱氧核苷酸(CpG-ODNs)的反应,从而抑制IFN-α和TNF-α的产生。另一方面,PCV2感染损害了巨噬细胞的吞噬和杀微生物能力。这些结果表明,PCV2与NIPCs和巨噬细胞的相互作用使宿主更容易并发或继发感染。考虑到PCV2在巨噬细胞中的复制是可以实现的在体外使用适当的刺激信号(如脂糖信号)并导致病毒抗原的积累,可以推测感染或接种的免疫刺激促进了PCV2在淋巴组织中的复制,这可能为PCV2与其他病毒或细菌病原体合并感染而不是单独感染PCV2后发生PCVAD的发展提供了一个很好的解释。此外,单核/巨噬细胞系与PCV2的相互作用在介导淋巴结肉芽肿病变和诱导PCVAD中发挥重要作用。巨噬细胞被认为是MCP-1和MIP-1的主要细胞来源,提示MCP-1和MIP-1的表达可能是由PCV2感染直接诱导的。考虑到MCP-1和MIP-1对单核细胞具有有效的趋化和激活作用,推测两者的高水平在很大程度上促进了单核细胞从血液中募集。更多的单核细胞被募集到淋巴组织,反过来又能进一步增加和放大细胞因子的分泌和细胞募集,随后诱导肉芽肿性炎症,导致PCVAD
树突状细胞也采取了防御措施来抵抗PCV2的感染。IL-12在宿主先天免疫防御病毒入侵中发挥重要作用,也通过促进Th1细胞分化介导适应性免疫反应。BMDCs中IL-12的产生在整个PCV2颗粒或病毒样颗粒(VLPs)刺激下显著增加,而PCV2 DNA序列则没有(Kekarainen等人)。2008年,一个),可能有助于vps诱导的免疫保护作用。
成熟树突状细胞和不成熟树突状细胞都能内化PCV2,这可能排除了病毒进入大胞饮途径的作用(Vincent et al。2005).网格蛋白被认为参与PCV2进入dc的过程,因为内化过程对氯丙嗪处理非常敏感(Vincent et al。2005).这与树突状细胞吸收猴免疫缺陷病毒相似,树突状细胞采用网格蛋白依赖性内吞进入途径,并与观察到的人类免疫缺陷病毒1 (HIV-1)感染的持久性有关(Ploegh)1998;弗兰克等人。2002;文森特等人。2005).PCV2在树突状细胞中的静默和持续感染以及细胞免疫调节能力将是病毒进化的进步。病毒和树突状细胞之间的相互作用对宿主免疫反应有重要影响。树突状细胞在PCV2感染和PCVAD中的作用可能是宿主免疫功能障碍的重要组成部分,值得进一步研究。
PCV2与单核/巨噬细胞的相互作用
除了树突状细胞外,单核细胞和巨噬细胞也是先天免疫系统中的主要细胞。单核细胞和巨噬细胞是源于常见髓样祖细胞的专业吞噬细胞,负责处理和呈递抗原,清除病原体和异物,分泌炎症细胞因子,以及激活适应性免疫反应。在PCV2感染的猪中,病毒抗原和DNA存在于单核细胞形态的细胞中,在病变区域的巨噬细胞中可见含有PCV2抗原的包涵体(Rosell et al。1999;Kim等人。2003;文森特等人。2003),提示单核细胞可能在PCV2感染和PCVAD中发挥作用。
根据一份在体外Gilpin et al.的研究。2003),在PCV2感染的单核细胞和巨噬细胞的细胞质中持续检测到病毒抗原,而病毒子代没有明显增加。此外,在接种了PCV2的孤立肺泡巨噬细胞中,病毒抗原和核酸只在细胞质区而没有在核内区观察到,这表明PCV2存在吞噬或内吞进入通路(Chang et al。2006年,一个).这些发现表明单核/巨噬细胞系细胞不是支持PCV2增殖的主要部位。与树突状细胞感染相似,吞噬细胞中的PCV2似乎仅仅是由吞噬其他受感染细胞或病毒颗粒的内化引起的,或为抗原呈递做准备。同样,淋巴细胞也被认为不是支持PCV2复制的主要部位(Rosell等。1999;艾伦和埃利斯2000;吉尔平等人。2003).然而,在感染猪的T、B淋巴细胞以及从PBMCs和支气管淋巴结分离的单核细胞中,通过剪切帽mRNA和病毒DNA检测到PCV2复制。根据这项研究,所有的细胞系都支持PCV2复制在活的有机体内(Yu et al。2007年,一个).更重要的是,PCV2在巨噬细胞中的复制被认为是可以实现的在体外与适当刺激信号的触发,如LPS (Chang et al。2006 b),从而导致病毒抗原积聚。结合之前的研究发现,PCV2感染损害巨噬细胞的吞噬和微生物杀灭能力,从而有利于合并感染(Chang et al。2006年,一个,2006 b),这也可以很好地解释PCVAD是由PCV2与其他病毒和细菌病原体的并发感染或继发感染引起的,而不是单纯的PCV2感染。有趣的是,在体外研究还发现,在ConA刺激下,淋巴细胞支持PCV2的复制(Yu et al。2007 b).因此,通过病原体或接种疫苗的免疫刺激可以促进PCV2在淋巴组织(可能是单核/巨噬细胞和淋巴细胞)中的复制,这可能在很大程度上有助于PCVAD的致病机制(图1)。1).
猪肺泡巨噬细胞(PAMs)是pmws感染猪的PCV2感染的主要靶细胞(Li等。2013).PAMs中未观察到PCV2复制在体外(吉尔平等。2003;Meerts等人。2005 b),而在活的有机体内结果显示PCV2帽mRNA存在于支气管肺泡灌洗(BAL)细胞中,其中90%以上由pam组成,这些细胞来自于感染后3天内接种PCV2的猪(Yu et al.)。2007年,一个).这些发现表明PAMs可能是PCV2复制的重要位点在活的有机体内.与炎症相关的宿主信号分子已被发现在接种PCV2的分离PAMs中上调在体外这导致持续的细胞因子产生,可能是PMWS系统性炎症的原因。据报道,PAMs中PCV2感染可上调TNF-α、粒细胞集落刺激因子和IL-8的表达(Chang等。2006年,一个,2006 b).由于PCV2引起的PAMs中的一些细胞因子谱变化可能会影响局部肺功能和防御,并导致组织病变。除了淋巴样耗损,肉芽肿性病变,其特征是组织细胞增殖伴随着上皮样巨噬细胞和多核巨细胞浸润,也被确定为pcvad感染猪的淋巴结损伤的特殊标记物(Opriessnig等人。2006;孟2013).肉芽肿区巨噬细胞主要来源于血液单核细胞和局部增殖的组织细胞,可转化为具有特定形态的上皮样细胞和多核巨细胞。在上皮样巨噬细胞中检测到PCV2病毒包涵体的存在以及MCP-1和巨噬细胞炎症蛋白-1 (MIP-1)的杂交信号。此外,多核巨细胞严格位于肉芽肿炎性区域(Kim and Chae2004).巨噬细胞被认为是MCP-1和MIP-1的主要细胞来源,它们的表达被认为是由PCV2感染直接诱导的(Kim和Chae2004).PCV2接种1日龄仔猪的淋巴结出现肉芽肿性炎症前,检测到这两种趋化因子的最高水平通过鼻内通路(Kim和Chae2004).由于MCP-1和MIP-1对单核细胞具有有效的趋化和激活作用(Wolpe et al。1988),两者的高水平被推测在很大程度上促进了单核细胞从血液中募集。更多的单核细胞募集到淋巴组织中,会增加和放大细胞因子的分泌和细胞募集,诱导肉芽肿性炎症,最终导致PCVAD(图1)。1).除了单核细胞外,MIP-1被认为与中性粒细胞的招募有关(Wolpe等。1988;Standiford等人。1995),这可能是pcvad感染猪淋巴组织中上述细胞比例变化的主要原因。这些结果表明,单核/巨噬细胞系与PCV2的相互作用在介导淋巴结肉芽肿病变和诱导PCVAD中起着重要作用(图1)。1).单核和巨噬细胞在宿主免疫防御系统中对病毒感染起着至关重要的作用。揭示这些细胞参与PCVAD对理解PCV2感染引起的发病机制和宿主免疫应答具有重要意义。
IL-10在PCV2感染中的作用
PCV2感染诱导的细胞因子谱改变在PCVAD的发病机制中起着重要作用。来自PMWS猪的PBMCs通过上调IL-10和IFN-γ表达,显示出对召回PCV2抗原刺激的阳性反应(Kekarainen等。2008 b在有丝分裂原(植物血球凝集素)或超级抗原的刺激下,几乎不产生IL-4、IL-2或IFN-γ (Darwich等人)。2003年,一个;Kekarainen等人,2008年,一个).此外,PCV2可以抑制从健康猪和pmws感染猪分离的PBMCs分泌IL-2和IL-4 (Darwich et al.)。2003年,一个),被认为削弱和削弱了宿主对病毒感染的免疫防御。IL-10可损害细胞的病原清除功能,包括巨噬细胞、Th1细胞和NK细胞,影响先天和适应性免疫反应。PCV2感染已被证实可促进培养的PBMCs分泌IL-10在体外主要是单核/巨噬细胞和dc,它们减少IFN-γ、IFN-α和IL-12的释放(Darwich et al。2003年,一个;Kekarainen等人。2008年,一个,2008 b;Kekarainen和Segalés2015).此外,IL-10的表达在PCVAD猪的胸腺中被证实上调,这被认为与淋巴样衰竭、胸腺萎缩和免疫功能障碍有关(Darwich等。2003年,一个).
宿主对PCV2感染的体液和细胞免疫反应
在现场病例中,部分感染pcv2的猪没有发生PCVAD(孟2013).这些猪中PCV2感染的限制或消除应该与有效的体液和细胞免疫反应的发展有关,这反映了宿主适应性免疫反应在对抗PCV2感染中的重要性(Fort et al。2009;达维奇和马图2012;孟2013).体液免疫反应被认为在防御过程中起着重要作用,因为中和抗体的水平与病毒复制、病理病变的严重程度和pcv2感染猪的发病有关(Hangartner等人)。2006;Meerts等人。2006;Fort等人。2007;宋等人。2007).在实验感染PCV2的特异性无病原体猪和免疫猪中,分别在感染后10天和15天检测到抗PCV2的抗体。pmws感染猪的总抗体和中和抗体水平已被证明低于无症状猪,无症状猪也出现早期血清转换(Meerts等。2005年,一个,2006).此外,母猪通过初乳被动获得的抗pcv2抗体对新生仔猪有保护作用。事实上,仔猪母体抗体越高,发生病毒血症的可能性越低(McKeown等。2005;Ostanello等人。2005;萨哈等人。2014).仔猪中可检测到的抗体浓度被认为与母猪中观察到的抗体浓度呈正相关(Kekarainen和Segalés2015).随着乳汁中抗体浓度的下降,仔猪对PCV2感染的易感性逐渐增加(Rodríguez-Arrioja等。2002;Larochelle等人。2003;Grau-Roma等人。2009).这些发现也反映出抗体在对抗PCV2感染中发挥了重要作用。
然而,针对PCV2的抗体并不总是具有完全的保护作用。对病原体的中和抗体的有效功能明显依赖于巨噬细胞,巨噬细胞可以清除抗原-抗体复合物。PCV2感染损害巨噬细胞的吞噬和杀菌能力(Chang et al。2006年,一个,2006 b),这可能会干扰中和抗体的功能。此外,病毒是细胞内的强制性病原体,PCV2已经进化到导致免疫细胞的持续感染。因此,除了体液免疫,细胞免疫在宿主对PCV2感染的防御中也具有重要意义。
淋巴样减少是PCVAD的显著特征。然而,某些T细胞亚群也被证明是下调的,包括naïve CD4+CD8−Th细胞,CD4−CD8+细胞毒性T细胞和CD3+CD4+CD8+记忆/激活Th细胞,在PCVAD中(Nielsen et al。2003).在这些细胞亚群中,后者的减少程度被认为与疾病发展相关(Nielsen et al.)。2003;Kekarainen和Segalés2015).PCV2特异性IFN-γ分泌细胞(SC)的水平与病毒载量呈负相关,并被证明是在感染和接种PCV2以及PCV2特异性IFN-γ/TNF-α共同产生CD4+亚群时诱导的(Meerts等。2005年,一个;Fort等人。2007,2008;Kekarainen和Segalés2015).IFN-γ/TNF-α共同产生CD4+细胞亚群和IFN-γ- sc被认为在PCV2感染的细胞免疫防御中发挥核心作用(Kekarainen和Segalés2015;Koinig等人。2015).
PCV2作为一种免疫抑制病毒,可以作为揭示单链DNA病毒如何与宿主免疫防御相互作用的合适模型。了解和剖析PCV2感染和宿主免疫反应的潜在机制对预防和控制PCVAD具有重要意义。
PCV3与宿主免疫系统的相互作用
与PCV2相比,实验证明,在没有小孔帽贝血色素注射液免疫刺激的情况下,单独感染PCV3可以成功复制PDNS (Jiang et al.)。2019年,一个).PCV3还被证明可以感染淋巴类器官,包括淋巴结和脾脏,据报道,在感染组织的淋巴细胞、巨噬细胞、中性粒细胞、嗜酸性粒细胞和上皮细胞中检测到PCV3抗原(Palinski等。2016;Jiang等。2019年,一个).pcv3感染的脾脏淋巴滤泡破坏,白色髓萎缩。此外,除了在pcv2感染病例中观察到的淋巴样减少和组织细胞浸润外,在pcv2感染猪的淋巴结中还明显观察到嗜酸性粒细胞密集浸润和铁血铁氧素沉着(Jiang et al。2019年,一个).嗜酸性粒细胞被认为在介导对过敏原刺激或病原体感染的炎症反应以及诱导宿主抗病毒免疫中发挥重要作用。据推测,嗜酸性粒细胞浸润可能是pcv3感染猪出现过敏性炎症症状(包括皮疹和哮喘)和免疫功能低下状态的重要原因(Jiang et al.)。2019年,一个).虽然PCV3已被证实存在于嗜酸性粒细胞中,但PCV3是否能在细胞中进行增殖复制尚不清楚。因此,PCV3与嗜酸性粒细胞之间的相互作用具有重要意义,值得进一步研究。
先天免疫反应已被证明在对抗PCV3感染中发挥重要作用;这是由PCV3感染诱导的一些吞噬相关蛋白和isg编码蛋白的上调所揭示的(Jiang et al。2019 b).PCV3感染也显著上调了MHC- I和MHC- II的表达水平,这可能是通过介导和促进抗原提呈活性和细胞毒性T细胞杀伤作用来促进宿主的适应性防御(Jiang et al.)。2019 b).
PCV3在宿主免疫调节和免疫损伤机制中的作用也在以下方面得到了揭示。从pcv3感染猪分离出的PBMCs在有丝分裂原刺激下表现出增殖能力不足,这可能导致T淋巴细胞无能(Jiang et al。2019 b).据报道,PCV3 Cap蛋白通过与G3BP1相互作用抑制外源DNA分子识别诱导的细胞IFN的产生,这似乎影响宿主先天和适应性免疫反应的启动和激活(Zhang等。2020).在PCV3感染的反应中,HSP60的表达上调,这可能干扰宿主的免疫防御,有利于病毒感染(Jiang et al.)。2019 b).铁血黄素是巨噬细胞吞噬红细胞后产生的。pcv3感染猪的淋巴结组织病理学诊断显示大量铁血黄素沉积(Jiang et al。2019 b),提示严重炎症可能引起血管损伤。此外,PCV3感染引发的促炎细胞因子IL-1β、IL-6和TNF-α的上调和急性噬菌体蛋白clusterin、ITIH4和haptoglobin等水平的升高可能与感染猪的严重炎症有关,并可能导致淋巴细胞耗损和随后的免疫破坏(Jiang et al.)。2019 b).
结论与展望
PCV2和PCV3被认为在感染过程中诱导宿主免疫抑制。PCV2可诱导宿主持续感染,并已进化出利用和操纵免疫细胞和免疫反应的策略,以实现自身利益。随着PCV2的成功分离和传播在体外PCV2与宿主免疫系统相互作用的研究较多;然而,PCV3与宿主免疫系统相互作用的研究仍然很粗略,仍然有必要。虽然两者都属于致病性猪圆环病毒,但PCV2和PCV3在基因组大小、Cap蛋白氨基酸序列、建立两者动物感染模型等方面存在诸多差异。这说明PCV2和PCV3在与宿主的免疫相互作用过程中存在着不同的性能。此外,推测PCV2和PCV3的细胞表面受体是不同的(Misinzo et al。2006;Shi等人。2021),这可能是导致不同临床症状和宿主免疫反应的重要因素之一。因此,对PCV2和PCV3感染进行比较研究在体外而且在活的有机体内为更好地阐明pcv的致病机制和免疫相互作用提供了依据。此外,详细分析宿主对PCV2和PCV3感染的免疫应答机制,将有助于未来开发新的有效的控制PCVAD的疫苗。
数据和材料的可用性
不适用。
参考文献
艾伦,g.m., J.A.艾利斯,2000。猪圆环病毒:综述。兽医诊断调查杂志12(1): 3-14。https://doi.org/10.1177/104063870001200102.
艾伦,g.m., S.肯尼迪,F.麦克内利,J.C.福斯特,J.A.艾利斯等人。1999。猪圆环病毒和猪细小病毒混合感染猪严重消瘦病的实验繁殖。比较病理学杂志121(1): 1 - 11。https://doi.org/10.1053/jcpa.1998.0295.
Allan, g.m., F. Mcneilly, J. Ellis, S. Krakowka, B. Meehan等。2000。初乳缺失仔猪实验感染猪圆环病毒2型(PCV2)和猪繁殖与呼吸综合征病毒(PRRSV)增强了PCV2的复制。病毒学档案145(11): 2421-2429。https://doi.org/10.1007/s007050070031.
Balmelli, C., E. Steiner, H. Moulin, N. Peduto和K. Mccullough. 2015。猪圆环病毒2型DNA影响浆细胞样和单核细胞来源的树突状细胞的细胞骨架重排。免疫学132(1): 57-65。https://doi.org/10.1111/j.1365-2567.2010.03339.x.
Cecere t.e., X.J.孟,K. Pelzer, S.M. Todd, N.M. Beach, Y.Y. Ni和T. Leroith. 2012。猪树突状细胞与猪圆环病毒2a型(PCV2a)和基因型猪繁殖与呼吸综合征病毒(PRRSV)联合感染,体外诱导CD4(+)CD25(+)FoxP3(+) T细胞。兽医微生物学160(1-2): 233-239。https://doi.org/10.1016/j.vetmic.2012.04.040.
蔡,C. 2004。断奶后多系统消瘦综合征:病因、诊断和病理综述。兽医杂志》168(1): 41-49。https://doi.org/10.1016/j.tvjl.2003.09.018.
张洪伟,郑忠荣,林忠良,刘建军,赵敏桐,蔡永昌,贾美英,杨廷荣,彭文凤。2006a。猪圆环病毒2型(PCV2)体外接种对猪肺泡巨噬细胞免疫病理的影响。兽医免疫学与免疫病理学110(3-4): 207-219。https://doi.org/10.1016/j.vetimm.2005.09.016.
张洪伟,彭文芳,陈丽娟,贾敏英,蔡永昌,郑志荣。2006b。细菌脂多糖诱导猪圆环病毒2型在猪肺泡巨噬细胞中的复制。兽医微生物学115(4): 311-319。https://doi.org/10.1016/j.vetmic.2006.03.010.
郑h.c.,阮g . Park yh .和B.K. Park. 2021。基于重组病毒基因序列的PCV3基因分型。兽医医学7(2): 474-482。https://doi.org/10.1002/vms3.374.
L.达维奇,M.巴拉什,J. Plana-Durán, J. Segalés, M.多明戈,E.马图。2003a。断奶后多系统消瘦综合征猪外周血单个核细胞对有丝分裂原、超抗原或召回病毒抗原应答的细胞因子谱。普通病毒学杂志84(12): 3453-3457。https://doi.org/10.1099/vir.0.19364-0.
Darwich, L.和E. Mateu. 2012。猪圆环病毒2型(PCV2)免疫学研究。病毒的研究164(1-2): 61-67。https://doi.org/10.1016/j.virusres.2011.12.003.
L.达维奇,S. Pié, A.罗维拉,J. Segalés, M.多明戈,I.P.奥斯瓦尔德,E.马特乌,2003b。自然受断奶后多系统消瘦综合征影响的猪淋巴组织细胞因子mRNA表达谱。普通病毒学杂志84 (Pt 8): 2117-2125。https://doi.org/10.1099/vir.0.19124-0.
达威奇,L., J. Segalés, M.多明戈,和E. Mateu. 2002。断奶后多系统消瘦综合征感染猪和年龄匹配的未感染废猪和健康猪的CD4+、CD8+、CD4+ CD8+和免疫球蛋白m阳性外周血单个核细胞的变化与病变和猪圆环病毒相关。临床与诊断实验室免疫学“,9(2): 236-242。https://doi.org/10.1128/cdli.9.2.236-242.2002.
多尔,下午,R.B.贝克,G.W.阿尔蒙德,S.R.韦恩和W.A.格布雷耶,2007。猪圆环病毒2型与其他病原体在猪体内合并感染的流行病学评估。美国兽医协会杂志230(2): 244-250。https://doi.org/10.2460/javma.230.2.244.
埃利斯,2014。猪圆环病毒:一个历史的视角。兽医病理学51(2): 315-327。https://doi.org/10.1177/0300985814521245.
埃利斯,J., L.哈萨德,E.克拉克,J.哈丁,G.艾伦,P.威尔逊,J. Strokappe, K.马丁,F.麦克内利,B.米汉,D.托德,和D.海恩斯。1998。从断奶后多系统消瘦综合征猪皮损中分离圆环病毒。加拿大兽医杂志39(1): 44-51。
范思思,顾晓霞,陈芳,王莹,余旭,何琼。2016。猪圆环病毒3型新毒株PCV3/ cn /湖北-618/2016全基因组序列基因组的公告5 (15): e00100-e00117。https://doi.org/10.1128/genomeA.00100-17.
Fort, M., A. Olvera, M. Sibila, J. Segalés, E. Mateu. 2007。在断奶后多系统消瘦综合征(PMWS)感染猪和非PMWS感染猪中检测中和抗体。兽医微生物学125(3-4): 244-255。https://doi.org/10.1016/j.vetmic.2007.06.004.
Fort, M., M. Sibila, A. Allepuz, E. Mateu, F. Roerink和J. Segalés。2008.常规猪圆环病毒2型(PCV2)疫苗接种可预防不同基因型和地理来源的PCV2分离株的病毒血症。疫苗26(8): 1063-1071。https://doi.org/10.1016/j.vaccine.2007.12.019.
Fort, M. Sibila, E. Pérez-Martín, M. Nofrarías, E. Mateu和J. Segalés。2009.在一个实验模型中,一剂猪圆环病毒2 (PCV2)亚单位疫苗给3周大的常规仔猪可诱导细胞介导免疫,并显著减少PCV2病毒血症。疫苗27(30): 4031-4037。https://doi.org/10.1016/j.vaccine.2009.04.028.
Frank, I., M. Piatak Jr., H. Stoessel, N. Romani, D. Bonnyay, J.D. Lifson和M. Rope. 2002。传染性和全灭活的猴免疫缺陷病毒与灵长类树突状细胞相互作用相似:成熟和不成熟树突状细胞中病毒粒子的细胞内命运不同。病毒学杂志76(6): 2936-2951。https://doi.org/10.1128/jvi.76.6.2936-2951.2002.
Geissmann, F., M.G. Manz, S. Jung, M.H. Sieweke, M. Merad, K. Ley. 2010。单核细胞、巨噬细胞和树突状细胞的发育。科学。327(5966): 656-661。https://doi.org/10.1126/science.1178331.
吉尔平,d.f., K.麦卡洛,B.M.米汉,F.麦克内利,I.麦克奈尔,L.S.史蒂文森,J.C.福斯特,J.A.埃利斯,S.克拉科夫卡,B.M.阿代尔,和G.M.艾伦。2003。猪圆环病毒2型在猪免疫系统细胞中的感染和复制的体外研究。兽医免疫学与免疫病理学94(3-4): 149-161。https://doi.org/10.1016/s0165 - 2427 (03) 00087 - 4.
格罗-罗姆,L., C.K. Hjulsager, M. Sibila, C.S. Kristensen, S. López-Soria, C. Enøe, J. Casal, A. Bøtner, M. Nofrarías, V. Bille-Hansen, L. Fraile, P. Baekbo, J. Segalés, L.E. Larsen. 2009。西班牙和丹麦受断奶后多系统消瘦综合征(PMWS)影响的猪场中猪圆环病毒2型(PCV2)的感染、排泄和血清转换动态。兽医微生物学135(3-4): 272-282。https://doi.org/10.1016/j.vetmic.2008.10.007.
格里尔森,s.s., D.P.金,A.W.塔克,M.多纳杜,M. a .梅伦坎普,K.哈弗森,M.班克斯,M.贝利。2007。新生猪全身细胞免疫的个体发生:与断奶后多系统消瘦综合征的发展相关。兽医免疫学与免疫病理学119(3-4): 254-268。https://doi.org/10.1016/j.vetimm.2007.06.004.
李永华,李永华,安k.k.,金b . Kim,蔡C., 2008。通过产前猪圆环病毒2型感染和产后猪细小病毒感染或免疫刺激仔猪断奶后多系统消瘦综合征的繁殖。兽医病理学45(6): 842-848。https://doi.org/10.1354/vp.45-6-842.
L. Hangartner, R.M. Zinkernagel和H. Hengartner. 2006。抗病毒抗体反应:广泛谱的两个极端。自然评论。免疫学6(3): 231-243。https://doi.org/10.1038/nri1783.
哈丁,J., J. Ellis, D. Todd, B. Meehan, S. Kennedy, C. Charreyre, E. Espuna, E.G. Clark, F. McNeilly,和A. Botner. 1998。来自消瘦病综合征猪的新型猪圆环病毒。兽医记录142(17): 467-468。https://doi.org/10.1016/s0304 - 4017 (97) 00170 - 2.
姜浩、王东、王俊、朱硕、佘荣、任晓霞、田俊、权锐、侯磊、李志强、褚俊、郭莹、奚烨、宋浩、袁芳、魏磊、刘俊。20119a。猪圆环病毒3型感染诱导仔猪皮炎和肾病综合征病毒学杂志93 (4): e02045-e02018。https://doi.org/10.1128/JVI.02045-18.
江宏、魏丽丽、王东、王俊、朱硕、佘然、刘涛、田俊、权锐、侯磊、李忠、褚杰、周杰、郭颖、奚烨、宋宏、袁峰、刘杰。2019b。基于itraq的定量蛋白质组学揭示了第一个感染猪圆环病毒3型的仔猪的蛋白质组谱。蛋白质组学杂志212: 103598。https://doi.org/10.1016/j.jprot.2019.103598.
柯卡莱宁,T., M.蒙托亚,J.多明格斯,E.马蒂乌,J. Segalés。2008 a。猪圆环病毒2型(PCV2)病毒组分免疫调节召回抗原反应。兽医免疫学与免疫病理学124(1-2): 41-49。https://doi.org/10.1016/j.vetimm.2008.01.031.
T.克卡莱宁,M.蒙托亚,E. Mateu和J. Segales. 2008b。猪圆环病毒2型诱导的白细胞介素-10调节回忆抗原反应。普通病毒学杂志89(3): 760-765。https://doi.org/10.1099/vir.0.83354-0.
柯卡莱宁,T.和J. Segalés。2015.猪圆环病毒2的免疫学和病毒进化。猪健康管理1(1): 17。https://doi.org/10.1186/s40813-015-0012-z.
Kim J.和C. Chae, 2004。猪圆环病毒2诱导的肉芽肿性炎症中单核细胞趋化蛋白-1和巨噬细胞炎症蛋白-1的表达比较病理学杂志131(2-3): 121-126。https://doi.org/10.1016/j.jcpa.2004.02.001.
金j,崔C.,蔡c .。2003。与韩国分离株猪圆环病毒2和猪细小病毒合并感染的断奶后多系统消瘦综合征的发病机制。比较病理学杂志128(1): 52-59。https://doi.org/10.1053/jcpa.2002.0605.
M. Kiupel, G.W. Stevenson, J. Choi, K.S. Latimer, C.L. Kanitz, S.K. Mittal. 2001。猪圆环病毒分离自猪断奶后多系统消瘦病,实验接种BALB/c小鼠后病毒复制和病变。兽医病理学38(1): 74-82。https://doi.org/10.1354/vp.38-1-74.
Koinig, h.c., S.C. Talker, M. Stadler, A. Ladinig, R. Graage, M. Ritzmann, I. hennigg - pauka, W. Gerner, A. Saalmüller。2015.PCV2疫苗可诱导IFN-γ/TNF-α共产生T细胞,具有潜在的保护作用。兽医研究46(1): 20。https://doi.org/10.1186/s13567-015-0157-4.
克拉考卡,J.A.埃利斯,F.麦克内利,S.林格勒,D.M. Rings和G.艾伦,2001。免疫系统的激活是猪圆环病毒-2 (PCV-2)感染的猪产生消瘦病的关键事件。兽医病理学38(1): 31-42。https://doi.org/10.1354/vp.38-1-31.
克拉考卡,S., J.A.埃利斯,B.米汉,S.肯尼迪,F.麦克内利,G.艾伦,2000。猪病毒性消瘦综合征:猪圆环病毒2号和猪细小病毒联合感染,在共生猪中试验繁殖断奶后多系统消瘦综合征。兽医病理学37(3): 254-263。https://doi.org/10.1354/vp.37-3-254.
克拉考卡,S., C. Hartunian, A. Hamberg, D. Shoup, M. Rings, Y. Zhang, G. Allan, J.A. Ellis. 2008。在猪圆环病毒2型阴性的侏儒猪中诱导猪皮炎和肾病综合征的评价美国兽医研究杂志69(12): 1615-1622。https://doi.org/10.2460/ajvr.69.12.1615.
拉罗谢尔,R·R·马加尔和s·达莱尔。2003.具有和不具有断奶后多系统消瘦综合征的商品猪群的血清学和病毒学比较研究。加拿大兽医研究杂志67(2): 114-120。
李伟,刘硕,王玉玉,邓峰,严伟,杨琨,陈浩,何强,夏瑞尔,J.C. Audoneet。2013。猪圆环病毒2型对猪肺泡巨噬细胞应答的转录分析。BMC基因组学14(1): 353。https://doi.org/10.1186/1471-2164-14-353.
刘建军,陈毅,邝建军,2005。猪圆环病毒2型感染细胞中一种先前未发现的病毒蛋白的特性及其在病毒诱导凋亡中的作用。病毒学杂志79(13): 8262-8274。https://doi.org/10.1128/JVI.79.13.8262-8274.2005.
刘胜,李强,乔杰,王俊杰,崔东,顾凯,周硕,李浩。2019。猪圆环病毒2型诱导内皮细胞IL-8影响树突状细胞成熟和抗原递呈功能。病毒学杂志16(1): 154。https://doi.org/10.1186/s12985-019-1256-z.
McKeown, n.e., T. Opriessnig, P. Thomas, D.K. Guenette, F. Elvinger, M. Fenaux, P.G. Halbur,和X.J.孟. 2005。猪圆环病毒2型(PCV2)母体抗体对仔猪实验感染PCV2的影响临床与诊断实验室免疫学“,12(11): 1347-1351。https://doi.org/10.1128/CDLI.12.11.1347-1351.2005.
Meerts, G. Misinzo, D. Lefebvre, J. Nielsen, A. Bøtner, C.S. Kristensen, H.J. Nauwynck. 2006。猪圆环病毒2 (PCV2)中和抗体的存在与防止病毒复制和PCV2相关疾病发展之间的相关性兽医研究中心2(1): 6。https://doi.org/10.1186/1746-6148-2-6.
Meerts, G. Misinzo, F. Mcneilly和H.J. Nauwynck. 2005b。不同猪圆环病毒2株在PK-15细胞、胎儿心肌细胞和巨噬细胞中的复制动力学病毒学档案150(3): 427-441。https://doi.org/10.1007/s00705-004-0444-2.
Meerts, S. Van Gucht, E. Cox, A. Vandebosch和H.J. Nauwynck. 2005a。猪圆环病毒2型适应性免疫应答类型与病毒复制水平之间的相关性病毒免疫学18(2): 333-341。https://doi.org/10.1089/vim.2005.18.333.
梅尔曼和R.M.斯坦曼,2001。树突细胞。细胞。106(3): 255-258。https://doi.org/10.1016/s0092 - 8674 (01) 00449 - 4.
孟,x.j 2013。猪圆环病毒2型(PCV2):发病机制和与免疫系统的相互作用。动物生物科学年度评论1(1): 43-64。https://doi.org/10.1146/annurev-animal-031412-103720.
米辛佐,G., P.L. Delputte, P. Meerts, D.J. Lefebvre和H.J. Nauwynck. 2006。猪圆环病毒2使用硫酸肝素和硫酸软骨素B糖胺聚糖作为受体附着于宿主细胞。病毒学杂志80(7): 3487-3494。https://doi.org/10.1128/JVI.80.7.3487-3494.2006.
Morozov, I., T. Sirinarumitr, S.D. Sorden, P.G. Halbur, M.K. Morgan, K.J. Yoon, P.S. Paul, 1998。在断奶后多系统消瘦综合征猪体内发现一株新型猪圆环病毒。临床微生物学杂志36(9): 2535-2541。https://doi.org/10.1128/JCM.36.9.2535-2541.1998.
Nielsen, J, I.E. Vincent, A. Bøtner, A.S. Ladekaer-Mikkelsen, G. Allan, A. Summerfield, K.C. McCullough。2003.淋巴细胞减少与猪圆环病毒2型诱导的断奶后多系统消瘦综合征(PMWS)的关系兽医免疫学与免疫病理学92(3-4): 97-111。https://doi.org/10.1016/s0165 - 2427 (03) 00031 - x.
Opriessnig, T. M. Fenaux, P. Thomas, M.J. Hoogland, M.F. Rothschild, X.J.孟和P.G. Halbur. 2006。对猪圆环病毒2型相关疾病和病变易感性的品种依赖差异的证据。兽医病理学43(3): 281-293。https://doi.org/10.1354/vp.43-3-281.
Opriessnig, T.和P.G. Halbur. 2012。同时感染对猪圆环病毒相关疾病的表达很重要。病毒的研究164(1-2): 20-32。https://doi.org/10.1016/j.virusres.2011.09.014.
Opriessnig, T. X.J.孟和P.G. Halbur. 2007。猪圆环病毒2型相关疾病:当前术语、临床表现、发病机制、诊断和干预策略的更新。兽医诊断调查杂志19(6): 591-615。https://doi.org/10.1177/104063870701900601.
Ostanello, F., A. Caprioli, ad . Francesco, M. Battilani, G. Sala, G. Sarli, L. Mandrioli, F. McNeilly, G.M. Allan,和S. Prosperi. 2005。试验用3周龄常规初乳饲养猪感染猪圆环病毒2型和猪细小病毒。兽医微生物学108(3-4): 179-186。https://doi.org/10.1016/j.vetmic.2005.04.010.
R.帕林斯基,P. Piñeyro,尚p .袁芳,郭锐,方旸,拜尔斯,B.M.豪斯,2016。一种新的猪圆环病毒与已知的圆环病毒有较远的亲缘关系,与猪皮炎、肾病综合征和繁殖失败有关。病毒学杂志91 (1): e01879-e01816。https://doi.org/10.1128/JVI.01879-16.
Pallares, F.J, P.G. Halbur, T. Opriessnig, S.D. Sorden, D. Villar, B.H. Janke等。2002。猪圆环病毒2型(PCV-2)在美国现场病例断奶后多系统消瘦综合征(PMWS)合并感染。兽医诊断调查杂志14(6): 515-519。https://doi.org/10.1177/104063870201400614.
Ploegh, H.L. 1998。病毒式的免疫逃避策略科学。280(5361): 248-253。https://doi.org/10.1126/science.280.5361.248.
Ramamoorthy, S.和X.J.孟. 2009。猪圆环病毒:一个微小而巨大的悖论。动物健康研究综述10(1): 1 - 20。https://doi.org/10.1017/S1466252308001461.
任丽娟,陈晓霞,欧阳浩,2016。猪圆环病毒2与宿主的相互作用。病毒基因52(4): 437-444。https://doi.org/10.1007/s11262-016-1326-x.
雷森德斯,N. Majó, J. Segalés, E. Mateu, M. Calsamiglia, M. Domingo. 2004。猪圆环病毒2型自然感染猪淋巴器官的凋亡。普通病毒学杂志85 (Pt 10): 2837-2844。https://doi.org/10.1099/vir.0.80221-0.
Rodríguez-Arrioja, g.m., J. Segalés, M. Calsamiglia, A.R. Resendes, M. Balasch, J. Plana-Duran, J. Casal, M. Domingo. 2002。一群断奶后多系统消瘦综合征猪圆环病毒2型感染的动态美国兽医研究杂志63(3): 354-357。https://doi.org/10.2460/ajvr.2002.63.354.
C.罗塞尔,J. Segalés, J. Plana-Durán, M.巴拉什,G.M. Rodríguez-Arrioja, S.肯尼迪,G.M.艾伦,F.麦克内利,K.S.拉蒂默,M.多明戈,1999。猪断奶后多系统消瘦综合征(PMWS)自然病例的病理、免疫组化和原位杂交研究比较病理学杂志120(1): 59-78。https://doi.org/10.1053/jcpa.1998.0258.
萨哈,D. R.D.P. Sacristán, N. Van Renne, L. Huang, R. Decaluwe, A. Michiels,等。2014。抗猪圆环病毒2型(PCV2)抗体胎盘屏障从母猪泄漏到胎儿:对子宫内PCV2感染诊断的影响。Virologica中央研究院29(2): 136-138。https://doi.org/10.1007/s12250-014-3432-z.
J. G.M. Allan和M. Domingo. Segalés, 2005。猪圆环病毒病。动物健康研究综述6(2): 119-142。https://doi.org/10.1079/ahr2005106.
沈浩,刘晓霞,张鹏,王磊,刘赟,张磊,梁鹏,宋晨。2017。中国南方猪圆环病毒3型的基因组特征。跨界和新发疾病65(1): 1 - 3。https://doi.org/10.1111/tbed.12639.
石荣,侯磊,魏磊,权荣仁,周波,江宏,王俊杰,朱思,宋俊,王德华,刘俊。2021。猪圆环病毒3型通过网格蛋白和动力蛋白2介导的内吞作用以Rab5/Rab7和ph依赖的方式进入PK15细胞。微生物学前沿12: 636307。https://doi.org/10.3389/fmicb.2021.636307.
柴原,T., K.佐藤,Y.石川,K. Kadota, 2000。猪圆环病毒诱导消耗性疾病综合征猪B淋巴细胞耗竭。《兽医科学杂志62(11): 1125-1131。https://doi.org/10.1292/jvms.62.1125.
西波斯,J.C. Duvigneau, M. Willheim, F. Schilcher, R.T. Hartl, G. Hofbauer, B. Exel, P. Pietschmann和F. Schmoll. 2004。采用半定量RT-PCR和流式细胞仪细胞内细胞因子检测测定了自然断奶后多系统消瘦综合征(PMWS)喂养猪的全身细胞因子谱。兽医免疫学与免疫病理学99(1-2): 63-71。https://doi.org/10.1016/j.vetimm.2004.01.001.
宋玉玉,金明明,张少华,徐晓霞,肖山,曹山,陈浩。2007。表达猪圆环病毒2型帽蛋白的重组伪狂犬病病毒的生成及其免疫原性。兽医微生物学119(2-4): 97-104。https://doi.org/10.1016/j.vetmic.2006.08.026.
斯坦迪福德,t.j., S.L.昆克尔,N.W.卢卡奇,M.J.格林伯格,J.M.丹福斯,R.G.昆克尔,R.M.斯特里特,1995。巨噬细胞炎症蛋白-1 α介导内毒素血症小鼠肺白细胞招募、肺毛细血管渗漏和早期死亡。免疫学杂志155(3): 1515-1524。
托切托,德利马检察官,a.p.m Varela, L.C. Ortiz, M.R. Loiko, C.M. Scheffer, W.P. Paim, S.P. Cibulski, C. Cerva, J. Herpich, C. Schmidt, A.C. Franco, F.Q. Mayer,和P.M.Roehe》2020。产死胎母猪血清中猪圆环病毒3型的调查。微生物发病机理149: 104316。https://doi.org/10.1016/j.micpath.2020.104316.
文森特,即C. Balmelli, B. Meehan, G. Allan, A. Summerfield和K.C. McCullough。2006.猪圆环病毒2型DNA激活的天然干扰素产生细胞的沉默。免疫学120(1): 47-56。https://doi.org/10.1111/j.1365-2567.2006.02476.x.
文森特,即C.P.卡拉斯科,L. guzylak - piriou, B. Herrmann, F. McNeilly, G.M. Allan, A. Summerfield和K.C. McCullough。2005.圆环病毒2型对树突状细胞活性的亚群依赖性调节免疫学115(3): 388-398。https://doi.org/10.1111/j.1365-2567.2005.02165.x.
文森特,即C.P.卡拉斯科,B.赫尔曼,B.M.米汉,G.M.艾伦,A.萨莫菲尔德和K.C.麦卡洛。2003.树突状细胞中潜伏着具有传染性的猪圆环病毒2型,但没有明显的细胞调制或病毒复制。病毒学杂志77(24): 13288-13300。https://doi.org/10.1128/jvi.77.24.13288-13300.2003.
王晓霞,陈磊,袁伟,李颖,李丽,李涛,李浩,宋强。2017。猪圆环病毒2型(PCV2)对小鼠脾脏CD11c+树突状细胞功能的影响病毒学档案162(5): 1289-1298。https://doi.org/10.1007/s00705-017-3221-8.
Wolpe, s.d., G. Davatelis, B. Sherry, B. Beutler, D.G. Hesse, H.T. Nguyen, L.L. Moldawer, C.F. Nathan, S.F. Lowry和A. Cerami。1988。巨噬细胞分泌一种具有炎症和中性粒细胞趋化动力学特性的新型肝素结合蛋白。实验医学杂志167(2): 570-581。https://doi.org/10.1084/jem.167.2.570.
于,S., T. Opriessnig, P. Kitikoon, D. Nilubol, P. g . Halbur, E. Thacker. 2007a。猪圆环病毒2型(PCV2)在早期感染猪的组织和免疫细胞中的分布和复制。兽医免疫学与免疫病理学115(3-4): 261-272。https://doi.org/10.1016/j.vetimm.2006.11.006.
于,S, A.文森特,T.奥普里斯尼格,S.卡朋特,P.基提昆,P. g .哈尔伯,E.塞克。2007b。体外外周血单个核细胞(PBMCs)中PCV2衣壳转录物的定量。兽医微生物学123(1-3): 34-42。https://doi.org/10.1016/j.vetmic.2007.02.021.
翟硕,周旭东,张浩,豪斯贝,林涛,刘荣,陈强,魏伟,吕东,文旭东,李峰,王东。2017。猪圆环病毒3型在不同临床表现猪中的比较流行病学病毒学杂志14(1): 222。https://doi.org/10.1186/s12985-017-0892-4.
张鹏,沈海辉,刘晓霞,王胜,刘赟,徐志忠,宋晨。2020。猪圆环病毒3型帽通过与G3BP1相互作用抑制I型干扰素的诱导。兽医科学前沿7: 594438。https://doi.org/10.3389/fvets.2020.594438.
朱斌,周玉云,徐峰,帅军,李旭东,方伟。2012。猪圆环病毒2型通过pk15细胞的AMPK/ERK/TSC2/mTOR信号通路诱导自噬。病毒学杂志86(22): 12003-12012。https://doi.org/10.1128/JVI.01434-12.
确认
不适用。
资金
本研究得到江苏省高等学校重点学科建设项目(PAPD)资助。
作者信息
作者和隶属关系
贡献
RS和JL:概念化。RS和LH:写作-初稿准备。RS和JL:写作审查和编辑。JL:监督和项目管理。JL:融资收购。所有作者都进行了批判性阅读和编辑。作者(们)阅读并批准了最终稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者刘珏(音)没有参与该杂志的评审或有关该稿件的决定。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
权利与权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
石荣,侯林,刘杰。猪圆环病毒感染对宿主免疫应答的影响。动物疾病1, 23(2021)。https://doi.org/10.1186/s44149-021-00027-3
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s44149-021-00027-3
关键字
- 猪圆环病毒(PCV)
- 猪圆环病毒相关疾病
- 淋巴损耗
- 免疫反应
- 发病机理