摘要
很明显,阿尔茨海默病(AD)不仅与其标志性病变——淀粉样斑块和神经纤维缠结(NFTs)——有关,还与其他同时发生的病理有关。这可能导致各自细胞和分子参与者的协同作用,导致神经元死亡。这些共同病理之一是磷酸化的交易反应DNA结合蛋白43 (pTDP-43)作为神经元细胞质内含物的积累,目前被认为代表边缘为主的年龄相关TDP-43脑病神经病理改变(LATE-NC),在高达70%的症状性AD病例中。颗粒空泡变性(Granulovacuolar degeneration, GVD)是AD的另一种共同病理,其中也含有TDP-43等AD相关蛋白。最近,我们发现所有坏死执行所需的蛋白质(先前定义的程序性神经元细胞死亡形式)都存在于GVD中,如磷酸化坏死执行者混合谱系激酶结构域样蛋白(pMLKL)。因此,该蛋白与其他已知的GVD蛋白相似,是GVD病变的可靠标记物。重要的是,目前尚不清楚有症状的AD病例中LATE-NC的存在是否与坏死通路激活有关,可能是细胞死亡执行导致神经元丢失的原因。在本研究中,我们研究了LATE-NC对坏死相关GVD病变严重程度、磷酸化tau (pTau)病理和神经元密度的影响。首先,我们用了230个人死后包括82例无AD神经病理改变(non-ADNC)的对照组,81例非痴呆性ADNC,即病理定义的临床前AD (p-preAD)和67例痴呆性ADNC。我们发现Braak NFT期和LATE-NC期是海马CA1区GVD扩张和神经元丢失的良好预测因子。此外,我们比较了TDP-43积累对pmlkl阳性GVD海马表达和pTau的影响,以及对9个非adnc对照组(10个有症状的AD病例)神经元密度的影响TDP +)和8个没有LATE-NC (ADTDP−).在这里,我们观察到pmlkl阳性,在AD中显示gvd的神经元水平增加TDP +与AD相比TDP−对照组,同时伴有pTau病变增强。AD患者CA1区的神经元损失增加TDP +与AD相比TDP−用例。这些数据表明,AD中共病的LATE-NC不仅影响pTau病理,还影响gvd介导的坏死通路激活,从而导致神经元加速死亡。这进一步强调了共病病理的累积和协同作用导致AD的神经元损失。因此,对坏死性神经元死亡的保护似乎是AD和LATE的一个有前途的治疗选择。
介绍
阿尔茨海默病(AD)是最常见的痴呆症形式,占全世界痴呆症病例的80%,其特征是进行性记忆丧失和其他认知领域的损害,如执行功能障碍[1].AD包括两个主要的神经病理特征,即含有淀粉样β蛋白(Aβ)的老年斑和含有异常磷酸化tau蛋白(pTau)的神经纤维缠结(NFTs) [39].
越来越多的证据表明,AD通常伴有多种共同病理,而不是构成一种严格定义的疾病[3.,4,60,66,67,最终导致神经元的丢失。其中一种共同病理是交互反应dna结合蛋白43 (TDP-43)的神经元积累,最近被认为代表边缘为主的年龄相关TDP-43脑病神经病理改变(LATE-NC) [53].在高达70%的AD病例的边缘系统中发现LATE-NC [46].在疾病中,TDP-43被磷酸化并转移到细胞质中,形成病理聚集体[54,83].重要的是,AD中LATE-NC的存在与较小的海马体积和恶化的认知表现有关[35,37].有趣的是,与没有TDP-43病理的患者相比,有pTDP-43夹杂物的患者在临床上表现出更严重的痴呆[35],强调LATE-NC是AD的相关共病。TDP-43也一直与严重的神经元损失有关,如海马硬化[50],以及重现AD和TDP-43病理的动物模型[22,57].然而,很少有研究评估了AD大脑中神经元细胞死亡与TDP-43蛋白病变之间的关系[38,42].
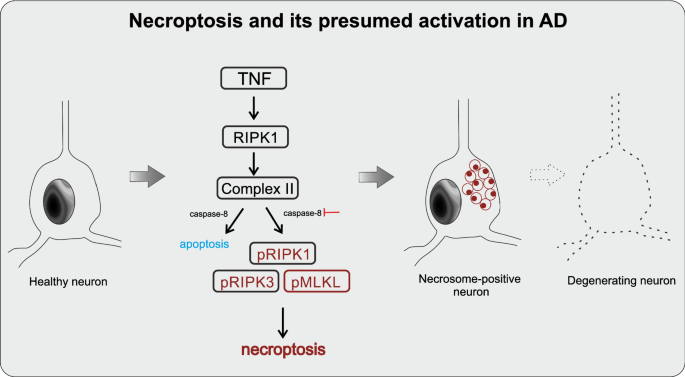
粒空泡变性(GVD)病变是AD的另一种共病病理[36],其特征为3-5 μm空泡,核心为0.5-1.5 μm致密颗粒[21,40,65,70].最近,我们发现GVD颗粒也表现出激活的程序性细胞死亡途径的组成部分,特别是坏死,这与AD中的神经元损失相关[41].典型坏死途径的激活依赖于三种蛋白质的组装,包括磷酸化受体相互作用的丝氨酸/苏氨酸蛋白激酶1和3 (pRIPK1和pRIPK3) [14]以及磷酸化的混合谱系激酶结构域样蛋白(pMLKL)(图。1) [13,69].坏死的激活之前已经与AD联系在一起[12].重要的是,我们发现pMLKL是AD中GVD颗粒的可靠标记物,与pTDP-43和CK1δ [41].一旦被激活的蛋白质在细胞膜上形成坏死体复合体,细胞就会膨胀,细胞膜就会坍塌,细胞死亡通常会在24小时内发生。1) [62,63].因为坏死体成分被封存在GVD颗粒中[41],细胞死亡的执行可能被推迟,这表明在ad相关的神经退行性病变中有一种特定形式的坏死,这里将其称为gvd介导的坏死。
在AD的神经退行性过程中,pTau病理被认为是导致神经元萎缩和认知能力下降的最重要因素[2,52,68].此前,我们观察到pmlkl阳性GVD与Braak NFT分期之间存在很强的相关性[41].此外,我们发现TDP-43在AD进展过程中与pTau病变共同定位并相互作用[75],表明这些蛋白质之间存在协同作用[43].在ALS/FTLD中,我们发现TDP-43和tau病理有助于海马CA1亚场神经元中pmlkl阳性的GVD [79].然而,目前尚不清楚AD大脑中LATE-NC存在时局部pTau和GVD严重程度如何变化。因此,问题就来了,在伴有LATE-NC的AD病例中,神经元的丢失是否与坏死途径有关,激活的坏死标记物的表达和神经元的丢失在伴有和不伴有LATE-NC的AD病例中是否不同。
这里,我们调查了死后有LATE-NC和无LATE-NC的症状性AD病例的人脑,简称ADTDP +和广告TDP−以阐明LATE-NC在AD坏死激活和神经元死亡中的影响。我们还使用了更大的队列,包括伴有或不伴有AD神经病理改变(ADNC)的非患病个体和伴有ADNC的痴呆病例,伴有或不伴有LATE-NC。我们发现,brak NFT和LATE-NC分期与GVD分期、海马神经元损失和痴呆评分显著相关。此外,我们观察到症状性AD中神经元死亡水平较低TDP−与AD相比TDP +.有趣的是,广告TDP +与AD相比,pmlkl阳性GVD体表达加重TDP−用例。在AD中,局部pTau病理也持续加重TDP +用例。这些数据表明,AD中LATE-NC的存在加速了神经元细胞的死亡,特别是通过gvd介导的坏死形式。TDP-43可能通过其对pTau病理的影响而间接影响GVD中pMLKL的表达。我们的数据强调了TDP-43、pTau和坏死执行子pMLKL之间的协同作用。因此,我们强调LATE-NC联合病理在发展未来针对AD神经退行性病变的治疗策略的重要性。
材料与方法
人类的样本
共调查了230例尸检病例样本:82例无AD神经病理改变(ADNC)和痴呆迹象的非AD对照组,81例被认为代表病理诊断为临床前AD (p-preAD)的非ADNC患者和67例伴有ADNC的痴呆患者。所有解剖大脑均来自鲁汶(比利时)、波恩、美因河奥芬巴赫和乌尔姆(德国)的大学或市立医院,并根据当地伦理委员会的准则和比利时和德国关于使用人体组织进行研究的联邦法律收集。痴呆症是根据DSM-IV标准诊断的。当观察到痴呆时,根据国家衰老研究所和阿尔茨海默病协会工作组发布的ADNC神经病理诊断标准(NIA-AA标准),至少确定中度ad相关神经病理时,就可以做出ADNC的神经病理诊断[28].通过对临床痴呆评分(CDR)总体评分的估计,回顾性确定死亡时的痴呆程度[26,47].为此,来自临床文件的信息被用于提供CDR全局评分。CDR总体评分应用于对照组和有临床症状的AD病例[47].伴有ADNC的非痴呆病例,包括Aβ 1期或2期病例,被认为是病理定义的临床前AD [58].当病例在缺乏Aβ的情况下出现ad样pTau病理时,考虑到初龄相关tau病(PART) [15].
左半球用福尔马林固定2 ~ 4周后解剖。石蜡包埋额叶、顶叶、颞叶、枕叶、内嗅皮层、外侧膝状体水平的海马组、基底节区、下丘脑、丘脑、杏仁核、梅纳特基底核(NBM)、中脑、脑桥、延髓和小脑。使用显微刀(赛默飞世尔科学公司)切割5 μm切片。
选择标准
关于内侧颞叶Aβ沉积分期(Aβ mtl期)、Braak NFT、LATE-NC、GVD分期、CDR总体评分、神经元密度和APOE状态的评估,所有来自230例整个队列的可用数据集(表2)1)。临床诊断为ALS的病例和年龄小于18岁的病例不包括在研究中。
为了评估TDP-43病理对gvd介导的AD坏死和神经元丢失的影响,我们选择了27例(表2)2)基于AD病例中是否存在LATE-NC。临床诊断为额颞叶痴呆(FTD)伴FTLD-TDP病理、肌萎缩性侧索硬化症(ALS)病例或其他神经退行性疾病(FTLD-tau、路易体痴呆、帕金森病)的病例被排除在研究之外。病例数由AD的可用性决定TDP−用例。非AD控件和AD控件数量相似TDP +每组随机选择病例。9例对照组是在Aβ病理不存在且Braak分期为0或i期时选择的。因此,与230例患者(67岁)相比,该队列患者的平均死亡年龄(48岁)较低。这与之前的观察相一致,即缺乏ADNC的病例通常更年轻[9].
神经病理学
对于每个病例,brak NFT分期、AβMTL分期、GVD和LATE-NC分期由经验丰富的委员会认证神经病理学家(DRT)确定。Aβ mtl分期确定如下:0期的特征是没有检测到Aβ斑块。颞新皮层(III、V和VI层)中的Aβ斑块是Aβ mtl阶段1的特征。在AβMTL 2期,斑块沉积扩散到内嗅皮层、CA1和下皮质的pre-β - pri-γ层。Aβ mtl第3期的特征是Aβ沉积在所有6层的颞新皮层,包括亚皮质带样Aβ积累。此外,Aβ斑块也存在于齿状回的外分子层和锥体前区的小锥体细胞层。最后,在AβMTL第4期,MTL中有充分发展的β-淀粉样变,在海马的CA4区域和内嗅皮层的前α层中有额外的Aβ斑块[73].Aβ mtl阶段与整个大脑中Aβ沉积阶段密切相关[72],可作为Aβ相的替代品[28].
采用Braak NFT分期法评估NFT分布:0期以pTau NFTs缺失为特征,I期以pTau阳性NFTs和螺纹为特征,局限于经鼻区,II期为内嗅区pTau病理,延伸至CA1和CA2, III期为梭状回和舌回新皮层的影响,IV期为进展到新皮层相关区域和齿状回,V期为累及额枕皮层,到达外围区域(V层也开始受到影响),最后,第VI阶段由次级和初级新皮层区域的pTau病理确定,包括延伸到枕叶的纹状区[7,8].
GVD分期如前所述:0期无GVD, 1期GVD病变局限于CA1/下皮层,2期GVD病变进展至CA4, 3期内嗅皮层伴颞新皮层。第四阶段的特点是杏仁核和下丘脑的影响。第5阶段定义为额叶和顶叶新皮层存在GVD病变[70].
如果发现以下一个或多个病变,则考虑存在迟发性nc:神经元细胞质夹杂物、营养不良的神经突和神经纤维缠结样物质,pTDP-43抗体阳性(S409/S410) [32,33].一贯地,GVD不被认为是适当的LATE-NC,因此,如果一个病例只有GVD而没有其他pTDP-43病变,则被认为是阴性的LATE-NC。GVD病变用抗pmlkl抗体定量。
值得注意的是广告TDP +研究中使用的病例都符合Josephs的TDP-43病理亚型β,该亚型包括与pTau NFTs相邻/共定位的TDP-43病变病例[31].
根据最近发表的指南评估了LATE-NC分期:没有LATE-NC对应于第0阶段,在第1阶段,TDP-43病变出现在杏仁核,随后是第2阶段的海马形成,并在第3阶段扩大到额中回[53].
这些病例的APOE基因型如前所述[71].简单地说,从新鲜冷冻或固定的石蜡包埋组织中提取DNA,然后进行PCR,然后进行酶切。
免疫组织化学
利用免疫组织化学技术检测了27个人类海马样本中pTDP-43 (S409/S410)、pMLKL (S358)和pTau (S202/T205,克隆AT8)在CA1中的局部表达和积累情况(表2)2).在机器人自动染色器(徕卡微系统)中进行脱仿,然后在PT链接模块(Dako)中使用低pH值(柠檬酸盐缓冲溶液,pH值为6,1,Dako)的EnVision Flex目标检索溶液进行抗原检索。用EnVision FLEX过氧化物酶阻断试剂阻断内源性过氧化物酶5分钟,然后用5%牛血清白蛋白(BSA)阻断30分钟。组织切片与一抗一起在潮湿的室温(RT)中孵育一夜。研究中使用的所有抗体的信息汇总在附加文件中1:表A1。使用3,3'-二氨基联苯胺溶液(Liquid DAB + Substrate Chromogen System, Dako)检测一抗与相应的hrp偶联二抗(30 min, RT, Dako)的结合。苏木精反染色和脱水步骤在自动染色器中进行,随后安装在自动盖滑靴中(徕卡微系统)。阳性和阴性对照包括在每个染色程序中。检查组织切片,使用配备徕卡DFC7000 T数码相机(徕卡微系统)的徕卡DM2000 LED显微镜拍摄图像。
免疫荧光
用三标记免疫荧光技术研究了目标蛋白的共表达。免疫染色在海马组织中进行,使用在同一物种中培养的两种抗体。一抗(附加文件1:表A1)用种特异性荧光偶联二抗检测(Jackson免疫研究)。基于先前描述的方法,对多兔对兔染色方案进行了优化[24].简单地说,当使用同一种一抗时,采用偶联方法避免二抗的交叉反应。将组织分别与兔和小鼠培养的抗ptdp -43和抗ptau的鸡尾酒孵育,然后使用荧光驴抗兔和抗小鼠二抗(分别为Cy2和Cy5)。在兔子中产生的第二种一抗(pMLKL)偶联到与荧光团Cy3偶联的驴抗兔Fab片段(Jackson ImmunoResearch) (Jackson ImmunoResearch)。为了偶联,我们将一抗与各自的Fab片段在RT下孵育20分钟(每1 μg一抗2 μg Fab片段)。接着,加入正常兔血清(Jackson ImmunoResearch)捕获未结合的Fab片段(每1 μg Fab片段捕获10 μl血清)10 min。然后,用这些偶联一抗对第二表位进行染色。核可视化采用Hoechst 33342染色(赛默飞世尔科学公司)。使用甘油安装介质(Dako)手动安装载玻片。海马神经元图像采集在尼康ns - elements软件上进行,使用尼康A1R激光扫描共聚焦系统连接到尼康Eclipse Ti倒置显微镜(尼康仪器公司)。
神经元密度和蛋白质积累的定量
对于一项定量研究,根据TDP-43病理的存在/不存在选择了27例:9例无迟发性nc的非患病对照,8例神经病理证实的有症状的无迟发性nc的AD病例(ADTDP−)和10例神经病理证实的症状性AD合并LATE-NC (ADTDP +)(表2).GVD病变中pTDP-43的免疫反应在非adnc对照组、AD中被接受TDP−和广告TDP +因为GVD不是LATE-NC的一部分。
为此,用徕卡DM2000 LED显微镜上的20 ×物镜与DFC 7000 T相机耦合,连续拍摄了三张针对特定抗体(pTDP-43, pMLKL或pTau)免疫反应的海马组织CA1亚野的图像(0.632 × 0.474 mm)。根据苏木精反染的形态学和核图鉴定神经元。形态学特征表明细胞死亡或核损伤/缺失的神经元被排除在分析之外。使用开源图像分析软件(Fiji/ImageJ)来量化神经元密度(以神经元/mm为单位显示)2)以及pTDP-43-、pMLKL-和ptau阳性神经元相对于神经元总数的比例(以百分比表示)。两个AD的全海马体图TDP−和两个ADTDP +可以通过以下超链接在公共存储库BioImage Archive中找到病例:https://www.ebi.ac.uk/biostudies/studies/S-BIAD514?key=475a3bbe-6fc9-476e-8e45-6429422b85bf.
统计分析
采用GraphPad Prism(版本9)、SPSS(版本28)和R软件(版本4.1.1)进行统计分析。采用Kruskal-Wallis检验比较各组神经元密度和每种抗体阳性神经元百分比。组间非参数两两比较采用事后Dunn 's检验。采用非配对t检验比较AD的Braak NFT分期TDP−和广告TDP +用例。半偏相关系数(右)基于斯皮尔曼秩相关,保持年龄和性别常数,使用ppcor R包计算。使用Holm-Bonferroni方法对显著性检验结果进行多重比较校正。建立回归模型,分析解释变量(即Braak NFT和LATE-NC阶段)对每个特定因变量的影响。结果以均数±标准差表示。α水平为0.05,具有统计学意义。为了估计我们的参数之间的相互作用强度,并去除由间接效应引起的伪关系,我们使用图形套索计算了一个稀疏高斯图形模型[20.].在Spearman偏相关矩阵上进行正则化,并根据扩展贝叶斯信息准则(EBIC)选择优化参数[19]使用qgraph R包中的EBICglasso函数。为了确保高特异性,我们使用了EBIC超参数0.5的推荐值,并按照Jankova等人的方法对方差-协方差矩阵的逆矩阵元素进行了阈值处理.[29].我们利用bootnet R包中的corStability计算节点强度和边缘权重的相关稳定性(CS)系数来估计网络的稳定性[18].
结果
LATE-NC和pTau病理的扩散与GVD扩张、神经元丢失和认知状态相关
为了解决LATE-NC和pTau病理的扩散(即,LATE-NC和Braak NFT分期)是否影响AD中GVD的严重程度、神经元损失和痴呆评分,我们使用了230例人体尸检病例,包括82例非ADNC对照,81例非痴呆p-preAD伴ADNC但无痴呆临床症状,67例伴有ADNC的痴呆病例(表2)1).从这些病例中,64例还评估了海马形成CA1亚场的神经元密度,178例回顾性评估了临床痴呆评级(CDR),表明个体的认知状态。该队列的年龄分布在附加文件中描述1:图A1a,显示对照组、p-preAD和AD病例之间的年龄范围重叠。
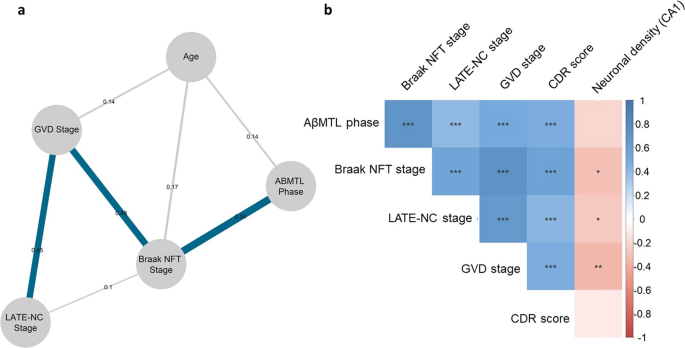
首先,我们使用Spearman偏相关和图形套索正则化进行网络分析,包括痴呆和非痴呆个体(图2)。2A, n = 221)。我们确定了七条边(即直线),表示节点(即变量)之间的积极关系。AβMTL期与Braak NFT期的相关性最强(r= 0.54)。Braak NFT分期也与GVD分期密切相关(r= 0.48),这反过来又表现出与LATE-NC阶段显著相关(r= 0.45)。LATE-NC期与Braak NFT期也有直接关系,但影响较弱(r= 0.1)。年龄与brak NFT分期(r= 0.17), GVD分期(r= 0.14), AβMTL相(r= 0.14)。(无花果。2a).稳定性分析表明,该网络中的节点强度和边权值都足够稳定(CS(cor = 0.7) > 0.5),可以支持我们的结论。
所有230例患者经年龄和性别校正后的半部分相关性证实了这些数据,并揭示了Braak NFT和LATE-NC分期与GVD分期和CDR评分显著相关(图2)。2b). Braak NFT期、LATE-NC期和GVD期也与ca1 -海马区神经元密度呈显著负相关(r=−0.30,r=−0.27,和r=−0.36,n = 64)。Aβ mtl期、CDR与神经元密度呈负相关趋势,但不显著(图2)。2b)。调整p-values和系数值在附加文件中表示1:表A2a-b。
为了验证这些数据,我们进行了控制年龄和性别的逻辑回归分析。我们发现,当置于同一模型中时,LATE-NC和Braak NFT分期独立地促进了GVD病变的扩大(p< 0.001,β= 0.313和β= 0.596,R2= 0.740,附加文件1:表A3)。此外,我们观察到LATE-NC和Braak NFT分期可以预测海马体CA1亚场的神经元密度,尽管它们之间不是独立的(p= 0.026,β=−0.273,R2= 0.250和p= 0.008,β=−2.223, R2= 0.276;n = 64;额外的文件1:表A4a-c)。在线性回归模型中使用LATE-NC分期和Braak NFT分期预测CDR评分时,仅Braak NFT分期具有显著相关性(p< 0.001,β= 0.562,R2= 0.373;n = 178;额外的文件1:表A5)。晚期nc阶段也影响CDR评分,尽管并不独立于Braak NFT阶段(p< 0.001,β= 0.458,R2= 0.209;n = 178;额外的文件1:表A6a-b)。此外,我们观察到GVD扩张影响CA1的神经元密度(p= 0.006,β=−0.374,R2= 0.290;n = 64;额外的文件1:表A7)。值得注意的是,AβMTL相对GVD扩张没有独立影响(p= 0.728,β= 0.020,R2= 0.739;N = 230)或海马神经元密度(p= 0.891,β= 0.032,R2= 0.261;n = 64),当置于具有Braak NFT和LATE-NC阶段的模型中时(附加文件1:表A8 a-b)。
在有症状的AD合并LATE-NC病例中,gvd介导的坏死和pTau严重程度增加
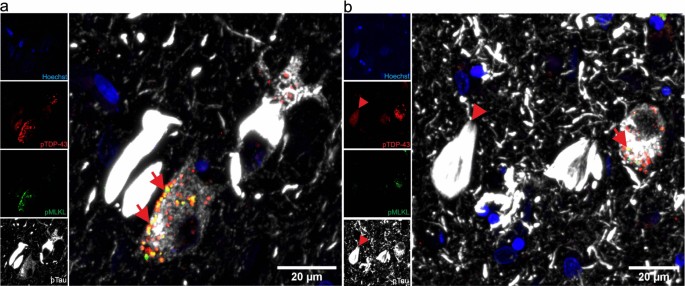
为了研究pTDP-43和pTau是否在坏死体阳性的GVD颗粒中共表达,我们用抗pTDP-43 (S409/S410)、pTau (S202/T205,克隆AT8)和坏死效应蛋白pMLKL (S358)对有症状的AD伴迟发性nc病例进行了三标记。我们观察到pMLKL和pTDP-43蛋白可以在相同的GVD颗粒中共定位,特别是在承载pTau病理的神经元中(图2)。3.a - b,箭头)。值得注意的是,在邻近的NFTs中,pTau也与pTDP-43共定位(图2)。3.b,箭头)。
接下来,我们旨在研究LATE-NC对pmlkl阳性GVD严重程度、神经元死亡和pTau病理的影响。9例非痴呆、非adnc对照组,8例症状性AD病例,无LATE-NC (ADTDP−10例有症状的AD伴LATE-NC (ADTDP +).如前所述,LATE-NC的存在由NCIs、nft样材料、dn或NIIs的存在来定义[32,53,54,77].用以下抗体对这些病例进行组织病理学评估:pTDP-43评估TDP-43病理,pMLKL评估gvd阳性神经元,pTau评估pTau病理(图2)。4a).我们定量评估了海马CA1亚场中神经元的总数以及每种标记物的阳性神经元的百分比。为此,估计了阳性神经元数量相对于CA1神经元总数的比率,并以百分比显示。有症状的广告TDP +pTDP-43阳性神经元平均为22.15%。4a箭头,c).相对于ADTDP−和控制,ADTDP +病例CA1 (AD)神经元密度降低TDP +, 106.3±7.3个神经元/mm2;广告TDP−, 146.4±8.1个神经元/mm2;p= 0.0204)而ADTDP−病例与对照组无显著差异(165.0±10.9个神经元/mm)2;p> 0.9999)(图4b).由于坏死被证明在AD神经退行性变中起作用,我们检查了在LATE-NC存在时观察到的神经元死亡差异是否可以通过坏死途径的参与来解释。有症状的广告TDP +与AD组相比,pmlkl阳性神经元(45.87%±2.64)明显增多TDP−例(9.47%±2.98;p= 0.025)和未患病对照组(0.21%±0.15;p< 0.0001)(图4a箭头,d)持续的症状性ADTDP +与AD相比,pTau的局部积累也增加(61.29%±5.04)TDP−(21.27%±5.16;p= 0.045)和对照组(0.00;p< 0.0001)(图4a, e),强调共病LATE-NC对pTau病理的影响,从而对gvd介导的坏死激活的影响。有症状的广告TDP +与AD相比,brak NFT分期较高TDP−(p= 0.0016;额外的文件1:图A2a),重要的是,这些组在死亡年龄上没有差异(p= 0.8435,附加文件1:图A2b),排除年龄作为影响神经元密度、pTau和pMLKL严重程度差异的因素。此外,载脂蛋白e Ɛ4等位基因的存在/缺失没有差异(p= 0.1679;额外的文件1:图A2c,表2).
在伴有LATE-NC的AD病例中,pMLKL和pTau严重程度以及神经元损失增加。一个在AD中观察到磷酸化tau和MLKL的局部积累TDP +.DAB免疫组化染色AD对照组ca1 -亚ulum野的pTDP-43 (S409/S410)、pTau (S202/T205)和pMLKL (S358)TDP−和广告TDP +case(显示案例7、16、21,见表2).比例尺= 50µm。b广告TDP +与对照组和AD相比,病例显示神经元密度下降TDP−和控制。表示每毫米神经元总数的定量数据2海马区CA1子野区的每组。CA1阳性神经元数量的定量cpTDP-43dpMLKL和epTau。广告TDP +pMLKL和pTau病变严重程度明显升高。数据以均数±标准差表示。N = 27(对照组= 9,ADTDP−= 8, ADTDP += 10)。f本队列中年龄控制的部分Spearman相关矩阵和多重比较(Holm-Bonferroni检验)证实,在CA1、AβMTL期和Braak NFT期,pTDP-43、pMLKL和pTau病理的积累与神经元密度显著相关。支持图像显示病例12、16、21和22的整个海马体的概况(表2)以pMLKL染色,可在公共储存库BioImage Archive内找到,连结如下:https://www.ebi.ac.uk/biostudies/studies/S-BIAD514?key=475a3bbe-6fc9-476e-8e45-6429422b85bf
最后,我们进行了半偏相关分析,控制性别,但不控制年龄(因为各组之间的年龄分布不重叠,附加文件1:达到)。我们验证了LATE-NC的严重程度、pTau和pMLKL之间的显著关系(图2)。4f). AβMTL期和Braak NFT期也与pTDP-43、pTau和pMLKL阳性神经元的百分比相关。相反,神经元密度与上述所有参数呈负相关(图2)。4调整f)。p-values和系数值在附加文件中表示1:表A9a-b。
讨论
在这项研究中,我们发现LATE-NC的存在影响有症状的AD病例的神经元损失。这似乎与GVD体中坏死途径的激活有关,这是我们和其他人之前在AD中报道过的一种细胞死亡形式[12,41].因此,LATE-NC的存在与pTau和GVD负担的增加有关,这表明LATE-NC可能加速pTau病理,随后诱导GVD介导的坏死(图2)。5).
此外,我们提供的证据表明,TDP-43和pTau病变的扩散与包含激活坏死体的GVD体的扩张、临床痴呆评分总体评分和海马神经元密度的降低有关。这与既往研究表明LATE-NC积极参与AD的发病机制和临床过程一致[35,37,49].
重要的是,我们发现坏死执行子pMLKL在有症状的AD的GVD体中表达较高TDP +与AD相比TDP−病例,并伴有AD中pTau局部积累的增强TDP +组。Latimer及其同事最近发现,与Braak期相匹配的AD病例,在共病性TDP-43蛋白病存在的情况下,pTau新皮层负担增加[42],并报道了TDP-43在动物模型中促进pTau聚集[44].此外,Josephs等人.观察到TDP-43病理的AD病例有更高的Braak NFT分期[35],这支持了我们的结果。此外,我们之前提供的证据表明pTau和TDP-43在AD过程中相互作用,可能促进了疾病的进展[75].其他研究也报道了这些蛋白质在致病过程中有很强的相互作用[16,44].因此,TDP-43可能加剧pTau病理(图。5(橙色箭头),这被认为是促进AD神经元萎缩和认知能力下降的关键退行性过程[52,68].这突出了TDP-43在AD中的相关作用,与AD中与单独ADNC相比,共病LATE-NC会恶化临床表型的观察结果一致[35,37,51].在这种情况下,a β似乎发挥了较小的作用,因为除了NFT和TDP-43病理外,它并没有单独促进GVD扩张,尽管已知它可以加速pTau的传播和聚集[23,25,45].
AD中的LATE-NC蛋白病通常以边缘为主,而新皮层通常幸免[33,53].因此,一旦LATE-NC出现,内侧颞叶的pTau和TDP-43病理平行增加[33].因此,我们推测TDP-43加速pTau,可能有助于先前描述的“边缘优势亚型”和“典型AD”亚型的发展,而不是“海马保留型”AD亚型[30.,34,48].
关于AD中坏死激活的第一篇报道揭示了其与Braak期呈正相关;而与认知功能呈负相关[12].此前,我们也分析了pmlkl阳性GVD与ad定义参数的关系,并观察到与Braak分期的相关性最强[41].与此一致,我们在有症状的AD的海马中检测到更多pmlkl阳性的GVD体TDP +其中pTDP-43, pTau和Aβ存在,与仅表现出pTau和Aβ的病例相比。在过去的几十年里,pTau被认为是GVD的主要诱导物[5,82],但最近的报道强调了其他蛋白质聚集物在这一背景下的作用,如TDP-43 [79),C9orf72突变相关二肽重复蛋白(DPR)在FTLD和ALS中的表达[59].我们的发现证实了退行性蛋白病变对GVD病变形成的共病和累积效应的假设,在AD中间体的背景下,坏死通路激活和神经元死亡的过程。
GVD颗粒的起源尚不清楚,但一些作者将其描述为由功能失调的大自噬过程引起的病理性细胞质病变,并包含有害的翻译后修饰蛋白[21,40,55].有研究表明,由蛋白质聚集物诱导的上游混合过程可以通过损害溶酶体来启动GVD的发展,这些溶酶体最终无法维持细胞内稳态,在病理条件下成为晚期自噬细胞器[21,82].pTDP-43和pTau是已知的GVD颗粒成分[36,82],主要发生在ADNC中,但也在较小程度上发生在非ad tau病中,包括嗜银颗粒病(AGD)、进行性核上性麻痹(PSP)和皮质基底变性(CBD),以及TDP-43蛋白病,如ALS和FTLD,以及正常衰老[41,70,78,79].在这里,TDP-43病理伴有pmlkl阳性GVD病变和pTau病理的加重。这与海马体CA1区明显的神经元死亡有关。在分析更大的队列(n = 230例)时,我们观察到NFT、GVD和LATE-NC分期之间有很强的相关性。此外,海马神经元密度与Braak NFT、LATE-NC和GVD进展呈负相关,支持我们的结果。出乎意料的是,在该网络中,年龄与LATE-NC分期没有显著相关。这可能是由于与Braak NFT、GVD、LATE-NC期和/或AβMTL期的共线性效应,这些阶段也包括在该网络中,并与年龄相关。
尽管我们在AD中观察到坏死途径和LATE-NC之间的正相关,但也有报道证实了其他疾病中的这种关系。最近,我们报道了pmlkl阳性GVD颗粒与ALS/FTLD海马中适当的TDP-43病理相关[79].此外,有证据表明,少突胶质细胞中TDP-43的缺失触发ripk1介导的坏死,这对髓鞘形成过程产生负面影响;但对ALS/FTD模型中的运动神经元没有影响[80].最近的一项研究表明TDP-43具有保护功能,可防止干扰素介导的坏死性细胞死亡的间接激活[17].与此一致,有一份报告强调了线粒体损伤,随后是tdp -43相关的细胞死亡在调控坏死的背景下[81].我们的研究结果显示,在有症状的AD病例中存在TDP-43蛋白病变时,gvd介导的坏死增强,这表明TDP-43病理改变在不同疾病实体中导致细胞死亡的作用相同。
因此,这项研究强调了开发可靠的TDP-43临床生物标志物的紧迫性,它与已经可用的Aβ和Tau生物标志物一起[6,10,56,74可以帮助根据潜在病理的存在和严重程度对痴呆患者进行分层。在伴有并发LATE-NC的AD患者中,与神经元丢失增强相关的gvd介导的坏死似乎加剧了。我们假设TDP-43和a β在AD中的累积效应加剧pTau神经毒性,从而导致神经元死亡。因此,在生命过程中检测TDP-43对于定制针对AD患者神经元死亡的治疗至关重要。
本研究的局限性是这种基于免疫组化的方法不能得出关于功能、病理机制途径的结论。然而,从网络分析中获得的数据将有助于进一步的功能研究,以发现精确的分子机制。此外,无LATE-NC的症状性AD病例数量有限。与基于社区的队列研究相比,本研究采用医院队列进行,这限制了对这些病理的流行病学的解释。此外,与基于社区的研究相比,以医院为基础的队列通常在疾病和痴呆方面更丰富[64],而且个体的死亡年龄往往较低。因此,我们也承认在我们的队列中缺乏相对“纯”的LATE-NC病例,因为大多数LATE-NC病例具有低至中等水平的ADNC。然而,以医院为基础的样本方法仍然允许对病理参数进行相关性、关联和网络分析,以确定它们之间的关系,如本文所示。最后一个限制是非ADNC对照组的死亡年龄较低,低于有症状的ADNC病例。死亡年龄差异的原因是与年龄相关的Aβ和pTau病理频率的结果,这解释了为什么大多数没有ADNC的病例年龄在65岁或以下,而有症状的ADNC终末期AD病例通常年龄在70岁或以上[9].
综上所述,我们的发现为病理聚集蛋白之间的协同作用提供了证据,这有助于AD的神经元损失,正如其他人已经提出的那样[11,27,43,61,67].在这里,AD患者的LATE-NC缺失与减弱的神经元损失相关,即使存在细胞内pTau病变和Aβ斑块。我们假设TDP-43通过加速pTau病理来促进AD的病理级联,可能是通过直接的相互作用,进而诱导细胞死亡过程(即gvd介导的坏死),从而导致神经元死亡(图5)。5).因此,我们的研究结果支持开发考虑共病病理的个性化治疗策略[43,76],在这种情况下,gvd介导的坏死可能是非常重要的下游靶点。
数据和材料的可用性
在当前研究中使用和/或分析的匿名数据集存储在UZ/KU-Leuven网络驱动器中,并可根据合理要求从相应作者处获得。辅助图像显示两个AD的pMLKL染色的整个海马体的概况TDP +和两个ADTDP−个案可透过以下超连结在公共储存库BioImage档案中查阅:https://www.ebi.ac.uk/biostudies/studies/S-BIAD514?key=475a3bbe-6fc9-476e-8e45-6429422b85bf.
参考文献
阿尔茨海默病协会(2021年)2021年阿尔茨海默病事实和数据。老年痴呆症17:327-406
阿里加达PV, Growdon JH, Hedley-Whyte ET, Hyman BT(1992)神经原纤维缠结而不是老年斑与阿尔茨海默病的病程和严重程度平行。神经病学42:631 - 639。https://doi.org/10.1212/WNL.42.3.631
王志强,王志强(2013)脑多病的神经病理学研究。Curr Alzheimer Res 10:569-577。https://doi.org/10.2174/15672050113109990002
J, Neltner JH, Nelson PT(2014)定量神经病理学评估研究脑多发病。阿尔茨海默氏Res Ther 6:85。https://doi.org/10.1186/s13195-014-0085-y
Ball MJ(1977)海马区神经元丢失、神经原纤维缠结和颗粒空泡变性与衰老和痴呆。神经病理学报37:11 - 118。https://doi.org/10.1007/BF00692056
Barthélemy NR, Bateman RJ, Hirtz C, Marin P, Becher F, Sato C, Gabelle A, Lehmann S(2020)脑脊液磷酸化tau T217作为阿尔茨海默病鉴别诊断和PET淀粉样蛋白阳性患者鉴定的生物标志物优于T181。阿尔茨海默氏Res Ther 12:26。https://doi.org/10.1186/s13195-020-00596-4
brak H, Alafuzov I, Arzberger T, Kretzschmar H, Del Tredici K(2006)阿尔茨海默病相关神经纤维病理的石蜡切片和免疫细胞化学分期。神经病理学报112:389-404。https://doi.org/10.1007/s00401-006-0127-z
brak H, brak E(1991)阿尔茨海默病相关变化的神经病理分期。神经病理学报82:239-259
brak H, Thal DR, Ghebremedhin E, Del Tredici K(2011)阿尔茨海默病病理过程的阶段:年龄类别从1岁到100岁。神经病理学杂志神经病理学杂志70:960-969。https://doi.org/10.1097/NEN.0b013e318232a379
Bucci M, Chiotis K, Nordberg A, ADN倡议(2021)阿尔茨海默病的液体和成像标志物:tau PET最好地预测认知能力下降。摩尔精神病学26:5888-5898。https://doi.org/10.1038/s41380-021-01263-2
Busche MA, Hyman BT(2020)淀粉样蛋白β和tau在阿尔茨海默病中的协同作用。神经科学23:1183-1193。https://doi.org/10.1038/s41593-020-0687-6
Caccamo A, Branca C, Piras IS, Ferreira E, Huentelman MJ, Liang WS, Readhead B, Dudley JT, Spangenberg EE, Green KN, Belfiore R, Winslow W, Oddo S(2017)阿尔茨海默病的坏死激活。神经科学20:1236-1246。https://doi.org/10.1038/nn.4608
陈霞,李伟,任娟,黄东,何伟,宋勇,杨超,李伟,郑霞,陈萍,韩娟(2013)混合谱系激酶样域蛋白向质膜转运导致坏死细胞死亡。Cell Res 24:105。https://doi.org/10.1038/cr.2013.171
Cho Y, Challa S, Moquin D, Genga R, Ray TD, Guildford M, Chan fp -M(2009)磷酸化驱动的RIP1-RIP3复合物组装调节程序性坏死和病毒诱导的炎症。细胞137:1112 - 1123。https://doi.org/10.1016/j.cell.2009.05.037
Crary摩根富林明,Trojanowski金桥,施耐德JA Abisambra摩根富林明,押尼珥EL, Alafuzoff我,阿诺德,Attems J TG海滩,Bigio呃,凯恩斯新泽西,迪克森DW,传动装置,格林贝格LT,霍夫公关,海曼BT,定形K, Jicha GA, Kovacs GG, Knopman DS, Kofler J, Kukull佤邦,Mackenzie IR, Masliah E,麦基,Montine TJ,穆雷我,Neltner JH,圣玛丽亚,斯利WW, Serrano-Pozo, Shelanski ML,斯坦T,高雄M,需要博士,托莱多JB, Troncoso JC, Vonsattel JP,白色的CL, Wisniewski T, Woltjer RL,山田,Nelson PT(2014)原发性年龄相关牛头病(PART):一种与人类衰老相关的常见病理。神经病理学报128:755-766。https://doi.org/10.1007/s00401-014-1349-0
Davis SA, Ann Gan K, Dowell JA, Cairns NJ, Gitcho MA (2017) TDP-43表达影响淀粉样β斑块沉积和tau聚集。一般人说。https://doi.org/10.1016/j.nbd.2017.04.012
Dunker W, Ye X, Zhao Y, Liu L, Richardson A, Karijolich J (2021) TDP-43阻止内源性rna触发rig - i依赖的致命干扰素反应。电话代表35:108976。https://doi.org/10.1016/j.celrep.2021.108976
Epskamp S, Borsboom D, Eiko FI(2018)估计心理网络及其准确性:教程论文。行为决议50:195-212。https://doi.org/10.3758/s13428-017-0862-1
Foygel R, Drton M(2010)高斯图模型的扩展贝叶斯信息准则
傅瑞敏,李志强,李志强(2008)稀疏逆协方差估计。生物统计学9:432 - 441。https://doi.org/10.1093/biostatistics/kxm045
Funk KE, mark RE, Kuret J(2011)阿尔茨海默病(AD)的颗粒空泡变性(GVD)体类似于晚期自噬细胞器。神经病理学应用神经生物学37:295-306。https://doi.org/10.1111/j.1365-2990.2010.01135.x
高洁,王磊,高超,Arakawa H, Perry G,王旭(2020)TDP-43抑制肽缓解阿尔茨海默病APP转基因小鼠模型的神经退行性变和记忆丧失。生物化学生物物理学报Mol基础Dis。https://doi.org/10.1016/J.BBADIS.2019.165580
Gomes LA, Hipp SA, Rijal Upadhaya A, Balakrishnan K, Ospitalieri S, Koper MJ, Largo-Barrientos P, Uytterhoeven V, Reichwald J, Rabe S, Vandenberghe R, von Arnim CAF, Tousseyn T, Feederle R, Giudici C, Willem M, Staufenbiel M, Thal DR (2019)神经病理学报138:913-941。https://doi.org/10.1007/s00401-019-02053-5
Goodpaster T, Randolph-Habecker J(2014)一种灵活的小鼠对小鼠免疫组化染色技术,适用于无生物素试剂、免疫荧光和多抗体染色。组织化学细胞化学62:197-204。https://doi.org/10.1369/0022155413511620
Götz陈峰,陈芳,陈建平,陈建平(2001)Aβ42原纤维诱导P301L tau转基因小鼠神经纤维缠结的形成。科学学报(自然科学版)。https://doi.org/10.1126/science.1062097
Hecht M, Krämer M, Von Arnim CAF, Otto M, Thal DR(2018)阿尔茨海默病中的毛细血管脑淀粉样血管病变:与皮质/海马微梗死和认知能力下降的关系。神经病理学报135:681-694。https://doi.org/10.1007/s00401-018-1834-y
Higashi S, Iseki E, Yamamoto R, Minegishi M, Hino H, Fujisawa K, Togo T, Katsuse O, Uchikado H, Furukawa Y, Kosaka K, Arai H (2007) TDP-43, tau和α-突触核蛋白在阿尔茨海默病和痴呆中与Lewy体并发的病理。Brain Res 1184:284-294。https://doi.org/10.1016/J.BRAINRES.2007.09.048
Hyman BT, Phelps CH, Beach TG, Bigio EH, Cairns NJ, Carrillo MC, Dickson DW, Duyckaerts C, Frosch MP, Masliah E, Mirra SS, Nelson PT, Schneider JA, Thal DR, Thies B, Trojanowski JQ, Vinters HV, Montine TJ(2012)老年痴呆症的神经病理学评估指南。阿尔茨海默氏症8:1-13。https://doi.org/10.1016/j.jalz.2011.10.007
Janková J, Van De Geer S(2018)高维图形模型的推理。见:图形模型手册,325-346页
Jellinger KA(2020)阿尔茨海默病的病理生物学亚型。《老年认知疾病杂志》49:21 - 333。https://doi.org/10.1159/000508625
Josephs KA, Murray ME, Tosakulwong N, Weigand SD, Serie AM, Ralph PB, Perkerson B, Matchett BJ, Jack CR Jr, Knopman DS, Petersen RC, Parisi JE, Petrucelli L, Baker M, Rademakers R, Whitwell JL, Dickson DW(2019)病理、成像和遗传特征支持非ftld大脑中存在不同的TDP-43类型。神经病理学报137:227-238。https://doi.org/10.1007/s00401-018-1951-7
Josephs KA, Murray ME, Whitwell JL, Parisi JE, Petrucelli L, Jack C Jr, Petersen RC, Dickson DW(2015)阿尔茨海默病TDP-43分期病理。神经病理学报127:441-450。https://doi.org/10.1007/s00401-013-1211-9.Staging
Josephs KA, Murray ME, Whitwell JL, Tosakulwong N, Weigand SD, Petrucelli L, Liesinger AM, Petersen RC, Parisi JE, Dickson DW(2016)更新了阿尔茨海默病分期计划中的TDP-43。神经病理学报131:571-585。https://doi.org/10.1007/s00401-016-1537-1
Josephs KA, Whitwell JL, Tosakulwong N, Weigand SD, Murray ME, Serie AM, Petrucelli L, Senjem ML, Ivnik RJ, Parisi JE, Petersen RC, Dickson DW (2015) TDP-43与阿尔茨海默病病理亚型影响临床特征。神经科学78:697-709。https://doi.org/10.1002/ana.24493
Josephs KA, Whitwell JL, Weigand SD, Murray ME, Tosakulwong N, Liesinger AM, Petrucelli L, Senjem ML, Knopman DS, Boeve BF, Ivnik RJ, Smith GE, Jack CR, Parisi JE, Petersen RC, Dickson DW (2014) TDP-43是阿尔茨海默病相关临床特征的关键参与者。神经病理学报127:811-824。https://doi.org/10.1007/s00401-014-1269-z
Kadokura A, Yamazaki T, Kakuda S, Makioka K, Lemere CA, Fujita Y, Takatama M, Okamoto K(2009)磷酸化依赖的TDP-43抗体检测神经元内显示颗粒空泡变性形态特征的点状结构。神经科学杂志463:87-92。https://doi.org/10.1016/j.neulet.2009.06.024
Kapasi A, Yu L, Boyle PA, Barnes LL, Bennett DA, Schneider JA(2020)年龄相关边缘主导的TDP-43脑病,ADNC病理与衰老的认知能力下降。神经病学95:e1951。https://doi.org/10.1212/WNL.0000000000010454
Keage H, Hunter S, Matthews FE, Ince P, Hodges J, Hokkanen SRK, Highley J, Dening T, Brayne C(2014)人群TDP-43病理:患病率及其与痴呆和年龄的关系。阿尔茨海默病杂志42:641-650。https://doi.org/10.3233/JAD-132351
Knopman DS, Amieva H, Petersen RC, Chételat G, Holtzman DM, Hyman BT, Nixon RA, Jones DT(2021)阿尔茨海默病。Nat Rev Dis Prim 7:1-21。https://doi.org/10.1038/s41572-021-00269-y
Köhler C(2016)颗粒液泡变性:伴随tau病理的神经退行性改变。神经病理学报132:339-359
Koper MJ, Van Schoor E, Ospitalieri S, Vandenberghe R, Vandenbulcke M, Von Arnim CAF, Tousseyn T, Balusu S, De Strooper B, Thal DR(2019)在粒空泡变性中检测到的坏死性复体与阿尔茨海默病的神经元损失有关。神经病理学报139:463-484。https://doi.org/10.1007/s00401-019-02103-y
Latimer CS, Burke BT, Liachko NF, Currey HN, Kilgore MD, Gibbons LE, Henriksen J, Darvas M, Domoto-Reilly K, Jayadev S, Grabowski TJ, Crane PK, Larson EB, Kraemer BC, Bird TD, Keene CD(2019)在社区队列中,对阿尔茨海默病病理的耐药性和恢复力与皮质pTau减少和无边缘为主的年龄相关TDP-43脑病相关。神经病理学报,共7:9。https://doi.org/10.1186/s40478-019-0743-1
Latimer CS, Liachko NF (2021) Tau和TDP-43协同作用:散发性晚发型阿尔茨海默病的新治疗靶点。老年科学出版社43:1627-1634。https://doi.org/10.1007/s11357-021-00407-0
Latimer CS, Stair JG, Hincks JC, Currey HN, Bird TD, Keene CD, Kraemer BC, Liachko NF (2022) TDP-43促进tau积累和选择性神经毒性秀丽隐杆线虫.Dis模型机甲。https://doi.org/10.1242/DMM.049323
Lewis J, Dickson DW, Lin WL, Chisholm L, Corral A, Jones G, Yen SH, Sahara N, Skipper L, Yager D, Eckman C, Hardy J, Hutton M, McGowan E(2001)表达突变tau和APP的转基因小鼠神经纤维变性增强。https://doi.org/10.1126/science.1058189
McAleese KE, Walker L, Erskine D, Thomas AJ, McKeith IG, aams J(2017)阿尔茨海默病、路易体痴呆和衰老的TDP-43病理学。脑病理27:472-479。https://doi.org/10.1111/bpa.12424
Morris JC(1993)临床痴呆评分(CDR):当前版本和评分规则。神经病学43:2412 - 2414。https://doi.org/10.1212/WNL.43.11.2412-A
Murray ME,格拉夫- radford NR, Ross OA, Petersen RC, Duara R, Dickson DW, Alzheimer RE(2011)具有不同临床特征的阿尔茨海默病神经病理学定义亚型:一项回顾性研究。《柳叶刀》:785 - 796。https://doi.org/10.1016/s1474 - 4422 (11) 70156 - 9
王晓明,王晓明,王晓明,王晓明,等。(2018)老年痴呆症与前颞极皮层TDP-43的相关性研究。神经病理学报。https://doi.org/10.1186/s40478-018-0531-3
Nag S, Yu L, Capuano AW, Wilson RS, Leurgans SE, Bennett DA, Schneider JA(2015)老年痴呆症与海马硬化和TDP-43病理学。Ann Neurol 77:942。https://doi.org/10.1002/ANA.24388
伴有很少或没有阿尔茨海默病的晚期神经病理改变很常见,与认知障碍有关,但与额颞叶痴呆无关。神经病理学杂志80:649-651。https://doi.org/10.1093/jnen/nlab050
Nelson PT, Alafuzoff I, Bigio EH, Bouras C, Braak H, Cairns NJ, Castellani RJ, Crain BJ, Davies P, Del TK(2012)阿尔茨海默病神经病理改变与认知状态的相关性:文献综述。神经病理学杂志71:362-381。https://doi.org/10.1097/NEN.0b013e31825018f7
纳尔逊PT、迪克森DW Trojanowski金桥,杰克CR,博伊尔PA, Arfanakis K,说Rademakers R, Alafuzoff我Attems J, Brayne C, Coyle-Gilchrist,崔HC, Fardo DW,弗拉纳根,韩礼德G, Hokkanen SRK,猎人,Jicha GA,清水正孝Y,川CH,基恩CD, Kovacs GG, Kukull佤邦,利维AI, Makkinejad N, Montine TJ, Murayama年代,穆雷我,唠叨,Rissman RA,斯利WW,斯珀林RA,白色三世CL, Yu L,施耐德JA (2019) Limbic-predominant老年性TDP-43脑病(后期):协商一致工作组报告。大脑。https://doi.org/10.1093/brain/awz099
Neumann M, Kwong LK, Lee EB, Kremmer E, Flatley A, Xu Y, Forman MS, Troost D, Kretzschmar HA, Trojanowski JQ, Lee VM-Y (2009) TDP-43蛋白病中S409/410磷酸化是所有散发性和家族性TDP-43蛋白病的一致特征。神经病理学报117:137-149。https://doi.org/10.1007/s00401-008-0477-9
冈本K,平井S, Iizuka T, Yanagisawa T, Watanabe M(1991)颗粒空泡变性的复查。神经病理学报82:340-345。https://doi.org/10.1007/BF00296544
曲艳,马艳红,黄艳艳,欧艳娜,沈晓楠,陈世东,董强,谭玲,于建涛(2021)健忘性轻度认知障碍和阿尔茨海默病的血液生物标志物诊断:系统综述和荟萃分析。神经科学生物行为学Rev 128:479-486。https://doi.org/10.1016/j.neubiorev.2021.07.007
Quadri Z, Johnson N, Zamudio F, Miller A, Peters M, Smeltzer S, Hunt JB, Housley SB, Brown B, Kramer S, Norris CM, Nash K, Weeber E, Lee DC, Selenica MLB (2020) CAMKII-tTa转基因小鼠模型中人wtTDP-43的过表达导致海马可塑性损伤和行为缺陷。Mol细胞神经科学102:103418。https://doi.org/10.1016/J.MCN.2019.103418
Rijal Upadhaya A, Kosterin I, Kumar S, Von Arnim CAF, Yamaguchi H, Fändrich M, Walter J, Thal DR(2014)人脑中淀粉样蛋白-β肽聚集和积累的生化阶段及其与症状性和病理前阿尔茨海默病的关系。大脑137:887 - 903。https://doi.org/10.1093/brain/awt362
Riku Y, Duyckaerts C, Boluda S, Plu I, Le Ber I, Millecamps S, Salachas F, Network BNN, Yoshida M, Ando T (2019) C9orf72突变增加颗粒空泡变性的患病率。Acta Neuropathol。https://doi.org/10.1007/s00401-019-02028-6
Robinson J, Xie S, Richardson H, Suh E, Van Deerlin V, Alfaro B, Loh N, Nirschl J, Porras-Paniaqua M, Wolk D, Lee E, Lee V, Trojanowski J(2021)阿尔茨海默病共病理的发展与融合。大脑144:953 - 962
Robinson JL, Richardson H, Xie SX, Suh ER, Van Deerlin VM, Alfaro B, Loh N, Porras-Paniagua M, Nirschl JJ, Wolk D, Lee VMY, Lee EB, Trojanowski JQ(2021)阿尔茨海默病共病理的发展和收敛。大脑144:953 - 962。https://doi.org/10.1093/brain/awaa438
Ros U, Peña-Blanco A, Hänggi K, Kunzendorf U, Krautwald S, Wong WWL, García-Sáez AJ(2017)独立于钙的质膜纳米孔介导坏死执行。Cell Rep 19:175-187。https://doi.org/10.1016/j.celrep.2017.03.024
Samson AL, Zhang Y, Geoghegan ND, Gavin XJ, Davies KA, Mlodzianoski MJ, Whitehead LW, Frank D, Garnish SE, Fitzgibbon C (2020) MLKL在质膜上的转运和积累控制坏死动力学和阈值。Nat Commun 11:1-17。https://doi.org/10.1038/s41467-020-16887-1
Schneider JA, Aggarwal NT, Barnes L, Boyle P, Bennett DA(2009)社区与诊所队列中患有和没有痴呆症的老年人的神经病理学。阿尔茨海默病18:691。https://doi.org/10.3233/JAD-2009-1227
Simchowicz T(1911)组织病理学研究über老年德门茨。在:Nissl F,阿尔茨海默病A (eds)组织学和组织病理学Arbeiten über die Großhirnrinde,卷4。费希尔,耶拿,267-444页
Spina S, La JR, Petersen C, Nolan AL, Cuevas D, Cosme C, Hepker M, Hwang J-H, Miller ZA, Huang EJ, Karydas AM, Grant H, Boxer AL, Gorno-Tempini ML, Rosen HJ, Kramer JH, Miller BL, Seeley WW, Rabinovici GD, Grinberg LT(2021)早期和晚发性阿尔茨海默病共病神经病理诊断。大脑144:2186 - 2198。https://doi.org/10.1093/brain/awab099
spres - jones TL, atems J, Thal DR(2017)神经退行性疾病病理蛋白的相互作用。神经病理学报134:187-205。https://doi.org/10.1007/s00401-017-1709-7
Spires-Jones TL, Hyman BT(2014)阿尔茨海默病突触中β淀粉样蛋白和tau蛋白的交集。神经元82:756 - 771
孙玲,王辉,王震,何松,陈松,廖东,王玲,闫娟,刘伟,雷霞(2012)混合谱系激酶样域蛋白介导RIP3激酶下游坏死信号通路。细胞148:213 - 227。https://doi.org/10.1016/j.cell.2011.11.031
Thal DR, Del Tredici K, Ludolph AC, Hoozemans JJM, Rozemuller AJ, Braak H, Knippschild U(2011)粒空泡变性的分期:与阿尔茨海默病和慢性应激反应的关系。神经病理学报122:577-589。https://doi.org/10.1007/s00401-011-0871-6
Thal DR, Papassotiropoulos A, Saido TC, Griffin WST, Mrak RE, Kölsch H, Del TK, atos J, Ghebremedhin E(2010)零星阿尔茨海默病中发现了一种明显的APOE ε4相关亚型。神经病理学报120:169-183。https://doi.org/10.1007/s00401-010-0707-9
Thal DR, Rub U, Orantes M, Braak H(2002)人脑中a β-沉积阶段及其与AD发展的相关性。神经病学58:1791 - 1800。https://doi.org/10.1212/WNL.58.12.1791
Thal DR, Schultz C, Sassin I, Ghebremedhin E, Del Tredici K, Braak E, Braak H(2000)人内侧颞叶a β蛋白沉积序列。神经病理学经验杂志59:733-748。https://doi.org/10.1093/jnen/59.8.733
Therriault J, Pascoal TA, Lussier FZ, Tissot C, Chamoun M, Bezgin G, Servaes S, Benedet AL, Ashton NJ, Karikari TK, Lantero-Rodriguez J, Kunach P, Wang Y-T,费尔南德兹- arias J, Massarweh G, Vitali P, Soucy J-P, Saha-Chaudhuri P, Blennow K, Zetterberg H, Gauthier S, Rosa-Neto P (2022)Nat老化。https://doi.org/10.1038/s43587-022-00204-0
Tomé SO, Gomes L, Li X, Vandenberghe R, Tousseyn T, Thal DR (2021) TDP-43与阿尔茨海默病病理性τ蛋白相互作用。神经病理学报141:795-799。https://doi.org/10.1007/s00401-021-02295-2
Tomé SO, Thal DR(2021)阿尔茨海默病的共同病理:只是多种病理或犯罪伙伴?大脑144:706 - 708。https://doi.org/10.1093/brain/awab027
Tomé SO, Vandenberghe R, Ospitalieri S, Van Schoor E, Tousseyn T, Otto M, Von Arnim CAF, Thal DR(2020)阿尔茨海默病TDP-43病理的独特分子模式:与临床表型的关系。神经病理学报,8:1-22。https://doi.org/10.1186/s40478-020-00934-5
汤林森,基钦纳D(1972)海马锥体细胞的颗粒空泡变性。中华病理学杂志106:165-185
Van Schoor E, Koper MJ, Ospitalieri S, Dedeene L, Tomé SO, Vandenberghe R, Brenner D, Otto M, Weishaupt J, Ludolph AC, Van Damme P, Van Den Bosch L, Thal DR (2021) ALS/FTLD患者海马区坏死体阳性颗粒空泡变性与TDP-43病理病变相关。神经病理学应用神经生物学47:328-345。https://doi.org/10.1111/nan.12668
王娟,何文勇,林凯,冯军,陈晓娟,陈晓娟,陈晓娟(2018)ALS/FTD信号蛋白TDP-43对少突胶质细胞存活和髓鞘形成的影响。Proc natalacadsci 115: E10941-E10950
王伟,王磊,陆娟,Siedlak SL, Fujioka H,梁军,姜松,马霞,蒋震,Da Rocha EL (2016) TDP-43线粒体定位抑制阻断其神经元毒性。Nat Med 22:869-878
Wiersma VI, van Ziel AM, Vazquez-Sanchez S, Nölle A, Berenjeno-Correa E, Bonaterra-Pastra A, Clavaguera F, Tolnay M, Musters RJP, van Weering JRT, Verhage M, Hoozemans JJM, Scheper W(2019)颗粒空泡变性体是细胞内tau病理诱导的神经元选择性溶酶体结构。Acta Neuropathol。https://doi.org/10.1007/s00401-019-02046-4
张艳杰,徐艳飞,Cook C, Gendron TF, Roettges P, Link CD, Lin W-LW-L, Tong J, castandes - casey M, Ash P, Gass J, Rangachari V, Buratti E, Baralle F, gold TE, Dickson DW, Petrucelli L (2009) TDP-43异常裂解增强聚集和细胞毒性。Proc Natl acadsci usa 106:7607-7612。https://doi.org/10.1073/pnas.0900688106
确认
我们要感谢那些捐赠大脑支持我们研究的患者和他们的家人。我们还要感谢Alicja Ronisz和Simona Ospitalieri提供的所有技术和行政支持。
资金
阿尔茨海默病预防倡议(AFI) #13803 (DRT);温德佐克基金会(FWO) G0F8516N, G065721N (DRT);荷兰老年痴呆(IWT 135043) (RV, DRT);Mady browayys额颞叶变性研究基金;BMBF (FTLDc)拨款(MO)。鲁汶大学内部基金:PDMT2/21/069 (SOT);FWO #1S46219N (EVS) SB博士奖学金。Methusalem基金(BDS)。博士后奖学金- fonds Wetenschappelijk Onderzoek (FWO/Belgium) (12Y1620N)和Stichting Alzheimer协会(#SAO-FRA 2021/00022) (JS)。高级博士后研究员(FWO) #12P5922N (SB)。
作者信息
作者及隶属关系
贡献
研究设计:D.R.T。,S.O.T M.J.K。最初,S.B.;免疫组织化学:S.O.T。,M.J.K A.B。那么,J.S.二;神经病理学:D.R.T, S.O.T M.J.K, A.B。那么,J.S.二;遗传分析:例如;临床神经学:R.V。,M.V C.A.F.V.A,犯罪手法;统计分析:S.O.T。M.J.K,其它,M.B.B, D.R.T.;数据解释:S.O.T。M.J.K,其它,D.R.T.;手稿准备:s.o.t., m.j.k., k.g., D.R.T.;关键手稿评审:a.b., e.v.s., j.s., r.v., m.v., c.a.f.v.a., M.O, m.b.b., b.d.s., s.b., e.g. .所有作者阅读并批准最终手稿。
相应的作者
道德声明
伦理批准并同意参与
所有尸体解剖都是在获得适当同意的情况下,根据当地法律进行的。乌尔姆大学伦理委员会(德国)和UZ/ ku -鲁汶伦理委员会(比利时)批准了使用病例的伦理批准。本研究涵盖了样本和数据的回顾性分析,得到了UZ/KU-Leuven伦理委员会(S-59295, S-65147)(比利时)的批准。
发表同意书
不适用于这项研究,它没有使用个人的数据。只处理匿名或假名数据。
相互竞争的利益
MO曾担任Axon神经科学和Fujirebio的顾问,并受邀为Roche和Fujirebio进行演讲。CAFvA曾在纽迪西亚公司(2014)、罗氏公司(2018)和香港大学研究委员会(2014)担任科学顾问委员会成员,并获得了来自纽迪西亚公司(2014 - 2015)、礼来德国有限公司(2013-2016)、Desitin Arzneimittel有限公司(2014)、百健(2016-2018)、罗氏(2017-2019)和Dr. Willmar Schwabe有限公司的旅费和演讲酬金。公斤(2014 - 2019)。BDS是或曾经是礼来、百健、杨森制药、卫材、艾伯维和其他公司的顾问。BDS还是Augustine Therapeutics的科学创始人,Muna Therapeutics的科学创始人和股东。DRT获得了诺华制药公司(瑞士)和百健(美国)的荣誉演讲嘉宾,GE-Healthcare(英国)和UCB(比利时)的旅费报销,并与诺华制药公司(瑞士)、Probiodrug(德国)、GE-Healthcare(英国)和杨森制药公司(比利时)合作。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1。
表A1-本研究中使用的抗体。表A2比较ca1 -海马a β mtl期、Braak NFT期、LATE-NC期、GVD期、CDR评分和神经元密度的相关矩阵的p值(a)和系数值(b) (n = 230)。表A3-LATE-NC和Braak NFT对GVD的扩展有独立的贡献。以GVD分期为因变量,以LATE-NC和Braak NFT分期、年龄和性别为自变量的线性回归模型(n = 230)。表A4-LATE-NC和Braak NFT有助于ca1 -海马神经元密度,尽管相互依赖(a-b)。以神经元密度为因变量,以LATE-NC和Braak NFT分期、年龄和性别为自变量的线性回归模型(n = 64)。表A5-只有brak NFT分期有助于痴呆症评级。以CDR评分为因变量,以LATE-NC、Braak NFT分期、年龄、性别为自变量,建立线性回归模型(n = 178)。表A6-后期nc阶段影响CDR全局评分,但不独立于Braak NFT阶段。以LATE-NC分期、年龄、性别为自变量,CDR总体评分为因变量(n = 178)建立线性回归模型。表A7-GVD期对神经元密度有显著贡献。以神经元密度为因变量,以GVD分期、年龄、性别为自变量的线性回归模型(n = 64)。表A8当置于具有Braak NFT和LATE-NC期的模型中时,-AβMTL期不独立地影响(a) GVD期或(b)神经元密度。以GVD分期或CA1神经元密度为因变量,以Braak NFT分期、LATE-NC分期、年龄和性别为自变量的线性回归模型(a, n = 230;B, n = 64)。表A9比较a β mtl分期、Braak NFT分期、CDR评分、ca1 -海马神经元密度以及pTDP、pMLKL和pTau严重程度的相关矩阵的p值(a)和系数值(b)。N = 26(非AD = 9, ADTDP−= 8, ADTDP += 9)。图A1-本研究中使用的队列的年龄分布a) n = 230,对应于表1;b) n = 27,对应于表2。图A2广告TDP +与AD相比,brak NFT分期较高TDP−病例(a),但死亡年龄(b)和(c)载脂蛋白eꜪ4等位基因阳性病例的百分比。(a-b)未配对t检验和sem均值(n = 27);(c)卡方双面检验。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
科佩尔,m.j., Tomé, s.o.,高高尔,K。et al。LATE-NC加重gvd介导的阿尔茨海默病坏死。神经病理学报10, 128(2022)。https://doi.org/10.1186/s40478-022-01432-6
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s40478-022-01432-6
关键字
- Granulovacuolar变性
- LATE-NC
- TDP-43
- Necroptosis
- 细胞死亡
- pMLKL
- pTau
- 蛋白质聚合